氢氧化钠降解原花青素的聚合度及抗氧化活性分析
杨洋,张磊,李学文*
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)(2.新疆农业大学林学与园艺学院,新疆乌鲁木齐 830052)
葡萄(Vitis vinifera)为葡萄科(Vitaceae)葡萄属(Vitis)木质藤本植物[1-3],酿酒过程中,白葡萄酒通常不经过浸渍,并且在发酵前葡萄籽、皮与葡萄汁的接触时间短,因此白葡萄皮渣中保留了较多的酚类物质(60%~70%)[4],此外还有蛋白质[5,6]、脂类[7,8]、膳食纤维[6]、氨基酸[9]、甾醇[10]和有机酸[11]等营养成分,其中最主要的是原花青素(Proanthocyanidins,PC)[12],来源于葡萄籽的原花青素具有很强的抗氧化活性[13]、预防癌症[14]、抑制肿瘤[15]等药理学功能,但它们的生物活性很大程度上取决于结构和聚合度[16]。葡萄籽中原花青素主要是由黄烷-3-醇单元(儿茶素、表儿茶素)及其衍生物(表儿茶素没食子酸酯)聚合而成不同聚合度(Degree of Polymerization,DP)的混合物[12,17-19],以次级代谢产物的形式广泛存在于植物中,它们主要是以C4→C8 或C4→C6 连接形成B 型结构[16]。研究发现,葡萄籽中的65%是高聚原花青素[20](Polymeric Proanthocyanidins,PPC),由于聚合度高,分子量大,很难透过生物膜进入细胞内[21],一定程度上降低了其生物利用度和抗氧化活性[22],因此将高聚原花青素转化成DP 为2~4 的人体更好吸收的低聚原花青素(Oligomeric Proanthocyanidins,OPC)[16]是葡萄籽高附加值应用的重要途径之一。
目前,国内外原花青素降解的方法有酸催化降解[23]、碱催化降解[17]、催化加氢降解[24,25]等。这些降解方法中,有些方法对设备要求严苛、生产成本较高,或产生刺激的、令人不愉快的气味,不适用于食品工业生产。碱裂解法最早被应用于制备A 型原花青素,Brittany 等[26]采用NaOH 对蔓越莓果渣高聚原花青素进行降解,结果显示低聚原花青素提高了3.8~14.9 倍;苏惠娟[27]选择四种碱液进行降解工艺探究,其降解效果为从大到小依次为:氢氧化钠>碳酸钠>碳酸氢钾或碳酸氢钠,以氢氧化钠为降解液时,单体和二聚体降解率分别达到1.5%和2.0%。综上,碱降解具有出产量高、成本低、操作便捷等优势,表现出较高的工业应用潜力。本文通过单因素和响应面试验,优化氢氧化钠降解葡萄籽原花青素的工艺条件,并对其降解后的目标产物进行体外抗氧化活性及原花青素组分变化的研究,为葡萄籽及高聚原花青素降解的开发利提供了理论依据,具有一定的实际应用价值和意义。
1 材料与方法
1.1 材料与设备
1.1.1 试验原料及试剂
试验原料来源于酿酒后的霞多丽葡萄籽,于2019年10 月取自新疆农业大学食品科学与药学学院;儿茶素(Catechin,C)、表儿茶素(Epicatechin,EC)、原花青素B2 均购于Sigma-Aldrich 科技有限公司;表儿茶素没食子酸酯(Epicatechin gallate,ECG)、原花青素B1、B3、B4、C1、儿茶素(HPLC>95%)、Trolox(98%)、DPPH、TPTZ、ABTS、香草醛均购于上海源叶生物科技有限公司;盐酸、甲醇、丙酮均为分析纯,乙酸、甲醇均为色谱纯。
1.1.2 仪器设备
UV-1800 紫外可见分光光度计;ACQUTTY ARC沃特世超高效液相色谱;恒温振荡器;KQ3200E 型超声波清洗器;HH-S6 数显恒温水浴锅;涡旋混合器;RE-52AA 旋转蒸发器;FD-1C-50 真空冷冻干燥机。
1.2 试验方法
1.2.1 葡萄籽预处理
葡萄籽预处理参照文献[28]方法,并略作修改。霞多丽葡萄籽经压榨后得到,洗净晾干,粉碎后过20目筛。称取葡萄籽粉100.00 g于锥形瓶中,加入500 mL正己烷封口,置于恒温振荡器中,250 r/min、25℃、避光脱脂12 h 后取出,静置30 min,于通风橱中过滤得到滤渣并挥干溶剂。
1.2.2 原花青素提取及含量测定
葡萄籽原花青素提取,参照文献方法[29],并略作修改。根据前期原花青素提取条件的优化,扩大试验用量,准确称取50.00 g 脱脂葡萄籽粉于锥形瓶中,加入料液比1:6 的60%乙醇,50℃避光提取70 min,离心取上清液,测定原花青素含量,于45℃减压旋蒸除去溶剂,待提取液无醇味,得到的原花青素-水溶液分装在平皿中,于-20℃保鲜膜封口预冻,完全冻结后扎孔、置于真空冷冻干燥机冷冻24 h,干燥成粉备用,原花青素得率计算见公式(1)。

采用香草醛-盐酸法测定原花青素含量[30]。以儿茶素为标准品,不加标准液的溶液为对照,以儿茶素浓度x 为横坐标,吸光值y 为纵坐标绘制标准曲线为y=0.0045x+0.0964,R2=0.9991。原花青素含量计算见公式(2)。

1.2.3 原花青素聚合度快速分离
参照文献方法[22],并稍作改动。取5 g 原花青素粉末分装在10 个锥形瓶中,加入1:100(V/V)的蒸馏水超声波助溶。待完全溶解后,加入3 倍体积的乙酸乙酯,于恒温振荡器中萃取2 h,取出后置于分液漏斗中,室温静置,待完全分层后进行分液。使用上述方法萃取三次。将三次萃取水相和乙酸乙酯相分别合并,用旋转蒸发仪旋干乙酸乙酯,用蒸馏水少量多次复溶。将两部分水溶液分装在平皿中,冷冻干燥成粉备用。
1.2.4 原花青素降解工艺优化
1.2.4.1 单因素试验
称取高聚原花青素粉末于离心管中,分别加入一定浓度的不同碱液,置于水浴中,在一定时间、一定温度下反应后,4 mol/L 的盐酸于冰水浴中调节pH 至 6~7,终止反应,得碱降解粗提液,以平均聚合度为指标,考察各因素对降解高聚原花青素效果及平均聚合度的影响。
1.2.4.2 响应面法优化降解工艺
根据单因素试验结果,以A(氢氧化钠浓度)、B(处理时间)、C(处理温度)为因素,原花青素平均聚合度为响应值,根据Box-Behnken 原理,运用Design-Expert.V 8.0.6.1软件进行试验优化设计。
1.2.5 原花青素粗提液除盐液制备
参考文献[17]方法,并略作修改。旋蒸后鸡心瓶用5 mL色谱甲醇溶解,并过0.45 μm有机滤膜,HPLC待测。
1.2.6 原花青素平均聚合度的测定
不纯的原花青素测定其平均聚合度,使用分光光度法检测待测液的平均聚合度并计算[22],见公式(3)。

式中:m 为原花青素质量含量,μg;M 为儿茶素相对分子质量,290;n 为原花青素物质的量,μmol。
1.2.6.1 原花青素质量含量测定
参照文献方法[31],略作修改。在甲醇体系中,以儿茶素为标准品绘制标准曲线。配置儿茶素标准品浓度1 mg/mL。分别稀释成不同浓度的儿茶素系列标准溶液;取上述各浓度标准溶液1 mL,分别加入2.5 mL 1.5%香草醛-甲醇溶液和30%盐酸-甲醇溶液混匀,于25℃水浴中避光反应15 min。反应结束后取出,以空白显色液为对照,用紫外分光光度于500 nm 波长下测定吸光度,绘制的标准曲线方程为y=0.8441+0.0598,R2=0.9991。取1 mL 样品稀释液,按以上步骤测定。
1.2.6.2 原花青素物质的量测定
参照文献方法[32],略作修改。在乙酸体系中,以儿茶素为标准品绘制标准曲线。配置儿茶素系列标准溶液,取1 mL 与1.5%香草醛和4%盐酸各2.5 mL 的显色液,在25℃水浴中避光反应15 min,反应结束后取出,以空白显色液为对照,用紫外分光光度计在500 nm 测试吸光度,绘制的标准曲线方程为y=0.1146x+0.0026,R2=0.9990。取1 mL 样品稀释液,按以上步骤测定。
1.2.7 原花青素体外抗氧化活性的测定
1.2.7.1 DPPH 自由基清除能力测定
参照文献方法[33],略作修改。将0.1 mL 粗提液加入到3.9 mL 2.5×10-2mg/mL DPPH 甲醇溶液中(现配现用),室温避光处反映30 min,于517 nm 处测定吸光度。采用Trolox 溶液浓度(0~1 mM)及%清除率来建立标曲,待测样品的DPPH 自由基清除能力根据%清除率表示为Trolox 当量(TE)(μmol Trolox/g DW)。DPPH 自由基清除活性标准曲线见图1。DPPH 自由基的百分清除率按公式(4)计算:

图1 DPPH 自由基清除活性标准曲线 Fig.1 DPPH free radical scavenging activity standard curve
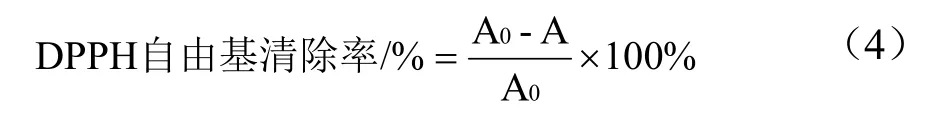
式中:A0为未加待测液反应后的吸光度,A 为加入待测液反应后测得的吸光度。
1.2.7.2 ABTS 自由基清除能力测定
参照文献方法[34],略作修改。取5 mL 7 mmol/L的ABTS 溶液和88 μL 140 mmol/L 的过硫酸钾溶液,均匀混合,使用室温避光放置12~16 h。将配置好的ABTS工作液用无水乙醇稀释至其在734 nm波长下测得吸光度为0.68~0.72。将粗提液50 μL 加入到4.0 mL稀释后的ABTS 溶液中,室温避光反应10 min,于734 nm处测定吸光值。标准曲线采用Trolox溶液浓度(0~2 mmol)及(%)清除率来建立,待测样品的ABTS 自由基清除能力根据(%)清除率表示为Trolox当量(TE)(μmol Trolox/g DW),ABTS 自由基清除活性标准曲线见图2,ABTS 自由基的百分清除率按式(5)计算:
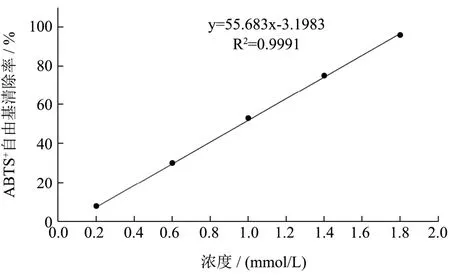
图2 ABTS 自由基清除活性标准曲线 Fig.2 ABTS free radical scavenging activity standard curve
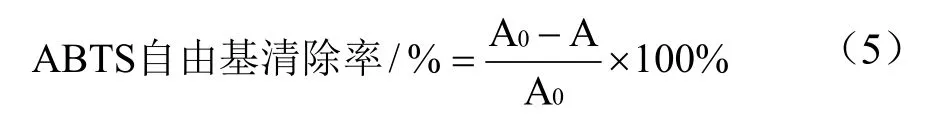
式中:A0为未加待测样品反应后的吸光度,A 为加入待测样品反应后测得的吸光度。
1.2.8 HPLC 分析原花青素组分变化
HPLC 色谱条件:德国Merck 公司,Purospher STAR RP18 endcapped 色谱柱(250×4.6 mm,5 μm);柱温30℃;流速:1.0 mL/min;进样量:10 μL;检测波长:280 nm;流动相:A:2%乙酸,B:50%色谱甲醇(含1%乙酸);梯度洗脱:0~5 min,15%~15% B;5~10 min,15%~30% B;10~15 min,30%~45% B;15~20 min,45%~60% B;20~30 min,60%~65% B;30~40 min,65%~82% B;40~45 min,82%~82% B;45~50 min,82~100% B;50~52 min,100%~100% B;52~60 min,为100%~82% B;60~65 min,82%~15% B;65~70 min,15~15% B。
1.2.9 数据处理及分析
每组试验设置3 次平行;实验结果以平均值±标准偏差表示;数据统计及处理采用Excel 软件;使用Origin 2018 作图软件绘图;Design-Expert.V 8.0.6.1 软件设计试验;显著性差异分析使用IBM SPSS Statistics 26,显著性水平p<0.05。
2 结果与讨论
2.1 原花青素平均聚合度的测定

表2 低聚、高聚原花青素占原花青素粗提物比例及平均聚合度 Table 2 The proportion of oligomeric and polymeric proanthocyanidins in crude proanthocyanidin extract and the average degree of polymerization
按照1.2.2、1.2.3 的方法进行试验,经旋转蒸发,真空冷冻干燥,得到原花青素粗提物冻干粉,称重,按照公式(1)、(2)、(3)计算原花青素提取率、含量及平均聚合度,结果见表1。由计算得原花青素得率为11.81%,说明葡萄籽可以用作原花青素的来源进行开发,为原花青素开发利用奠定基础。

表1 原花青素粗提物提取率及平均聚合度 Table 1 Extraction rate and mean degree of polymerization of proanthocyanidins crude extract
按照1.2.4 的方法进行低聚和高聚原花青素分离,经冷冻干燥得到的低聚、高聚原花青素分别占原花青素粗提物的32.92%、67.08%,平均聚合度分别为4.17、5.71。
2.2 碱降解单因素试验结果
2.2.1 碱液种类对降解效果的影响
在碱液浓度为4%,处理时间30 min,处理温度60℃的条件下,分别以氢氧化钾、氢氧化钠、碳酸钠和碳酸氢钠为降解液,以碱液种类为横坐标,平均聚合度为纵坐标作图,结果如图3 所示,以平均聚合度为考察指标,氢氧化钾、碳酸钠、碳酸氢钠的降解效果差异不显著(p>0.05),氢氧化钠的降解结果差异显著(p<0.05)。Brittany[26]等研究发现,使用不同浓度的氢氧化钠降解高聚原花青素,单体和二聚体提取率分别提高了14.9 和8.4 倍,可能是由于碱降解能够使原花青素的C→C 键发生断裂[23],从而达到降低原花青素平均聚合度的效果。因此,选择氢氧化钠作为降解液。
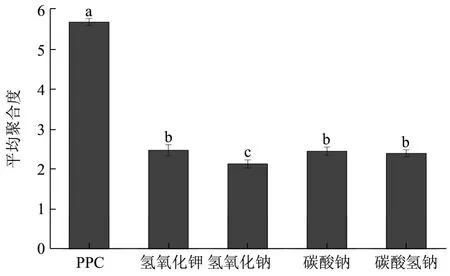
图3 碱液种类对平均聚合度的影响 Fig.3 Effect of alkali liquor type mean polymerization degree
2.2.2 氢氧化钠浓度对降解效果的影响
选择氢氧化钠作为降解碱液,在处理时间30 min,处理温度60℃的条件下,分别设置2%、4%、6%、8%、10%的氢氧化钠浓度,以浓度为横坐标,平均聚合度为纵坐标作图,结果如图4 所示。当氢氧化钠浓度为4%时,平均聚合度显著下降(p<0.05),降解效果达到最好,随后继续增大氢氧化钠浓度,降解效果不显著(p>0.05)。结果表明,氢氧化钠浓度过低或过高会不利于原花青素的降解,总体来看,氢氧化钠降解对原花青素聚合度的降低有一定的效果,且每个浓度处理的原花青素平均聚合度均小于4。

图4 氢氧化钠浓度对平均聚合度的影响 Fig.4 The influence of sodium hydroxide concentration on the average degree of polymerization
2.2.3 处理时间对降解效果的影响
选择氢氧化钠作为降解碱液,在氢氧化钠浓度为4%,处理温度60℃的条件下,分别设置20、30、40、50、60 min 的处理时间,以处理时间为横坐标,平均聚合度为纵坐标作图,结果如图5 所示。时间为20 min~30 min 时,降解效果差异显著(p<0.05),处理30 min 时,降解效果达到最佳,平均聚合度为2.50,随处理时间增加,平均聚合度再次上升,且40、50 min平均聚合度差异均不显著(p>0.05),50 min~60 min时差异显著(p<0.05)。结果显示,处理时间对原花青素平均聚合度的降解有一定的影响,是因为碱液与底物反应需要一定的时间,时间过长或过短均不利于反应进行[31]。
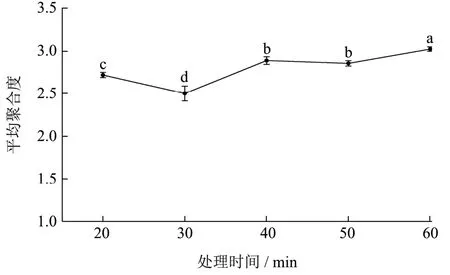
图5 处理时间对平均聚合度的影响 Fig.5 Effect of treatment time mean polymerization degree
2.2.4 处理温度对降解效果的影响
选择氢氧化钠作为降解碱液,在氢氧化钠浓度为4%,处理时间30 min 的条件下,分别设置40、50、60、70、80℃的处理温度,以处理温度为横坐标,平均聚合度为纵坐标作图,结果如图6 所示。当温度为40~50℃时,平均聚合度虽然有所降低,但差异不显著(p>0.05),当升温至60℃时,降解效果达到最佳,平均聚合度变化差异显著(p<0.05),随着温度升至70℃~80℃,平均聚合度差异不显著(p>0.05),是因为温度越高,高聚原花青素越不稳定[27]。

图6 处理温度对平均聚合度的影响 Fig.6 Effect of treatment temperature mean degree of polymerization
2.3 氢氧化钠降解响应面试验结果
2.3.1 建立回归模型
以2.2 单因素试验结果为依据,选择氢氧化钠为降解碱液,氢氧化钠浓度4%、处理时间30 min、处理温度60℃,根据Box-Behnken 原理,以A(氢氧化钠浓度)、B(处理时间)、C(处理温度)为自变量,原花青素平均聚合度为响应值,进行试验优化设计,如表3 所示。

表3 响应面试验因素水平表 Table 3 Response surface test factor level table
采用三因数三水平的试验分析,进行完全随机组合,得到17 组试验,如表4 可见。

表4 响应面试验设计和结果 Table 4 Design and results of response surface test
应用Design-Expert.V 8.0.6.1进行响应面多元回归拟合分析,得到葡萄籽高聚原花青素通过氢氧化钠降解后的平均聚合度与A、B、C 三个因素之间的二次多元回归模型
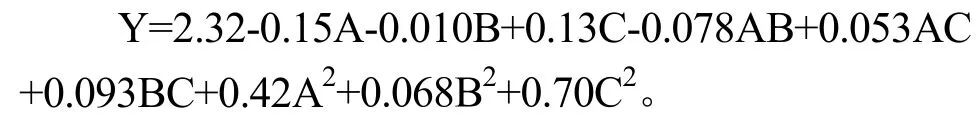
注:Y 为平均聚合度,A 为氢氧化钠浓度、B 为处理时间、C 为处理温度。
通过比较回归方程中一次项系数大小的绝对值,可以判断影响因素的主次性。由方程可知,对葡萄籽原花青素平均聚合度影响最大的是氢氧化钠浓度,其次是处理温度,最后是处理时间。
2.3.2 回归模型方差分析及显著性分析
回归系数和显著性用P 值和F 值来表示,回归模型的方差分析见表5,R2=0.9948,校正决定系数R2Adj=0.9880,说明该模型可较好地反映高聚原花青素的降解效果与氢氧化钠浓度、处理时间和处理温度之间的关系,且方法可靠。整体模型极显著(p<0.01),表明方程和试验拟合度好,失拟项不显著(p>0.05),表明氢氧化钠降解高聚原花青素回归模型的建立能解释响应的结果,试验设计可行。此外,回归模型中A、C、BC、A2、C2对原花青素降解效果影响极显著(p<0.01),AB、B2对其降解效果影响显著(p<0.05),B、AC 为不显著(p>0.05)。

表5 回归模型方差分析及显著性检验 Table 5 Analysis of variance and significance test of regression model
2.3.3 因素间的交互作用分析
各因素对原花青素平均聚合度的影响见图7。通过Design-Expert.V 8.0.6.1 软件模拟的各因素间交互作用对原花青素平均聚合度影响作用的强弱,并绘制响应面图与等高线图。试验设计中各因素对响应值的影响可以通过响应曲面的走势来体现,走势越陡峭,表明交互作用的两因素对响应值的影响越显著,响应值的变化越灵敏,反之则走势越平缓[35]。等高线的疏密程度和形状反应两因素互作效应的强弱,曲线越密集且形状呈椭圆形,表明两因素互作效应显著,若曲线越稀疏且呈圆形,则互作效应不显著[36]。如响应面图7a~c 所示,其中7b 的走势最陡峭,表明氢氧化钠浓度和处理温度这两个因素的交互作用对原花青素平均聚合度的影响较显著,而图7a 和7c 的走势较平缓,表明处理时间与氢氧化钠浓度、处理时间与处理温度两两因素的交互作用均较弱;如图7d~f 所示,3 个等高线图均为椭圆形,表明3 个因素间均存在交互作用。


图7 氢氧化钠浓度、处理时间、处理温度交互作用的三维响应面图和等高线图 Fig.7 Three-dimensional response surface plot and contour plot of the interaction of lye concentration,treatment time,and treatment temperature
2.3.4 验证试验
通过Design-Expert.V 8.0.6.1 软件分析,优化后的最佳降解工艺为碱液浓度4.39%、处理时间31.08 min、处理温度58.93℃,在此条件下原花青素平均聚合度的预测值为2.30。为了方便实际操作,将降解条件修正为氢氧化钠浓度4.40%、处理时间31 min、处理温度59℃,在此工艺下做3 次平行验证试验,原花青素平均聚合度为2.37<4(n=3),即为低聚原花青素,与预测值非常接近,说明模型可以较好地反映原花青素的降解工艺,表明工艺的参数是可行的。
2.4 氢氧化钠降解对原花青素及抗氧化活性的影响
2.4.1 原花青素含量及组分变化
采用梯度洗脱对原花青素混合标准品进行HPLC分析,由表6、图8 可知,8 种标准品单峰无重合且分离度良好,可以进行样品检测。
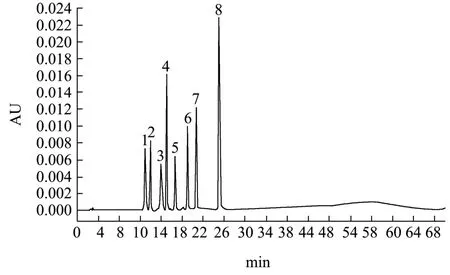
图8 原花青素混标液相结果 Fig.8 Procyanidin mixed standard liquid phase results

表6 原花青素保留时间及标准曲线 Table 6 Proanthocyanidins retention time and standard curve
以儿茶素为标准品,采用盐酸-香草醛法(紫外分光光度法),通过计算不同处理原花青素含量变化(图9a),并采用HPLC 分析不同处理原花青素的组分变化(图9b),由图可见,不同处理条件下原花青素含量和HPLC 分析原花青素组分,均呈现先上升后下降的趋势,且氢氧化钠降解的ECG 峰面积均大于高聚原花青素,三聚体全部降解成小分子单体、ECG 和二聚体。对响应面最佳降解工艺处理的样品进行分析可得,原花青素含量比高聚原花青素增加了1.68 倍;单体、ECG 和二聚体峰面积分别增加了14267.50、28304.00、52998.33,是高聚原花青素的1.36、27.37和2.48 倍,总峰面积增加了1.80 倍。

图9 不同处理原花青素含量(a)及HPLC 分析不同组分变化(b)结果 Fig.9 The content of proanthocyanidins in different treatments (left) and the changes of different components in HPLC analysis (right)
2.4.2 氢氧化钠降解原花青素抗氧化活性
以Trolox 为标准品对照,结果表示为Trolox 当量(TE)(μmol Trolox/g DW),考察氢氧化钠浓度、处理时间和处理温度对抗氧化活性的影响。
氢氧化钠降解后原花青素DPPH、ABTS 自由基清除能力如图10 所示。随着氢氧化钠浓度增大,处理时间延长,处理温度增加,原花青素DPPH、ABTS自由基清除能力整体呈现先增大后减小的趋势。

图10 不同处理对DPPH(a)、ABTS(b)抗氧化活性的影响 Fig.10 Effects of different treatments on the antioxidant activity of DPPH (a) and ABTS (b)
当氢氧化钠浓度10%、处理时间40 min、处理温度60℃时,DPPH 自由基清除能力最高,分别为1898.11、2156.85、1773.52 μmol Trolox/g DW;当氢氧化钠浓度6%、处理时间30 min、处理温度60℃时,ABTS 自由基清除能力最高,分别为1815.38、2131.97、1981.15 μmol Trolox/g DW;对响应面最佳降解工艺处理的样品,进行体外抗氧化活性的测定,其结果表明与高聚原花青素相比,氢氧化钠降解后的DPPH、ABTS 自由基清除能力为2055.82、1999.13 μmol Trolox/g DW,分别提高了2.41 倍和2.19 倍。有研究表明ECG 的抗氧化活性高于原花青单体[37],并且原花青素二聚体的抗氧化活性比单体的抗氧化活性强[38],从图9b 可以看出,不同处理时间组富含ECG 组分和原花青素二聚体,且图10 的DPPH 和ABTS 自由基清除能力均强于其他处理组,结果表明,氢氧化钠降解可将高聚原花青素的平均聚合度降至4 以下,当平均聚合度越小,小分子单体、ECG、二聚体组分越高,DPPH 和ABTS 自由基清除能力均呈现较强的抗氧化活性,反之抗氧化活性则相对较弱,这是由于原花青素的抗氧化活性取决于其聚合度和结构特征的不同[39]。
3 结论
原花青素是不同聚合度聚合而成的复杂混合物,本文以霞多丽葡萄籽为原料,经脱脂后提取得到原花青素粗提物,通过聚合度分离,得到的高聚原花青素占原花青素含量的67.08%。通过单因素试验结果,确定碱降解种类为氢氧化钠,并在此基础上进行响应面条件优化,以氢氧化钠浓度4.4%、处理时间31 min、处理温度59℃为最佳降解工艺,降解后原花青素平均聚合度为2.27,且平均聚合度<4;原花青素含量增加了1.68 倍;单体、ECG 和二聚体峰面积分别增加了14267.50、28304.00、52998.33,总峰面积增加了1.80 倍。DPPH、ABTS 自由基清除能力分别提高了2.41 倍和2.19 倍。综上,氢氧化钠降解作为一种低成本、操作便捷的方法,可用于高聚原花青素的降解,从而得到聚合度低、抗氧化活性更强的低聚原花青素。

