QuEChERS-液相色谱-串联质谱法测定南瓜中噻虫胺和氟啶虫胺腈的残留量
杨晋青,俞所银,葛宇
(上海市质量监督检验技术研究院,上海 200233)
噻虫胺和氟啶虫胺腈是新型烟碱类广谱杀虫剂,主要通过激活烟碱型乙酰胆碱受体,作用于昆虫的神经系统而表现出杀虫活性[1,2]。由于作用机制新颖、应用方式多样化、防效优良,高效、快速并且残效期长,能有效防治对烟碱类、菊酯类,有机磷类和氨基甲酸酯类农药产生抗性的吸汁类害虫,故常被用于瓜果类蔬菜的害虫防治,是害虫综合防治优选药剂。但不科学合理使用的现象比比皆是,如为达到短期防效盲目加大施药量,施药后没有达到安全采收间隔期采收上市等,因此,农产品中农药残留含量超标现象时有发生。GB 2763-2019《食品安全国家标准食品中农药最大残留限量》中规定了氟啶虫胺腈在瓜类蔬菜中的最大残留限量(MRLs)为0.5 mg/kg、尚未制定噻虫胺在瓜类蔬菜中的最大残留限量[3]。
目前噻虫胺和氟啶虫胺腈的检测技术方面主要集中在液相色谱、气相色谱和液质联用方面[4-7]。前处理技术主要包括乙腈匀浆提取-固相萃取柱净化和乙腈匀浆提取-基质分散萃取。现行国家标准GB/T 20769-2008《水果和蔬菜中450 种农药及相关化学品残留量的测定液相色谱-串联质谱法》包括了噻虫胺,但不包括氟啶虫胺腈;而且前处理方法需要匀浆提取、旋转浓缩、固相萃取柱净化、再次旋转浓缩和氮气吹干等多个步骤,存在过程复杂且耗时较长、结果重现性差和方法回收率低等问题,不利于大批量样品的高效检测。利用简单的样品前处理方法和成本较低的检测手段获得结果准确度高、数据重现性好和灵敏度高的检测结果是目前农药残留研究者的共同追求。“QuEChERS”方法作为一种基质分散固相萃取净化技术,由于具有快速,简单,经济,有效,稳定,安全的特点,正越来越普遍用于食品和农产品中的农药多残留分析[8,9]。
南瓜含有大量的糖类物质,另外还含有丰富的甾类及酚类化合物,样品组成较为复杂。现尚未见同时检测南瓜中噻虫嗪和氟啶虫胺腈的方法报道。为了有效监控南瓜中噻虫胺和氟啶虫胺腈两种农药残留的情况,研究建立高效准确、同时测定噻虫嗪和氟啶虫胺腈农药残留的检测方法,对于保障食品安全、进行农药安全性评价具有重要意义。本研究采用“QuEChERS”前处理技术,乙腈作为提取试剂,结合灵敏度高、分析时间短的LC-MS/MS 分析检测手段,在选择比较不同“QuEChERS”净化包的基础上,优化并建立了噻虫胺和氟啶虫胺腈在南瓜中的残留分析方法,为噻虫胺和氟啶虫胺腈在南瓜上的残留检测提供方法参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
乙腈,甲酸均为色谱纯;氯化钠(分析纯),国药集团化学试剂有限公司;水为符合GB/T 6682 规定的一级水,Milli-Q Synthesis 超纯水系统(密理博公司)制备。cleanert 萃取盐包(内含6 g 无水硫酸镁(MgSO4)、1.5 g 醋酸钠(NaAc)),天津博纳艾杰尔有限公司;QuEChERS 分散固相萃取管A(15 mL 离心管中装150 mg 乙二胺-N-丙基硅烷(primary secondary amine,PSA)、900 mg MgSO4)、QuEChERS分散固相萃取管B(15 mL 离心管中装400 mg PSA、400 mg 十八烷基键合相硅胶(C18)、1200 mg MgSO4),美国Agilent 公司;QuEChERS 分散固相萃取管C(2 mL 离心管中装50 mg PSA、100 mg C18、100 mg MgSO4),天津博纳艾杰尔有限公司;Carbon/NH2固相萃取小柱D(500 mg,6 mL),美国Agilent 公司。
标准储备溶液噻虫胺(纯度≥98.0%,100 µg/mL)、氟啶虫胺腈(纯度≥98.0%,100 µg/mL),天津阿尔塔科技有限公司。
混合标准溶液的配制取适量100 µg/mL 噻虫胺储备液和100 µg/mL 氟啶虫胺腈储备液,用乙腈配制成质量浓度为0.2 µg/mL 氟啶虫胺腈和1 µg/mL 噻虫胺的混合标准溶液。
标准工作曲线溶液的配制精确吸取一定量的混合标准溶液,用乙腈稀释成标准工作曲线溶液,使噻虫胺的浓度2.5、5、10、20、50、100 μg/L;氟啶虫胺腈的浓度为0.5、1、2、5、10、20 μg/L。
基质匹配工作曲线溶液的配制:取空白样品按样品前处理过程进行处理,得到空白基质提取净化液,用该基质溶液稀释混合标准溶液,配制成适当质量浓度的标准工作液,用于LC-MS/MS 定量分析。
1.1.2 仪器与设备
高效液相色谱仪,日本岛津公司LC-20AD;三重四级杆串联质谱仪,美国AB SCIEX 4000;其他设备包括超声仪,上海科导超声仪器有限公司;多样品氮吹浓缩仪,美国ATR 公司;旋转蒸发仪,德国Heidolph公司;Vortex-Genie 2 涡旋振荡器,美国Scientific Industries 公司;离心机,德国Heidolph 公司;0.22 μm有机相滤膜,Dikma 公司。
1.2 实验方法
1.2.1 色谱条件
色谱柱Waters ACQUITY UPLC○R BEH C18(2.1 mm×100 mm,1.7 μm),柱温:35℃;进样体积:2 µL;流动相为0.1%甲酸水溶液和乙腈,梯度淋洗条件列于表1。
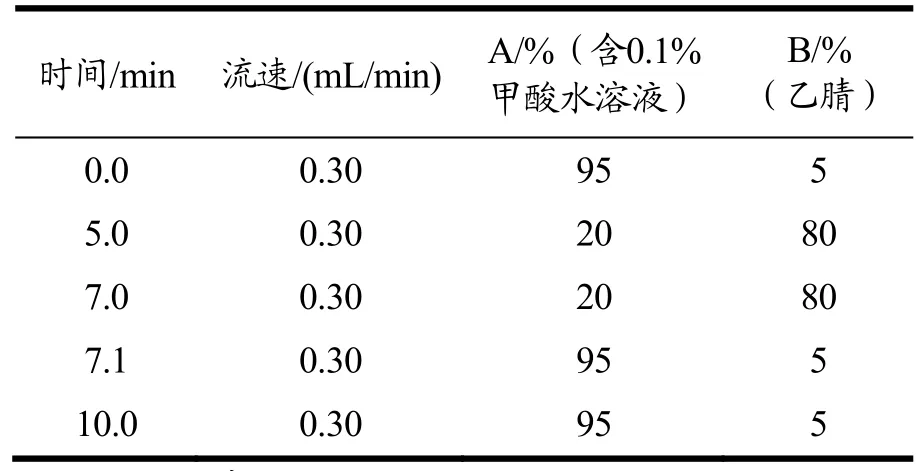
表1 梯度洗脱表 Table 1 Gradient profile
1.2.2 质谱条件
离子源:ESI;电喷雾电压:+4000 V;雾化气压力:60 psi;辅助加热气压力:60 psi;气帘气压力:20 psi;离子源温度:400℃;检测方式:多反应监测(MRM);噻虫胺和氟啶虫胺腈的定性定量离子对、碰撞能量等质谱分析参数见表2,MRM 色谱图见图1。
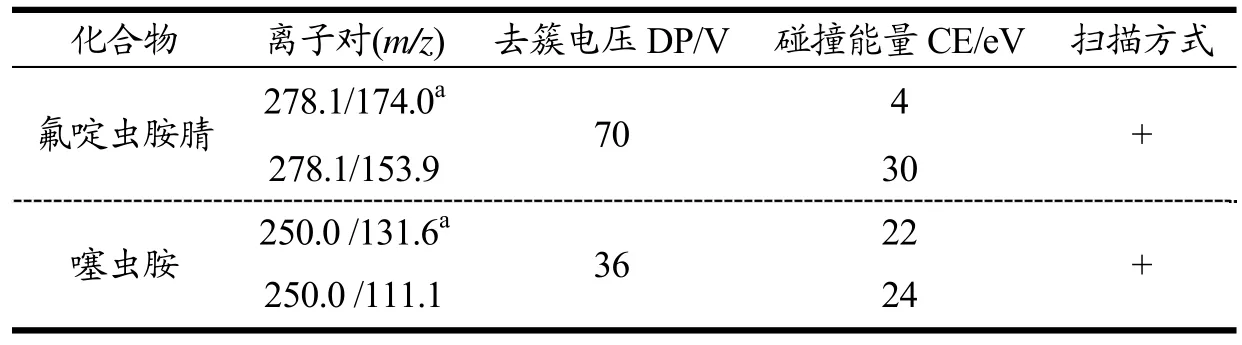
表2 噻虫胺和氟啶虫胺腈的质谱分析参数 Table 2 Parameters of mass spectra of clothianidin and sulfoxaflor
1.2.3 样品处理方法
将农场生产的南瓜,去柄粉碎并混合均匀,准确称取15 g(精确至0.01 g),置于50 mL 离心管中,准确加入15 mL 乙腈,以10000 r/min 均质提取1 min,加入6 g 无水MgSO4、1.5 g NaAc,立即涡旋混匀后,以9000 r/min 离心1 min。吸取5.0 mL 上层有机相转移至装有150 mg PSA 和900 mg 无水MgSO4粉末的离心管中,加入后立即将其涡旋混匀2 min,9 000 r/min 离心1 min,取上清液过0.22 µm 滤膜于进样小瓶中,待LC-MS/MS 测定。
1.2.4 数据处理
采用AB Sciex 公司的Analyst 1.5.2 软件进行数据采集;采用Excel 和Origin 软件进行数据统计分析计算。
2 结果与分析
2.1 仪器条件的确立
2.1.1 质谱条件的优化
本方法采用ESI 源和多反应监测模式对噻虫胺和氟啶虫胺腈目标化合物进行分析。采用1 mg/L 的待测化合物的标准溶液以流动注射的方式分别注入离子源,分别用ESI 正离子和负离子模式进行全扫描模式,扫描后发现噻虫胺和氟啶虫胺腈在ESI 正离子模式下响应更高,因此选择采用正离子扫描在此模式下确定了噻虫胺和氟啶虫胺腈母离子分别为m/z278.1 和250.0。通过优化离子化电压、雾化气压力、辅助气压力和去簇电压使母离子丰度及稳定性最佳,从中选出丰度最高的去簇电压作为最佳去簇电压;然后在Product 模式下,扫描确定母离子产生的响应最高的2个子离子作为定量离子和定性离子。然后在MRM 模式下,分别对不同母离子产生的子离子的碰撞能量进行优化,从中选出丰度最高的碰撞能量作为最佳碰撞能量,建立MRM 采集模式。图1 和图2 分别为噻虫胺和氟啶虫胺腈MRM 色谱图和碰撞诱导解离质谱图。
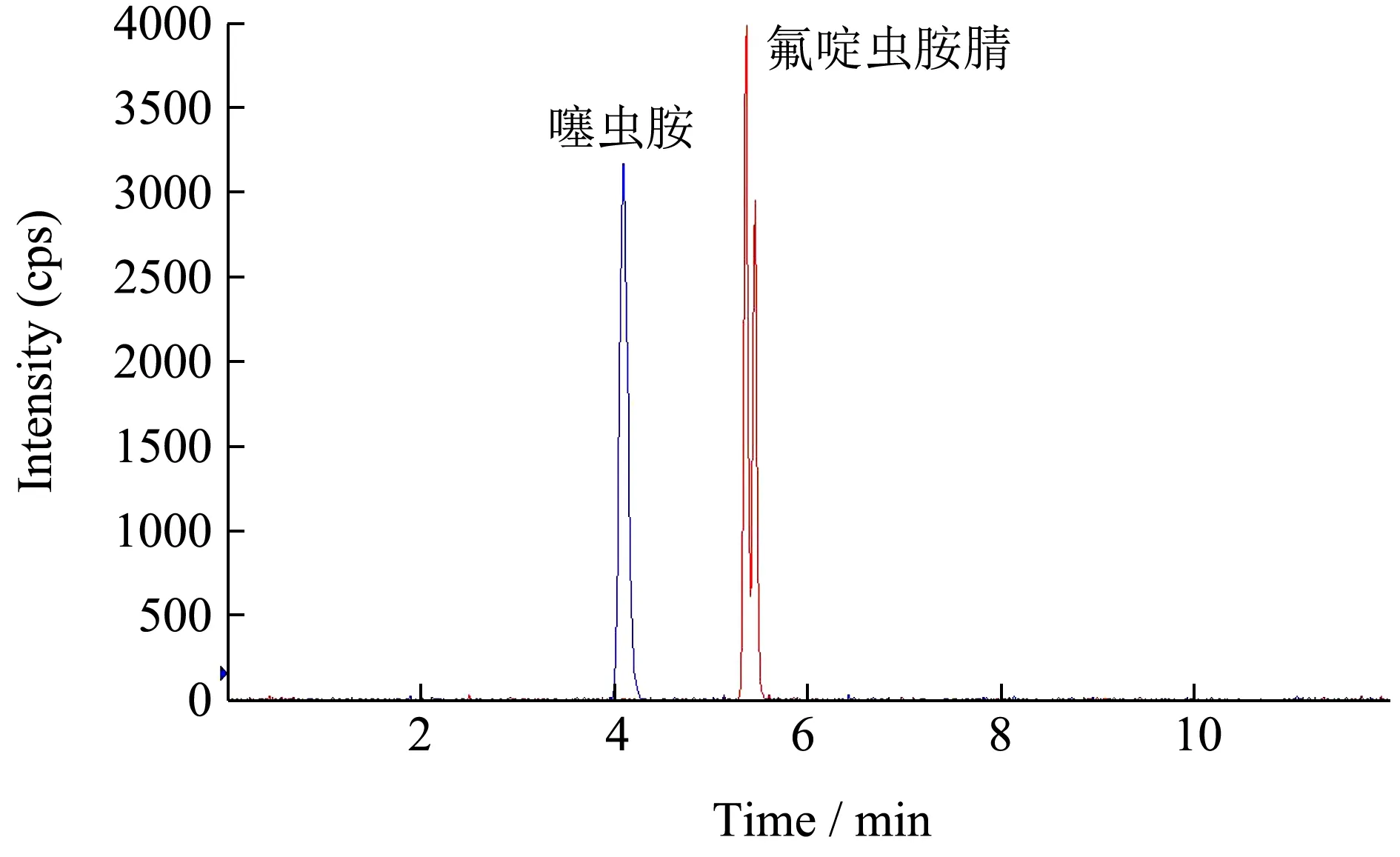
图1 噻虫胺和氟啶虫胺腈标准溶液的MRM 图 Fig.1 MRM of clothianidin and sulfoxaflor standard solutions

图2 噻虫胺和氟啶虫胺腈标准溶液的碰撞诱导解离质谱图 Fig.2 CID of clothianidin and sulfoxaflor standard solutions
2.1.2 色谱柱和流动相选择
试验发现,采用Waters ACQUITY UPLC○R BEH C18(2.1 mm×100 mm,1.7 μm)色谱柱,比较了乙腈和甲醇作为有机流动相的色谱分离情况,当甲醇作为有机流动相时,氟啶虫胺腈响应值会大大降低。水相流动相中加入了0.1%甲酸溶液后,改善了质谱的离子化效果,从而大大提高了质谱检测的灵敏度,因此最终选择乙腈和含0.1%甲酸水溶液为流动相按照2.2.1色谱条件进行梯度洗脱试验。在柱温为35℃,流动相流速为0.3 mL/min,进样量为2 μL 的条件下,可获得南瓜样品基质中噻虫胺和氟啶虫胺腈稳定、良好的分离效果。并且比较了几个公司生产的色谱柱,结果显示,采用Waters ACQUITY UPLC○R BEH C18(2.1 mm×100 mm,1.7 μm)色谱柱分析时,待测农药保留时间以及峰形均比较理想。因此,选择该柱作为液相色谱分离柱。图l 为采用上述色谱检测条件对样品的检测结果。由图1 可以看出:噻虫胺和氟啶虫胺腈标准样品的出峰时间分别为4.07 min 和5.45 min,峰形良好,且与南瓜样品基质无干扰。
2.2 样品前处理条件的确定
2.2.1 提取溶剂的选择
本研究采用QuEChERS 技术进行了样品的提取,为了促使加入的乙腈提取液和水相分层,加入1.5 g 无水醋酸钠和6 g 无水硫酸钠粉末包除去提取液中的水分含量,保证提取充分,提高提取效率。分别比较了乙腈和1%乙酸乙腈溶液作为提取试剂时对含有噻虫胺和氟啶虫胺腈的加标样品的提取实验,结果如图3所示。实验结果表明,噻虫胺的平均回收率分别为87.1%和85.7%,氟啶虫胺腈的平均回收率分别为95.2%和93.0%。乙腈的提取效率相对较高,可能由于乙腈提取时干扰杂质较少而回收率偏高,故选用乙腈作为提取溶剂。

图3 不同提取试剂的回收率 Fig.3 Recoveries of clothianidin and sulfoxaflor by different extraction reagents
2.2.2 提取时间的确定
本实验比较了超声辅助提取对噻虫胺和氟啶虫胺腈回收率的影响。以南瓜空白样品为基质,噻虫胺和氟啶虫胺腈加标浓度分别为10 μg/kg 和2 μg/kg。固定其它前处理条件,比较样品超声时间分别为5、10、15、20 min 的回收率,结果见图4。实验结果表明,超声提取10 min 时回收率最高,且随超声时间增加回收率反而降低,可能是因为随着提取时间的延长,杂质成分也被进一步提取出来,影响目标物的离子化效率导致回收率反而降低。所以,综合以上因素考虑,本方法采用超声10 min 作为辅助提取方法。
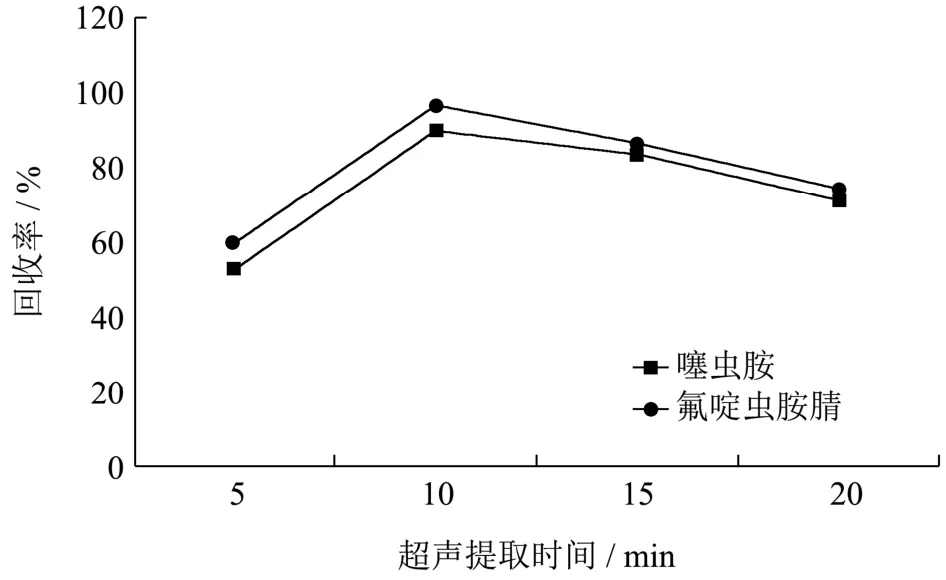
图4 不同超声提取时间的回收率 Fig.4 Recoveries of clothianidin and sulfoxaflor by different extraction times
2.2.3 基质分散净化剂的选择

表3 经不同种类净化剂处理后的回收率 Table 3 Recoveries of clothianidin and sulfoxaflor by different types of purifiers
本实验比较了QuEChERS 不同种类净化剂对噻虫胺和氟啶虫胺腈回收率的影响。将噻虫胺(浓度为10 μg/L)和氟啶虫胺腈(浓度为2 μg/L)南瓜基质混合标准溶液,经装有不同种类净化剂的3 种QuEChERS 分散固相萃取管和1 种固相萃取小柱(具体成分见1.1 节)进行净化处理,处理后的回收率结果见表2。实验结果表明,不同净化剂对噻虫胺的回收率分别为89.4%、83.7%、68.8%和22.5%,对氟啶虫胺腈的回收率分别为98.0%、86.3%、60.2%和39.4%。萃取管A 的提取回收率最高;萃取管B、C 和萃取小柱D 提取回收率相对较低。由于萃取管B 和C 中均含有C18 吸附剂,在除去杂质的同时可能对目标物有不同程度的吸附导致回收率偏低;萃取小柱D 由于操作相对复杂,并且受到洗脱次数的限制导致回收率较低;最终采用移取5 mL 提取液到含有150 mg PSA 和900 mg MgSO4的固相萃取管A 来去除提取液中的杂质成分,从而起到净化除杂降低基质干扰的效果。
2.3 线性范围和基质效应
将2.2 节中配制的系列标准工作溶液,在优化的色谱条件和质谱条件下进行测定,以峰面积为纵坐标(y),质量浓度为横坐标(x)绘制校准曲线,按公式(1)计算基质效应(ME),噻虫胺和氟啶虫胺腈的溶剂标准工作曲线溶液(2.1.1)和南瓜基质匹配工作曲线溶液(2.1.1)的线性方程见表4。噻虫胺在2.5~100 μg/L之间,氟啶虫胺腈在0.5~20 μg/L 之间的范围内线性关系良好,相关系数均大于0.995。并且均存在明显的基质抑制效应。

表4 噻虫胺和氟啶虫胺腈的线性范围、线性回归方程、相关系数、基质效应、检出限和定量限 Table 4 Linear ranges,linear regression equations,correlation coefficients,matrix effect,limits of detection (LODs) and limit of quantitation (LOQs) for clothianidin and sulfoxaflor

其中,Sm 和Ss 分别表示基质匹配标准曲线和溶剂标准曲线的斜率。当ME>0 时,说明为基质增强效应;ME<0,说明为基质抑制效应[10]。
2.4 方法的检出限和定量限
取一定浓度的空白样品基质加标溶液在优化的色谱条件和质谱条件下进行测定,按信噪比为3 计算方法检出限,按信噪比为10 计算方法定量限,结果见表4。噻虫胺和氟啶虫胺腈在南瓜基质中的检出限分别为2.5 和0.5 μg/kg,定量限分别为5.0 和1.0 μg/kg。
2.5 方法的回收率和精密度
在不含噻虫胺和氟啶虫胺腈的阴性南瓜样品中添加3 个水平(定量限的1 倍、2 倍和10 倍)的混合标准溶液,添加30 min 后按上述样品处理步骤进行残留量测定,将测定质量浓度与理论添加质量浓度进行比较,得到添加回收率,每个添加水平平行测定6 次,得其相对标准偏差(RSD),测定结果见表5。由表5可以看出,噻虫胺和氟啶虫胺腈在南瓜中添加平均回收率在88.5%~111.2%之间,相对标准偏差在1.12%~ 6.92%之间,说明本方法的回收率较高、重复性好。

表5 噻虫胺和氟啶虫胺腈在三个添加水平下的平均回收率及其RSD 值 Table 5 Average recoveries and RSDs of clothianidin and sulfoxaflor under three addition levels (n=6)
2.6 实际样品检测结果
按照本方法对农场生产的50 批次南瓜样品进行噻虫胺和氟啶虫胺腈检测,均未检出噻虫胺和氟啶虫胺腈。
3 结论
本实验在优化样品前处理条件和仪器条件的基础上,建立了QuEChERS 结合LC-MS/MS 测定南瓜中噻虫胺和氟啶虫胺腈残留量的检测方法。样品经乙腈均质提取和基质分散萃取法净化后,净化后的样液经0.22 μm 滤膜过滤后,采用液相色谱-串联质谱法测定。采用Waters ACQUITY UPLC○R BEH C18(2.1 mm×100 mm,1.7 μm)色谱柱分离,电喷雾离子化、正离子扫描方式和动态多反应监测模式检测,基质匹配标准溶液外标法定量。噻虫胺在2.5~100 μg/L(氟啶虫胺腈在0.5~20 μg/L)的范围内线性关系良好,相关系数分别为0.9994和0.9988。噻虫胺在5、10 和50 μg/kg(氟啶虫胺腈在1、2 和10 μg/kg)的3 个添加水平的平均回收率在88.5%~111.2%之间,相对标准偏差在1.12%~6.92%。噻虫胺和氟啶虫胺腈的方法定量限分别为1.0 μg/kg 和5.0 μg/kg。该方法快速简便、灵敏度高、重现性好,符合GB/T 27404-2008《实验室质量控制规范食品理化检测》的方法技术要求,可应用于实际南瓜样品中噻虫胺和氟啶虫胺腈残留量的检测分析。

