杨树菇凝集素诱导C57BL/6小鼠肝损伤和活化CD8+T细胞
李岳亮,陈丽琼,文钰棣,黄壮霖,曾淑娴,梁一
(广东医科大学医学技术学院检验医学研究所,广东省医学分子诊断重点实验室,广东东莞 523808)
食用型蘑菇具有美味、营养和药用价值高等特点,它富含各种酶和生物活性物质,包括多糖、多萜、酚类、活性多肽/蛋白等,其具有抗肿瘤、降血压、抗炎、抗病毒、抗氧化、免疫调节等作用,因此,在中国、美国、荷兰、波兰等国家倍受欢迎[1]。
蘑菇的毒性研究主要集中在毒蘑菇中的毒伞肽、毒蝇蕈醇、鹅膏蕈氨酸等活性作用[2,3],食用蘑菇的毒性报道较少。例如欧洲、北美食用已久的黄口菇,近期被报道过量食用会造成横纹肌溶解,并伴随血浆肌酸激酶和肝脏转氨酶的异常升高[4]。在亚洲被称为“天使之翼”的贝形圆孢侧耳在日本因其脱髓鞘活性引发的脑病致死17人[5]。还有一些食用蘑菇例如双孢蘑菇、鸡油菌、平菇等,或可诱导突变、溶肌、脏器出血、肝脏炎症等作用[6]。食用蘑菇中被鉴定到的毒性成分包括林地蘑菇、鸡油菌中有微量的毒伞肽[6],亚稀褶黑菇含有cycloprop-2-ene carboxylic acid,棕灰口蘑含有saponaceolide B 和M,平菇中含有造成高钾血症、心动过缓的磷脂酶蛋白和抑制蛋白合成的奥来毒素[7],双孢蘑菇中的Agaritin 可诱导突变,贝形圆孢侧耳含有一种二甲亚胺氨基酸,金针菇中含有心脏毒性的flammutoxin 蛋白等。毒性成分的鉴定难度也是食用菌毒性有所争议的重要原因之一。
杨树菇(Agrocybe aegerita)是一种常用的食用蘑菇,之前研究发现,杨树菇水提物组分在小鼠试验中表现出致死作用,半致死剂量(LD50)为8.77 g/kg,在BALB/c 小鼠模型中,水提物组分灌胃有显著的肝脏毒性[8]。进一步研究发现,水提物中蛋白组分主要是凝集素AAL(Agrocybe aegeritalectin),它是由含有碳水化合物特异性识别区域的158 个氨基酸组成的分子量为18 ku 的半乳糖凝集素,具有抗肿瘤凋亡活性[9]。AAL 可诱导HeLa 细胞[10]和肝癌细胞[11]凋亡,对消化酶的作用耐受,口服或尾静脉注射具有显著的肝脏毒性[8]。AAL 的肝脏毒性损伤机制不明,因此,本文将研究AAL 在C57BL/6 小鼠模型中的作用,为食用蘑菇毒性研究和安全饮食提供数据。
1 材料与方法
1.1 实验材料
C57BL/6 小鼠,雌性,SPF 级,6~8 周龄,购于南方医科大学,动物合格证书由广东省实验动物研究所出具。
小鼠谷丙转氨酶(ALT)试剂盒,小鼠谷草转氨酶(AST)试剂盒,南京建成生物工程研究所;Trizol,Invitrogen;逆转录试剂盒(RR047A),Takara;SYBR(RR820A),Takara;Anti-mouse CD3e FITC,eBioscience;Anti-mouse NK1.1 APC,eBioscience;Anti-mouse F4/80-APC-eFluor,eBioscience ;Anti-mouse CD4-APC-eFluor,eBioscience;Anti-mouse CD8a PerCP Cyanine5.5,eBioscience;GAPDH,F:5′-G CAGTGGCAAAGTGGAGATT-3′,R:5′-CGCTCCTG GAAGATGGTGAT-3′;IL-10,F:5′-ACAACATACTG CTAACCGACTC-3′,R:5′-CTGGATCATTTCCGATA AGG-3′;IL-33,F:5′-GATGGGAAGAAGCTGATGGT G-3′,R:5′-TTGTGAAGGACGAAGAAGGC-3′;IL-27,F:5′-CTGTTGCTGCTACCCTTGCT-3′,R:5′-GGAA ACATTGGGAAGATGGTAT-3′;IFN-γ,F:5′-AGCAA CAACATAAGCGTCAT-3′,R:5′-CCTCAAACTTGGC AATACTC-3′;TNF-α,F:5′-CTACTGAACTTCGGGG TGAT-3′,R:5′-CAGGCTTGTCACTCGAATT-3′。
1.2 实验方法
1.2.1 杨树菇凝集素的制备
杨树菇子实体购买自福建省三明食用菌研究所,将之研磨成干粉后,通过浸泡、过滤和离心方式收集滤液。在滤液中加入硫酸铵至饱和度为40%,搅拌20 min 后离心弃沉淀收集上清。在上清中加入硫酸铵至80%饱和度,沉淀60 min 后离心收集沉淀。用磷酸盐缓冲溶液(PBS)重悬沉淀并将之透析除盐得到杨树菇总蛋白。将杨树菇总蛋白用0.45 μm 的滤膜进行抽滤。安装lactose 亲和层析柱,用PBS 平衡柱子30 min,调节机器的流速为1 mL/min。将杨树菇总蛋白溶液(置于冰上)上样到亲和层析柱。然后用PBS 溶液冲洗杂蛋白,直到280 nm 吸收线处于水平。用200 mMα-lactose PBS 缓冲液洗脱并收集目的蛋白AAL,并在PBS 缓冲液中充分透析,真空干燥后于-20℃保存。
1.2.2 AAL 诱导C57BL/6 小鼠肝脏损伤
将AAL 溶解在无菌PBS 中,配制成2.5 mg/mL的AAL 溶液。根据不同处理时间0 h、6 h 和9 h 把小鼠分为三组,每个处理组的小鼠数量n=7。0 h 组注射无菌PBS 溶液,6 h 组和9 h 组按照2.5 mg/kg 的剂量将AAL 尾静脉注射到C57BL/6 小鼠体内处理6 h 和9 h。三个时间点进行眼球采血,同时处死小鼠。血清用于检测转氨酶ALT 和AST 的活性,取小鼠部分肝脏组织做石蜡组织切片,部分肝脏组织用于提取肝脏总RNA 和单个核细胞分离、染色。
1.2.3 小鼠血清ALT 和AST 的检测
使用南京建成生物工程研究所的ALT 和AST 试剂盒,按照试剂盒说明书分别测定小鼠血清中的ALT和AST 两项指标。
1.2.4 小鼠肝脏组织石蜡切片与苏木精-伊红染色法(HE 染色)
小鼠眼球取血处死后,取肝脏组织,剪下一块组织(1.5 cm×1 cm×0.5 cm)置于包埋盒中,通过脱水、浸蜡、包埋、冰冻等操作后,用组织切片机将肝脏组织切成3 μm 厚的薄片。制作好的组织切片用HE 染色后,进行脱水、透明、封片等操作,以便在镜下观察。
1.2.5 Real-time PCR 测定小鼠肝脏组织细胞因子表达
用Trizol 法提取肝组织中的RNA,按照Takara的逆转录试剂盒说明书将肝脏组织中的RNA 逆转录为cDNA。按照Takara 的SYBR(RR820A)试剂说明书,用荧光定量PCR 仪检测并分析GAPDH、IL-10、IL-33、IL-27、IFN-γ和TNF-α的mRNA 表达水平。
1.2.6 小鼠肝脏单个核细胞表面抗原染色
小鼠眼球取血处死后,取肝脏组织。用生理盐水灌注清洗肝脏组织,并通过切块、研磨、胰酶消化和过滤将提取肝脏细胞。将提取的细胞用RPMI1640 培养基重悬并800×g 离心5 min。重复上述步骤一次后弃上清,用15 mL 33% Percoll 分离液将离心后的细胞沉淀重悬。室温条件下,800×g 离心30 min,弃上清。往细胞沉淀中加入1 mL RBC lysing buffer 破碎红细胞,3 min 后加入9 mL RPMI1640 培养基终止反应。800×g 离心5 min 后用RPMI1640 培养基重悬,重复上述步骤一次后获得单个核细胞。
设置空白对照管和单标抗体管。在100 μL 重悬细胞液中加入 Anti-mouse-NK1.1-APC、Anti-mouse-CD3e-FITC、Anti-mouse-NK1.1-APC、Anti-mouse-CD69-PE,Anti-mouse-F4/80-APC-eFluor、Anti-mouseCD4-APC-eFluor、Anti-mouse-CD8a-PerCP Cyanine5.5,4℃避光孵育30 min。加入3 mL PBS,1500 r/min 离心5 min 弃上清收集细胞,重复上述步骤一次,最后加入200 μL 2%多聚甲醛,避光4℃保存,24 h 内上机分析。
1.3 统计学方法
用SPSS 统计软件分析数据。小鼠血清ALT、AST检测结果,RT-PCR结果和流式细胞术结果均用()表示,p值小于0.05 具有统计学意义。
2 结果与讨论
AST/ALT 比值,n=7,***p<0.001,****p<0.0001;(c)分别取小鼠的肝脏和胰脏,(d)进行组织切片与HE 染色,组织切片的放大倍数均为400 倍。
2.1 尾静脉注射AAL诱导C57BL/6小鼠肝脏损伤
对C57BL/6 小鼠静脉注射AAL(2.5 mg/kg),在处理后的0 h、6 h、9 h 三个时间点通过眼球采血,其血清用于检测转氨酶活性,同时处死小鼠取其肝脏做石蜡组织包埋、切片及HE 染色。结果如图1a、1b所示,AAL 处理6 h 后,ALT 的测定值升高了134 倍,AST 的测定值升高了23 倍。处理9 h 后,ALT 的测定值升高了94 倍,AST 的测定值升高了19 倍。6 h组和9 h 组中的AST 与ALT 比值均小于1,提示AAL的处理可能引起非酒精性脂肪肝疾病。与对照组相比,AAL 处理6 h 和9 h 的C57BL/6 小鼠肝脏均出现肉眼条件下明显的肝损伤表征,包括肝脏淤血变暗和肿大;另外脾脏有变黑、肿大和淤血的现象(图1c)。在6 h和9 h 两个实验组之间,肝脏与脾脏的肉眼观察变化差异不明显。从肝脏组织HE 染色结果(图1d)可见,正常肝脏组织肝细胞以中央静脉为中心放射状排列形成肝板,相邻肝板之间的空隙为肝窦,是肝小叶内血液流通的管道。AAL 处理6 h 后,肝脏组织肝窦内出现红细胞淤积,肝实质细胞皱缩,连接消失,与周围的细胞脱离,大量肝细胞开始空洞化,坏死区还可见大量淋巴细胞、中性粒细胞等免疫细胞浸润。9 h 组的肝脏组织的肝窦红细胞淤积、肝细胞空洞化及免疫细胞浸润的程度减弱。
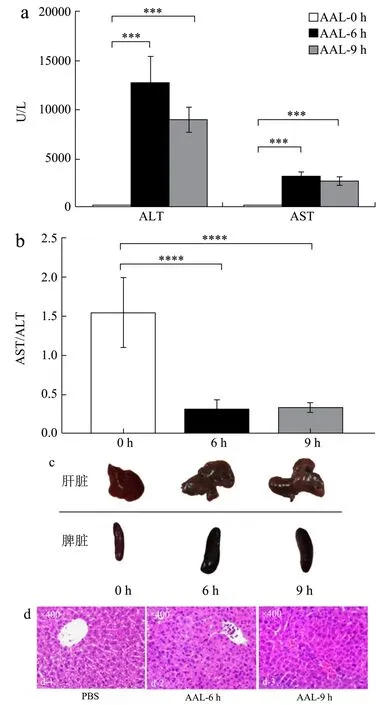
图1 尾静脉注射AAL 诱导C57BL/6 小鼠肝脏损伤 Fig.1 Tail intravenous injection of AAL induced liver injury in C57BL/6 mice
凝集素是一类广泛存在于真核细胞和细菌、病毒、真菌中的蛋白质或糖蛋白,能够保护或促进肝损伤。高剂量的槲寄生凝集素在小鼠模型中表现出致死性,低剂量的槲寄生凝集素具有肝脏毒性,并诱导血清AST 和ALT 显著升高[12]。接骨木果实中的核糖体灭活凝集素Ebulin f在年老小鼠模型中表现出致死活性,诱导包括肝脏坏死等消化器官的衰竭[13]。巴西青香木叶提取物及凝集素在荷S180 小鼠模型中均有抗肿瘤活性,但会引起肝脏组织的液泡化和脂肪肝[14]。另外,常用于诱导小鼠肝脏损伤模型的刀豆蛋白Con A(concanavalin A)也是一类凝集素[15]。结合研究结果提示,在食用或使用天然产物作为药物时,要注意其中是否有凝集素成分,探讨其安全使用剂量。
2.2 AAL 调节C57BL/6 小鼠肝脏细胞因子的mRNA 表达
检测C57BL/6 小鼠在尾静脉注射AAL 后6 h 和9 h肝脏组织五种细胞因子IL-10、IL-33、IL-27、IFN-γ和TNF-α的mRNA 表达变化情况。如图2 所示,与对照组相比,AAL 处理6 h 和9 h 组的肝脏IL-10、IL-33、IL-27、IFN-γ和TNF-α的mRNA 表达水平都显著升高(p<0.001)。6 小时组中,细胞因子的表达分别升高到25.14 倍(IL-10)、4.62 倍(IL-33)、5.14 倍(IL-27)、16.51 倍(IFN-γ)、28.10 倍(TNF-α)。9 小时组中,细胞因子的表达分别升高到7.60倍(IL-10)、3.22倍(IL-33)、1.52 倍(IL-27)、12.78 倍(IFN-γ)、10.99 倍(TNF-α)。
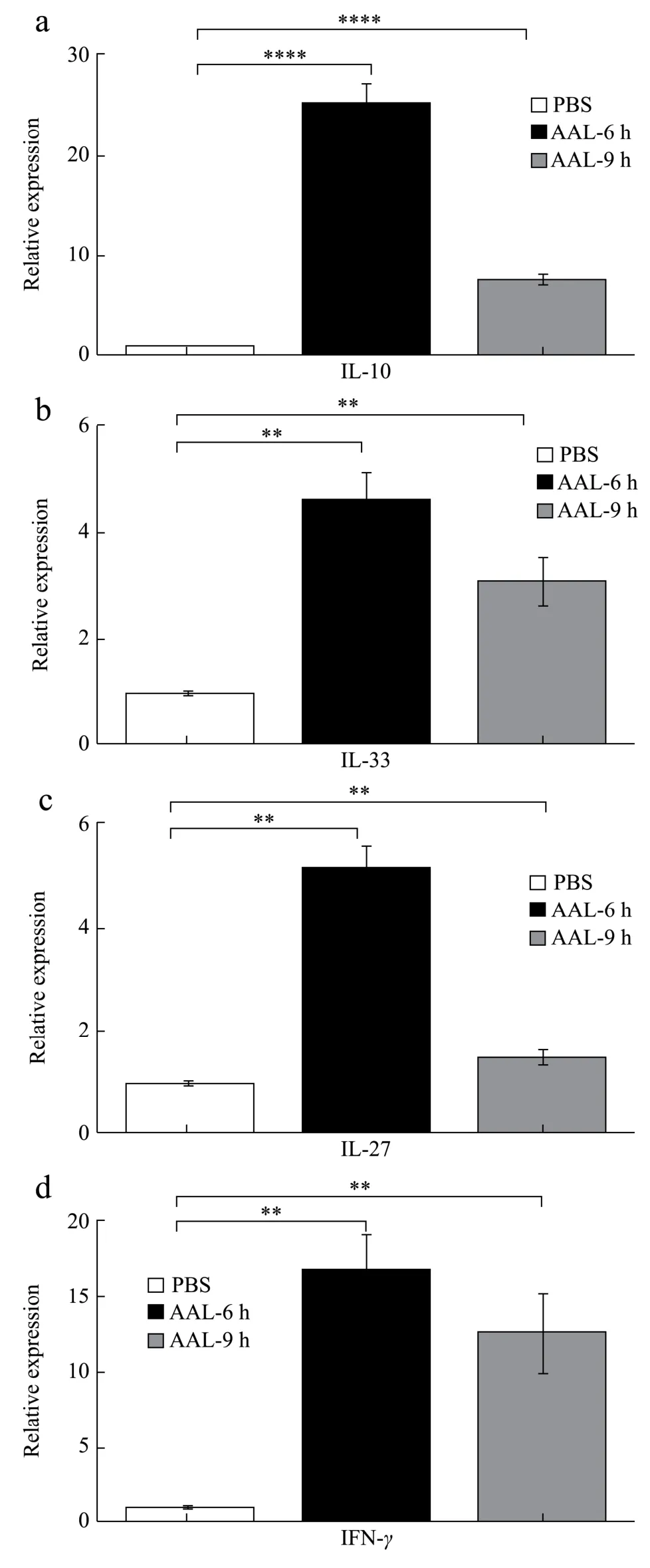
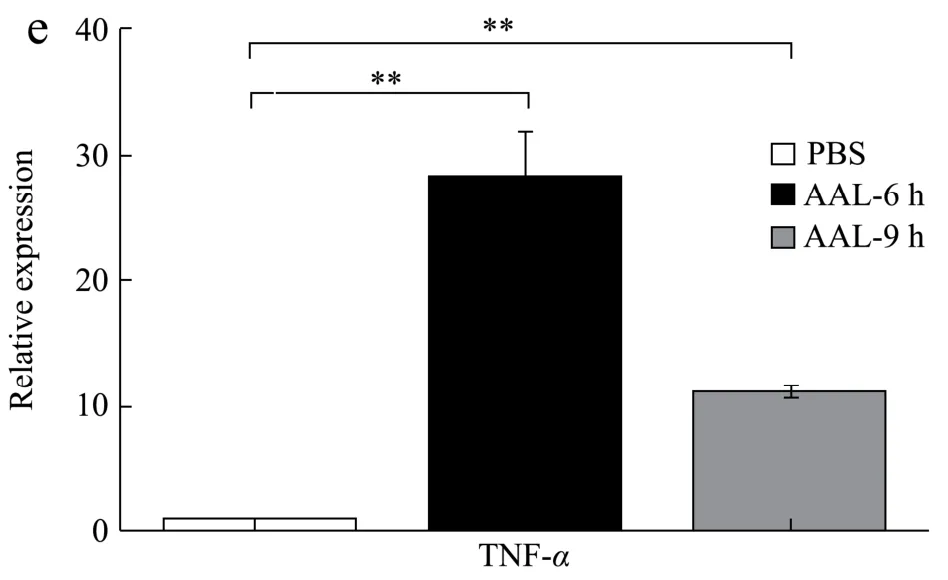
图2 AAL 调节C57BL/6 小鼠肝脏细胞因子的mRNA 表达 Fig.2 AAL regulated mRNA expression of cytokines in the liver of C57BL/6 mice
肝脏细胞因子的表达水平与肝损伤机制密切相关。肝损伤上调了IL-10 表达水平,增强巨噬细胞的吞噬功能,促进肝脏损伤的修复[16]。另一方面,肝脏中的巨噬细胞被IFN-γ诱导活化为M1,分泌TNF-α、IL-1β和IL-12,促进肝细胞凋亡和肝纤维化[17]。同时,肝损伤后高表达的IL-27 促进炎症反应,进而上调TNF-α和IL-6 的表达水平[18]。IL-33 在不同的肝脏损伤模型的作用机制不同,这可能与不同的免疫病理类型相关。在病毒性肝炎模型中,IL-33 通过Th2 细胞/IL-13/STAT6 诱导免疫抑制性中性粒细胞的发挥肝脏保护作用[19]。外源性IL-33 给药处理降低Con A 诱导的肝损伤小鼠的IFN-γ和TNF-α表达水平,减轻肝脏炎症[20];在Con A 诱导的肝损伤小鼠模型中,活化的CD8+T 细胞会损伤肝细胞,后者表达的IL-33 促进淋巴细胞IL-5 等炎症因子分泌[21]。另外在对乙酰氨基酚诱导的肝损伤小鼠模型中,阻断IL-33 后影响肝脏炎症因子的释放从而减轻肝脏损伤[22]。研究结果表明AAL 诱导小鼠肝损伤后,细胞因子IL-10、IL-33、IL-27、IFN-γ和TNF-α均参与肝损伤机制。
2.3 NKT 细胞和CD8+T 细胞参与了AAL 诱导C57BL/6 小鼠的肝脏损伤
为探究AAL 诱导C57BL/6 小鼠肝损伤的作用机制,通过分离肝窦单个核细胞结合流式细胞术,检测尾静脉注射AAL 后的C57BL/6 小鼠肝脏各类免疫细胞的变化情况。AAL(2.5 mg/kg)尾静脉注射C57BL/6小鼠,0 h、6 h、9 h 分离小鼠肝脏的单个核细胞,使用anti-CD3、anti-NK1.1 和anti-F4/80 荧光抗体染色结合流式细胞仪检测,通过设门(图3a、b),统计T细胞(CD3+T)、NKT 细胞(CD3+NK1.1+T)、Kupffer细胞(F4/80+)和NK 细胞(CD3-NK1.1+)占肝脏单个核细胞比例。结果表明,与对照组相比,6 h 组和9 h组小鼠肝脏T细胞比例由27.92%显著升高到45.95%和47.86%(p<0.05),NKT 细胞的比例由2.46%显著升高到6.36%和6.17%(p<0.05),而Kupffer 细胞和NK 细胞的比例没有显著改变(图3c)。
进一步用anti-CD3、anti-CD4 和anti-CD8 荧光抗体染色结合流式细胞仪检测,通过设门(图3d、e),统计CD4、CD8 T 细胞占单个核细胞的比例,以反映T 细胞亚群的变化。结果表明,与对照组相比,6 h 组小鼠肝脏CD8+T 细胞比例由17%显著升高到27.15%(p<0.05),而CD4+T 细胞的比例没有明显的改变(图3f)。
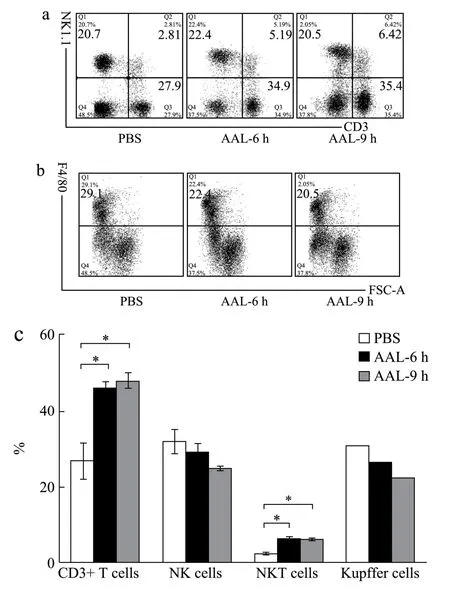
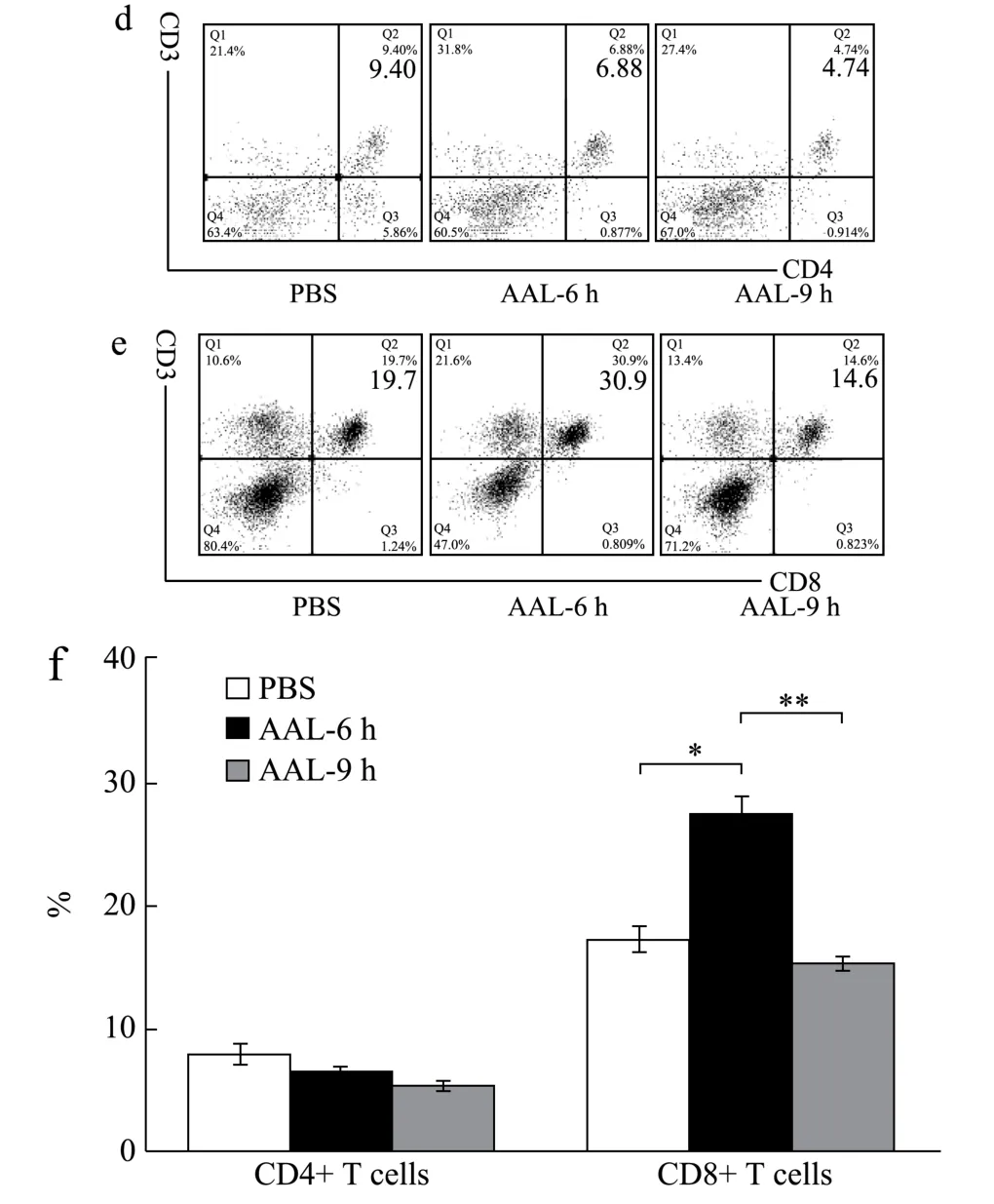
图3 注射AAL 后NKT 细胞和CD8+T 细胞数量的变化 Fig.3 The changes in number of NKT cells and CD8+T cells after AAL injection
正常肝脏中30%为非肝实质细胞,包括约50%的内皮细胞、20%的Kupffer 细胞和25%的淋巴细胞等[23,24]。在Con A 诱导的急性肝损伤模型中,Kupffer细胞、CD4+T 细胞、Treg 细胞和NKT 细胞均参与其中[25-27],且CD4+T 细胞是主要的效应细胞。这与AAL主要诱导CD8+T 细胞增多不同。另一关于AAL 诱导小鼠肝损伤的研究发现,AAL 可诱导T 细胞和NKT细胞的数量比例增加[28],这与该研究结果是一致的。
2.4 尾静脉注射AAL 促进了小鼠肝脏CD8+T细胞的活化
CD69 是T 淋巴细胞和天然杀伤细胞(NK 细胞)活化的表面标志[29,30],为进一步探索小鼠肝脏免疫细胞在AAL 处理后的活化情况。AAL(2.5 mg/kg)尾静脉注射C57BL/6 小鼠,0 h、6 h、9 h 分离小鼠肝脏的单个核细胞,用anti-CD3、anti-NK1.1、anti-CD4、anti-CD8 和anti-CD69 荧光抗体染色结合流式细胞仪检测,结果表明,与对照组相比,6 h 组的CD69+T细胞的比例由10.02%显著升高到18.28%(p<0.01),CD69+CD8+T 细胞的比例由 5.96%显著升高到16.20%(p<0.01),CD69+CD4+T 细胞的比例由2.27%显著降低到1.58%(p<0.01)。9 h 组的CD69+NKT细胞的比例由6.95%降低到4.62%(p<0.05)。以上结果说明AAL 促进小鼠肝脏的T 细胞和CD8+T 细胞的活化。
CD8+T 细胞是肝脏中主要的T 细胞群,CD8+T细胞的激活与急性甲型肝炎的肝损伤程度相关[31],并且是非酒精性脂肪性肝炎的主要调节细胞[32]。另一方面,急性肝炎的程度受CD8+T 细胞功能的调节,但是不受其细胞寿命变化的影响[33]。传统观点认为CD4+T 细胞而非CD8+T 细胞在Con A 诱导小鼠的急性肝损伤中发挥重要作用[34]。最新的一项ConA 的研究发现,在Rag2 缺陷小鼠转移T 细胞模型中,CD8+T细胞通过IL33 的释放介导肝脏的严重损伤[21]。本研究中,AAL 诱导小鼠急性肝损伤后使CD8+T 细胞的活化显著增加,且IL33 的mRNA 水平显著升高,提示在AAL 诱导C57BL/6 小鼠肝脏损伤中CD8+T 细胞的重要作用。未来仍需要通过封闭细胞试验进一步验证CD8+T 细胞参与肝脏毒性的作用机制。
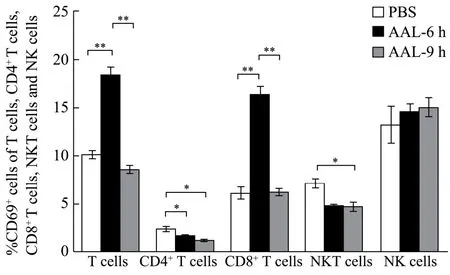
图4 注射AAL 促进小鼠肝脏免疫细胞的活化 Fig.4 The AAL injection promoted activation of liver immune cells in mice
3 结论
杨树菇凝集素AAL 尾静脉注射C57BL/6 小鼠,诱导血清ALT 和AST 水平显著增加,肝脏组织中出现炎症细胞浸润、肝细胞坏死空洞。其作用机制是上调肝脏NKT 细胞和CD8+T 细胞的数量,活化CD8+T细胞,诱导肝脏细胞因子IL-10、IL-33、IL-27、IFN-γ和TNF-αmRNA 的表达增加。

