植物乳杆菌(Lactobacillus plantarum)对过敏原原肌球蛋白免疫活性的消减作用
肖 叶,叶精勤,李晓晨,李晓晖,施文正,卢 瑛,*
(1.上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306;2.上海海洋大学 农业农村部水产品贮藏保鲜质量安全风险评估实验室,上海 201306)
虾和龙虾等甲壳类水产品因富含优质蛋白、必需氨基酸和微量元素而广受消费者青睐。近年来,甲壳类水产品的养殖量和人均消费量不断增长,从水产养殖生产扩张之初的1990年到2017年,甲壳类水产品的人均消费量年增长率达到2.9%[1]。因此由甲壳类水产品引发的过敏问题也一直受到社会各界的广泛关注,它不仅影响了己知过敏人群对甲壳类水产品的摄取,而且对潜在过敏人群存在严重的安全隐患,甚至危及生命。原肌球蛋白(tropomyosin,TM)是甲壳类和贝类的主要过敏原,它是一种酸性糖蛋白,分子质量约为35~38 kDa,由2 个相同的α-螺旋结构的亚基相互缠绕构成超螺旋结构,包含7 个交互的肌动蛋白结合位点,结构稳定且耐高温[2]。
乳酸菌是人体肠道中必不可少的一种有益于身体健康的细菌,且大量存在于人体内。研究发现,乳酸菌可以解离食物中的蛋白质、糖分以及合成维生素等,从而达到提高食物消化率和生物价,促进人体对食物消化吸收的目的[3]。Frias等[4]利用瑞士乳杆菌、枯草芽孢杆菌、米根霉和酿酒酵母混合菌种发酵大豆蛋白,发现发酵后的大豆过敏原的致敏性显著降低。高卿等[5]选用木糖葡萄球菌发酵海鲈鱼,结果显示发酵60 h后小清蛋白的IgG结合能力下降26.9%,IgE结合能力下降22.3%。Bu Guanhao等[6]在牛乳中分别接入L.helveticus和S.thermophilus2 种乳酸菌,酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)实验结果表明α-乳白蛋白的致敏性在发酵后分别降低了71%和49%,当2 种菌混合发酵牛乳时,α-乳白蛋白的致敏性降低了87%。Jedrychowski等[7]得到了一致的结论。
目前,国内外利用加热[8]、辐照[9]、美拉德反应[10]、酶解[11]等方法消减原肌球蛋白的免疫活性和致敏性的研究较多,然而利用乳酸菌消减过敏原原肌球蛋白的免疫活性和致敏性的报道很少。为探究植物乳杆菌L.plantarum对原肌球蛋白免疫活性的影响,解析植物乳杆菌消减TM免疫活性的作用位点,本研究利用植物乳杆菌的完整菌体、破碎菌体(破碎内容物、菌体碎片、胞内酶提取液)以及化学修饰菌体提取物(去除蛋白、去除脂肪、去脂磷壁酸、羧基酯化、氨基甲基化)分别水解TM,分析比较植物乳杆菌不同成分提取物对TM免疫活性的影响差异,然后利用表位多克隆抗体及红外光谱技术研究不同成分提取物对TM二级结构及其致敏表位的影响,探究TM免疫活性变化与结构及致敏表位变化的构效关系,为食物过敏原的活性控制及低致敏性水产加工制品的开发提供理论参考。
1 材料与方法
1.1 材料与试剂
南美白对虾(Penaeus vannamei) 市购。
植物乳杆菌(Lactobacillus plantarum)由上海海洋大学分子生物学实验室提供;MRS培养基 青岛海博生物技术有限公司;BCA蛋白质测定试剂盒 生工生物工程(上海)股份有限公司;预染色和未染色的蛋白质标记物 立陶宛Fermentas公司;96 孔板 美国Corning公司;山羊抗小鼠IgG-HRP抗体 美国Invitrogen公司;N,N,N’,N’-四甲基二乙胺、DAB显色试剂盒 美国Sigma公司;0.22 μm PVDF膜 美国Millipore公司。
针对甲壳类主要过敏原TM具有特异性反应的单克隆抗体5G5E及针对致敏表位Epitope l(TKLAEASQAADESER)、Epitope 2(DEERM)、Epitope 3(FLAEEADRK)的多克隆抗体由本实验室自制。
1.2 仪器与设备
Mini protean 4蛋白质电泳仪 美国Bio-Rad公司;AE-8135半干式转膜仪 日本ATTO公司;powerlook 2100XL-MSB凝胶扫描仪 美国MMAX公司;Synergy2多功能酶标仪 美国伯腾仪器有限公司;Z36HK高速冷冻离心机 德国Hermle公司;TS-8脱色摇床 江苏海门其林贝尔仪器制造有限公司;HH-4数显恒温水浴锅国华电器有限公司;Spotlight 400傅里叶变换红外光谱仪英国PerkinElmer公司。
1.3 方法
1.3.1 TM的提取和富集
参照孙佳益[12]的方法,虾去头去壳去尾去虾线后,绞肉机搅碎并加入冷丙酮抽提至丙酮溶液为无色,将沉淀物风干并向其中加入含0.5 mmol/L DTT的磷酸盐-吐温缓冲液(phosphate buffered saline-tween,PBST),匀浆煮沸并离心35 min后向上清液中加入45%硫酸铵溶液,待硫酸铵全部溶解后离心35 min收集沉淀。将沉淀用PBS溶解并透析48 h,即得到富集纯化的TM。
1.3.2 TM纯度验证
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)根据Laemmli[13]的方法进行。分离胶浓度为12%,浓缩胶浓度为5%。将不同样品分别与2×上样缓冲液混合并煮沸后加8 μL到样品孔中,设置电源电压进行跑胶,电泳结束用考马斯亮蓝染色液染色,然后脱色至蛋白条带清晰。
1.3.3 植物乳杆菌不同成分提取物样品的制备
1.3.3.1 活菌体制备
将活化3 代后的植物乳杆菌液体培养至对数期末稳定期初,调整菌浓度使其含菌量在1×108CFU/mL以上,取1 mL菌液,离心(12 000 r/min,4 ℃,15 min)收集沉淀,无菌PBS清洗3 次后保存于4 ℃待用。
1.3.3.2 破碎内容物、菌体碎片和胞内酶提取液制备
破碎内容物制备:根据李秀明等[14]的方法略有改动,向菌体中添加终质量浓度为1 mg/mL的溶菌酶并在30 ℃作用2 h,再用超声波细胞破碎仪以功率200 W,超声2 s、停2 s,超声5 min后即得到菌体的破碎内容物,4 ℃保存待用。
菌体碎片和胞内酶提取液制备:将菌体的破碎内容物离心(12 000 r/min,4 ℃,15 min),收集的沉淀为菌体碎片,收集的上清液为胞内酶提取液,4 ℃保存待用。
1.3.3.3 去除蛋白、脂肪、脂磷壁酸样品制备
去除蛋白样品制备:根据Elnezami等[15]的方法略有改动,将12 mg真空冷冻干燥的菌体溶解于1.2 mL 10 mmol/L的磷酸钠缓冲溶液中(pH 7.6,含0.5 mg/mL蛋白酶),37 ℃摇床中反应2 h,离心收集沉淀(12 000 r/min,4 ℃,15 min),无菌PBS清洗3 次后得到去除蛋白的菌体,4 ℃保存待用。
去除脂肪样品制备:参考去除蛋白样品的制备方法,将含有蛋白酶的缓冲溶液替换为1.2 mL 10 mmol/L的磷酸钠缓冲溶液(pH 7.6,含0.5 mg/mL脂肪酶)[15],其余操作不变,制得去除脂肪的菌体,4 ℃保存待用。
去脂磷壁酸样品制备:参考郭春锋[16]的方法略有改动,将12 mg真空冷冻干燥的菌体溶解于1.2 mL正丁醇溶液,37 ℃摇床中反应2 h,离心(12 000 r/min,4 ℃,15 min)收集沉淀,无菌PBS清洗3 次后得到去除脂磷壁酸的菌体,4 ℃保存待用。
1.3.3.4 羧基酯化和氨基甲基化样品制备
羧基酯化样品制备:参考Ramrakhiani等[17]的方法略有改动,向真空冷冻干燥的菌体中加入1.2 mL甲醇-浓盐酸(108∶1,V/V)混合溶液,125 r/min室温反应6 h后,离心(12 000 r/min,4 ℃,15 min)收集沉淀,无菌PBS清洗3 次后得到羧基酯化的菌体,4 ℃保存待用。
氨基甲基化样品制备:参考Chen Huimei等[18]的方法略有改动,向真空冷冻干燥的菌体中加入1.2 mL甲醛-甲酸(1∶2,V/V)混合溶液,之后参照羧基酯化样品的制备方法制备得到氨基甲基化的菌体,4 ℃保存待用。
1.3.4 植物乳杆菌不同成分提取物对TM免疫活性影响作用评价
1.3.4.1 植物乳杆菌不同成分提取物水解TM
将植物乳杆菌不同成分提取物分别接入质量浓度为2 mg/mL的TM溶液中,置于37 ℃摇床中(200 r/min)水解48 h,每隔12 h取一次样,以未加乳酸菌,但在同等条件下(37 ℃、200 r/min)放置48 h的TM溶液作为对照。离心(12 000 r/min,4 ℃,10 min)收集上清液进行免疫活性测定。
1.3.4.2 SDS-PAGE
参照1.3.2节方法进行。
1.3.4.3 蛋白免疫印迹
根据Song Yongna等[19]的方法进行。根据SDS-PAGE法制得转移胶,180 mA、20 min条件下将胶上条带转移至PVDF膜上,5%脱脂奶粉封闭1 h后PBST洗膜3 次,每次5 min,然后用TM的特异性单抗5G5E(1 μg/mL)孵育1 h,洗涤后用HRP-羊抗小鼠IgG(1∶2 500)溶液孵育1 h,洗液洗涤,加入DAB工作液显色5 min后用去离子水洗去残留显色液并风干拍照。
1.3.4.4 竞争性ELISA
根据Kamath等[20]的方法进行。将纯化TM用50 mmol/L碳酸盐缓冲液(pH 9.6)稀释至4 μg/mL,每孔100 μL,4 ℃过夜包被,PBST溶液洗板3 次后加入200 μL 5%脱脂奶粉,37 ℃孵育2 h,洗涤。每孔加入100 μL不同产物和5G5E的混合液(混合液37 ℃提前孵育1 h),37 ℃孵育1 h,洗涤后加入100 μL HRP-羊抗小鼠IgG(1∶2 500),37 ℃孵育1 h,洗涤后加100 μL邻苯二胺底物显色液室温避光反应10 min,最后加2 mol/L硫酸终止反应,并立即测定波长490 nm处的OD值。以50 mmol/L包被液为阴性对照,以抗体稀释液稀释的5G5E作为阳性对照,每个样品做4 个平行。样品中TM的抑制率和消减率按式(1)、(2)计算:

式中:OD阳性为阳性孔的OD值;OD样品为样品孔的OD值;OD阴性为阴性孔的OD值。
1.3.5 植物乳杆菌的不同成分提取物与TM致敏表位多抗间的结合反应
1.3.5.1 表位多克隆抗体效价分析
参照1.3.4.4节方法,各表位用50 mmol/L碳酸盐缓冲液(pH 9.6)稀释至4 μg/mL作为包被抗原,不同稀释倍数的表位多克隆抗体溶液分别作为一抗,采用ELISA测定表位多克隆抗体的效价。
1.3.5.2 植物乳杆菌的不同成分提取物与TM致敏表位多抗间的结合情况
参照1.3.4.4节方法,将TM的致敏表位Epitope l(TKLAEASQAADESER)、Epitope 2(DEERM)、Epitope 3(FLAEEADRK)的多克隆抗体分别作为一抗,采用ELISA检测不同成分提取物水解前后TM蛋白质与3 个致敏表位多克隆抗体的特异性结合反应,以TM蛋白质为对照,表位多抗与水解样品间的结合反应变化率按式(3)计算:

式中:OD对照为TM对照样品的ELISA检测OD值;OD样品为不同成分提取物的TM水解产物的ELISA检测OD值。
1.3.6 红外图谱的采集与分析
将水解前后的TM样品及植物乳杆菌样品进行真空冷冻干燥,直至样品不含水分,取干燥样品与KBr晶体按照1∶100的比例混合,压片机压成薄片,以空气为背景,在4 000~400 cm-1范围内采集光谱,分辨率为±4 cm-1,信号累加32 次,每个样品重复扫描3 次。利用Peakfit软件对处理前后TM样品的红外光谱原始图进行去卷积、二阶导数处理,使拟合残差R2不小于0.990,根据子吸收峰的积分面积计算各二级结构的相对含量。利用Spectrum软件对植物乳杆菌处理TM前后的红外光谱原始图进行基线校正,13 点平滑及归一化处理,获得样品的二阶导数红外光谱图。
1.4 数据处理
2 结果与分析
2.1 TM的提取和富集
Lehrer等[21]研究报道TM分子质量在32~38 kDa之间。如图1所示,对比各样品条带可以明显看到,相较于未经处理的提取液样品1,煮沸后的样品2和硫酸铵处理透析后的样品5位于35.0 kDa附近的条带很粗。由此可见,煮沸和硫酸铵处理可以有效富集南美白对虾中的TM蛋白质,富集后的提取液中TM含量较多,纯度较高,可以满足实验需求。
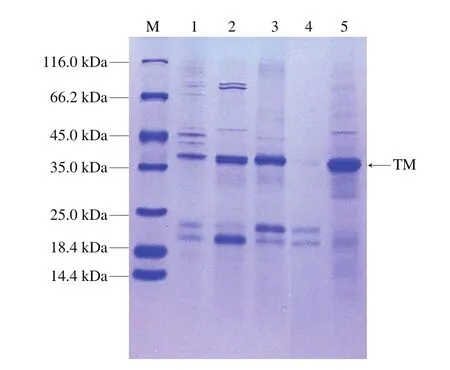
图1 南美白对虾的TM提取液和富集处理样品的SDS-PAGE图Fig.1 SDS-PAGE of crude and enriched TM extracts of P.vannamei
2.2 提取物对TM含量及免疫活性的影响
SDS-PAGE能够从电泳条带的宽窄及颜色深浅中判断不同成分提取物对TM含量及浓度的影响。蛋白免疫印迹和竞争ELISA利用抗原抗体的特异性反应,评价不同成分提取物对TM免疫活性的改变。

从图2可以看出,与TM对照样品(C)相比,经植物乳杆菌菌体及其不同成分提取物水解TM 12 h后,35 kDa附近条带均明显变窄变浅或消失,水解48 h的TM产物条带均肉眼不可见(图2a),由此可见TM含量明显减少,其中,部分产物与5G5E有2 个反应条带,其原因很可能是TM蛋白在植物乳杆菌的作用下发生部分水解造成的。与此相对应的,不同处理的植物乳杆菌水解TM后的产物与TM特异性单克隆抗体5G5E的免疫反应条带随着反应时间的延长明显减弱,免疫印迹结果显示这2 个条带均可与5G5E发生特异性反应,表明植物乳杆菌的水解虽然可破坏TM蛋白质的空间结构,但其抗原表位并未被完全破坏,因此水解产物仍会与5G5E抗体发生反应(图2b)。此外,SDS-PAGE和免疫印迹结果显示,菌体胞内酶及破碎内容物水解TM 24 h,TM条带几乎不可见,而菌体碎片水解TM 36 h,TM条带及其与5G5E抗体的免疫反应条带仍清晰可见,说明菌体胞内酶及破碎内容物的水解效果明显优于菌体碎片;去除菌体表面的蛋白质、脂肪、脂磷壁酸或将羧基酯化后,其12 h的水解产物条带与5G5E的结合能力无显著差异,表明这几种处理的植物乳杆菌对TM蛋白的水解能力无明显差别。然而,菌体表面经氨基甲基化处理后,水解TM 24 h的产物依然存在与5G5E抗体的免疫反应条带,表明氨基甲基化后的菌体对TM免疫活性的消减能力明显减弱,这与SDS-PAGE结果一致。

图2 植物乳杆菌不同成分提取物的TM水解产物的SDS-PAGE和蛋白免疫印迹Fig.2 SDS-PAGE and Western blot results of TM hydrolysates obtained by treatment with different L.plantarum materials
为进一步定量分析植物乳杆菌及其不同成分提取物对TM免疫活性的影响作用,本研究采用竞争性ELISA评价菌体及各提取物对TM免疫活性的降低程度。由图3可知,水解反应12 h后,菌体碎片和氨基甲基化菌体对免疫活性消减率最低,分别为21.1%和18.5%,其他成分提取物和菌体样品对TM免疫活性消减效果差别不大,消减率均在31.8%~37.1%之间;水解反应48 h后,菌体及其不同成分提取物对TM免疫活性的消减率均大于60%,其中菌体对免疫活性的消减效果最佳,达76.9%,菌体碎片及氨基甲基化菌体消减效果最差,消减率分别为60.7%和61.7%。消减率越高,TM的免疫活性越弱,说明该成分提取物对TM免疫活性的消减效果最佳,反之亦然。

图3 植物乳杆菌不同成分提取物对TM免疫活性的消减效果Fig.3 Reduction effect of different L.plantarum materials on TM immune activity
由此可见,SDS-PAGE、蛋白免疫印迹和ELISA结果均显示,不同处理的植物乳杆菌对TM免疫活性的影响具有显著差异,将菌体破碎或将其氨基甲基化后,其对TM免疫活性的消减能力明显下降,其原因很可能是它们在水解TM的过程中,会不同程度地破坏TM蛋白的空间结构及其抗原表位。
2.3 植物乳杆菌不同成分提取物对TM二级结构的影响
蛋白质红外光谱酰胺I带(1 700~1 600 cm-1)的特征振动频率主要取决于其氨基酸残基的C=O和N—H之间的氢键性质,它可以反映多肽或蛋白质二级结构中α-螺旋、β-折叠、β-转角及无规卷曲等结构相对含量的信息(1 610~1 640 cm-1特征β-折叠;1 640~1 650 cm-1特征无规卷曲;1 650~1 658 cm-1特征α-螺旋;1 660~1 700 cm-1特征β-转角[22-23])。SDS-PAGE和免疫印迹结果显示植物乳杆菌的不同成分提取物对TM免疫活性的影响具有显著差异,其中破碎菌体和氨基甲基化后的菌体对TM免疫活性的消减能力明显减弱(图2)。为进一步解析植物乳杆菌对TM免疫活性的消减作用,采用红外光谱技术分析了植物乳杆菌不同成分提取物对TM二级结构的影响作用。
由图4可知,TM对照样品的α-螺旋相对含量最高,无规卷曲结构次之,分别为71.7%、15.2%,这与相关研究结果一致[24]。研究发现,菌体水解TM后其α-螺旋相对含量最少,为15.4%,下降了56.3%,解旋率高于其他成分提取物,α-螺旋大部分解旋为β-折叠,β-折叠相对含量增加了26.2%。与之相反,菌体碎片和氨基甲基化菌体水解TM的产物,其α-螺旋相对含量分别为23.7%和21.2%,解旋率低于其他成分提取物,β-折叠相对含量分别为17%和19.2%,也明显低于其他成分的TM水解产物。潘迪[25]利用超高压协同转谷氨酞胺酶处理花生致敏蛋白Ara h 1,结果发现随着压力增加,Ara h 1的α-螺旋相对含量明显减少,β-折叠相对含量增多,Ara h 1二级结构的变化影响其致敏性。由此可见,植物乳杆菌会较大程度破坏TM的二级结构,大部分α-螺旋解旋为β-折叠,TM结构的进一步折叠化导致暴露的抗原表位被包埋,减少了与抗体结合的机会,从而降低了TM蛋白的免疫活性。而菌体碎片和氨基甲基化菌体对TMα-螺旋结构的破坏最小,且TM的折叠化结构较少,因而相较于其他成分提取物,增加了处理产物与免疫位点的特异性结合机会,表现为菌体碎片和氨基甲基化菌体对TM的免疫活性消减率最低(图3)。
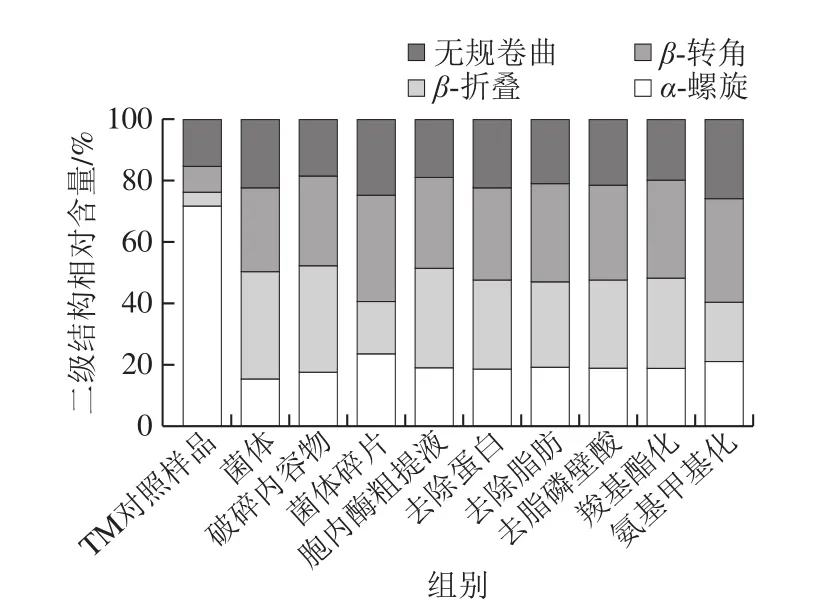
图4 植物乳杆菌不同成分提取物水解前后TM的二级结构相对含量Fig.4 Relative contents of secondary structures in TM before and after hydrolysis by different L.plantarum materials
2.4 植物乳杆菌不同成分提取物对TM致敏表位的影响
本团队前期研究发现,TM经体外模拟胃液消化2 h后,其消化产物中存在3 个抗消化性能强的抗原表位Epitope l(TKLAEASQAADESER)、Epitope 2(DEERM)和Epitope 3(FLAEEADRK),这3 个抗原表位很可能是TM的关键致敏表位[26]。为进一步分析植物乳杆菌不同成分提取物对TM致敏表位的影响,以3 个合成表位与血蓝蛋白的偶联物作为抗原免疫BALB/c小鼠,制备这3 种表位的多克隆抗体,通过间接ELISA分析植物乳杆菌不同成分提取物的TM水解产物与这3 个致敏表位间的特异性反应情况。
将致敏表位的抗血清从100 倍梯度稀释至1 600 倍,ELISA结果显示随着小鼠血清稀释倍数的增加,小鼠血清与合成表位反应的OD值逐渐降低,表明这3 种致敏表位的多克隆抗体与Epitope 1、Epitope 2、Epitope 3具有特异性反应(图5)。

图5 3 种表位抗体效价结果Fig.5 Titers of three epitope antibodies
由图6可知,菌体水解TM后其产物与PAb-Epitope l、PAb-Epitope 2、PAb-Epitope 3的结合反应变化率均高于其他成分提取物的水解产物,分别下降了70.3%、30.7%、54.3%;菌体碎片与氨基甲基化菌体的水解产物与3 个表位抗体的结合反应变化率均明显低于其他成分提取物,其中与PAb-Epitope l的结合反应下降最为显著,分别为48.1%、46.1%,其次是与PAb-Epitope 3的结合反应(27.3%、23.9%),而与PAb-Epitope 2的结合反应分变化率最低(6.5%、5.4%)。变化率越大表示水解产物与表位抗体间的结合能力越弱,表明该成分提取物对TM的免疫活性影响越大,反之亦然。

图6 植物乳杆菌不同成分提取物水解后TM蛋白与表位抗体结合反应变化情况Fig.6 Change in binding reaction between TM hydrolysates obtained by treatment with different L.plantarum materials and epitope antibodies
Ruan Weiwei等[27]研究了美拉德反应对拟穴青蟹中TM以及精氨酸激酶的致敏性影响,发现美拉德反应可以使易消化抗原表位大量消失,且对具有抗消化能力的抗原部分具有一定破坏性,从而降低其致敏性;Fu Linglin等[28]研究发现,美拉德反应可以消除一部分表位的过敏性,进而影响TM蛋白的致敏性。结合二级结构变化结果,认为菌体碎片、氨基甲基化菌体的TM水解产物与3 个表位抗体的结合反应变化率显著低于其他成分提取物,其原因很可能是两者对TM的这3 种致敏表位的破坏程度较小。此外,发现所有成分对Epitope 2抗体的结合反应变化率显著低于Epitope 1和Epitope 3,这可能是因为Epitope 1与Epitope 3氨基酸序列中的赖氨酸及谷氨酸在植物乳杆菌水解TM的过程中会发生交联反应[25],导致结构发生变化,增加了表位的破坏程度。
2.5 植物乳杆菌对TM的消减作用位点分析
不同处理植物乳杆菌的TM水解产物的免疫学分析以及TM二级结构变化数据显示,菌体对TM蛋白空间结构及致敏表位破坏程度最大,菌体碎片和氨基甲基化菌体破坏程度最小,其他几种处理菌体对TM结构及表位的破坏程度无较大差别(图3、4)。为了解析植物乳杆菌对TM免疫活性的可能消减作用位点,选取菌体、羧基酯化菌体、菌体碎片和氨基甲基化菌体及其TM水解产物的样品进行傅里叶变换红外光谱分析。对比分析各成分提取物及其TM水解产物的二阶导数谱图,发现谱图变化主要集中在1 800~1 500 cm-1范围(图7)。各成分提取物水解TM前后的峰形大致保持不变,但其中一部分峰形变得明显尖锐,峰面积也明显增大。

图7 植物乳杆菌不同成分提取物及TM消减产物的傅里叶变换红外光谱二阶导数谱图Fig.7 FT-IR secondary derivative spectra of TM treated with different L.plantarum materials
由表1可知,各提取物在水解TM后,红外谱图吸收峰变化集中在C=O引起的伸缩振动吸收峰、N—H键引起的弯曲或变角振动吸收峰。其中菌体的TM水解产物有N—H键引起的5 个变角振动吸收峰((1 648±1)、(1 641±1)、(1 630±1)、(1 624±1)、1 613 cm-1)、3 个弯曲振动吸收峰(1 659、(1 540±1)、(1 534±1) cm-1)、2 个面内弯曲振动吸收峰((1 559±1)、1 696 cm-1)和C=O引起的3 个伸缩振动吸收峰((1 773±1)、1 724、(1 711±1)cm-1)的峰形或峰面积发生了变化。与菌体相比,羧基酯化菌体的TM水解产物有N—H键引起的3 个弯曲振动吸收峰(1 659、1 541、1 535 cm-1)、2 个面内弯曲振动吸收峰((1 558±1)、1 695 cm-1)、2 个变角振动吸收峰((1 648±1)、(1 630±1)cm-1)和C=O引起的2 个伸缩振动吸收峰(1 773、(1 723±1)cm-1)的峰形或峰面积发生了变化;菌体碎片水解产物有N—H键引起的3 个弯曲振动吸收峰(1 658、(1 540±1)、(1 530±1)cm-1)、3 个变角振动吸收峰((1 648±1)、1 631、(1 618±1)cm-1)和C=O引起的1 个伸缩振动吸收峰((1 773±1)cm-1)的峰形或峰面积发生了变化;氨基甲基化菌体的水解产物有N—H键引起的2 个变角振动吸收峰(1 668、1 648 cm-1)、1 个面内弯曲振动吸收峰(1 700 cm-1)和C=O引起的1 个伸缩振动吸收峰((1 717±1)cm-1)的峰形或峰面积发生了变化。比较发现,各提取物及其TM水解产物的红外谱图主要是N—H键的振动吸收峰发生了变化,其中菌体的3 个N—H键特征峰变化数量最多(10 个),其次是羧基酯化菌体(7 个)和菌体碎片(6 个);而氨基甲基化菌体的3 个N—H键特征峰的变化数量最少,仅为3 个(1 700、1 668、1 648 cm-1),且菌体碎片和氨基甲基化菌体的变化强度均小于菌体和羧基酯化菌体。结合免疫学分析结果,推测,氨基很可能是植物乳杆菌消减TM免疫活性的一个重要作用位点。
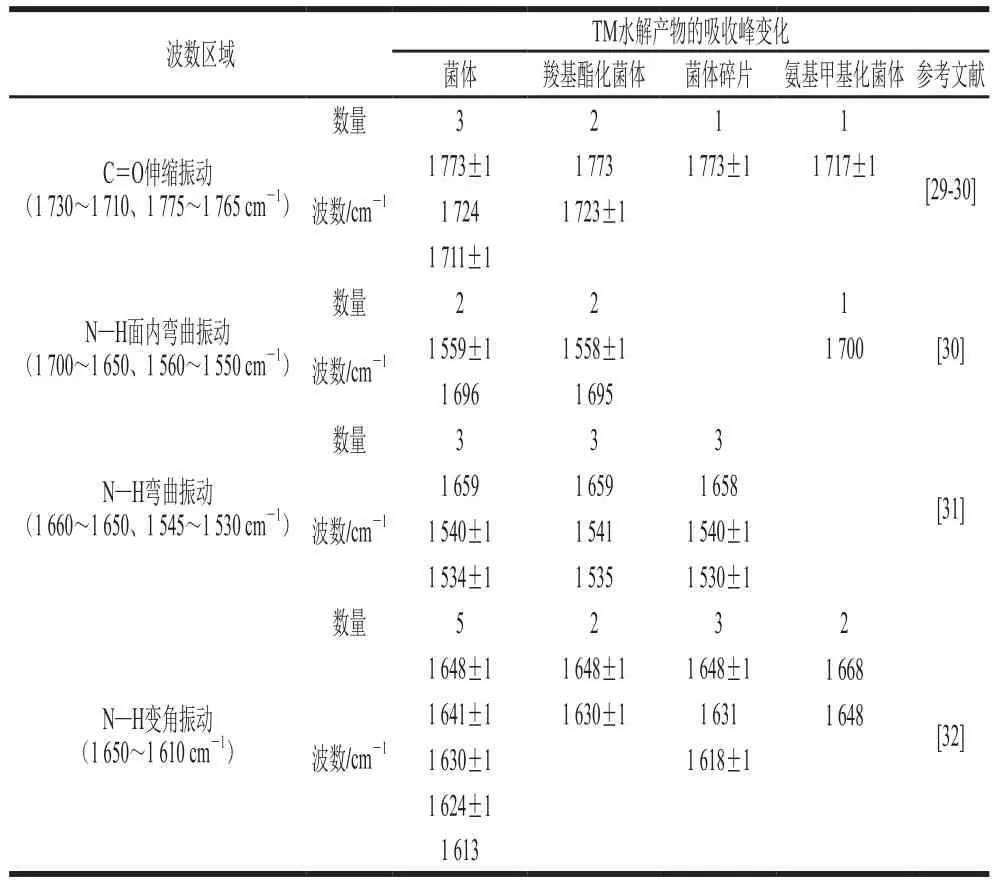
表1 植物乳杆菌不同成分提取物及TM水解产物的傅里叶变换红外光谱二阶导数谱图分析Table 1 FT-IR secondary derivative spectral analysis of TM hydrolyzed by different L.plantarum materials
3 结 论
本研究通过对比分析植物乳杆菌菌体和各种不同成分提取物对TM免疫活性的影响作用和作用方式,发现植物乳杆菌会较大程度地改变TM的二级结构并破坏其致敏表位,其中氨基甲基化菌体和菌体碎片对TM的α-螺旋结构和致敏表位的破坏最小,且TM的折叠化结构较少,因而对TM的免疫活性消减率最低。此外,研究发现氨基很可能是植物乳杆菌消减TM免疫活性的一个重要作用位点。本研究可为今后食物过敏原的活性控制以及低致敏性水产加工制品的开发提供科学依据。

