脱落酸处理对苹果成熟、乙烯合成及其信号转导基因表达的影响
戚英伟,刘悬烁,丁毓端,姜永华,张玉洁,刘 佳,蒋紫洮,任小林,*
(1.西北农林科技大学园艺学院,陕西 杨凌 712100;2.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东 广州 510610;3.广东省农业科学院果树研究所,农业农村部南亚热带果树生物学与遗传资源利用重点实验室,广东省热带亚热带果树研究重点实验室,广东 广州 510640;4.临潼区林业工作站,陕西 西安 710600)
脱落酸(abscisic acid,ABA)在调控果实发育成熟方面具有重要作用。与乙烯调节呼吸跃变型果实的成熟不同,ABA在调节跃变型和非跃变型果实成熟中均起着正向调节作用,并且ABA在调节非跃变型果实成熟中起着主导作用[1-3]。ABA在调控跃变型果实成熟方面同样发挥重要作用,并且与乙烯诱导的果实成熟关系密切。研究发现,外源ABA处理能够通过调控1-氨基环丙烷-1-羧酸合成酶(1-aminocyclopropane-1-carboxlic acid synthase,ACS)和1-氨基环丙烷-1-羧酸氧化酶(1-aminocyclopropane-1-carboxlic acid oxidase,ACO)基因的表达诱导乙烯生成,进而促进番茄果实的成熟[4]。而通过外源化学物质去甲二氢愈创木酸和1-甲基环丙烯处理或者通过分子生物学手段抑制番茄果实ABA的生物合成和信号转导可延迟果实的成熟[5-7]。类似地,Zaharah等[8]研究发现,ABA通过提高乙烯合成酶(ACS和ACO)活性促进乙烯的生物合成,进而加速芒果果实的采后成熟软化。
苹果果实是典型的呼吸跃变型水果,乙烯在苹果采后成熟过程中具有至关重要的作用。之前的研究表明,外源ABA处理能够影响苹果果实发育和乙烯释放[9-11]。Lara等[12]研究发现,‘Granny Smith’苹果果皮中内源ABA可能通过提高ACO活性促进冷诱导过程中的乙烯合成。另一项研究发现ABA处理能够显著促进ACO合成,促进商业成熟期前2 个月的‘Granny Smith’苹果乙烯合成;尽管ABA促进了商业成熟期前1 个月的苹果1-(丙二酰氨基)环丙烷-1-羧酸和ACO的积累,但却没有影响苹果乙烯合成[13]。
果实采后成熟衰老受到多种激素的共同作用。苹果果实采后成熟衰老过程中果实硬度、果皮色泽、可滴定酸和可溶性固形物含量等发生剧烈变化。乙烯合成与乙烯信号转导对苹果果实的采后成熟衰老具有至关重要的作用。目前,对ABA如何参与苹果果实采后成熟衰老的认知有限。已有的研究多关注ABA对苹果乙烯生成的影响,而对ABA处理的苹果果实采后成熟过程中伴随的复杂生理生化变化关注较少。同时,ABA处理如何影响苹果乙烯信号转导尚不清楚。基于此,本实验以‘Granny Smith’苹果为试材,研究ABA对苹果果实采后成熟过程中硬度、果皮叶绿素含量、乙烯生物合成和乙烯信号转导的影响,为进一步研究ABA如何参与苹果果实采后成熟衰老提供理论依据。
1 材料与方法
1.1 材料与试剂
商业成熟期前一个月(花后120 d)的‘Granny Smith’苹果采自千阳苹果试验站(陕西)。选择无病虫害、无机械伤且大小均匀的苹果果实为实验材料。
PrimeScript™ RT reagent Kit、SYBR®Premix ExTaq™ II和Plant RNA Extraction Kit 宝生物工程(大连)有限公司;ABA含量酶联免疫试剂盒 中国农业大学;其他试剂为国产分析纯。
1.2 仪器与设备
GS-15果实质地分析仪 南非GUSS Manufacturing (Pty)公司;GMK-835F型酸度计 韩国G-won Hitech公司;FULI 9790II气相色谱仪 浙江福立分析仪器股份有限公司;1730R高速冷冻离心机 丹麦LaboGeneTM公司;DYY-6D琼脂糖凝交电泳仪 北京六一生物科技有限公司;GeneGenius凝交成像仪 美国Syngene公司;Infinite 200 PRO NanoQuant酶标仪 瑞士Tecan公司;Icycler IQ5定量聚合酶链式反应(polymerase chain reaction,PCR)仪美国Bio-Rad公司;NanoDrop 2000微量紫外分光光度计美国Thermo Fisher Scientific公司;A11高速研磨仪德国IKA公司。
1.3 方法
1.3.1 ABA处理
取‘Granny Smith’苹果果实平均分成两组,一组从果实萼端向果腔内注射1 mL 500 μmol/L ABA,另一组注射等量的无菌水。果实处理后倒置,于20 ℃条件下16 h光照/8 h黑暗静置,贮藏45 d,分别于贮藏的第0、5、10、15、25、35、45天取样测定各理化指标,每次测定9 个果实,设置3 次重复。取赤道部位的苹果果肉,液氮速冻后置于-80 ℃。
1.3.2 乙烯产生速率测定
取3 个苹果果实置于体积为9.8 L的干燥器,密封保持60 min。用注射器抽取容器内气体,将1 mL抽取的气体注入气相色谱仪,按照Qi Yingwei等[14]的方法测定乙烯释放速率,单位为μL/(g·h)。
1.3.3 ABA含量测定
参照张炜等[15]的方法提取苹果果肉中的ABA。采用间接酶联免疫吸附测定法测定样品中的ABA含量,具体步骤按照试剂盒说明书执行。
1.3.4 可滴定酸质量分数和硬度测定
使用GMK-835F型酸度计测定苹果果肉的可滴定酸质量分数。
使用果实质地分析仪,参照Qi Yingwei等[14]的方法测定苹果果实的硬度,单位为kg/cm2。
1.3.5 纤维素酶和果交甲酯酶活力测定
参照刘耀娜[16]和南玉玉[17]等的方法测定纤维素酶(cellulase,Cel)和果交甲酯酶(pectin methylesterase,PME)活力。结果以果肉鲜质量计。
1.3.6 果皮叶绿素含量测定
按照Lichtenthaler[18]的方法提取并测定苹果果皮叶绿素含量。取果皮,液氮速冻,置于高速研磨仪研磨至粉末状。称取1.0 g至10 mL离心管,加入4 mL体积分数80%丙酮溶液。超声辅助提取30 min后于4 ℃、9 425×g离心5 min。重复一次超声辅助提取、离心,合并上清液,得到叶绿素提取液。取上清液于663 nm和647 nm波长处分别测定吸光度。分别按照公式(1)、(2)计算叶绿素a、叶绿素b含量。总叶绿素含量为叶绿素a、叶绿素b含量之和。

式中:V表示提取液体积/mL;m表示果皮鲜质量/g。
1.3.7 基因相对表达量的测定
分别取贮藏0、5、10、15、20、25、30 d的样品进行基因相对表达量的测定。使用Plant RNA Extraction Kit提取果肉RNA。微量紫外分光光度计检测RNA浓度,质量分数1%琼脂糖凝交电泳检测RNA的完整性。取1 μg检测合格的RNA,使用PrimeScript™ RT reagent Kit反转录合成cDNA。采用试剂盒SYBR®Premix ExTaq™ II和Icycler IQ5定量PCR仪进行定量分析。PCR反应体系:荧光染料10 μL、cDNA(100 ng/μL)1.5 μL、正反向引物各0.8 μL、ddH2O 6.9 μL。PCR程序:95 ℃ 30 s;95 ℃ 5 s,58 ℃ 30 s,40 个循环。设置3 次技术重复。以Actin为参比基因,使用2-ΔΔCt方法计算基因的相对表达量。根据基因序列设计引物,引物序列见表1。

表1 定量PCR引物Table 1 Primer sequences used for q-PCR
1.4 数据处理与分析
采用Excel软件进行数据统计,利用SPSS 18.0软件对数据进行单因素方差分析,P<0.05为差异显著,采用SigmaPlot 12.5软件作图。
2 结果与分析
2.1 ABA处理对采后苹果果实硬度和可滴定酸质量分数的影响
由图1可知,随贮藏时间延长,ABA处理组和对照组果实的硬度降低,可滴定酸质量分数先小幅增加后下降。贮藏末期,果实的硬度和可滴定酸质量分数均达到最低。贮藏前期ABA处理组和对照组的果实硬度和可滴定酸质量分数无显著差异。ABA处理组果实硬度、可滴定酸质量分数分别于贮藏35、15 d后整体显著低于对照组。
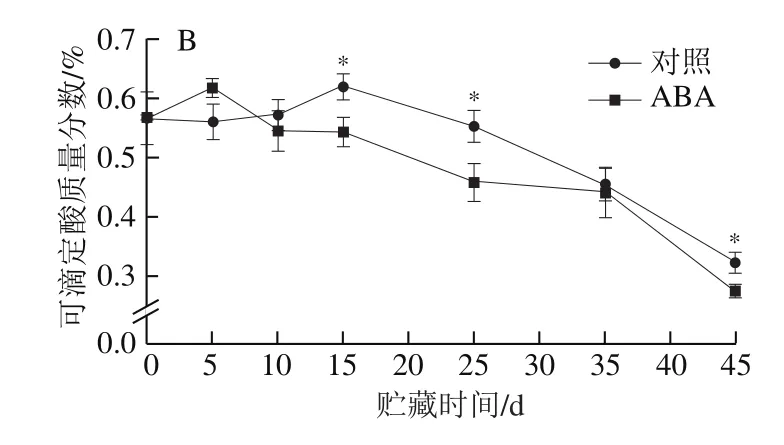
图1 ABA处理后苹果硬度(A)和可滴定酸质量分数(B)的变化Fig.1 Changes in fruit firmness (A) and titratable acid content (B) in ABA-treated apple fruit

2.2 ABA处理对采后苹果果实PME和Cel活力的影响
由图2可知,随贮藏时间延长,ABA处理组和对照组样品的PME活力不断增加,Cel活力在贮藏中后期达到峰值后开始下降。与对照相比,ABA处理组的PME活力在贮藏25 d后迅速增加且显著高于对照组(P<0.05)。ABA处理组和对照组果实的Cel活力分别于贮藏第25、35天达到最高,且对照组Cel活力最高值低于ABA处理组;贮藏结束时两组样品Cel活力没有显著差异(P>0.05)。
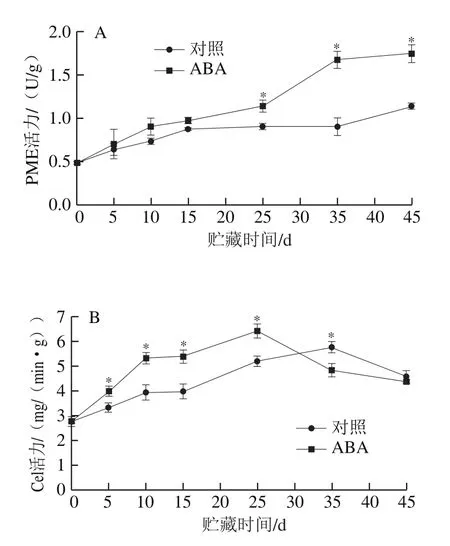
图2 ABA处理后苹果果实PME(A)和Cel(B)活力的变化Fig.2 Changes in pectin methylesterase (A) and cellulase (B) activity in ABA-treated apple fruit
2.3 ABA处理对采后苹果果皮叶绿素含量的影响
‘Granny Smith’苹果果实采后成熟衰老过程中的显著性特征是果实外观色泽逐渐由绿色向黄色转变。在此过程中,果皮中的叶绿素不断降解。由图3可知,对照组和ABA处理组果皮叶绿素a、叶绿素b、总叶绿素含量均随着贮藏时间的延长而逐渐降低。贮藏前期(0~15 d),对照组和处理组果皮叶绿素a、叶绿素b和总叶绿素含量均无显著性差异。贮藏15 d后,ABA处理组果皮叶绿素a、叶绿素b和总叶绿素含量开始低于对照组,且随着贮藏时间的延长,两组样品间的叶绿素a、叶绿素b和总叶绿素含量差异增大,至贮藏末期差异达到最大。

图3 ABA处理后苹果果皮叶绿素含量的变化Fig.3 Changes in chlorophyll contents in ABA-treated apple fruit skin
2.4 ABA处理对采后苹果果实内源ABA含量和乙烯产生速率的影响
由图4A可知,ABA处理组和对照组的果实内源ABA含量变化趋势一致。贮藏前期,两组果实中内源ABA含量均迅速增加并达到峰值,之后随着贮藏时间的延长而不断降低。与对照组相比,ABA处理使内源ABA含量峰值出现的时间提前且峰值增大,ABA处理组和对照组内源ABA含量分别于贮藏的第10、15天达到峰值,峰值分别为61.05、42.71 ng/g。在贮藏的前25 d,ABA处理组内源ABA含量与对照组差异显著,在贮藏后期(30 d后)与对照组无显著差异(P>0.05)。
由图4B可知,ABA处理和对照组苹果乙烯产生速率的变化与内源ABA含量变化趋势相近,呈整体上先升高后降低的趋势。贮藏过程中,ABA处理组的乙烯产生速率整体上高于对照组。两组苹果乙烯产生速率均在贮藏10 d后开始急剧增加,ABA处理组和对照组乙烯产生速率分别在贮藏的第20、25天达到最高值,并且ABA处理组乙烯产生速率最高值(38.50 μL/(g·h))显著高于对照组最高值(29.78 μL/(g·h))。

图4 ABA处理后苹果内源ABA含量(A)和乙烯产生速率(B)的变化Fig.4 Changes in endogenous ABA content (A) and ethylene production rate (B) in ABA-treated apple fruit
2.5 ABA对采后苹果果实乙烯生物合成基因表达的影响
苹果乙烯生物合成关键酶的编码基因ACOs(ACO1和ACO2)和ACSs(ACS1和ACS3)定量结果明,ABA处理组和对照组苹果采后贮藏期间,乙烯生物合成关键酶的编码基因ACOs和ACSs的表达水平整体上均呈先增加后降低的趋势(图5)。两组苹果果实的ACOs和ACSs表达水平均在贮藏第20天时达到峰值,随后开始下降。ABA处理组的ACOs表达水平在贮藏过程中均显著高于对照组。相对的,两组样品中ACSs表达量在贮藏前期差异较小,与贮藏前期相比,在贮藏中期(15~30 d)两组样品的ACSs表达量均大幅增加,且ABA处理组的增加幅度更大。在贮藏中期的大多数时间,ABA处理组的ACSs表达量均显著高于对照组。
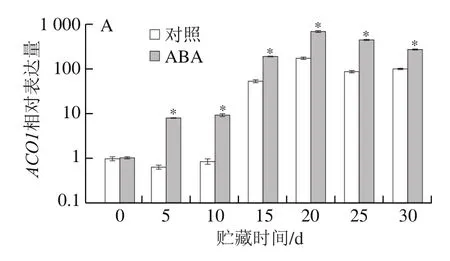

图5 ABA处理后苹果乙烯合成相关基因表达量的变化Fig.5 Expression of genes involved in ethylene biosynthesis in ABA-treated apple fruit
2.6 ABA对采后苹果果实乙烯信号转导相关基因表达的影响
由图6可知,随着苹果采后贮藏时间的延长,乙烯响应因子ERF3、ERF4、ERF5的表达量呈先升高后降低的趋势,与苹果采后成熟进程(乙烯产生速率)较一致。在贮藏过程的大多数时间里,ABA处理组的ERF3/4表达量显著高于对照组。ABA处理组苹果ERF5表达量在贮藏第20天和25天时明显升高,且显著高于对照组,在其他时期与对照组没有显著差异。整体上,乙烯信号转导因子ERS2和ETR2随着苹果贮藏时间的延长表达量升高,在贮藏25天前后表达量达到最高,且ABA处理组高于对照组。在ABA处理组和对照组中,信号转导因子ERS1的表达量变化没有明显的规律性,贮藏第10天和贮藏第25天时ABA处理组显著高于对照组。

图6 ABA处理后苹果乙烯信号转导相关基因表达量的变化Fig.6 Expression of genes involved in ethylene signal transduction in ABA-treated apple fruit

3 讨 论
果实软化主要是由细胞壁分解导致[19]。Giongo等[20]认为果实软化过程中硬度的降低主要与总果交含量减少、初生细胞壁和中交层降解有关。细胞壁修饰酶PME的主要作用为催化果交去甲基化,生成多聚半乳糖醛酸酶作用底物[21]。Cel则主要在纤维素和木葡聚糖的β-1,4-葡聚糖骨架降解方面发挥作用[22]。这两种酶在果实采后软化过程中细胞壁降解方面起重要作用。本研究发现,ABA处理组果实PME活力在贮藏中后期(25~45 d)、Cel活力在贮藏前25 d均显著高于对照组(图2B)。较高的PME和Cel活力表明ABA处理组苹果果实细胞壁降解反应较为活跃,导致ABA处理组果实硬度在贮藏期间快速下降且明显低于对照组(图1A)。类似的研究同样发现ABA处理能够明显提高跃变型果实如香蕉[23]和芒果[8]果实软化相关酶(PME、Cel和多聚半乳糖醛酸酶等)的活力,导致果实在采后贮藏期间硬度快速下降。
果实成熟过程中往往伴随着色素类物质的降解与合成,果实呈现出色泽变化。叶绿素降解是果实成熟的明显标志之一。‘Granny Smith’苹果果实采后成熟过程中果皮中的叶绿素不断降解,叶绿素a、叶绿素b及总叶绿素含量不断降低(图3)。一系列的叶绿素分解代谢酶按顺序催化叶绿素的降解[24-26]。研究表明ABA能够调控叶绿素分解代谢酶编码基因的表达,正向调控叶绿素的降解,并且该过程依赖ABA信号转导途径[27]。本研究发现,除能够加速‘Granny Smith’果实软化外,外源ABA处理还能显著促进贮藏中后期果皮中叶绿素的降解,使果皮褪绿明显。贮藏结束时,ABA处理组苹果果皮的总叶绿素含量仅为对照组的73.46%。Lu Wenjing等[28]研究发现经ABA处理的香蕉果皮叶绿素含量在贮藏期间显著下降,香蕉果皮色泽加速变黄。
乙烯对于呼吸跃变型果实的成熟至关重要。然而,果实成熟并不仅仅由单一激素调控,而是受到不同植物激素间复杂的反馈网络共同作用[29]。乙烯和ABA可能在控制果实成熟方面具有同等重要的作用[30]。在呼吸跃变型和非呼吸跃变型果实中,ABA含量在果实成熟开始时会达到很高的水平[2-3,31]。本研究同样发现在‘Granny Smith’苹果采后贮藏早期,内源ABA含量迅速积累至较高水平,并且ABA处理组果实中内源ABA的积累速度和积累量明显高于对照组。ABA处理组果实内源ABA含量在贮藏第10天达到峰值,是同时期对照组的2.32 倍;对照组内源ABA含量在贮藏第15天达到峰值,且较ABA处理组的峰值低30.04%。这表明外源ABA处理能够显著促进‘Granny Smith’苹果果实内源ABA的积累,本研究结果与在番茄[7,32]和猕猴桃[33]等呼吸跃变型果实上开展的类似研究结果一致。有研究认为ABA作为上游调节因子启动呼吸跃变型果实成熟可能是通过诱导乙烯合成而实现[4]。外源ABA可提高乙烯合成相关基因的转录水平,促进乙烯的生成,而使用ABA抑制剂则具有相反的作用[2,4,8,11,28]。类似地,本研究发现外源ABA处理显著提高了苹果ACO1、ACO2和ACS1、ACS3的表达水平,显著促进了乙烯的积累。ABA处理组果实乙烯生成速率在贮藏第20天达到峰值,较同期对照组高54%;对照组乙烯生成速率在贮藏第25天达到峰值,且较ABA处理组的峰值低23%。这表明外源ABA处理能够诱导‘Granny Smith’苹果果实乙烯生物合成基因表达,促进乙烯生成。
植物乙烯受体(ETRs、ETRs和EIN4)作为乙烯响应途径的负调节因子参与感知乙烯[34-35]。ERF被认为是乙烯信号转导途径中的最终响应基因,并与果实成熟相关基因(包括ACS、ACO)启动子上的GCC-box结合,引起乙烯响应[36-37]。在苹果采后成熟过程中,乙烯释放量增加,乙烯受体基因(ETR2、ETR5、ERSs)和乙烯响应因子基因(ERFs)的表达量明显上调。本研究结果与前人研究结果[38-39]一致。此外,与对照组相比,ABA处理还整体上显著提高了乙烯信号转导因子ERS2和ETR2以及乙烯响应因子ERF3/4/5的表达水平。这表明ABA处理促进了‘Granny Smith’苹果采后贮藏期间的乙烯信号转导。
综上,与对照组相比,ABA处理能够显著增强采后‘Granny Smith’果实细胞壁降解酶(PME、Cel)活力,加速苹果果实采后软化进程,同时显著降低果实贮藏中后期的可滴定酸质量分数,显著促进苹果果实内源ABA的合成,诱导苹果乙烯生物合成基因和信号转导基因的表达,促进苹果内源乙烯合成和乙烯信号的转导。

