黑豆糖蛋白的结构分析及抗氧化和免疫活性
胡懿化,王星滟,张武霞,*,岳爱琴,杜维俊,赵晋忠,李 鹏,*
(1.山西农业大学基础部,山西 太谷 030801;2.山西农业大学农学院,山西 太谷 030801)
糖蛋白是由寡糖链与多肽链通过共价键相连而构成的糖缀合物[1]。糖肽键是糖链和肽链之间的连接键。糖蛋白结构中,糖的半缩醛羟基和含羟基的丝氨酸、苏氨酸、羟基赖氨酸等氨基酸之间连接的共价键是O-糖肽键;而糖的半缩醛羟基和天冬酰胺的酰胺基之间连接的共价键是N-糖肽键[2]。糖蛋白因其结构而同时具有糖和蛋白质两者的性质,是动植物和微生物的重要组成物质,也是生物体内细胞通讯、免疫调控等生命现象不可或缺的生物大分子[3]。已有研究报道,天然糖蛋白具有增强机体免疫力、抗氧化、抗肿瘤、降糖降脂等药理作用[4-5],因此天然活性糖蛋白的获取一直是开发药物、功能性食品及保健品的研究热点。
黑豆是一种营养价值丰富且药用价值极高的植物[6]。在民间流传的许多古方中记载,药黑豆具有补肾补血、清热解毒、活血化瘀和明目延年等功效[7]。目前关于黑豆多酚[8]、花青素[9]、类黄酮[10]和皂苷[11]等小分子化合物的活性研究报道较多,但缺乏黑豆糖蛋白结构和活性的研究。本研究对两种纯化后的黑豆糖蛋白的结构组成、抗氧化活性及免疫活性进行初步探究,以期为黑豆的功能研究提供理论参考,同时为其产品的开发提供可靠数据资料。
1 材料与方法
1.1 材料与试剂
C57BL/6小黑鼠购自中国山西医科大学,动物生产许可证号:SCXK(晋)2020-0003,动物使用许可证号:SYXK(晋)2019-0001;太谷‘青仁黑豆1号’产于中国山西省太谷区。
D-葡萄糖(纯度≥99%)、三氟乙酸(trifluoroacetic acid,TFA)、半乳糖醛酸(galacturonic acid,GalA)、考马斯亮蓝G-250、牛血清白蛋白、间羟基联苯、K3Fe(CN)6溶液、磷酸钠、钼酸铵、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、抗坏血酸、二甲基亚砜(dimethyl sulfoxide,DMSO)上海阿拉丁公司;RPMI-1640培养基 美国HyClone公司;胎牛血清 杭州四季青公司;DEAE-52纤维素、葡聚糖标准品(纯度≥99%)、单糖标准品(纯度≥99%)、刀豆蛋白(concanavalin A,ConA)、脂多糖(lipopolysaccharide,LPS)、噻唑蓝(methyl thiazolyl tetrazolium,MTT) 北京索莱宝生物科技有限公司。其他试剂均为分析纯。
1.2 仪器与设备
RE-2000A型旋转蒸发仪 上海亚荣生化仪器厂;UV-1800型分光光度计 上海精科仪器厂;1260型液相色谱仪 美国安捷伦公司;S-433D型氨基酸分析仪 德国Sykam公司;DNM-9602型酶标分析仪 北京普朗新技术有限公司;SW-CJ-1D型超净工作台 苏州净化设备有限公司;Galaxy 170S型二氧化碳细胞培养箱英国New Brunswick公司。
1.3 方法
1.3.1 黑豆糖蛋白的提取、分离及其纯化
分离纯化步骤如图1所示,采用碱提沉醇法制备黑豆糖蛋白粗品。首先将黑豆粉碎成末,加入95%(体积分数,下同)乙醇溶液,80 ℃加热回流2 h脱脂。抽滤收集的残渣加水,然后在80 ℃水浴锅中提取2 h,抽滤分离滤液,重复操作3 次。所得滤渣在50 ℃下用0.2 mol/L NaOH溶液提取2 h,收集滤液,重复操作3 次,合并滤液,进行浓缩。向浓缩后的滤液中加入4 倍体积的95%乙醇溶液,低温条件下使糖蛋白完全沉淀,将收集的沉淀溶解透析后冻干,得到糖蛋白粗品(HDJ)。然后采用Cl-型DEAE-52纤维柱(5 cm×50 cm)分离纯化,用蒸馏水,0.1 mol/L、0.2 mol/L和0.5 mol/L NaCl溶液以0.5 mL/min的流速依次洗脱,并根据糖含量收集0.2 mol/L和0.5 mol/L NaCl洗脱组分。再采用Sephadex G-100凝交过滤层析柱(柱料粒径:40~120 μm)进一步纯化上述0.2 mol/L和0.5 mol/L NaCl洗脱组分,分别用蒸馏水以0.2 mL/min的流速洗脱,硫酸-苯酚法跟踪检测不同试管糖含量,收集纯化得到两种纯黑豆糖蛋白,分别命名为HDJS2和HDJS5-2。
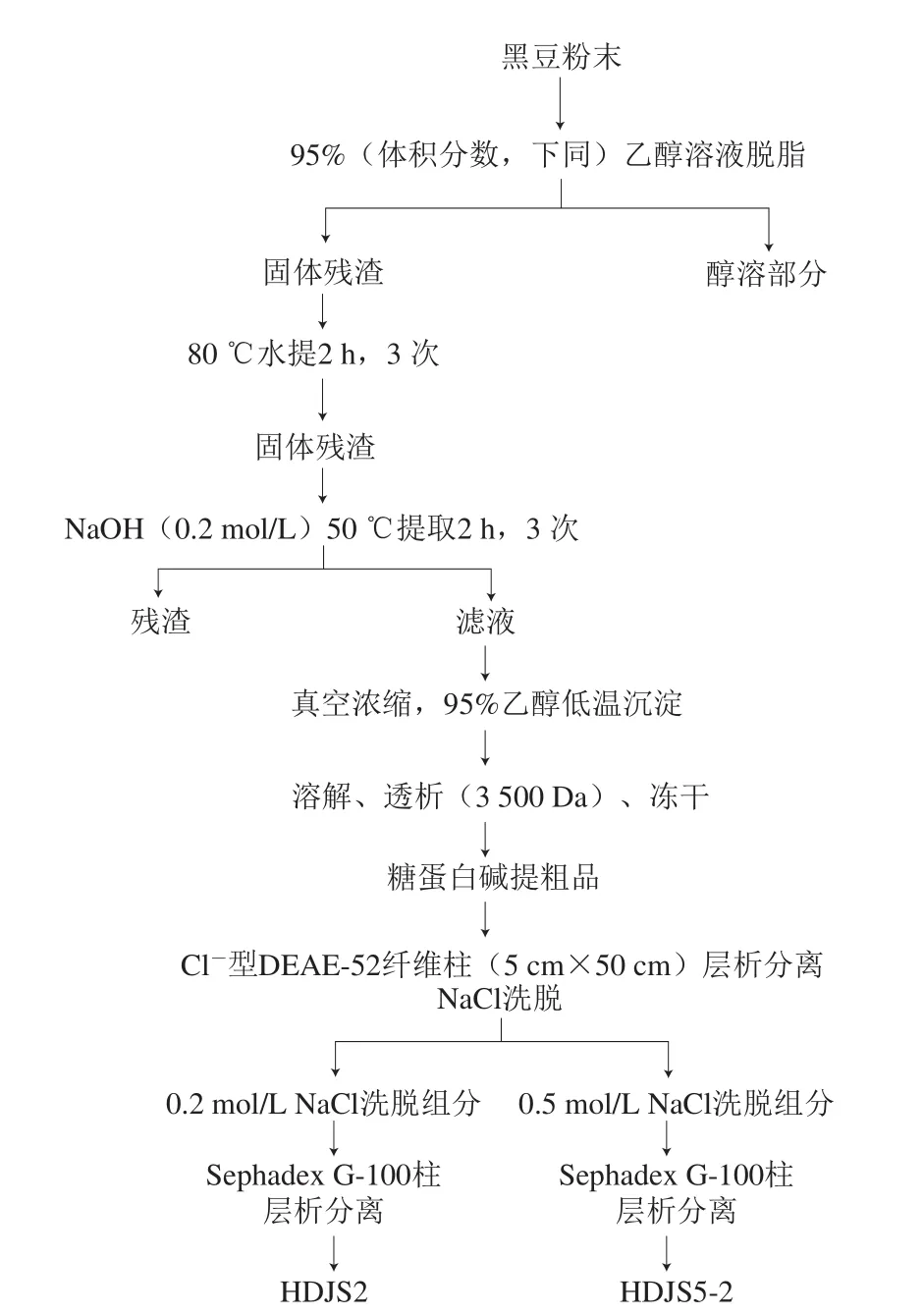
图1 黑豆糖蛋白HDJS2和HDJS5-2的提取纯化流程Fig.1 Flow chart for the extraction and purification of glycoproteins HDJS2 and HDJS5-2 from black soybeans
1.3.2 糖蛋白分子质量及化学组分的测定
1.3.2.1 分子质量的测定
黑豆纯糖蛋白HDJS2和HDJS5-2的分子质量通过高效凝交渗透色谱法(high performance gel permeation chromatography,HPGPC)[12]测定。3 根Waters色谱柱串联(型号:Ultrahydrogel Columns 250、1000和2000;300 mm×7.8 mm,6 μm),3 mmol/L乙酸钠溶液作为流动相,流速保持在0.5 mL/min,进样量为50 μL。用6 种不同分子质量的葡聚糖标准品(5.2、11.6、23.8、48、148、668 kDa)校准色谱柱,lgMw与洗脱时间(t/min)的校准曲线如式(1)所示。根据样品的保留时间,利用式(1)来定量计算HDJS2和HDJS5-2的分子质量/Da。
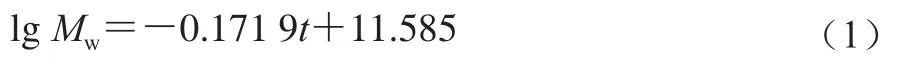
1.3.2.2 化学组分的测定
D-葡萄糖作为标准品,采用硫酸-苯酚法[13]绘制标准曲线测定HDJS2和HDJS5-2的中性糖相对含量。牛血清白蛋白作为标准品,考马斯亮蓝法[14]绘制标准曲线测定HDJS2和HDJS5-2中的蛋白质相对含量。采用间羟基联苯比色法[15]测定黑豆糖蛋白中糖醛酸的相对含量,GalA作为标准品,绘制标准曲线并计算HDJS2和HDJS5-2中的糖醛酸相对含量。
1.3.2.3 单糖组成分析
以8 种单糖标准品甘露糖(mannose,Man)、鼠李糖(rhamnose,Rha)、GalA、葡萄糖(glucose,Glc)、半乳糖(galactose,Gal)、木糖(xylose,Xyl)、阿拉伯糖(arabinose,Ara)和岩藻糖(fucose,Fuc)(纯度≥99%)作为对照,采用柱前PMP衍生法,通过高效液相色谱(high performance liquid chromatography,HPLC)进行分析[16]。待测样品HDJS2和HDJS5-2加水预溶,加入4 mol/L TFA 110 ℃水解4 h,冷却后加甲醇除去多余的TFA至无酸味,蒸馏水溶解得到多糖水解液。向上述处理好的样品水解液或单糖混合液中加入0.6 mol/L氢氧化钠溶液充分混合,加入0.5 mol/L的PMP甲醇溶液,振荡混匀并在70 ℃水浴反应100 min。反应混合物用0.3 mol/L盐酸中和后用氯仿提取3 次,0.22 μm滤膜过滤后,用高效液相色谱仪1260检测。色谱条件:ZORBAX Eclipse XDB-C18色谱柱(250 mm×4.6 mm,5 μm),柱温20 ℃;紫外检测波长:254 nm;流速:1 mL/min。进样体积:20 μL。流动相由两种溶液的梯度洗脱组成(A相:15%乙腈+85%磷酸盐缓冲液;B相:40%乙腈+60%磷酸盐缓冲液)。对照标准品,根据出峰时间确定单糖种类,根据峰面积计算单糖含量。
1.3.2.4 氨基酸分析
采用全自动氨基酸分析仪对黑豆糖蛋白中水解氨基酸的种类及含量进行测定[17]。准确称取2 mg待测样品于10 mL水解管中;加入6 mol/L盐酸2 mL,充入高纯氮气1~2 min;移开氮气后立即盖好并拧紧盖子。将水解管置于(110±1)℃恒温烘箱中水解22 h;水解完成后冷却混匀,将水解液过滤、定容至10 mL。吸取1 mL样液于圆底烧瓶内,在45 ℃条件下抽真空浓缩,残留物用样品稀释液溶解稀释,振荡混匀,用0.22 μm滤膜过滤后,上机测定。
S433-D氨基酸分析仪检测系统分析条件:固定相:Na+型磺酸基阳离子交换树脂;流动相:四元梯度混合系统(A相:pH 3.45的柠檬酸钠缓冲液;B相:pH 10.85的柠檬酸钠缓冲液;C相:5%甲醇溶液;再生液:2% NaOH溶液);柱温:58 ℃;紫外检测波长:570 nm和440 nm;流速:0.45 mL/min;进样体积:0.1 mL。
1.3.3 傅里叶变换红外光谱分析
采用KBr压片法对系列黑豆纯糖蛋白进行傅里叶变换红外光谱分析[18]。将HDJS2和HDJS5-2置于常压干燥器中过夜。分别取干燥的HDJS2和HDJS5-2按1∶100的质量比与KBr粉末混匀、研磨后压片,Spectrom Two傅里叶变换红外光谱仪在4 000~400 cm-1的波长范围内进行扫描,并记录吸收峰。
1.3.4 黑豆糖蛋白糖肽键的鉴定
糖肽键类型的判断主要采用β-消除反应[19],用0.2 mol/L NaOH溶液处理HDJS2和HDJS5-2,45 ℃反应30 min,冷却后在240 nm波长处测定NaOH处理前后样品的吸光度。
1.3.5 体外抗氧化活性的测定
1.3.5.1 总还原力的测定
参考文献[20]评估样品作为还原剂在氧化还原反应中的抗氧化活性。用蒸馏水配成质量浓度分别为0.5、1、2、4、8 mg/mL的样品溶液,加入0.2 mmol/L磷酸盐缓冲液(pH 6.6)和质量分数1% K3[Fe(CN)6]溶液混匀,在50 ℃下反应20 min后,加入质量分数为10%三氯乙酸溶液终止反应。取上清液并加入等体积的超纯水和质量分数为0.1%三氯化铁溶液混匀。室温下反应15 min后,测定700 nm波长处的吸光度。
1.3.5.2 总抗氧化能力的测定
参考文献[21]根据反应体系的颜色变化来测定HDJS2和HDJS5-2的抗氧化能力。配制不同质量浓度的样品(0.5、1、2、4、8 mg/mL)。配制磷钼试剂:称取2.660 8 g磷酸钠(Na3PO4·12H2O)和1.235 7 g钼酸铵[(NH4)6Mo7O24·4H2O],放入烧杯中,并缓缓加入8.2 mL浓硫酸使之充分溶解,然后用蒸馏水定容至250 mL备用。取1 mL待测样品溶液和6 mL磷钼试剂于试管中,快速混匀并在95 ℃恒温水浴反应90 min。测定并记录735 nm波长处的吸光度。
1.3.5.3 DPPH自由基清除率的测定
DPPH自由基清除实验被广泛用于评估植物提取物的自由基清除活性[22]。用质量分数为95%的乙醇溶液配制0.1 mmol/L的DPPH溶液,分别向1 mL不同质量浓度(0.5、1、2、4、8 mg/mL)的HDJS2和HDJS5-2中加入4 mL DPPH溶液,振荡,使其充分混匀。室温条件下反应30 min后在517 nm波长处测定吸光度。蒸馏水代替样品为空白组,DPPH自由基清除率按式(2)计算。
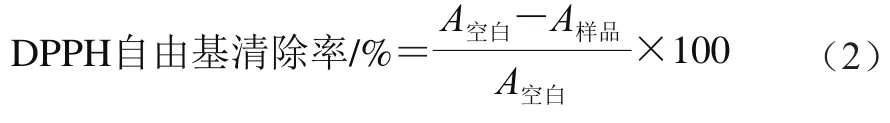
式中:A样品为1 mL不同浓度的样品和DPPH溶液反应后在570 nm波长处的吸光度;A空白为1 mL蒸馏水和4 mL DPPH溶液在570 nm波长处的吸光度。
1.3.6 脾细胞增殖实验
1.3.6.1 小鼠脾淋巴细胞悬液的制备
无菌操作取出小鼠脾脏,在100 目不锈钢网上用5 mL注射器活塞轻轻地研磨脾脏,用磷酸盐缓冲液洗涤两次后加入红细胞裂解液,1 000 r/min离心5 min,离心后用RPMI-1640培养基洗涤两次,获得的单细胞悬液用含有质量分数10%胎牛血清的RPMI-1640培养基培养。
1.3.6.2 黑豆糖蛋白对小鼠脾淋巴细胞增殖的影响
根据Mosmann[23]概述的MTT法体外评估黑豆糖蛋白对小鼠脾淋巴细胞增殖的影响。ConA和LPS作为刺激T淋巴细胞和B淋巴细胞的有丝分裂原。将按上述方法获得的小鼠脾淋巴细胞悬液,置于96 孔板中孵育,密度为1×107个/mL,实验组包括单独刺激组:分别加入不同质量浓度(50、100、200 μg/mL)的HDJS2和HDJS5-2单独作用,设置磷酸盐缓冲液空白对照和ConA、LPS两个阳性对照;ConA协同组:用不同质量浓度的(50、100、200 μg/mL)HDJS2和HDJS5-2与ConA(5 μg/mL)协同作用,设置ConA对照;LPS协同组:用不同质量浓度(50、100、200 μg/mL)的HDJS2和HDJS5-2与LPS(5 μg/mL)协同作用,设置LPS对照。设置6 个复孔,在37 ℃条件下孵育48 h后,加入MTT(5 mg/mL),再继续孵育4 h。用酶标仪在600 nm波长处测定OD值。
1.4 数据统计与分析
数据结果以平均值±标准差表示。使用GraphPad Prism 5软件进行统计分析及绘图。差异显著性采用t-检验分析,P<0.05表示差异显著,P<0.01表示差异极显著,P<0.001表示差异高度显著。
2 结果与分析
2.1 黑豆糖蛋白成分分析结果
2.1.1 化学组分分析
黑豆糖蛋白的分子质量及化学组分相对含量如表1所示,HDJS2和HDJS5-2主要是由蛋白质和中性糖组成,含有少量的糖醛酸,其中蛋白质含量最高。HDJS5-2的中性糖含量、蛋白质含量和糖醛酸含量均高于HDJS2。如图2所示,根据待测样品的保留时间,代入公式(1)计算得到HDJS2的分子质量为3.20×104Da、HDJS5-2的分子质量为3.89×104Da。

表1 HDJS2和HDJS5-2分子质量及组分相对含量Table 1 Molecular masses and components of HDJS2 and HDJS5-2
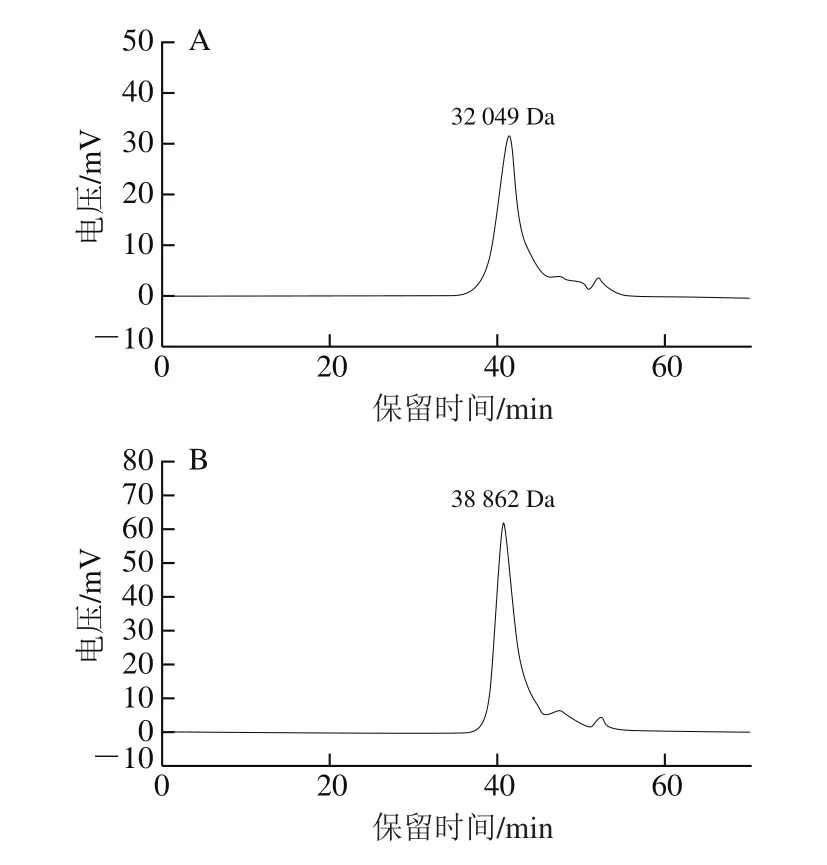
图2 HDJS2和HDJS5-2的高效液相色谱图Fig.2 HPGPC chromatograms of HDJS2 and HDJS5-2
2.1.2 单糖组成分析结果
如图3所示,单糖组成分析结果表明,HDJS2主要由Man、Glc、Gal、Ara和Fuc组成,对应物质的量比为17.754∶33.951∶18.240∶16.321∶4.407。HDJS5-2主要由Man、Glc、Gal和Ara组成,对应物质的量比为50.001∶4.688∶11.908∶10.741。
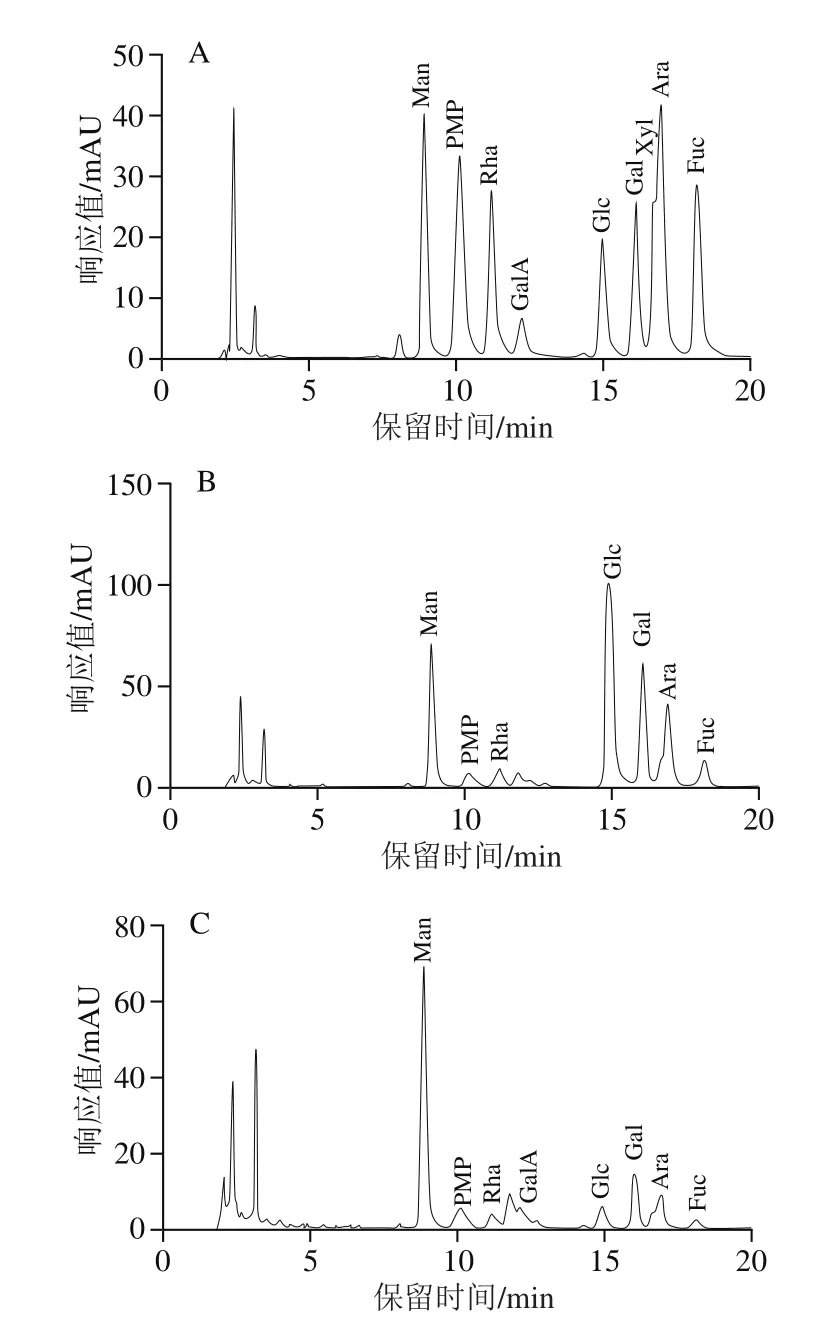
图3 PMP衍生物色谱图Fig.3 Chromatograms of PMP derivatives of HDJS2 and HDJS5-2
2.1.3 氨基酸分析结果
通过全自动氨基酸分析仪检测分析HDJS2和HDJS5-2所含氨基酸的种类和相对含量,结果如表2所示。HDJS2和HDJS5-2两个组分中均含有17 种氨基酸,其中7 种人体必需氨基酸,总相对含量分别为31.3%和17.4%;10 种非必需氨基酸,总相对含量分别为64.8%和53.9%。此外HDJS2和HDJS5-2还含有7 种药用氨基酸。HDJS2的氨基酸相对含量比HDJS5-2高,两者总相对含量分别为96.1%和71.3%。谷氨酸和天冬氨酸为主要氨基酸。
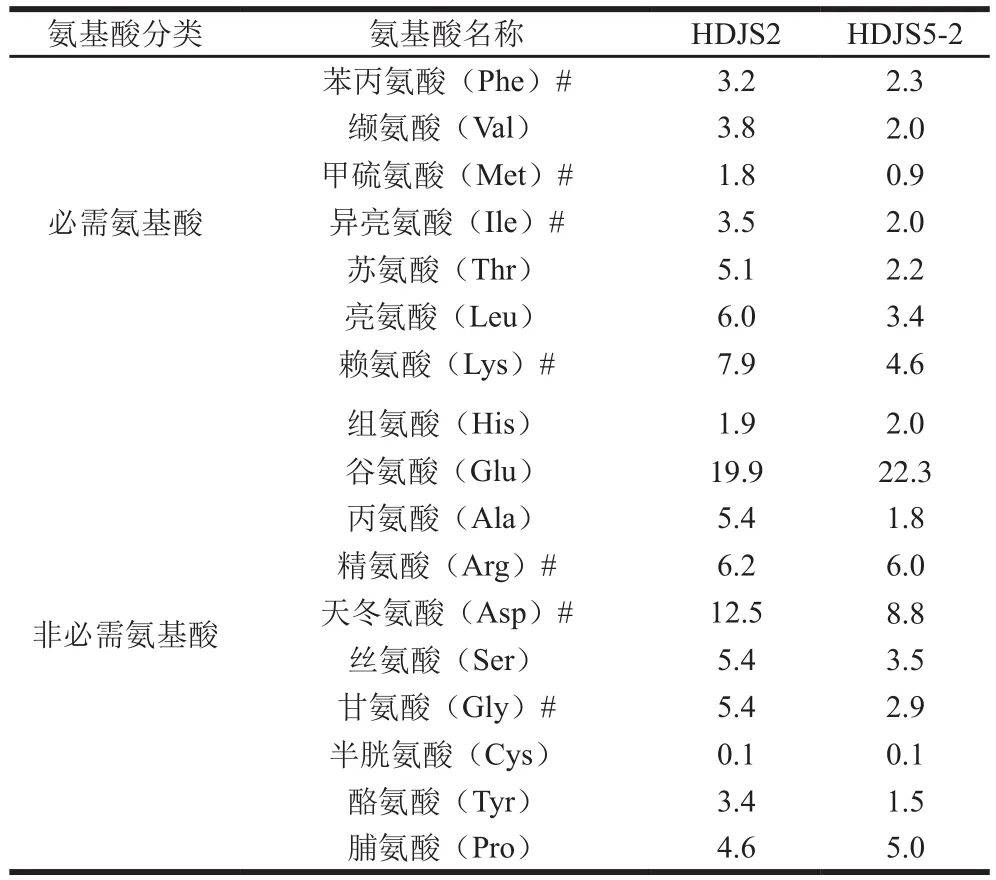
表2 黑豆糖蛋白氨基酸组成及相对含量Table 2 Amino acid composition of HDJS2 and HDJS5-2%
2.2 黑豆糖蛋白的结构鉴定
2.2.1 傅里叶变换红外光谱分析结果
如图4所示,在傅里叶变换红外光谱图3 300 cm-1左右处,HDJS2和HDJS5-2两个纯糖蛋白都出现了一个较宽的吸收峰,这是羟基的伸缩振动而产生的吸收峰,说明该组分中具有羟基官能团;在2 960 cm-1处产生的吸收峰由—CH伸缩振动引起,这说明HDJS2和HDJS5-2具有糖的化学结构[24]。在1 660 cm-1和1 240 cm-1附近分别出现了α-螺旋和β-折叠的特征吸收峰,说明这两个黑豆糖蛋白具有蛋白质的化学结构[25]。在1 650 cm-1处HDJS5-2的吸收峰面积比HDJS2大,这说明HDJS5-2结构中酰胺键数量比HDJS2多,所以HDJS5-2的蛋白质含量比HDJS2组分的蛋白质含量高,这与上述蛋白质含量的测定结果一致。1 000~1 200 cm-1附近的吸收峰显示有吡喃糖环。
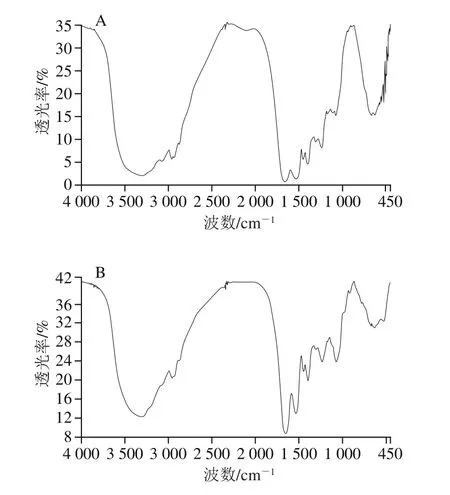
图4 HDJS2(A)和HDJS5-2(B)的傅里叶变换红外光谱图Fig.4 Fourier transform infrared spectra of HDJS2 (A) and HDJS5-2 (B)
2.2.2 糖肽键的鉴定
在碱性条件下,O-糖肽键发生β-消除反应,与糖链相连的丝氨酸转化形成不饱和脂肪酸,在240 nm波长处的吸光度发生明显的变化,从而鉴定HDJS2和HDJS5-2的糖肽键类型。NaOH处理后,HDJS2和HDJS5-2在240 nm波长处的吸光度均发生了明显的变化(表3),这说明HDJS2和HDJS5-2的糖肽键类型均为O-糖肽键。
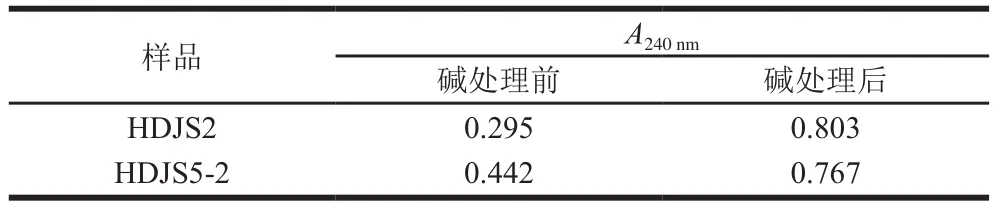
表3 HDJS2和HDJS5-2 β-消除反应前后吸光度的变化Table 3 Changes in absorbance of HDJS2 and HDJS5-2 before and after β-elimination reaction
2.3 抗氧化活性分析结果
通过体外实验评估黑豆糖蛋白HDJS2和HDJS5-2的抗氧化活性,结果如图5所示。吸光度越高,表明样品的总还原能力和总抗氧化能力越强。如图5A和5B所示,随着糖蛋白质量浓度的增加,HDJS2和HDJS5-2的总还原能力和总抗氧化能力不断增强,后者的总还原力和总抗氧化能力明显强于前者。
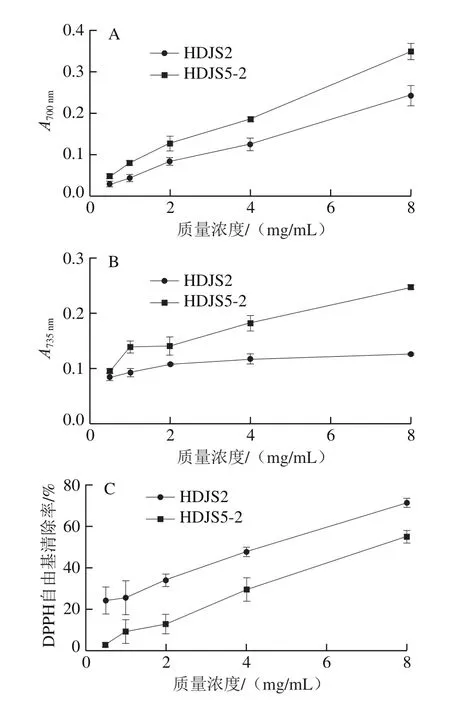
图5 HDJS2和HDJS5-2的抗氧化活性Fig.5 Antioxidant activity of HDJS2 and HDJS5-2
黑豆糖蛋白的DPPH自由基的清除能力如图5C所示。HDJS2和HDJS5-2的质量浓度与DPPH自由基清除率呈正相关关系,当样品质量浓度达到8 mg/mL时,HDJS2和HDJS5-2的DPPH自由基清除率达到最高,分别是71%和55%。此外,HDJS2的DPPH清除能力明显高于HDJS5-2的DPPH自由基清除能力。
2.4 黑豆糖蛋白对小鼠脾淋巴细胞增殖的影响
脾淋巴细胞的增殖也是机体发挥免疫调控作用的重要环节之一。HDJS2和HDJS5-2单独刺激脾细胞时,脾淋巴细胞增殖呈质量浓度依赖关系,HDJS2明显比HDJS5-2的促增殖效果好(图6A),这可能与两者氨基酸和单糖的组成及含量不同有密切的关系。LPS与HDJS2或HDJS5-2协同刺激小鼠脾淋巴细胞增殖的效果不明显(图6B)。ConA协同刺激组均低于ConA对照组(图6C),这说明HDJS2和HDJS5-2分别与ConA共同作用时,反而会抑制小鼠脾淋巴细胞的增殖。
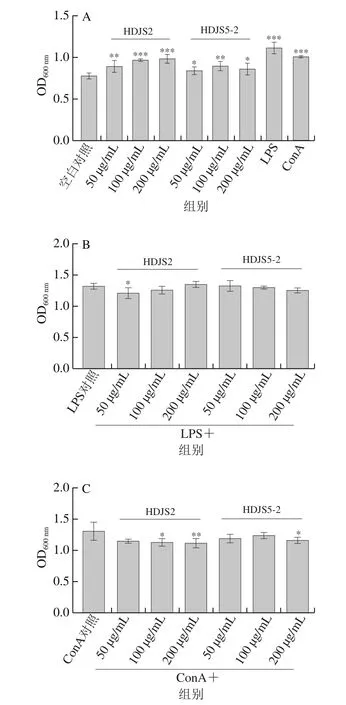
图6 HDJS2和HDJS5-2对脾细胞增殖的影响Fig.6 Effects of HDJS2 and HDJS5-2 on splenocyte proliferation
3 讨 论
糖蛋白来源丰富、种类繁多,在科研及食品医疗行业的应用十分广泛。天然糖蛋白是动物和植物体内的重要大分子物质,也是动植物体内的通讯媒介,因其糖蛋白的结构复杂多样,所以在细胞信号传递过程中有着极为复杂的作用[26-27]。本实验对两种黑豆糖蛋白(HDJS2、HDJS5-2)的结构特征、抗氧化活性及免疫活性进行研究,理化和光谱分析结果表明,HDJS2(3.2×104Da)和HDJS5-2(3.89×104Da)是O-型糖肽键连接的糖蛋白,含有α-螺旋和β-折叠蛋白质二级结构。HDJS2糖链部分主要是由Man、Glc、Gal、Ara和Fuc组成;而HDJS5-2糖链部分主要由Man、Glc、Gal和Ara组成。HDJS2和HDJS5-2均含有17 种氨基酸,7 种必需氨基酸总相对含量占总氨基酸的32.6%和24.4%,研究表明西藏不同产地的冬虫夏草必需氨基酸相对含量仅占总氨基酸的26.47%~27.52%[28],说明HDJS2中必需氨基酸的含量远高于冬虫夏草。HDJS2和HDJS5-2还含有7 种药用氨基酸(苯丙氨酸、甲硫氨酸、异亮氨酸、赖氨酸、精氨酸、天冬氨酸、甘氨酸),药用氨基酸种类丰富,总相对含量分别为40.5%和27.5%,其中HDJS2药用氨基酸总含量接近灵武长枣(药用氨基酸占总氨基酸的42.1%)中药用氨基酸的含量[29],这说明HDJS2和HDJS5-2可能有一定的药用价值。
机体细胞的癌变、衰老及其他疾病都与机体内自由基的过量产生有直接的密切联系[30-31]。霍山铁皮石斛糖蛋白具有较强的还原能力和DPPH自由基清除能力[32]。本实验测定了HDJS2和HDJS5-2的抗氧化活性。总还原能力、总抗氧化能力和DPPH自由基清除能力均呈剂量依赖关系(图5),抗氧化能力随着糖蛋白质量浓度的升高不断增强。
脾细胞增殖是细胞免疫或体液免疫激活途径中最重要的步骤之一,Zhang Wuxia等[33]研究发现从白芍中提取的多糖RPAPS能够促进脾细胞增殖,Shen Zhuying等[34]发现纳豆糖蛋白能够显著增强淋巴细胞的活化。HDJS2和HDJS5-2具有刺激免疫反应的潜力。前人研究发现,植物糖蛋白通过激活免疫细胞表面受体(Man受体、清道夫受体、Toll样受体以及CD3/CD28等),促进下游通路产生细胞因子进行免疫调节[35-36];T、B淋巴细胞表面抗原受体激活将信号转导至细胞内,产生刺激淋巴细胞活化的信号,促进增殖。此外,Man和Fuc残基,能够与Man受体结合,激活免疫应答反应[37]。本实验中的糖蛋白含有较多的Man和Fuc,分别占总糖相对含量的17%和50%,因此推测HDJS2和HDJS5-2可能通过激活抗原呈递细胞Man受体及Toll样受体等促进细胞因子的释放,或者直接结合T、B细胞表面受体促进脾细胞增殖,从而发挥免疫调节作用。本实验为HDJS2和HDJS5-2的合理开发和应用提供了一定的参考。

