宽皮柑橘浮皮时脱落酸积累变化及其代谢基因表达特征
贺明阳,洪 敏*,王日葵,喻最新,朱 莉,周 炼,邓涂静
(1.西南大学/中国农业科学院柑桔研究所,重庆 400712;2.中国科学院华南植物园植物资源保护与可持续利用重点实验室,广东 广州 510650;3.全国农业技术推广服务中心,北京 100125)
柑橘是世界上最重要的水果之一,栽培历史悠久[1],因其独特的风味、口感、香气和多种保健功效广受消费者喜爱[2]。柑橘果实浮皮是成熟后期或采后衰老过程中普遍发生的一种生理性病害,包裹果肉的囊瓣膜(囊衣)与果皮分离后浮起并产生空隙,常伴随果实粒化和枯水,果实糖酸品质劣变、风味寡淡[3-4]。宽皮柑橘(Citrus reticulataBlanco)是重要的柑橘类水果[5],产量占中国柑橘总产量的65%,果实浮皮现象严重[4],浮皮的危害程度随采收期推迟而加剧[6],是柑橘产业面临的重要问题。浮皮的发生与采前因素(品种、气候、果园管理、采收期等)和采后因素(贮藏条件等)有关[3,6],而浮皮发生的内在机制尚不明确,还需从更多角度进行分析。
研究发现浮皮与内源激素水平变化密切相关。外源赤霉素的施用对柑橘果皮发育具有重要调控作用[7],能够调节细胞膜通透性[8],延缓果实着色,增加果实白皮层的致密性,减少浮皮的发生[9-10]。Ibanez[11]和Martinelli[12]等发现赤霉素信号相关基因在柑橘浮皮果皮中表达受到抑制。张天志[13]利用温州蜜柑‘宫川’及其耐浮皮‘芽变’为材料进行研究,发现果实发育后期浮皮果白皮层中脱落酸(abscisic acid,ABA)含量高于耐浮皮果。王向阳等[14]发现贮藏期间‘椪柑’枯水果果皮ABA含量始终高于正常果果皮,生长素含量始终低于正常果果皮。陈昆松等[15]发现‘本地早’贮藏过程中果肉ABA含量逐渐降低,果皮ABA积累,果皮生长素水平迅速上升,认为果皮组织衰老迟于果肉,且有二次生长趋势。本团队从贮藏30 d后的柑橘果皮中检测了3 种生长发育相关激素,发现采后果皮大量积累ABA,且浮皮时ABA含量显著下调。目前浮皮时果皮ABA积累变化尚无定论,涉及不同品种和贮藏期,且采后贮藏过程中ABA代谢基因在浮皮果实中的表达情况尚不清楚,因此探究宽皮柑橘浮皮时ABA积累变化及其代谢基因表达特征具有重要意义。
类胡萝卜素代谢是ABA生物合成主要途径[16]。丙酮酸和3-磷酸甘油醛经2-C-甲基-D-赤藓糖醇-4-磷酸途径,由牻牛儿基牻牛儿基焦磷酸合成酶(geranylgeranyl diphosphate synthase,GGPPS)催化生成牻牛儿基牻牛儿基焦磷酸(geranylgeranyl diphosphate,GGPP)[17]。GGPP经八氢番茄红素合成酶(phytoene synthase,PSY)、八氢番茄红素脱饱和酶(phytoene desaturase,PDS)、15-顺-ζ-胡萝卜素异构酶、ζ-胡萝卜素脱饱和酶(ζ-carotene desaturase,ZDS)、胡萝卜素异构酶(carotene isomerase,CRTISO)催化合成全反式番茄红素[18]。番茄红素经ε-和β-环化(α-分支)、羟基化生成叶黄素,主要有番茄红素ε环化酶(lycopeneε-cyclase,LCYE)、番茄红素β环化酶(lycopeneβ-cyclase,LCYB)、β-胡萝卜素羟化酶(β-carotene hydroxylase,BCH)、ε-胡萝卜素羟化酶参与[19]。番茄红素经β-环化(β-分支)、羟基化和环氧反应生成β-胡萝卜素、β-隐黄质、玉米黄质、花药黄质、紫黄质、新黄质,主要有LCYB、BCH、玉米黄质环氧酶(zeaxanthin epoxidase,ZEP)、紫黄质脱环氧酶(violaxanthin de-epoxidase,VDE)、新黄质合成酶参与[20]。辣椒红素/辣椒玉红素合成酶(capsanthin-capsorubin synthase,CCS)可催化花药黄质、紫黄质分别生成辣椒红素和辣椒玉红素,辣椒红素经ZEP催化生成辣椒玉红素[17]。β-胡萝卜素经类胡萝卜素裂解双加氧酶(carotenoid cleavage dioxygenases,CCD)催化合成独脚金内酯[21-22]。紫黄质和新黄质经9-顺-环氧类胡萝卜素双加氧酶(nine-cis-epoxycarotenoid dioxygenase,NCED)催化合成ABA前体物质黄质醛[16,23]。ABA分解代谢主要由脱落酸8’-羟化酶(abscisic acid 8’-hydoxylase,AB1)催化[24]。MYB68、ABF3转录因子调控ABA代谢[25-26]。
‘克里曼丁’和‘椪柑’宽皮柑橘类采后易发生浮皮,因此,本研究以贮藏30 d的两个柑橘品种为材料,运用高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)和实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,q-PCR)技术,解析浮皮与正常果皮ABA、类胡萝卜素组分含量的差异以及ABA代谢基因表达特征。研究结果有助于揭示柑橘浮皮发生的内在机制,为柑橘采后浮皮防控技术研发提供理论依据。
1 材料与方法
1.1 材料与试剂
‘克里曼丁’和‘椪柑’果实于2018年采自国家柑橘种质资源圃(重庆北碚)。采摘大小一致、色泽均匀、无机械损伤、无病虫害、九成熟的果实为材料。
多糖多酚植物总RNA提取试剂盒(DP441) 天根生化科技(北京)有限公司;PrimeScript®RT reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒(RR047A)、SYBR®Premix ExTaq™ II(Tli RNaseH Plus)荧光定量试剂盒(RR820A) 宝生物工程(大连)有限公司。
1.2 仪器与设备
HPLC-MS/MS仪 美国Waters公司;高效液相色谱仪 美国安捷伦公司;H1850R台式高速冷冻离心机长沙湘仪离心机仪器有限公司;YGC-16A全自动氮吹浓缩仪 郑州宝晶电子科技有限公司;CFX96TM实时荧光定量PCR仪 美国伯乐公司。
1.3 方法
1.3.1 原料处理
用500 mg/L咪鲜胺浸泡果实30 s,捞出沥干,用聚乙烯薄膜袋单果包装。处理后的果实置于温度18~20 ℃、相对湿度85%~90%条件下贮藏。贮藏30 d后选择浮皮程度一致的果实为浮皮样品,正常果实为对照组样品(图1)。15 个果实为一组,设3 组重复,分别取1/4果皮用液氮速冻,混合粉碎后于-80 ℃保存备用。
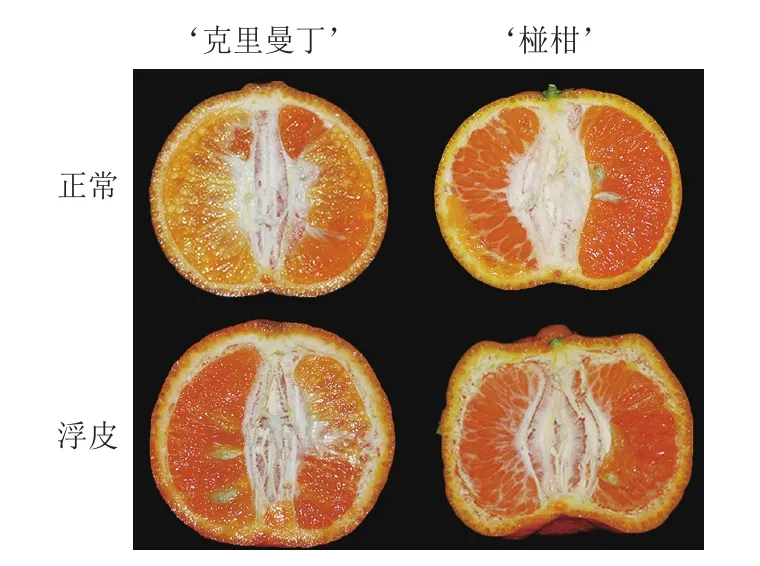
图1 柑橘贮藏30 d后正常和浮皮果实的纵切面图Fig.1 Longitudinal section of normal mandarins and those with peel puffing after 30 d storage
1.3.2 果实浮皮指数及果皮水分质量分数的测定
100 个果实为一组,设3 组重复,进行果实浮皮指数和果皮水分质量分数测定。果实浮皮指数测定参考石学根等[27]的方法。用1 cm直径的打孔器在每个果实的果皮对角线上各打一个孔,采用直接干燥法测定果皮水分质量分数。
1.3.3 果皮脱落酸含量的测定
脱落酸含量测定参考Pan Xianqing等[28]的方法。选用外标法进行定量分析。称取50 mg研磨成粉末的样品,加入0.5 mL提取液(异丙醇、去离子水、浓盐酸体积比为2∶1∶0.002),低温超声30 min,然后加入1 mL二氯甲烷,低温超声30 min。4 ℃、13 000×g离心5 min,吸取底层溶液在氮吹仪中浓缩。最后取0.1 mL甲醇溶解浓缩样品,用直径0.22 μm滤膜过滤后进行HPLC-MS/MS检测。实验重复3 次。
HPLC条件:C18柱(150 mm×2.0 mm,5 μm);柱温40 ℃;流动相A(体积分数0.1%甲酸溶液)、流动相B(0.1%甲酸-甲醇溶液);进样量为5 μL;流速为0.3 mL/min。MS条件:离子喷雾电压-4 500 V、离子源温度500 ℃、气帘气压强40 psi、雾化气压强45 psi、辅助气压强30 psi。
1.3.4 类胡萝卜素组分及含量的测定
类胡萝卜素提取、皂化参考陈细羽等[29]的方法,用直径0.22 μm滤膜过滤后上机。实验重复3 次。色谱条件:YMC类胡萝卜素C30柱(250 mm×4.6 mm,5 μm);柱温25 ℃;流动相为甲醇-甲基叔丁基醚(体积比70∶30);进样量为20 μL;流速为1 mL/min;检测波长为450 nm。
1.3.5 ABA代谢基因相对表达量的测定
参照多糖多酚植物总RNA提取试剂盒操作说明书提取柑橘果皮总RNA,然后利用反转录试剂盒反转录成cDNA,-20 ℃保存备用。
柑橘ABA代谢基因引物序列参考Zhu Feng[25]、Rodrigo[30]、Wang Lu[31]等的设计。采用SYBR染料法测定基因表达水平,参照SYBR®Premix ExTaq™ I(Tli RNaseH Plus)荧光定量试剂盒的说明操作,利用qPCR仪进行测定。反应体系如下:10 μL SYBR Green I mix、0.8 μL正向引物、0.8 μL反向引物、1.5 μL cDNA模板、6.9 μL ddH2O。两步法PCR反应程序如下:95 ℃、30 s;95 ℃、5 s,58 ℃、30 s,40 个循环。融解曲线绘制:95 ℃、10 s,降温到65 ℃后开始以0.5 ℃每步升温,并维持5 s采集荧光信号,反应至95 ℃结束。实验重复3 次。采用2-ΔΔCt法进行相对定量分析。
1.4 数据处理与分析
数据利用Microsoft Excel 2007软件进行统计处理,选用SPSS 20软件执行Duncan法进行显著性分析(P<0.05)和Pearson相关性分析(P<0.05),采用Origin 8软件绘图。
2 结果与分析
2.1 贮藏期间柑橘果实浮皮指数和果皮水分质量分数的变化
如表1所示,贮藏30 d后‘克里曼丁’和‘椪柑’果实浮皮指数显著增加,分别提高了177%和186%;果皮水分质量分数也显著上升,分别提高了5.9%和14.4%。
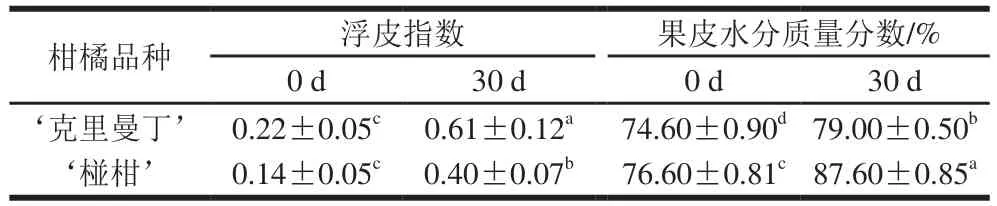
表1 ‘克里曼丁’和‘椪柑’贮藏前后果实浮皮指数和果皮水分质量分数的变化Table 1 Changes in peel puffing indexes and peel water contents in‘Clementine’ and ‘Ponkan’ fruits after storage
2.2 浮皮对柑橘果实果皮ABA含量的影响
柑橘果实采后贮藏过程是一个自身消耗引起的衰老过程,受ABA调控[32]。如图2所示,‘克里曼丁’和‘椪柑’果实正常果皮的ABA含量分别为1 659.2、464.6 ng/g,浮皮果实果皮ABA含量分别显著下降至795.1、230.5 ng/g,为正常果皮的47.9%、49.6%。‘克里曼丁’正常与浮皮果实的果皮ABA含量均高于‘椪柑’,其中正常果皮ABA含量为‘椪柑’正常果皮的3.57 倍,浮皮果实果皮ABA含量为‘椪柑’浮皮果实果皮的3.45 倍。
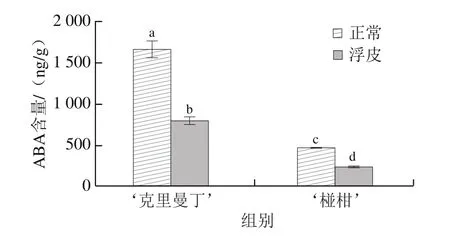
图2 ‘克里曼丁’和‘椪柑’浮皮时果皮ABA含量的变化Fig.2 Changes in abscisic acid contents in ‘Clementine’ and ‘Ponkan’fruits after peel puffing
2.3 浮皮对柑橘果实果皮类胡萝卜素组分含量的影响
如图3所示,‘克里曼丁’和‘椪柑’果皮中主要积累β-隐黄质。对于‘克里曼丁’柑橘,正常果皮和浮皮果实果皮中总类胡萝卜素含量分别为378.8、295.9 μg/g,浮皮果实果皮总类胡萝卜素含量显著降低,为正常果皮的78.1%;浮皮果实果皮β-胡萝卜素、β-隐黄质、叶黄素、辣椒红素含量显著降低,分别为8.7、248.8、3.8、14.5 μg/g,分别为正常果皮的85.2%、76.6%、70.1%、68.1%;浮皮果实果皮紫黄质、新黄质含量显著增加,分别为9.6、5.9 μg/g,为正常果皮的127.9%、138.4%。玉米黄质含量为4.6 μg/g,与正常果皮无显著差异。
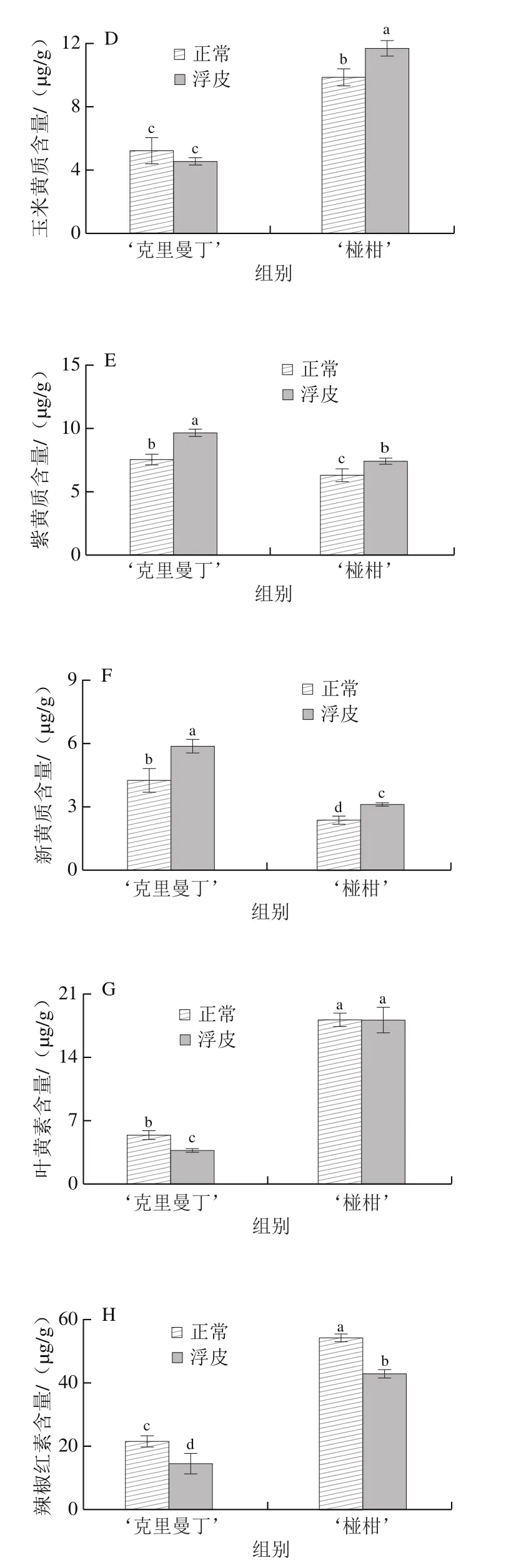
图3 ‘克里曼丁’和‘椪柑’浮皮时果皮类胡萝卜素及其组分含量的变化Fig.3 Changes in contents of total and individual carotenoids in‘Clementine’ and ‘Ponkan’ fruits after peel puffing
对于‘椪柑’,正常果皮和浮皮果实果皮中总类胡萝卜素含量分别为809.9、859.6 μg/g,浮皮时总类胡萝卜素含量虽有增加,但与正常果皮无显著差异;浮皮果实果皮β-胡萝卜素、辣椒红素含量显著降低,分别为22.1、42.6 μg/g,分别为正常果皮的80.8%、79.0%;浮皮果实果皮β-隐黄质、玉米黄质、紫黄质、新黄质含量显著增加,分别为754.3、11.8、7.4、3.1 μg/g,分别为正常果皮的109.0%、118.1%、117.6%、133.2%;浮皮果实果皮叶黄素含量为18.1 μg/g,与正常果皮无显著差异。
Pearson相关性分析发现,两个柑橘品种浮皮时果皮ABA含量与β-胡萝卜素、辣椒红素含量呈显著正相关(P<0.05),与新黄质、紫黄质含量呈显著负相关(P<0.05)。

2.4 浮皮对柑橘果实果皮ABA生物合成基因表达水平的影响
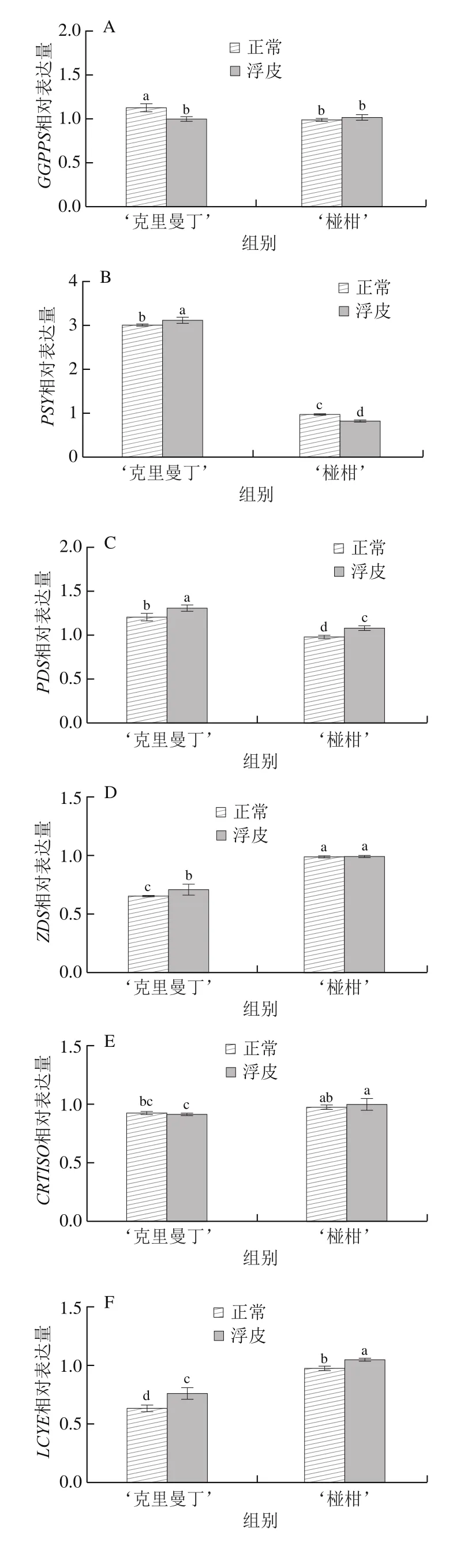
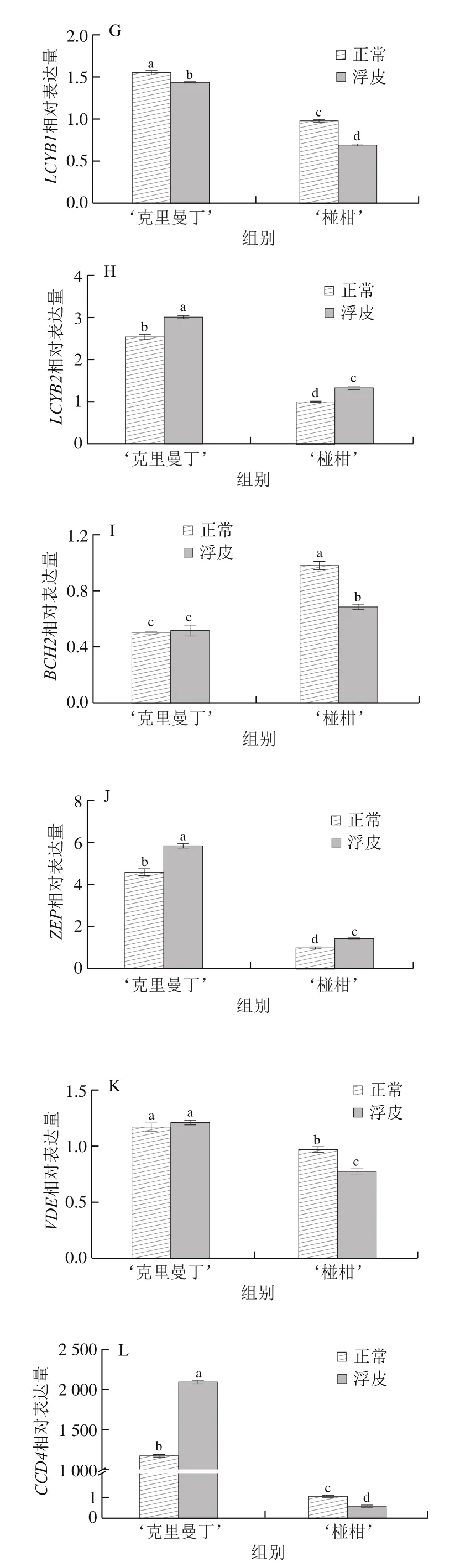
如图4所示,在ABA生物合成途径中共检测了15 个基因的相对表达量。对于‘克里曼丁’柑橘,浮皮果实果皮GGPPS、LCYB1、NCED2、NCED5相对表达量显著降低,分别为正常果皮的87.6%、92.3%、83.8%、92.8%;PSY、PDS、ZDS、LCYE、LCYB2、ZEP、CCD4、CCS相对表达量显著增加,分别为正常果皮的103.7%、107.4%、109.2%、120.3%、118.6%、128.0%、176.7%、129.2%;CRTISO、BCH2、VDE相对表达量与正常果皮无显著差异。
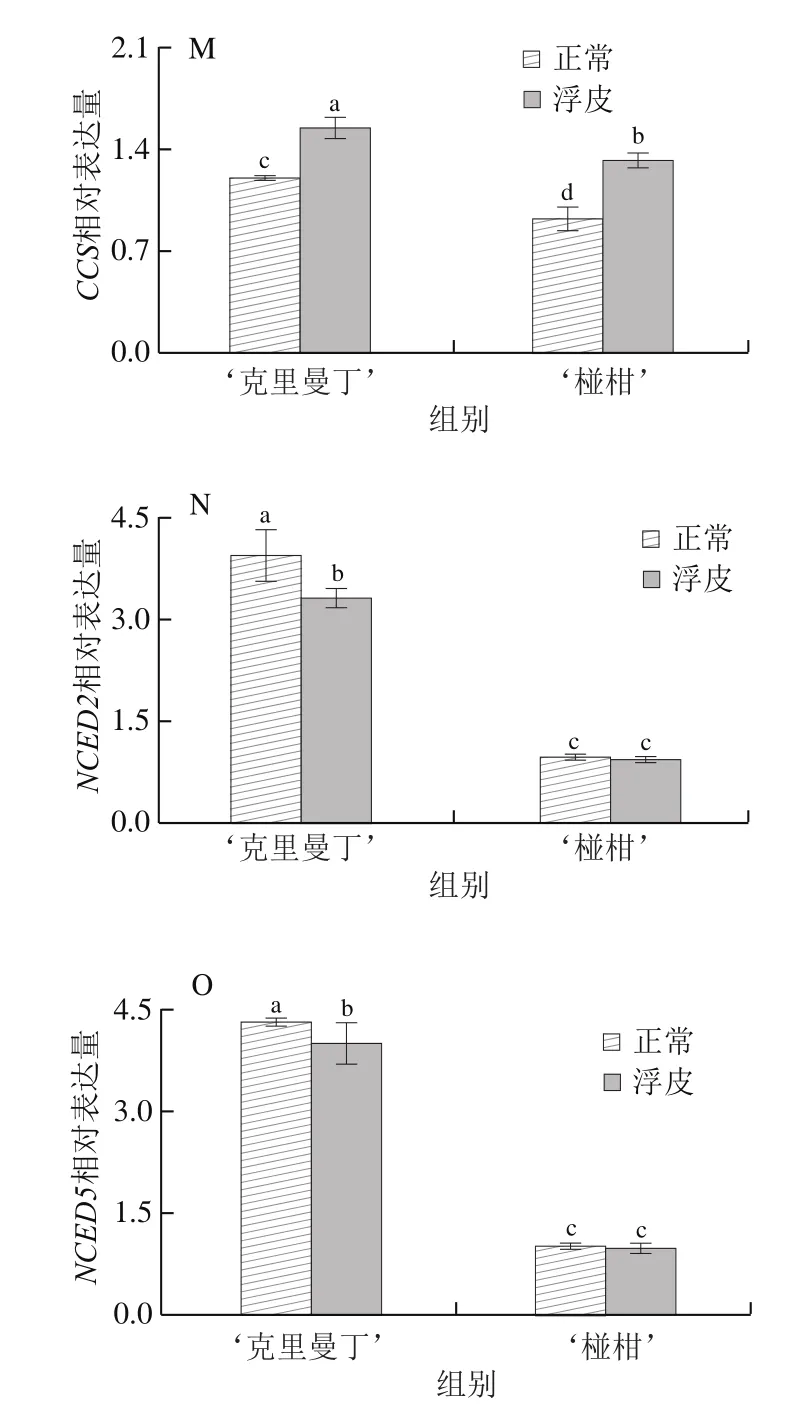
图4 ‘克里曼丁’和‘椪柑’浮皮时果皮ABA生物合成基因表达水平的变化Fig.4 Changes in expression patterns of genes involved in ABA biosynthesis in ‘Clementine’ and ‘Ponkan’ fruits after peel puffing
对于‘椪柑’,浮皮果实果皮PSY、LCYB1、BCH2、VDE、CCD4相对表达量显著降低,分别为正常果皮的84.4%、70.4%、70.1%、79.4%、52.7%;PDS、LCYE、LCYB2、ZEP、CCS相对表达量显著增加,分别为正常果皮的111.3%、108.2%、134.7%、145.4%、143.5%;GGPPS、ZDS、CRTISO、NCED2、NCED5相对表达量与正常果皮无显著差异。
Pearson相关性分析发现,两个柑橘品种浮皮时果皮ABA含量与LCYB1相对表达量呈显著正相关(P<0.05),与LCYE、LCYB2、ZEP、CCS相对表达量呈显著负相关(P<0.05)。
2.5 浮皮对柑橘果实果皮ABA分解相关基因表达水平的影响
如图5所示,‘克里曼丁’和‘椪柑’浮皮果实果皮AB1表达水平显著上调,分别为正常果皮的156.3%、128.3%;MYB68表达水平显著下调,分别为正常果皮的12.4%、44.9%;ABF3表达水平与正常果皮无显著差异。Pearson相关性分析发现,两个柑橘品种浮皮时果皮ABA含量与MYB68表达量呈显著正相关(P<0.05),与AB1表达量呈显著负相关(P<0.05)。
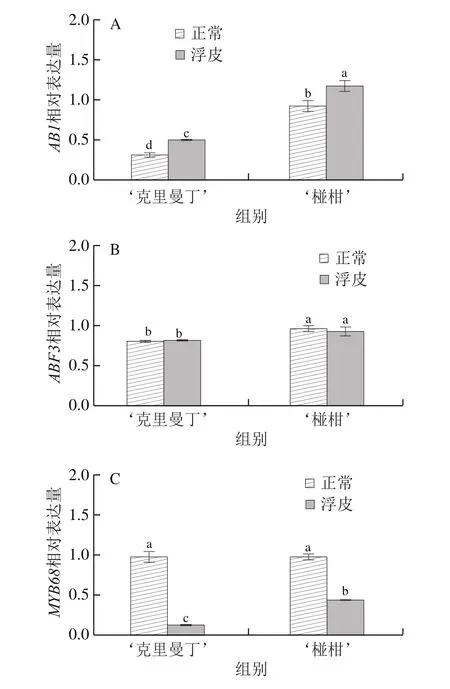
图5 ‘克里曼丁’和‘椪柑’浮皮时果皮ABA分解及相关转录因子表达水平的变化Fig.5 Changes in expression patterns of genes involved in ABA decomposition and related transcriptional factors in ‘Clementine’ and‘Ponkan’ fruits after peel puffing
3 讨 论
宽皮柑橘采后贮藏过程中浮皮现象严重,随着贮藏期延长,浮皮症状加重。本研究以‘克里曼丁’和‘椪柑’为试材,发现贮藏过程中浮皮指数显著增加,浮皮程度加剧,郑小华等[33]也发现类似结果。宽皮柑橘果皮和果肉之间有空隙且有发达的橘络(维管束),而紧皮柑橘白皮层和囊衣紧密贴合[32]。贮藏过程中‘克里曼丁’和‘椪柑’果皮水分质量分数显著上升,可能是贮藏过程中果皮响应外界逆境需消耗能量,果肉通过发达的维管束系统将大量水分运输至果皮,以此维持生理稳定[32]。
目前对于浮皮发生的机理存在分歧,除了推测浮皮的发生是因为果皮早衰外[34],也有推测是果肉与果皮衰老不一致及果皮相对二次生长所致[15],其他推测还包括果肉营养物质向果皮转移[32,35]。研究发现‘克里曼丁’和‘椪柑’浮皮时果皮ABA含量显著降低,表明浮皮的发生可能是由果皮衰老相对延迟所致。ABA生物合成主要通过类胡萝卜素代谢途径[16]。经Pearson相关性分析发现,两个柑橘品种浮皮时果皮ABA含量与β-胡萝卜素、辣椒红素、紫黄质、新黄质含量及LCYE、LCYB1、LCYB2、ZEP、CCS、MYB68、AB1表达量显著相关。浮皮时,β-胡萝卜素含量显著降低,抑制了ABA合成,其中LCYB1表达量显著降低,LCYB2表达量显著增加,说明浮皮时ABA合成主要受LCYB1调控。浮皮时LCYE表达量显著增加,可能促进了α-分支类胡萝卜素积累,相对抑制了β-胡萝卜素积累,从而引起ABA含量下降。前人研究发现沉默LCYE基因后,早实枳叶片中α-胡萝卜素含量下降,β-胡萝卜素含量增加[36]。浮皮时,CCS表达量增加而辣椒红素积累减少,可能与ZEP表达量上升致使辣椒红素环氧化生成辣椒玉红素有关[17]。浮皮时,ZEP表达量上升也促进了紫黄质合成。王宁[37]发现过量表达ZEP的番茄叶片玉米黄质、花药黄质含量降低,而紫黄质含量增加。紫黄质和新黄质经NCED酶催化生成ABA前体物质黄质醛,该过程是ABA生物合成的关键步骤[23]。浮皮时,紫黄质、新黄质含量显著增加,而ABA积累显著降低,原因可能是NCED活力低或AB1表达量显著上升加快了ABA分解。在拟南芥和大麦吸胀种子中发现AB1表达量上调伴随着ABA含量减少[38]。MYB68通过负调控BCH2和NCED5的表达,来负调节类胡萝卜素转化和ABA生物合成[25]。但本研究中两个柑橘品种浮皮时MYB68表达量与ABA含量均显著下调,与Zhu Feng等[25]的研究结果不一致,故基因MYB68的功能还需进一步研究。
ABA积累由其生物合成和分解代谢决定[38]。综合分析认为,两个柑橘品种浮皮时ABA生物合成途径中β-胡萝卜素含量下降及ABA分解加快共同导致ABA含量降低,其中LCYB1、LCYE、AB1发挥重要作用。本研究基于前期研究结果,探究宽皮柑橘浮皮发生过程中ABA积累变化机制及其代谢基因表达特征,而柑橘浮皮是个复杂的过程,还需从多品种、全基因组水平进行系统分析。
4 结 论
本研究发现‘克里曼丁’和‘椪柑’果实在贮藏过程中浮皮指数和果皮水分质量分数均显著增加,表明采后果实浮皮程度加剧,且存在水分转移至果皮的现象。进一步分析发现,与正常果皮相比,两个柑橘品种浮皮时果皮ABA含量显著降低,ABA积累下调与β-胡萝卜素合成降低及ABA分解加快有关,主要有LCYB1、LCYE、AB1协同作用。本研究揭示了柑橘果实浮皮的发生可能是由果皮衰老相对延迟所致,阐明了浮皮时ABA积累变化及其代谢基因表达特征。本研究结果有助于揭示浮皮发生的内在机制,为柑橘采后浮皮防控技术研发提供理论依据。

