红树莓叶茶的制备及与红树莓叶片、绿茶品质的比较
唐 莹,贾仕杰,蒋 莹,何红英,董 丹,王金玲,2,*,张 健
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.黑龙江省森林食品资源利用重点实验室,黑龙江 哈尔滨 150040;3.黑龙江彤生食品科技有限公司,黑龙江 哈尔滨 150030)
树莓(Rubus idaeusL.)属蔷薇科悬钩子属植物[1],又称覆盆子、托盘等,是欧洲最受欢迎的浆果之一[2]。红树莓叶作为果实采摘后的主要副产物,富含活性物质[3],但未得到充分利用[1]。植物丰富的多酚类化合物已成为研究热点[4],而红树莓叶中富含多酚化合物,包括黄酮类化合物[3,5],如鞣花酸[6-7],以及酚酸类化合物,如水杨酸[8]等,其提取物具有很强的抗氧化[9]、抗衰老、抗菌、抗血栓、降血糖等生物活性,并且可以提亮皮肤[10]。Pradeepa等[11]通过硝酸银溶液与树莓叶水提取物的反应制备银纳米材料,研究发现,树莓叶水提取物对金黄色葡萄球菌和大肠杆菌有很好的抑制能力,可作为一种有效的抗菌伤口愈合剂。Han Na等[12]研究了红树莓叶乙醇提取物的抗血栓作用,结果表明从红树莓叶中分离出的山柰酚、槲皮素和银锻苷3 种物质对血浆复钙时间有着明显的延长作用。树莓叶还被作为药草用于缓解与分娩有关的肌肉痉挛、感冒、伤口绞痛等症状[13],且无副作用[14]。
我国是世界上主要的茶叶生产国和全球茶叶贸易的重要参与国[15]。以红树莓叶为原料,结合我国传统的制茶工艺开发红树莓叶茶产品,可以变废为宝,提高树莓的经济价值[16]。韩卓等[17]研究表明,树莓叶发酵茶加工工艺简单,具有降血脂功效,可作为保健类茶饮,但该研究未进行其香气、活性成分等的进一步分析。
本实验以‘秋福’红树莓叶片为原料,按照我国传统的绿茶制作工艺流程,经摊晒、杀青、揉捻、干燥过程,以红树莓叶茶的可溶性糖、总酚和游离氨基酸含量为指标,确定红树莓叶茶的最佳制作工艺,并将红树莓叶片和市售绿茶的活性物质、抗氧化活性及抑菌活性进行比较,最后采用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)法比较3 种实验原料香气物质的区别,为红树莓叶茶进入市场提供理论参考。
1 材料与方法
1.1 材料与试剂
红树莓‘秋福’芽尖,2017年6月中旬采自哈尔滨市阿城区,用手采摘的方式挑选一芽两叶初展的新梢,采摘的红树莓叶片立即置于冰盒,带回实验室后进行处理或置于4 ℃冰箱冷藏;市售绿茶,2017年末购自山东省日照市,于4 ℃冰箱冷藏。
无水乙醇 天津市天力化学试剂有限公司;芦丁、儿茶素 上海源叶生物科技有限公司;香草醛 天津市致远化学试剂有限公司;浓硫酸、浓盐酸 公主岭市化学试剂厂;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzthiazoline-6-sulphonate),ABTS)等其他药品试剂均为国产分析纯。
1.2 仪器与设备
DL-6M型高速离心机 湖南星科科学仪器有限公司;RE-2000A型旋转蒸发仪、DHG-9030A型电热恒温鼓风干燥箱 巩义市予华仪器有限责任公司;722可见分光光度计 上海光谱仪器有限公司;RT502型分析天平 常熟市意欧仪器仪表有限公司;FW135型中草药粉碎机 天津市泰斯特仪器有限公司;GC 6890-MS 5973N型GC-MS仪 美国安捷伦仪器有限公司。
1.3 方法
1.3.1 红树莓叶茶制作最佳工艺的确定
1.3.1.1 制茶工艺
红树莓叶茶的加工工艺流程:叶片于室内自然摊晒(时间1 h)→炒锅杀青(时间45 min、温度100 ℃、摊放密度5 g/dm2)→揉捻(时间10 min)→热风干燥(温度50 ℃、时间12 h、摊放密度5 g/dm2)。在上述工艺参数下,保持其他因素不变,只改变其中一个因素,设置摊晒时间(1、1.5、2、2.5、3 h)、杀青方法(烫漂杀青、蒸汽杀青、炒锅杀青、烘烤杀青、微波杀青(800 W),处理条件相同)、揉捻时间(5、10、15、20、25 min)、干燥方式(自然干燥(25 ℃)、真空冷冻干燥(-20 ℃)、微波干燥(800 W)、热风干燥、紫外干燥(200 nm),以上摊放密度均为5 g/dm2,干燥时间12 h),以总酚、游离氨基酸和可溶性糖含量为指标,确定最佳制茶工艺。制备的叶茶置于4 ℃冰箱冷藏,待后续指标测定。最后将不同干燥方式制得的红树莓叶茶冲泡(冲泡条件:水温60 ℃、冲泡时间10 min、冲泡2 次)后,由专业评审员使用审评器具严格按照表1进行感官审评[18]。

表1 红树莓叶茶感官审评标准Table 1 Criteria for sensory evaluation of red raspberry leaf tea
1.3.1.2 红树莓叶茶总酚、游离氨基酸和可溶性糖水平测定
样品从冰箱取出后研磨成匀浆或者粉末,精确称取5.00 g加入50 mL含体积分数0.1%乙酸的甲醇溶液中超声提取1 h。将提取物置于4 ℃黑暗环境下放置24 h,离心并收集上清液(离心收集上清液步骤重复3 次,合并上清液)。在40 ℃条件下减压旋转浓缩合并得样品提取物,然后用体积分数60%甲醇溶液定容至100 mL,得到样品提取物溶液(样品提取物质量浓度为64 mg/mL),待指标检测分析[3]。
总酚含量测定采用福林-酚法[19],以没食子酸为标准品绘制的标准曲线为y=8.850 3x+0.011 1(R2=0.999 1)(x为没食子酸质量浓度/(mg/mL),y为765 nm波长处的吸光度),总酚含量折算成每克干质量样品含没食子酸的质量,单位为mg/g。游离氨基酸含量测定参考GB/T 8314—2013《茶 游离氨基酸总量的测定》;可溶性糖含量测定采用蒽酮比色法[20]。以上结果均以样品干质量计。
1.3.2 红树莓叶片、叶茶及市售绿茶活性物质含量的测定
采用1.3.1.2节中的方法制备3 种原料的提取物,然后进行活性物质的测定。总酚含量的测定同1.3.1.2节;黄酮含量的测定参考张海悦等[21]的方法,以芦丁为标准品绘制的标准曲线为y=1.022 9x+0.000 3(R2=0.999 2)(x为芦丁质量浓度/(mg/mL),y为510 nm波长处吸光度);原花青素含量的测定采用香草醛-硫酸法[22],以儿茶素为标准品绘制的标准曲线为y=1.695 7x-0.001 0(R2=0.999 4)(x为儿茶素质量浓度/(mg/mL),y为500 nm波长处的吸光度)。总酚、黄酮和原花青素的含量分别折算为每克干质量样品含没食子酸、芦丁和儿茶素的质量,单位为mg/g。
1.3.3 红树莓叶片、叶茶及市售绿茶抗氧化活性的测定
1.3.3.1 样品提取物的制备
同1.3.1.2节处理得到样品提取物。
1.3.3.2 铁离子还原能力测定
参考Benzie等[23]的方法测定铁离子还原能力(ferric reducing antioxidant power,FRAP),以VC作阳性对照。比较不同样品提取物中加入FRAP工作液后于734 nm波长处的吸光度,以A734nm表征样品的FRAP。
1.3.3.3 DPPH自由基清除率的测定
参考李树炎等[24]的方法并稍有改动。在100 μL样品提取物中加入4 mL 0.1 mmol/L的DPPH-乙醇溶液,避光反应30 min,以去离子水为参比,在517 nm波长处测定吸光度(A1);用等体积无水乙醇代替DPPH-乙醇溶液,测定吸光度(A2),用等体积无水乙醇代替样品提取物,测定吸光度(A3),以VC为阳性对照。按式(1)计算DPPH自由基清除率。

1.3.3.4 ABTS阳离子自由基清除率的测定
参考王振宇等[25]的方法并稍有改动。在100 μL样品提取物中加入ABTS溶液9 mL,避光反应6 min后,在734 nm波长处测定吸光度(Ai);用等体积无水乙醇代替ABTS溶液,测定吸光度(Aj),用等体积无水乙醇代替样品提取物,测定吸光度(A0),以VC为阳性对照。按式(2)计算ABTS阳离子自由基清除率。
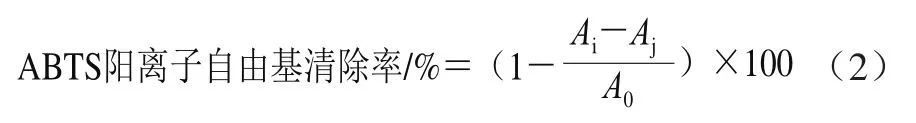
1.3.4 红树莓叶片、叶茶及市售绿茶的抑菌活性比较
1.3.4.1 培养基制备
选取大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、黑曲霉为受试菌种。培养基的配制参考迟超[26]的方法,并略有改动。细菌(大肠杆菌、金黄葡萄球菌)培养基制备:胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g,加蒸馏水搅拌溶解,用5 mol/L NaOH溶液调pH值至7.0,用蒸馏水定容至1 L;牛肉膏蛋白胨培养基(枯草芽孢杆菌):葡萄糖20 g、蛋白胨15 g、氯化钠5 g、牛肉膏0.5 g、用蒸馏水定容至1 L;霉菌培养基:PDA培养基(黑曲霉),土豆200 g、葡萄糖20 g,用蒸馏水定容至1 L;制备固体培养基时,添加琼脂至终质量浓度为20 g/L;121 ℃灭菌20 min。
1.3.4.2 菌悬液制备
将上述受试菌种接种于斜面,置于培养箱中培养(细菌37 ℃恒温培养24 h;霉菌30 ℃恒温培养48 h),将活化好的菌种分别挑取一环制成初始菌悬液,取适量初始菌悬液用生理盐水调整菌液浓度至107~108CFU/mL备用。
1.3.4.3 抑菌率测定
采用菌落计数法。按照1.3.4.1节方法配制固体培养基,灭菌后冷却至50~60 ℃后倒平板,每平板加入15 mL培养基,再加入1.0 mL经0.22 μm滤膜过滤提取物溶液并摇匀。待培养基凝固后吸取50 μL供试菌悬液于平板中,用涂布棒涂布均匀。将已接种完成的平板倒置于培养箱中培养,菌落个数记作A1;用等体积灭菌生理盐水代替提取液,将平板倒置于培养箱中培养,菌落个数记作A2。按式(3)计算抑菌率。
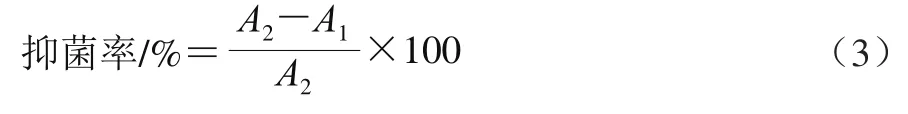
1.3.4.4 抑菌实验
参考樊佳等[27]方法。固体培养基高温灭菌后倒平板,待其凝固后,吸取50 μL供试菌悬液于平板中,涂布均匀。取直径为6 mm的无菌滤纸片3 片,顺时针轻贴在含菌平板上,吸取10 μL提取物滴于滤纸片中心,并浸润整个滤纸片。将已接种完成的平板置于培养箱中培养(细菌37 ℃恒温培养24 h;霉菌30 ℃恒温培养48 h)。观察有无抑菌圈并测量抑菌圈直径。
1.3.4.5 最低抑菌质量浓度测定
参考李小萍[28]的方法测定最低抑菌质量浓度(minimum inhibitory concentration,MIC)。将样品提取物溶液、菌悬液、液体培养基混合,设置样品提取物最终质量浓度分别为20、10、5、2.5、1.25、0.625 mg/mL,置于培养箱中静置培养,细菌37 ℃培养24 h,霉菌30 ℃培养48 h后,吸取培养液50 μL涂平板后,培养(细菌37 ℃恒温培养24 h;霉菌30 ℃恒温培养48 h)、观察菌落,提取物平板中无菌落形成时的最低质量浓度,即为样品提取物的MIC。
1.3.5 GC-MS法测定比较红树莓叶片、叶茶及市售绿茶的香气物质
萃取条件:取红树莓叶片、叶茶和市售绿茶碾碎,称取5.00 g碾碎样品置于40 mL样品瓶中,加入30 mL双蒸水,将样品瓶放入60 ℃的水浴中平衡10 min,将老化好(老化时间5 min)的萃取头插入样品瓶中,将萃取头暴露于样品瓶的顶空气体中,恒温60 ℃萃取45 min,拔出萃取头,插入GC-MS的进样器中,于230 ℃条件下解析1 min,同时启动仪器采集数据。
GC条件:进样口温度230 ℃、载气He、流速1.0 mL/min。采用分流进样,分流比10∶1。采用程序升温方式,由室温升至35 ℃保持10 min,然后以2 ℃/min升至200 ℃,再以10 ℃/min升至230 ℃,在此温度下保持5 min。
MS条件:离子源温度230 ℃,全扫描模式;电离方式为电子轰击电离(electron impact ionization,EI);电子能量70 eV;质量扫描范围30~300 amu;接口温度230 ℃;溶剂延迟时间3.5 min。
1.4 数据处理与分析
每个实验3 次重复,采用Excel软件对数据进行整理统计,结果表示为平均值±标准差。采用SPSS 20.0软件中Duncan法进行显著性分析。采用Origin 8.5软件作图。
2 结果与分析
2.1 红树莓叶茶制作最佳工艺的确定
茶鲜叶摊晒过程中既发生物理方面的失水,也发生内含物质的化学变化(如多酚类化合物轻微的氧化和分解),进而减轻茶的苦涩,有利于提高茶叶品质[29]。由图1A可见,随着摊晒时间的延长,红树莓叶茶可溶性糖和总酚的含量均呈下降趋势;游离氨基酸含量先降低,在摊晒2.5 h时升高但在3 h时又降低。当摊晒时间为1 h时,3 种物质的含量均最高。因此,摊晒时间1 h为最佳。
杀青和干燥工序是绿茶加工和品质形成的关键工序[30]。由图1B可知,5 种杀青方法中(均为优化的方法,数据未列出),经过烫漂杀青的红树莓叶茶3 种物质含量均显著低于其他杀青方法(P<0.05);红树莓叶茶的总酚和可溶性糖含量在采用蒸汽杀青时为最高,分别为(3.05±0.12)、(3.85±0.20)mg/g;红树莓叶茶游离氨基酸含量在采用微波杀青时最高,为(3.74±0.49)g/100 g,但与采用蒸汽杀青并无显著性差异(P>0.05)。经过蒸汽杀青的红树莓叶茶冲泡后颜色、鲜味较好,滋味以醇和鲜爽为主。因此,蒸汽杀青为最佳杀青方法。
由图1C可知,随揉捻时间(5~25 min)延长,红树莓叶茶游离氨基酸的含量显著增加,可溶性糖的含量先降低后增加,15 min以后无显著性差异。在揉捻25 min时,红树莓叶茶游离氨基酸和可溶性糖含量均为最高,分别为(3.47±0.03)g/100 g、(3.44±0.11)mg/g。红树莓叶茶总酚含量在揉捻5~25 min无显著性差异。因此,综合考虑选择25 min作为最适揉捻时间。
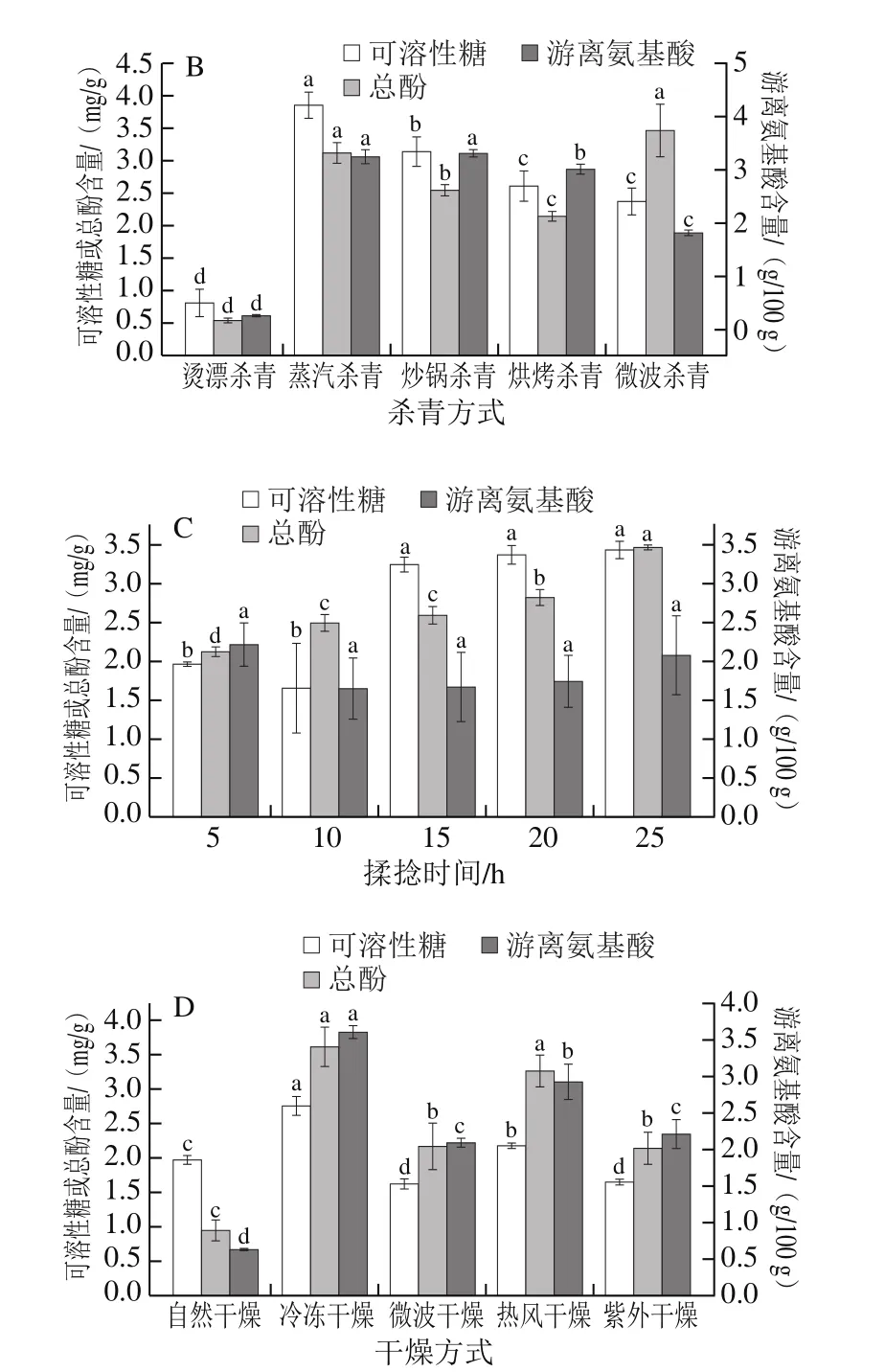
图1 不同工艺条件对红树莓叶茶可溶性糖、总酚及游离氨基酸含量的影响Fig.1 Effects of production conditions on contents of soluble sugar,total phenol, and free amino acids in red raspberry leaf tea
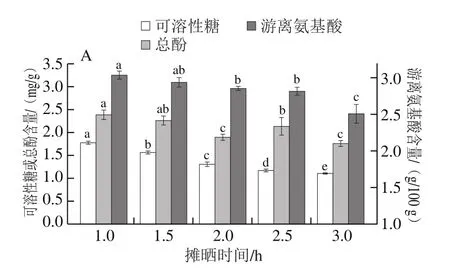
干燥工序不仅是水分散失和稳固外形的过程,更是内含成分发生微妙变化的过程,对茶叶的颜色、香气和滋味的形成尤为重要[31]。由图1D可知,经过真空冷冻干燥的红树莓叶茶总酚、可溶性糖和游离氨基酸含量均为最高,分别是(3.83±0.09)mg/g、(2.70±0.23)mg/g、(3.41±0.27)g/100 g;热风干燥组次之,总酚、可溶性糖和游离氨基酸含量分别为(3.11±0.26)mg/g、(2.18±0.03)mg/g、(3.08±0.21)%。徐建国等[32]研究发现,低于55 ℃热风干燥能很大程度地保留茶多酚,且茶叶外形紧结、香气持久,符合传统绿茶品质特征。本实验中,经热风干燥的红树莓叶茶游离氨基酸与可溶性糖含量较真空冷冻干燥低,可能是因为冷冻干燥过程中温度低,氧气含量少,不易发生氧化,更大程度保留了茶叶的营养成分[33]。相较于冷冻干燥,热风干燥能耗低、效率高。
为了进一步确定最佳干燥方式,对不同干燥方式制得的红树莓叶茶冲泡后进行感官审评,结果见图2、表2。5 种干燥方式制得的红树莓叶茶在外形、汤色、香气和滋味方面呈现一定差异。由表2可知,经真空冷冻干燥制得的红树莓叶茶的各项感官指标评分均显著高于其他干燥方式的叶茶,而自然干燥条件下的叶茶总分最低,说明自然干燥不利于叶茶品质的提升。红树莓叶茶在外形、滋味和香气方面,热风干燥与真空冷冻干燥无显著差异。考虑到能耗,选择热风干燥为最佳干燥方式,采用此方式制得的红树莓叶茶,外形紧缩、匀整,颜色翠绿。经冲泡后,汤色清澈明亮,滋味鲜醇,具有明显栗香味。
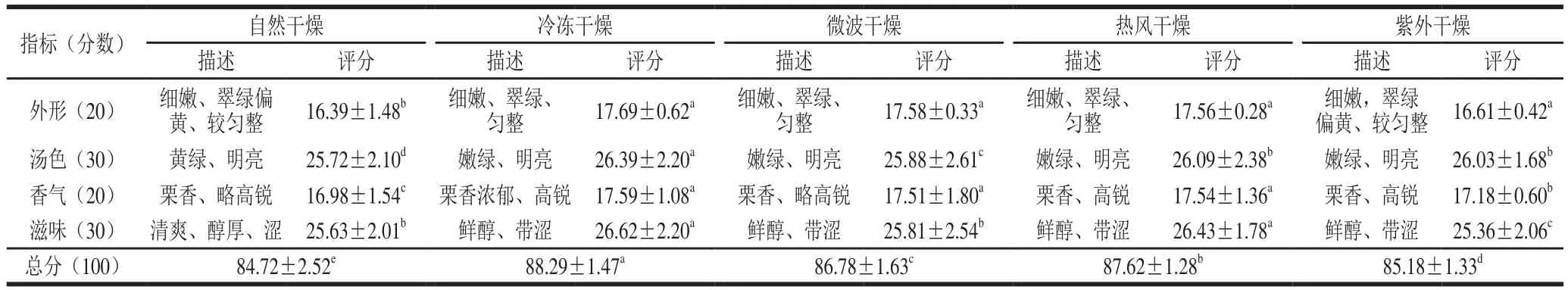
表2 不同干燥方式下红树莓叶茶的感官审评结果Table 2 Results of sensory evaluation of red raspberry leaf tea prepared by different drying methods

图2 不同干燥方式下制备的红树莓叶茶对比图Fig.2 Appearance of red raspberry leaf tea prepared by different drying methods and infusions from them
2.2 红树莓叶片、叶茶及市售绿茶活性物质的比较
由图3可知,市售绿茶中的总酚与黄酮含量分别为(7.91±0.58)、(4.18±0.13)mg/g,均显著高于红树莓叶片和叶茶,但原花青素含量显著低于其他两种原料。3 种原料的总酚含量由高到低的顺序为市售绿茶>红树莓叶茶>红树莓叶片;黄酮含量由高到低的顺序为市售绿茶>红树莓叶片>红树莓叶茶;原花青素含量由高到低的顺序为红树莓叶片>红树莓叶茶>市售绿茶。本实验制得的红树莓叶茶的总酚和黄酮含量均与市售绿茶呈现显著差异,与赵慧芳等[1]研究中对总酚含量比较的结果相似。红树莓叶茶中的黄酮和原花青素含量均显著低于叶片,可能是叶茶在制作过程中水分丧失,酶促反应活跃,使许多大分子水解,氧化还原反应加剧,黄酮等活性物质在氧化酶的作用下发生氧化作用,以及与其他物质形成络合物,导致含量减少[34],但红树莓叶茶的总酚含量显著高于叶片,而总酚含量与茶汤滋味浓度和汤色有关[35],因此也提升了红树莓叶茶的感官品质。
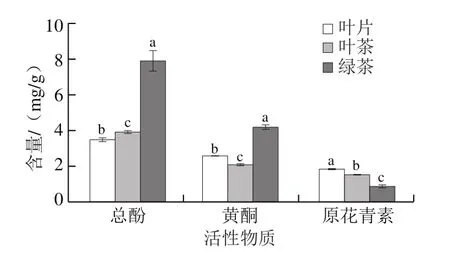
图3 红树莓叶片、叶茶和市售绿茶中总酚、黄酮和原花青素的含量Fig.3 Contents of total phenol, flavonoids and proanthocyanidins in red raspberry leaves, red raspberry leaf tea and commercial green tea
2.3 红树莓叶片、叶茶及市售绿茶抗氧化活性的比较结果
2.3.1 ABTS阳离子自由基和DPPH自由基清除率比较结果
由图4可知,随着样品提取物质量浓度的增加,3 种原料的提取物ABTS阳离子自由基和DPPH自由基的清除能力呈上升趋势。由表3可知,红树莓叶片、叶茶及市售绿茶提取物清除ABTS阳离子自由基的IC50均显著小于VC,即红树莓叶片、叶茶及市售绿茶提取物的ABTS阳离子自由基清除能力均大于VC;市售绿茶提取物清除DPPH自由基的IC50小于VC且呈现显著差异,而红树莓叶片提取物清除DPPH自由基的IC50与VC无显著性差异,红树莓叶茶提取物清除DPPH自由基的IC50大于VC。3 种提取物对ABTS阳离子自由基的清除能力由高到低依次为市售绿茶>红树莓叶茶>红树莓叶片;3 种提取物对DPPH自由基的清除能力由高到低依次为市售绿茶>红树莓叶片>红树莓叶茶。

图4 红树莓叶片、叶茶和市售绿茶的ABTS阳离子自由基(A)和DPPH自由基(B)清除率Fig.4 ABTS cation (A) and DPPH (B) radical scavenging capacity of red raspberry leaves, red raspberry leaf tea and commercial green tea
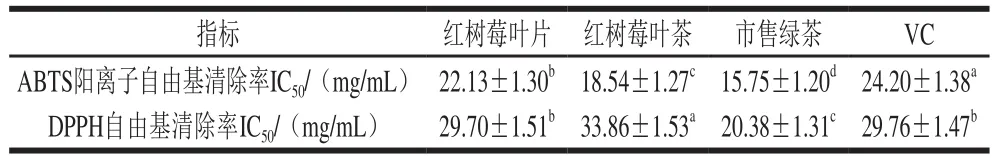
表3 红树莓叶片、叶茶和市售绿茶清除ABTS阳离子和DPPH自由基的IC50Table 3 IC50 for ABTS and DPPH radical scavenging capacity of red raspberry leaves, red raspberry leaf tea and commercial green tea
2.3.2 FRAP比较结果
由图5可知,3 种原料提取物的FRAP与样品提取物质量浓度均呈良好的剂量依赖效应,其中市售绿茶提取物的FRAP最高,且高于VC;其次是红树莓叶片,当其提取物质量浓度大于30 mg/mL时,FRAP高于VC;红树莓叶茶提取物质量浓度大于50 mg/mL时,FRAP高于VC。FRAP越大,抗氧化能力越强[36]。3 种原料提取物的FRAP由高到低的排序依次为绿茶>红树莓叶片>红树莓叶茶,这可能是它们存在的活性物质种类有所差异引起的,且在制茶过程中,活性物质会进行转化。杨瑞[37]在研究蒙顶黄茶加工工艺中发现,制作过程中的湿热作用使所含的活性成分如多酚含量、儿茶素含量大量减少,酯型儿茶素发生自动氧化和异构化。
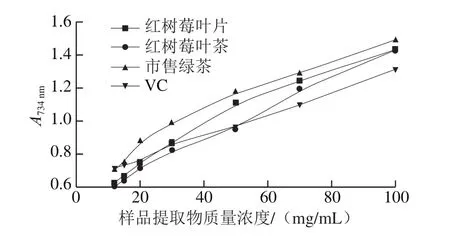
图5 红树莓叶片、叶茶和市售绿茶的FRAPFig.5 FRAP of red raspberry leaves, red raspberry leaf tea and commercial green tea
2.4 红树莓叶片、叶茶及市售绿茶抑菌活性的比较结果
由表4可知,3 种原料提取物对黑曲霉均无抑制效果,但对3 种细菌表现出良好的抑制效果。红树莓叶片、叶茶和市售绿茶提取物均对大肠杆菌(革兰氏阴性菌)表现出最好的抑菌效果,其次是枯草芽孢杆菌、金黄色葡萄球菌(革兰氏阳性菌);其中红树莓叶片提取物对3 种细菌的抑制率均最高,其次是红树莓叶茶提取物,最后是市售绿茶提取物。绿茶有较强的抑菌抗敏作用[27],本实验制得的红树莓叶茶提取物抑菌效果好于市售绿茶,因此其保质期可能相较于市售绿茶更长。

表4 红树莓叶片、叶茶及市售绿茶抑菌能力比较Table 4 Comparison of antibacterial activities of red raspberry leaves,red raspberry leaf tea and commercial green tea
2.5 红树莓叶片、叶茶及市售绿茶香气物质的比较结果
采用GC-MS法鉴定红树莓叶片、叶茶及市售绿茶中的香气物质,3 种实验原料的总离子流图见图6,其香气物质详见表5。
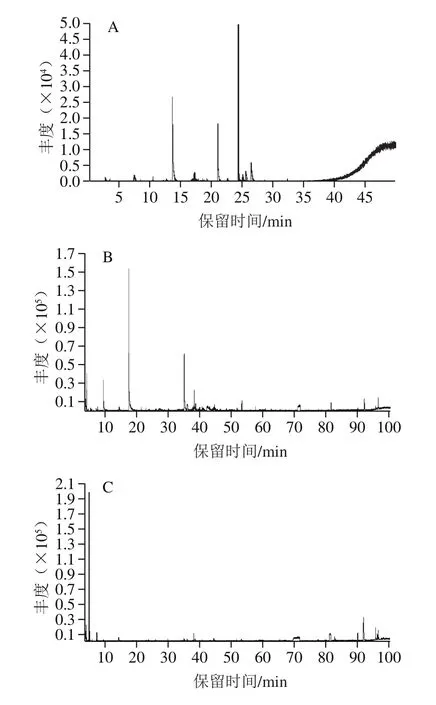
图6 红树莓叶片(A)、叶茶(B)及市售绿茶(C)的香气物质GC-MS总离子流色谱图Fig.6 Total ion current chromatograms of aroma substances of red raspberry leaves (A), red raspberry leaf tea (B) and commercial green tea (C)
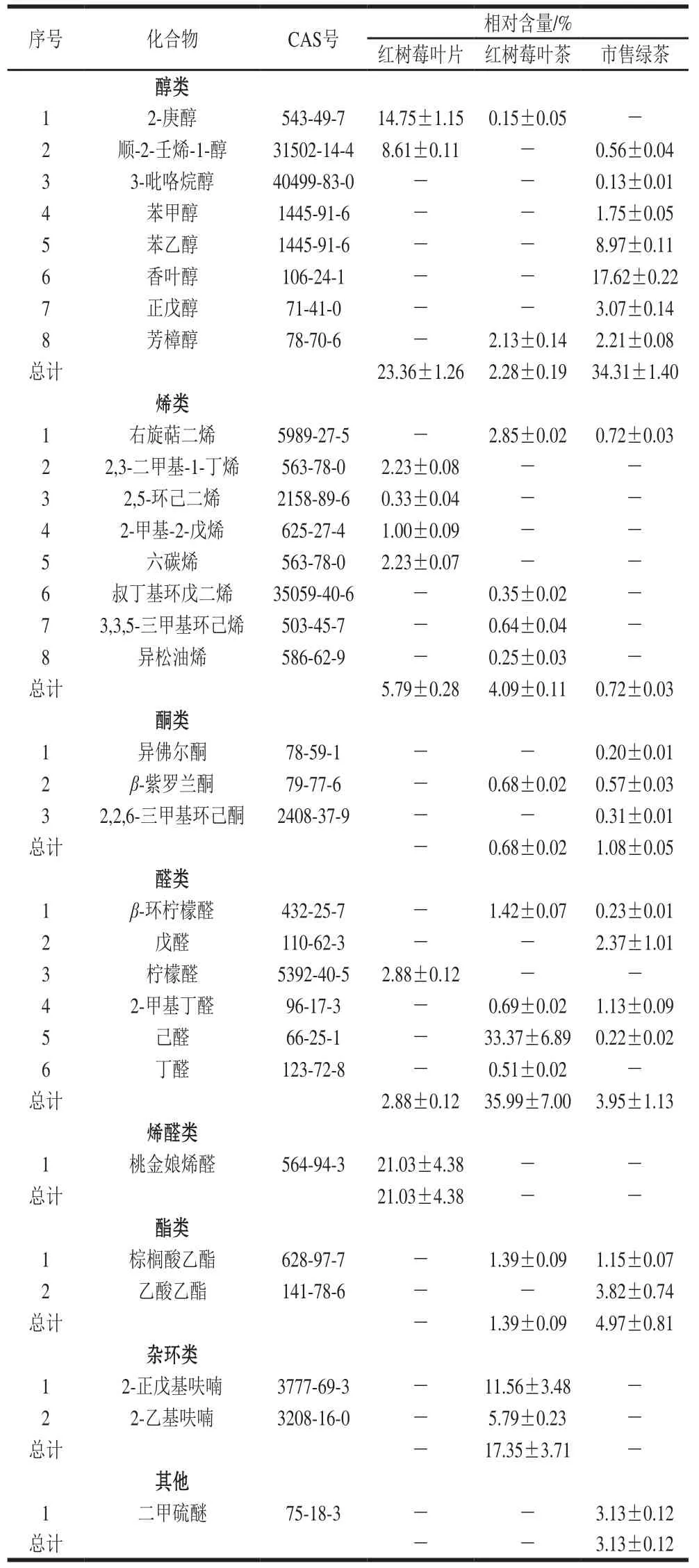
表5 红树莓叶片、叶茶及市售绿茶香气物质的GC-MS分析结果Table 5 GC-MS analysis of aroma substances of red raspberry leaves,red raspberry leaf tea and commercial green tea
由表5可知,通过GC-MS法从红树莓叶片、叶茶及市售绿茶中分别检出了8、14 种和18 种香气物质(以匹配度大于80%的香气物质定性)。从香气物质含量来看,红树莓叶片中检出的香气物质中以醇类占比最高,占香气物质总量的(23.36%),包括2-庚醇和顺-2-壬烯-1-醇;其次是烯醛类,即桃金娘烯醛,占香气物质总量的(21.03%);检测出了4 种烯类物质,占香气物质总量的5.79%,分别是2,3-二甲基-1-丁烯、2,5-环己二烯、2-甲基-2-戊烯和六碳烯;检测出了一种醛类物质——柠檬醛,占香气物质总量的2.88%。在红树莓叶片中,未检测到酯类、酮类和杂环类化合物。
本实验制得的红树莓叶茶中检出的香气物质以醛类占比最高(35.99%),其包括β-环柠檬醛、2-甲基丁醛、己醛和丁醛,都是重要的挥发性物质;检测出的两种杂环类化合物占香气物质总量的17.35%,分别是2-正戊基呋喃和2-乙基呋喃,具有坚果香气;检测出的4 种烯类化合物占香气物质总量的4.09%,分别是右旋萜二烯、叔丁基环戊二烯、3,3,5-三甲基环己烯和异松油烯;检测出的酯类是棕榈酸乙酯,占总香气物质总量的1.39%;检测出一种酮类化合物——β-紫罗兰酮,占比为0.68%,具有板栗香,对叶茶香气有一定贡献作用;红树莓叶茶中还检测到芳樟醇和2-庚醇两种醇类物质,占香气物质总量的2.28%。闫玉浛[38]在研究树莓叶茶加工过程中香气物质变化时发现,树莓叶茶经摊晒、杀青、揉捻和干燥后,含有包括芳樟醇、2-庚醇等7 种醇类化合物,与本研究结果有所不同,可能是树莓叶品种、香气物质提取条件及分析方法存在差异造成的。通过对比红树莓叶片和叶茶的香气物质发现,除2-庚醇外,二者无共有香气物质,红树莓叶片以2-庚醇和桃金娘烯醛为主要香气物质,而红树莓叶茶中2-庚醇相对含量少,且以己醛与2-正戊基呋喃为主要香气物质,说明新鲜叶片在制茶过程中香气物质发生了转变或者生成了新的香气物质。本实验制得的红树莓叶茶中所含的己醛、棕榈酸乙酯、右旋萜二烯在‘金观音’叶茶中[39]也含有。Owuor等[40]研究表明,萜烯含量影响绿茶的香气,萜烯含量高,则绿茶香气馥郁宜人;萜烯含量低,则绿茶香气高锐。本实验制得的红树莓叶茶与平阳黄汤茶相比,具有相同的芳香类物质β-紫罗兰酮和β-环柠檬醛[41]。β-芳樟醇与β-紫罗兰酮是大部分茶叶中都含有的香气物质,但是本实验中从红树莓叶茶和市售绿茶中仅鉴定出少量的β-紫罗兰酮。叔丁基环戊二烯、3,3,5-三甲基环己烯、异松油烯、丁醛以及杂环类2-正戊基呋喃和2-乙基呋喃只存在于红树莓叶茶中,在红树莓叶片和绿茶中都未能检出。红树莓叶茶所含有的香气物质2-甲基丁醛、丁醛、2-乙基呋喃是GB/T 2760—2014《食品安全国家标准 食品添加剂使用标准》允许使用的食品添加香料,这些和其他未与绿茶吻合的香气物质可能是红树莓叶茶特有的,该结果可为树莓叶茶香气评价提供参考。
市售绿茶中的香气物质中以醇类占比最高,占香气物质总量的(34.31%),包括顺-2-壬烯-1-醇、3-吡咯烷醇、苯甲醇、苯乙醇、香叶醇、正戊醇和芳樟醇,其中,香叶醇的相对含量最高,其具有温和、甜的玫瑰花气息,芳樟醇具有木香、果香和花香气息;其次是酯类物质,占香气物质总量的4.97%,包括乙酸乙酯和棕榈酸乙酯;还检测出具有脂肪香和薄荷味的含硫化合物——二甲硫醚,占香气物质总量的3.13%;检测出的4 种醛类化合物占香气物质总量的3.95%,分别是β-环柠檬醛、戊醛、2-甲基丁醛、己醛;检测出的烯类物质为右旋萜二烯,占香气总量的0.72%;检测出的3 种酮类化合物占比为1.08%,分别是异佛尔酮、β-紫罗兰酮和2,2,6-三甲基环己酮。刘淑娟等[42]采用顶空固相微萃法对6 种嫩栗香型绿茶进行香气物质提取,共检测出了42 种香气物质,醇类(11 种)是主要香气物质,其中香叶醇占比最高,与本实验绿茶香气物质中香叶醇相对含量高结果类似。
通过对比上述3 种原料的香气物质发现,红树莓叶片和市售绿茶中醇类化合物相对含量最高,而红树莓叶茶中醛类物质占比高,其次是杂环类化合物。从检测出的单个香气物质来看,红树莓叶片中2-庚醇和桃金娘烯醛相对含量较高,实验制得的红树莓叶茶中以己醛、2-正戊基呋喃为主要香气物质,市售绿茶中香气物质种类丰富,以香叶醇为主。闫玉浛[38]在树莓鲜叶摊晒、杀青以及干燥过程中都检测出超过30 种香气物质;田甜等[43]通过动态顶空-GC-MS法鉴定出凌云白毫绿茶中共37 种化合物;刘淑娟等[42]采用顶空-GC-MS法鉴定出栗香型绿茶中共42 种香气物质,未鉴定出2-庚醇、顺-2-壬烯-1-醇、异佛尔酮、戊醛、丁醛等香气物质,可能与样品前处理方法和鉴定方法不同有关,在今后的研究中,树莓叶茶香气物质的鉴定方法以及其他香气物质还有待进一步探究。
3 结 论
用本研究最佳红树莓叶茶加工工艺制得的红树莓叶茶外形紧缩、匀整,颜色翠绿;经冲泡后,汤色清澈明亮,滋味鲜醇,具有明显栗香味;且显示出较好的抗氧化和抑菌能力。通过GC-MS法从红树莓叶片、叶茶及市售绿茶分别检出了8、14 种和18 种香气物质。红树莓叶片以醇类化合物占比最高;红树莓叶茶中以醛类占比最高,己醛与2-正戊基呋喃为主要香气物质,还有绿茶的香气标志物β-紫罗兰酮、乙酸乙酯等香气物质。本研究结果可为树莓叶片的进一步开发以及红树莓叶茶香气品质的科学评价等提供理论支撑。

