麦胚清蛋白抗氧化肽的筛选及对细胞氧化损伤的保护作用
张 羽,汪 芳,翁泽斌,包伊凡,宋海昭,*,沈新春,*
(1.南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023;2.南京中医药大学中医学院·中医学院中西医结合学院,江苏 南京 210000)
活性氧自由基(reactive oxygen species,ROS)是机体代谢产生的一类氧化自由基,自由基过量或不足都会影响机体内环境的稳定。生物体内抗氧化防御系统主要由内源性抗氧化剂(谷胱甘肽(glutathione,GSH)等)和抗氧化酶(超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和过氧化物酶等)组成,能够维持机体正常的ROS代谢平衡,使ROS的产生和清除处于动态平衡,保护机体不受氧自由基的侵害[1]。当机体处于糖尿病和肥胖症等代谢紊乱状况下,无法清除自身的多余自由基,致使自由基过量累积,从而导致氧化应激。
大量研究表明,很多植物来源的天然化合物如多酚、多糖、肽等具有良好的抗氧化活性[2-4],其中肽的抗氧化活性日益受到关注。抗氧化肽是一种具有抗氧化活性,能够清除自由基,缓解氧化应激的生物活性肽。食源性抗氧化肽具有低毒高效的特点,可以广泛应用于食品及保健品行业,具有广阔的应用前景。动植物(如鱼、牛奶、亚麻籽、苦荞和小麦)来源的抗氧化肽已用于食品、药品抗氧化剂的开发[5-9]。
小麦胚芽是小麦粉加工的副产物,含有质量分数约30%的麦胚蛋白,其中,麦胚清蛋白(wheat germ protease,WGA)的酶解产物由于具有较强的抗氧化性,其在功能食品开发领域研究较多。殷微微等[10]分析了麦胚蛋白酶解物清除自由基及抗脂质过氧化物的作用,发现了其在亚油酸体系中具有较强的抗氧化效果,是有效的天然抗氧化剂。张丽萍等[11]采用中性蛋白酶水解麦胚蛋白,发现水解物的抗氧化活性和蛋白本身的结构、肽链长短及氨基酸残基有关。杨铭泽等[12]通过采用4 种不同蛋白酶对麦胚蛋白分别进行单酶水解、双酶同步水解和分步水解,比较研究麦胚蛋白的酶解方法与水解物抗氧化功能的关系,发现碱性蛋白酶与木瓜蛋白酶分步水解为最佳工艺。本课题组在之前的研究中通过响应面法优化WGA制备抗氧化肽条件,发现中性蛋白酶(底物质量分数为2.4%、加酶量5 900 U/g、酶解pH 7.04、酶解温度55 ℃、酶解时间4 h)为最佳用酶[13]。基于此,本研究以WGA中性蛋白酶酶解产物[13]为研究对象,通过超滤、凝交过滤层析、离子交换层析等技术对WGA酶解物(wheat germ protease hydrolysate,WGAH)进行逐级分离,根据各级分离产物的抗氧化活性筛选具有较高抗氧化活性的目标肽段,鉴定其氨基酸序列,并结合PeptideRanker数据库活性预测结果筛选出抗氧化活性最高的肽序列,进一步采用高糖诱导血管平滑肌细胞(vascular smooth muscle cells,VSMCs)及H2O2诱导的HepG2和VSMCs建立细胞氧化损伤模型,检测其生物活性,旨在为麦胚抗氧化肽产品的开发提供理论参考。
1 材料与方法
1.1 材料与试剂
Sephadex G-75、Sephadex G-25、Sephadex C-25中国GE医疗集团;2,2-联氮-双(3-乙基-苯并噻唑-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、荧光素(fluorescein,FL)、偶氮二异丁脒盐酸盐(2,2’-azobis[2-methylpropionamidine]dihydrochloride,AAPH)美国Sigma公司;HepG2细胞 南京中医药大学;VSMCs 北京市疾控中心;胎牛血清(fetal bovine serum,FBS)、DMEM(dulbecco’s modified Eagle’s medium)培养基(低糖/高糖)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)-胰蛋白酶(0.05%) 美国Gbico公司;小麦胚芽肽合成 金斯瑞生物工程有限公司;2’,7’-二氯二氢荧光素二乙酸酯(2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA)荧光探针、噻唑蓝(3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-diphenytetrazoliumromide,MTT) 美国Sigma公司。其他试剂均为分析纯。
1.2 仪器与设备
Labscale小型切向流超滤系统 美国密理博公司;H1850R高速冷冻离心机 湖南湘仪仪器有限公司;2XZ旋片真空泵 浙江黄岩天龙真空泵厂;蛋白质纯化系统上海沪析分析仪器厂有限公司;MZE多功能酶标仪美国Molecular Devices公司;EksigentnanoLC-UltraTM2D纳升液相色谱系统、TripleTOF 5600质谱系统 美国AB SCIEX公司;FACSVerse流式细胞仪 美国BD公司;荧光倒置显微镜 德国卡尔-蔡司公司。
1.3 方法
1.3.1 麦胚清蛋白酶解物制备和超滤膜分离
WGAH参考文献[13]制备。用pH 7.4、0.1 mol/L磷酸盐缓冲液配制质量分数为0.1%的WGAH,然后用0.45 μm纤维素膜过滤。选用截留分子质量分别为30 kDa和10 kDa的超滤膜,通过Labscale小型切向流超滤系统对酶解产物进行超滤分离,分离温度为4 ℃,压力小于0.1 MPa。将超滤得到的各级组分分别进行脱盐后冷冻干燥。得到3 个组分:WGAH-I(>30 kDa)、WGAH-II(10~30 kDa)和WGAH-III(<10 kDa)。
1.3.2 葡聚糖凝交柱层析
用Sephadex G-75凝交柱(2.6 cm×70 cm)进行层析,将1.3.1节组分配制为质量分数2%的样品溶液(去离子水溶解),上样量为柱体积的5%,流速0.5 mL/min,温度4 ℃,检测220 nm波长处信号强度。去离子水洗脱,调节恒流泵。洗脱液收集速率为8 min/管。收集合并分离色谱图中处于同一洗脱峰下的洗脱液并冷冻干燥,待测其抗氧化活性。
用Sephadex C-25阳离子交换柱(1.6 cm×60 cm)进行层析,加入含有0~2 mol/L NaCl的pH 4.0、0.02 mol/L醋酸盐缓冲液,以2 mL/min的流速进行洗脱,220 nm波长处检测信号强度,洗脱液收集速率为2 min/管,收集合并分离色谱图中处于同一洗脱峰下的洗脱液并冷冻干燥,待测其抗氧化活性。
用Sephadex G-25凝交柱(1.6 cm×60 cm)进行层析,用去离子水以0.5 mL/min的流速进行洗脱,220 nm波长处检测信号强度,洗脱液收集速率为8 min/管,收集合并分离色谱图中处于同一洗脱峰下的洗脱液并冷冻干燥,待测其抗氧化活性。
1.3.3 氧化自由基吸收能力测定
取20 μL质量浓度为50 μg/mL的1.3.2节逐级层析样品或合成多肽溶液于96 孔荧光板中,加入80 μL 175 nmol/L的荧光素钠溶液,37 ℃混匀,孵育15 min后加入100 μL 24 nmol/L AAPH反应,在激发与发射波长分别为485 nm和538 nm波长处连续测定荧光强度(1 次/2 min)。利用标准品绘制标准曲线,根据样品测得的荧光强度计算氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)[14],结果以Trolox的当量表示(μmol TE/g或μmol TE/μmol)。
1.3.4 ABTS阳离子自由基清除率测定
ABTS阳离子自由基清除率的测定参照Floch等[15]的方法。配制ABTS工作液,取96 孔板,每孔加入10 µL样品溶液,190 µL的ABTS工作液,25 ℃避光反应20 min,测定734 nm波长处吸光度。按下式计算ABTS阳离子自由基清除率。

式中:A0表示对照组(样品溶解液和ABTS)的吸光度;A表示实验组的吸光度。
1.3.5 液相色谱-串联质谱结构鉴定
采用液相色谱-串联质谱(liquid chromatographytandem mass spectrometry,LC-MS/MS)对多肽样品进行结构鉴定。结构鉴定由上海博苑生物科技有限公司完成。将冻干的多肽样品重新溶解于Nano-RPLC Buffer A中,分析柱采用ChromXP Eksigent C18反相色谱柱(75 μm×15 cm,3 μm),流速0.4 mL/min,柱温25 ℃,流动相A:2%(体积分数,后同)乙腈、0.1%甲酸;流动相B:98%乙腈、0.1%甲酸。梯度洗脱条件:流动相B由5%升高至35%(0~30 min)。采用TripleTOF 5600质谱系统结合纳升喷雾III离子源,喷雾电压为2.5 kV,雾化气压为5 psi,气帘气压为30 psi,加热器温度为150 ℃,对Sephadex G-25凝交柱分离得到的抗氧化能力最佳的组分进行结构鉴定。数据采用Mascot 2.3软件处理分析。
1.3.6 化学多肽合成
化学多肽委托金斯瑞生物科技公司用化学法固相合成(合成多肽纯度>95%)。
1.3.7 细胞培养
VSMCs培养:将细胞置于含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的低糖DMEM培养液中,于5% CO2、37 ℃恒温培养箱中培养,待细胞长至对数期用于实验。
HepG2细胞培养:将细胞置于含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的高糖DMEM培养液中,于5% CO2、37 ℃恒温培养箱中培养,待细胞长至对数期用于实验。
1.3.8 细胞氧化应激模型建立
高糖诱导的氧化应激模型:将VSMCs以1×105个/mL的浓度接种于96 孔板,于温度37 ℃、CO2体积分数5%的培养箱中培养48 h后吸除培养液,加入不含血清的低糖DMEM培养液。16 h后,随机分为3 组:正常组,不作任何处理;高糖组,加入适量质量分数45%的葡萄糖溶液,使其最终葡萄糖浓度为25 mmol/L;实验组,加入最终浓度为25 mmol/L的葡萄糖和不同浓度(5、10、20、40 μmol/L)的抗氧化肽,培养 8 h后,使用MTT法[9]测定细胞存活率。
H2O2诱导的氧化应激模型:将HepG2细胞与VSMCs以1×105个/mL的浓度接种于96 孔板中,培养48 h后,每孔加入作用浓度为25、50、100、150、200 μmol/L的H2O2溶液,继续培养12 h,除去培养液,使用MTT法测定细胞存活率,选取细胞存活率接近50%的H2O2浓度作为最适浓度,建立H2O2诱导的细胞氧化应激模型,在此基础上加入不同浓度(5、10、20、40 μmol/L)的抗氧化肽,培养12 h后使用MTT法测细胞存活率。
1.3.9 活性氧水平的测定
将两种细胞以1×105个/mL的浓度接种于6 孔板中,培养48 h后,按上述造模加样的方法处理细胞后,吸除培养液,用pH 7.2、0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)洗3 次,加入0.8 mL浓度为10 μmol/L的DCFH-DA溶液反应30 min,消化清洗细胞,制成细胞悬液,流式细胞仪检测荧光强度,每次上样1×104个细胞,用各处理组细胞与正常组细胞(未经高糖或H2O2诱导)荧光强度的比值表示活性氧水平。
1.4 数据统计与分析
所有实验至少重复3 次,实验数据以平均值±标准差表示,采用SPSS 17.0软件进行t检验,P<0.05表示差异显著。
2 结果与分析
2.1 超滤法分离麦胚清蛋白酶解物
30 kDa和10 kDa两种超滤膜将WGAH截留分成3 个组分:WGAH-I(分子质量>30 kDa)、WGAH-II(分子质量为10~30 kDa)和WGAH-III(分子质量<10 kDa)。ORAC法可以检测物质抑制过氧化自由基诱发氧化反应的水平,能够直接反映待测物质阴断自由基链式反应的能力[16];ABTS阳离子自由基的清除能力也常用作抗氧化活性评价指标。本研究应用ORAC法与ABTS法测定这3 个WGAH组分的体外抗氧化性。如表1所示,WGAH及其组分的分子质量和抗氧化活性具有显著的负相关性。WGAH超滤得到的3 个组分的抗氧化活性随着分子质量的减小而升高,其中WGAH-III组分抗氧化活性最高,其ORAC为1 258.98 μmol TE/g,ABTS阳离子自由基清除率为62.27%,分别为WGAH的1.14 倍和1.15 倍,是酶解前WGA的1.41 倍和2.68 倍(P<0.05)。结果表明,WGAH分子质量越小,其抗氧化活性越高。有研究认为生物活性肽活性与分子质量的大小有关,例如Zhang Jixian[17]、Hu Fei[18]等在分别提取小麦胚芽肽和山核桃蛋白肽时均发现低分子质量肽具有较高的抗氧化活性。本实验的结果与上述研究结果一致,并选择WGAH-III(<10 kDa)组分进行下一步层析分离。
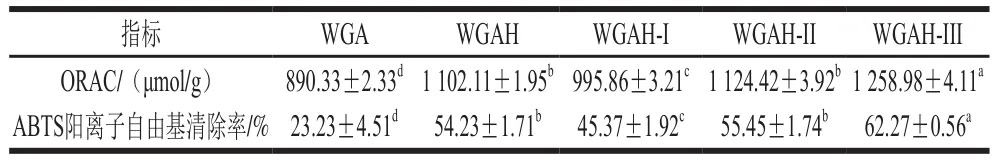
表1 不同组分的ORAC与ABTS阳离子清除率Table 1 ORAC values and ABTS cation radical-scavenging activity of different separation fractions
2.2 WGAH-III组分的层析分离
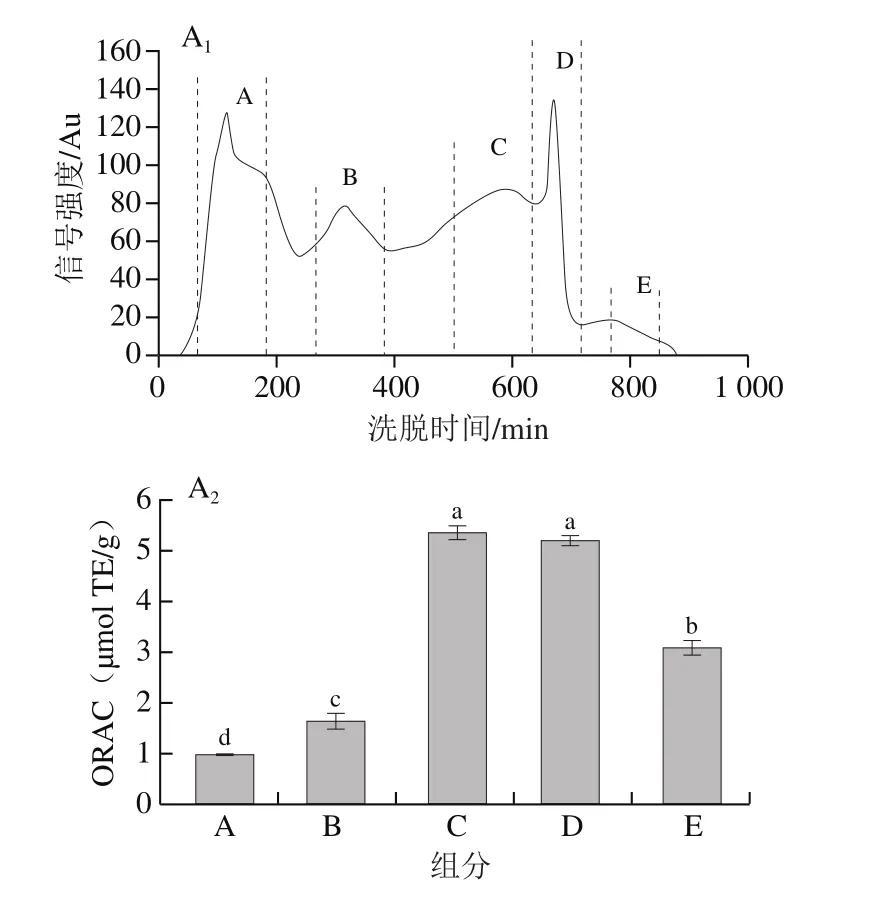
葡聚糖凝交柱根据分子质量大小分离目标化合物,已被广泛应用于分离蛋白质水解物中的肽段[19-20]。本研究采用交联葡聚糖Sephadex G-75凝交柱分离WGAH-III组分,如图1A1所示,可以看出WGAH-III组分经过Sephadex G-75分离后,得到5 个洗脱峰,分别为峰A、B、C、D、E。收集冻干后,分别测定5 个峰的ORAC,结果如图1A2所示,C、D组分的ORAC最高且无显著性差异。此外,ABTS阳离子自由基清除率结果显示D组分的ABTS阳离子自由基清除率为81.04%,明显高于C组分(71.85%)(数据未列出),因此本研究选择D组分进行Sephadex C-25阳离子交换柱分离。
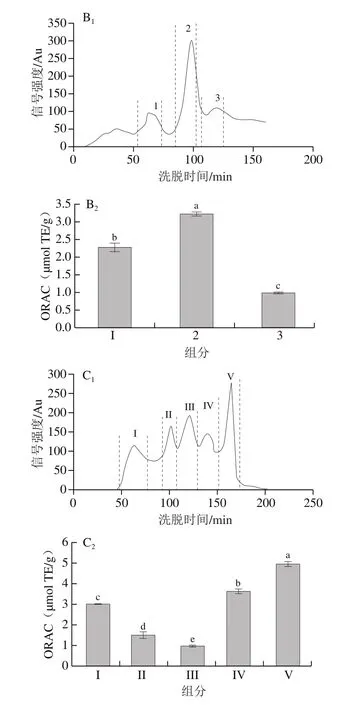
图1 层析色谱图以及不同组分的抗氧化活性Fig.1 Chromatogram and antioxidant activity of different separation fractions
离子交换色谱主要用于分离离子或可解离的化合物,因为它可以根据其对离子交换树脂的亲和力来分离带电分子[21]。蛋白质水解物包含各种碱性或酸性氨基酸残基的肽,这些肽易于吸附到固体载体(阳离子或阴离子交换树脂)上,相互作用的强度取决于分子和官能团上的电荷的数量和位置[7,21]。如图1B1所示,WGAH-III-D组分经过Sephadex C-25阳离子交换柱分离后,分离得到3 个峰,其中峰2的强度较高,分别对分离得到的3 个峰进行分段收集,脱盐冻干后,进行ORAC抗氧化能力的测定,结果如图1B2所示,峰2的ORAC抗氧化能力最高,峰3活性最低。该结果表明,经离子交换色谱分离,峰2具有最强的抗氧化能力。因此选择峰2组分进行Sephadex G-25凝交柱分离。
Sephadex G-25凝交柱分离原理与Sephadex G-75凝交柱相同,根据分子质量不同分离目标化合物。Sephadex G-25凝交柱可分离的分子质量为1~5 kDa,如图1C1所示,Sephadex G-25凝交柱对组分WGAH-III-D-2分离得到5 个峰,分别收集冻干后测定ORAC。如图1C2所示,V组分的ORAC显著高于其他4 个组分(P<0.05),说明其抗氧化能力最强,这说明分子质量最小的V组分具有最高的抗氧化活性。因此,选取组分WGAH-III-D-2-V进行进一步研究。
2.3 凝交柱层析产物的结构鉴定与PeptideRanker数据库预测
采用LC-MS/MS对WGAH-III-D-2-V组分进行结构鉴定,并通过Mascot 2.3软件分析得到与小麦胚芽蛋白质组中同源性最高的20 个短肽。如表2所示,这些肽均由6~10 个氨基酸组成。大量研究证实这种由10 个以下氨基酸组成短肽的抗氧化活性要高于其母蛋白及多肽[22],因为在蛋白质水解的过程中,肽链断裂使具有高抗氧化活性的肽段暴露出来,有利于清除自由基、螯合过氧化金属离子和抑制脂质过氧化[23]。本研究通过PeptideRanker数据库对这20 种短肽进行活性预测分析。PeptideRanker是一个较为系统的肽数据库,设置阈值为0.50,即预测值为0.50以上的肽被认为具有生物活性,且值越大生物活性越高。根据PeptideRanker数据库活性预测结果,按其活性指数排序,并选取活性最高的8 种肽序列进行人工合成以进一步验证其抗氧化活性。
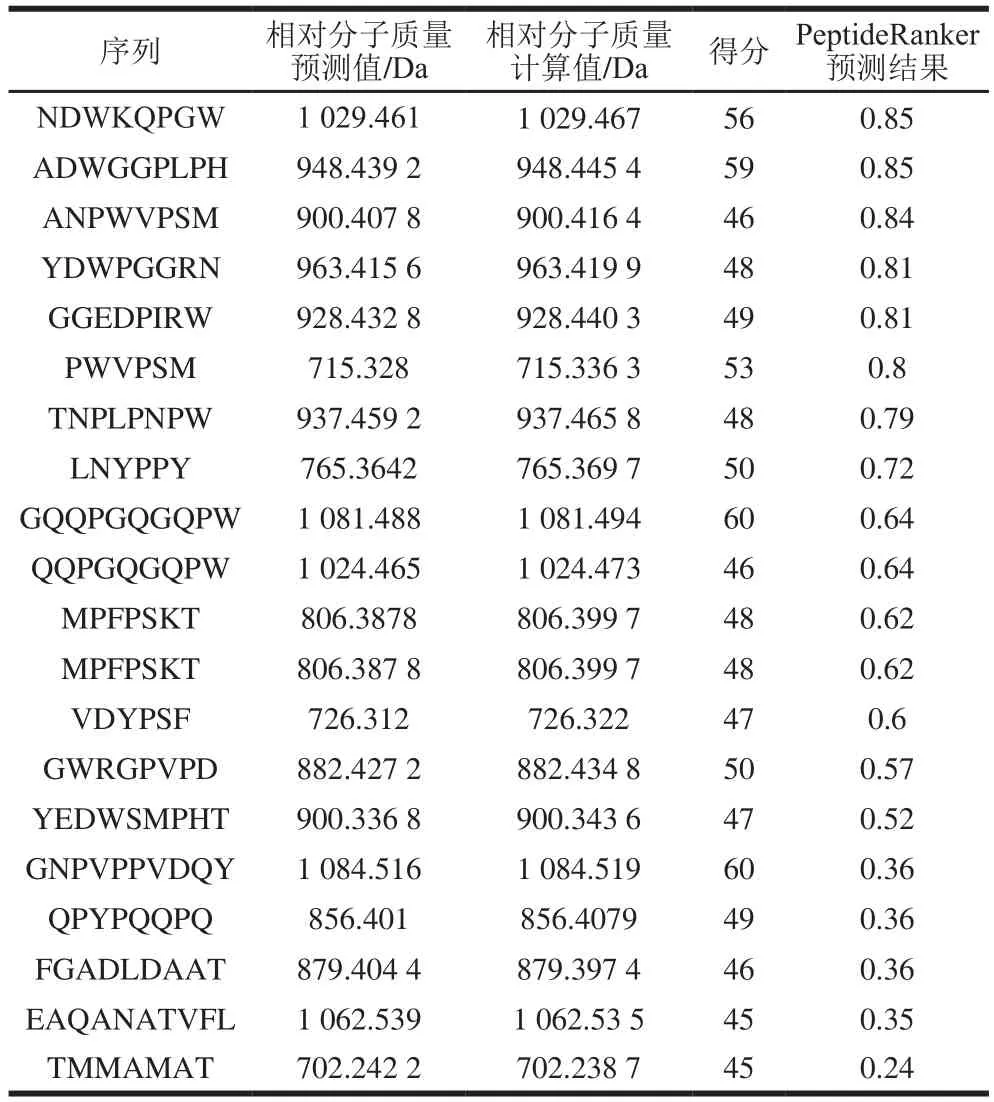
表2 目标肽段的鉴定及生物活性的预测Table 2 Amino acid sequences of potent peptides identified by LC-MS/MS and biological activity of potent peptides predicted by PeptideRanker
2.4 活性肽的筛选
根据PeptideRanker数据库活性预测结果选取活性最高的8 种肽序列,测定其ORAC及ABTS阳离子自由基清除能力。如表3所示,LNYPPY具有最高的ORAC(3.01 μmol TE/μmol)且清除ABTS阳离子自由基活性最强,清除率为95.58%。许多研究表明,肽的生物活性取决于氨基酸序列,氨基酸种类,以及分子质量。较小分子质量的肽具有较大的生物活性。多肽中氨基酸的特定位置影响其生物活性[24-25],当多肽的末端含有疏水性(Leu、Val和Gly)和芳香族氨基酸(Phe和Tyr)时,具有较高的抗氧化活性[26]。肽序列中,疏水性氨基酸(Leu、Val和Gly)、亲水性氨基酸(Pro)以及芳香族氨基酸(Phe和Tyr)的存在有助于其总体具有较高的抗氧化活性[27]。Fan Jian等[28]发现肽序列中含有Tyr有助于提高其抗氧化活性,与Tyr中含有酚羟基可以作为氢供体的特殊能力有关,特别是Tyr存在于肽末端。如表3所示,YDWPGGRN与LNYPPY都具有较高的自由基清除能力,推测与末端的Tyr有关,且LNYPPY含有两个Tyr。其次,肽序列LNYPPY具有最强的抗氧化能力,与其N端具有较强疏水性和较低带电性的Leu有关且其分子质量较小。因此,选取LNYPPY进行下一步研究,LNYPPY二级质谱图如图2所示。
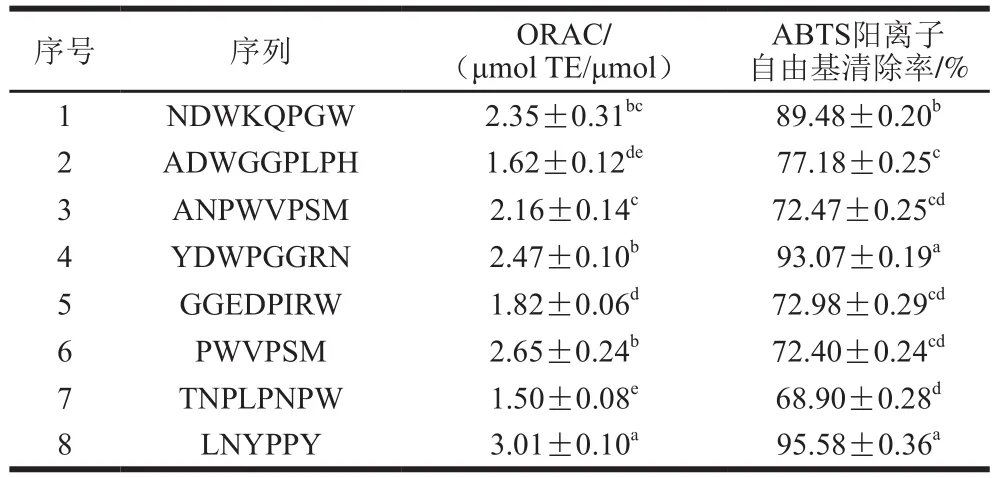
表3 不同肽的ORAC与ABTS阳离子自由基清除率Table 3 ORAC and ABTS cation radical scavenging activity of different peptides
图2 肽段LNYPPY的二级拟合质谱图Fig.2 TOF-MS/MS spectrum of the peptide (LNYPPY)
2.5 LNYPPY对细胞氧化应激损伤作用的影响
许多研究表明,高糖环境会使平滑肌细胞内ROS的生成量增加,一方面高糖加剧了细胞内葡萄糖有氧氧化,超出了线粒体呼吸链的处理能力而发生单电子传递,使ROS产生量增加;另一方面高糖能够激活细胞内NADPH氧化酶,使其表达量增加,导致ROS产生量增多,所以高糖诱导的VSMCs氧化应激模型被广泛用于体外抗氧化活性研究[29-30]。如图3所示,高糖能诱导VSMCs ROS水平极显著上升并使细胞异常增殖(P<0.01),抗氧化肽LNYPPY的添加并没有显著抑制高糖诱导的VSMCs的异常增殖和ROS产生,说明LNYPPY对高糖诱导的VSMCs氧化应激损伤无保护作用。
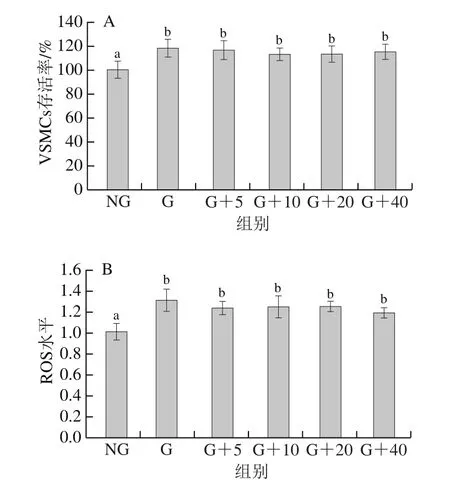
图3 LNYPPY对高糖诱导的VSMCs增殖及ROS水平的影响Fig.3 Effect of LNYPPY on viability and ROS levels of VSMCs exposed to high glucose
除了高糖诱导的VSMCs氧化应激模型,H2O2诱导的HepG2细胞氧化应激模型也经常用来检测抗氧化肽的生物活性。H2O2是一种常见的氧自由基产生物,在机体中容易分解产生羟自由基或氧自由基导致细胞过氧化损伤。已有研究表明不同浓度的H2O2会引起HepG2细胞不同程度的氧化损伤[31]。因此,本研究选用H2O2诱导的HepG2细胞氧化应激模型来检测LNYPPY的生物活性。
建立体外氧化应激模型的关键是确定适宜的H2O2氧化损伤诱导浓度,本研究选取不同浓度的H2O2(浓度梯度为25、50、100、150、200 μmol/L)对HepG2细胞进行诱导损伤,如图4A所示,加入H2O2处理12 h后,H2O2对HepG2细胞存活率的影响呈现明显的剂量依赖效应。当50 μmol/L H2O2刺激HepG2细胞时,可极显著抑制HepG2细胞的增殖(P<0.01),当H2O2浓度为150 μmol/L时,HepG2细胞存活率降至50%,因此选择添加150 μmol/L H2O2的HepG2为细胞氧化损伤模型。如图4B所示,在150 μmol/L H2O2诱导处理的HepG2细胞中添加抗氧化肽LNYPPY共同培养后,随着抗氧化肽浓度的增加(5、10、20、40 μmol/L),细胞存活率随之提高,且抗氧化肽处理组(10、20、40 μmol/L)与模型组相比具有极显著性差异(P<0.01),说明抗氧化肽LNYPPY能够有效改善由H2O2诱导HepG2细胞的活力降低。如图4C所示,当H2O2浓度为150 μmol/L时,HepG2细胞ROS水平是正常细胞的3.26 倍,加入抗氧化肽LNYPPY后,随着肽浓度的增加(5、10、20、40 μmol/L),ROS水平极显著下降(P<0.01),当肽浓度为40 μmol/L时,该条件下ROS水平降至正常细胞的1.47 倍。说明抗氧化肽LNYPPY能够有效的减少由外源性H2O2引起的HepG2细胞ROS异常增多的现象,对HepG2细胞氧化损伤具有保护作用,从而维护细胞的代谢平衡。
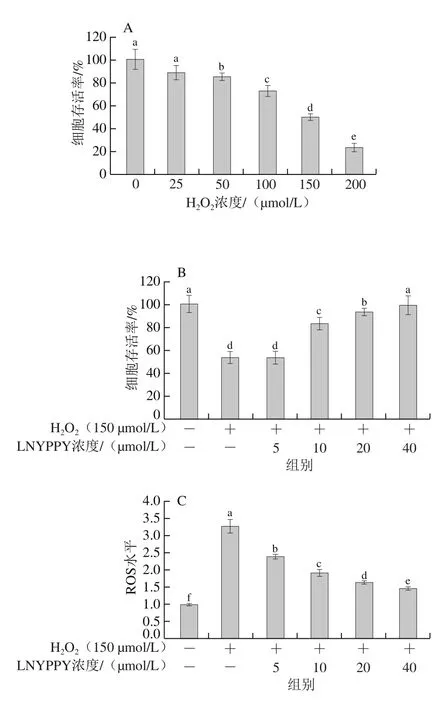
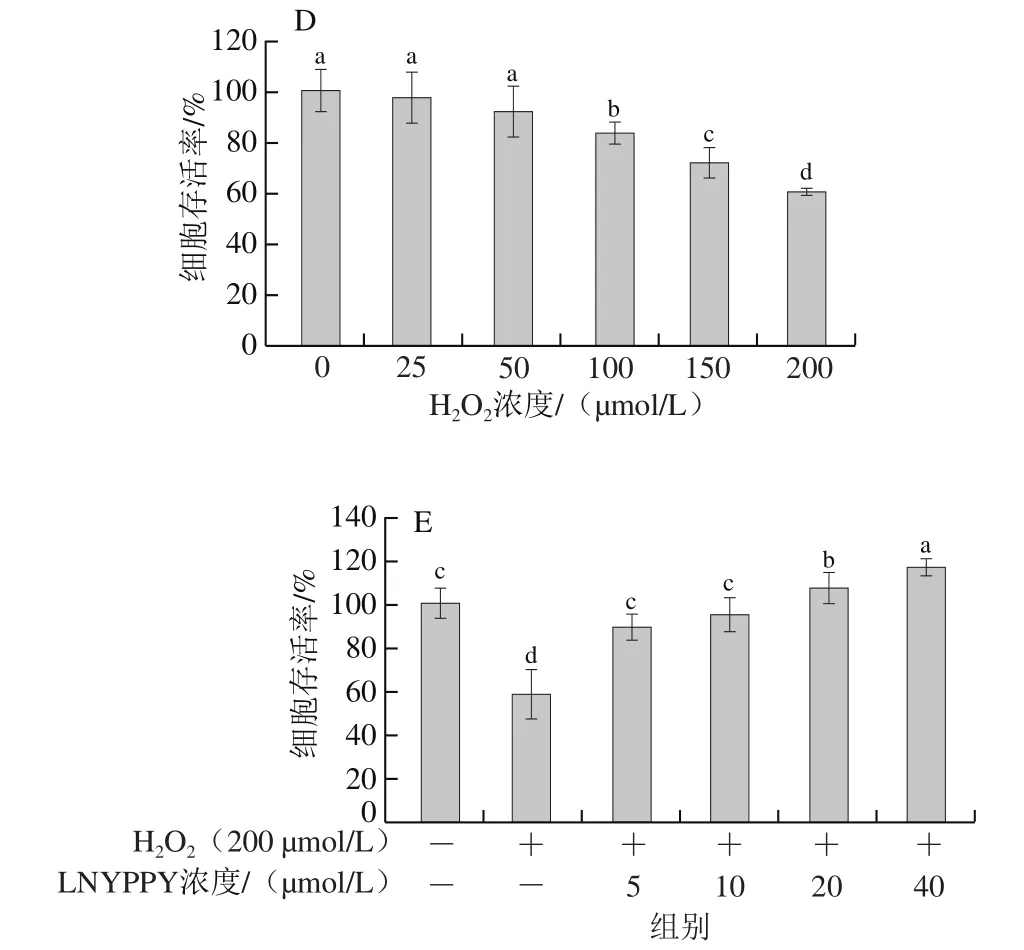
图4 LNYPPY对H2O2诱导的细胞存活率及ROS水平的影响Fig.4 Effect of LNYPPY on viability and ROS levels of cells exposed to H2O2
本研究还探讨了LNYPPY对H2O2诱导的VSMCs氧化损伤的作用。当H2O2浓度为200 μmol/L时可使VSMCs存活率降低幅度大于30%,因此选择200 μmol/L H2O2为建立模型的最适剂量,结果显示加入不同浓度的LNYPPY能够显著改善由H2O2诱导的VSMCs活性降低的现象(图4D、E)。该结果进一步说明抗氧化肽LNYPPY对H2O2诱导的VSMCs氧化应激损伤具有很好的保护作用。
氧化应激参与许多慢性疾病,如酒精性肝病、病毒性肝炎、肝纤维化、动脉粥样硬化等的发生过程,研究氧化应激模型对于筛选抗氧化药物以及功能食品的开发具有重要意义[32]。肝脏及肌肉是体内能量代谢的重要场所,也是慢性疾病发生的主要部位,肝细胞与肌细胞也经常用作体外生物活性研究。因此本实验选用了两种常用细胞(HepG2细胞和VSMCs)来建立氧化应激模型研究抗氧化肽LNYPPY的体外抗氧化活性。研究结果显示抗氧化肽LNYPPY对于H2O2诱导的HepG2和VSMCs氧化应激损伤具有很好的保护作用,说明抗氧化肽LNYPPY在生物体内也具有很好的清除氧化自由基的功能,可作为抗氧化剂进行开发应用。
高糖诱导的氧化应激是通过刺激细胞产生内源性ROS,造成细胞代谢紊乱,而H2O2对细胞造成氧化损伤的原理主要是通过外源刺激细胞产生过量的ROS,从而破坏细胞代谢平衡,造成细胞存活率降低。本研究发现抗氧化肽LNYPPY对高糖诱导的VSMCs氧化应激无作用,而对H2O2诱导的HepG2细胞和VSMCs氧化应激损伤有保护作用,可能与其在细胞中的作用靶点及其相对应的作用机制有关。有研究表明肽ADWGGPLPH能够通过作用于PKC/AMPK/NOX4信号通路,从而改善高糖诱导的VSMCs氧化应激损伤[30],而H2O2是通过Nrf2/HO-1通路诱导氧化应激损伤[33-34]。Yao Yijun等[35]通过研究发现薏仁种子不溶性多酚提取物可以通过Nrf2信号通路改善H2O2诱导的HepG2细胞氧化应激损伤;Chen Lei等[36]发现覆盆子提取物可以通过Nrf2信号通路对HepG2细胞氧化损伤产生保护作用。根据本研究结果推测肽LNYPPY在细胞内可能作用于Nrf2/HO-1信号通路,而对PKC/AMPK/NOX4信号通路无明显影响。关于抗氧化肽LNYPPY改善H2O2诱导的氧化损伤分子机制还需要进一步研究。
3 结 论
本研究利用超滤、Sephadex G-75凝交柱分离层析、Sephadex C-25阳离子交换层析和Sephadex G-25凝交柱层析以及PeptideRanker数据库活性预测技术从WGAH中分离筛选得到了具有较高抗氧化活性的肽LNYPPY,并进一步通过高糖诱导VSMCs以及H2O2诱导HepG2细胞和VSMCs建立细胞氧化应激模型,发现LNYPPY对高糖诱导的VSMCs氧化应激损伤无明显改善作用,但对H2O2诱导的HepG2细胞和VSMCs氧化应激损伤具有很好的保护作用,且根据这一结果推测LNYPPY的抗氧化作用可能是通过Nrf2/HO-1信号通路的介导。本研究可为麦胚蛋白抗氧化肽的理论研究与开发应用提供重要参考。

