3例转移性去势抵抗性前列腺癌不同转移灶中AR-V7的表达异质性分析
尹文莲,陈雪芹,聂 玲,张孟尼,曾 浩,钟金晶,卫昱燕,周 桥,陈 铌
(四川大学华西医院病理科,四川成都 610041)
全球癌症统计数据显示,前列腺癌已成为全球男性发病率第2的恶性肿瘤,死亡率也呈快速上升趋势[1]。前列腺癌早期症状不明显,部分患者就诊时已进展为晚期。雄激素剥夺疗法(androgen deprivation therapy,ADT)是晚期前列腺癌的基础治疗方案,通过手术或药物治疗(黄体生成激素释放激素类似物)让患者达到去势水平。但是大多数患者将在ADT治疗后2~3年内进展为危险程度更高的去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)[2]。
研究表明,雄激素和雄激素受体(androgen receptor,AR)活化是进展为CRPC的关键因素之一。AR扩增,突变或形成剪接变异体(AR-Vs)等导致的AR持续活化是CRPC发生发展的重要原因[3]。AR剪切变异体7(AR-V7)与前列腺癌生化复发风险增加、内分泌治疗应答率降低及患者生存率下降相关[4-6]。由于前列腺癌是一种异质性较高的肿瘤,同一患者原发灶与转移灶之间或者不同转移灶间都可能存在较大差异。目前关于AR-V7的研究较少,多集中于循环肿瘤细胞(circulating tumor cell,CTC)或血清外泌体等相关研究[7],基于肿瘤组织AR-V7蛋白表达情况的研究相对较少。本研究通过免疫组化技术检测3例前列腺癌患者不同时期及不同部位肿瘤组织中AR-V7的蛋白表达情况,分析其临床意义。
1 资料与方法
1.1 一般资料3例均为2017年8月至2019年11月四川大学华西医院收治的前列腺癌患者,经内分泌治疗后进入CRPC阶段,临床对前列腺原发病灶和转移病灶进行再次穿刺活检。
患者1,52岁,尿频、尿急、排尿困难7+年,服用前列康、哈乐治疗效果欠佳。磁共振成像(magnetic resonance imaging,MRI)检查示前列腺明显增大,血清前列腺特异性抗原(prostate-specific antigen,PSA)大于100.00 ng/mL,前列腺穿刺确诊为前列腺癌。全身骨显像检查示左侧髂前上棘异常代谢增高灶。经康士德、诺雷德治疗效果不佳,调整治疗方案为阿比特龙+诺雷德+泼尼松。后PSA连续上升,PET/CT示胸12椎体及骶椎高密度影,氟代脱氧葡萄糖(fluorodeoxyglucose,FDG)代谢增高,考虑转移,进入转移性去势抵抗前列腺癌(metastatic CRPC,mCRPC)阶段。临床对前列腺、骨盆转移灶和骶骨转移灶行再次穿刺活检。
患者2,58岁,尿急、尿频2年余,前列腺穿刺确诊为前列腺癌。外院给以康士德、诺雷德治疗效果不佳,血清PSA>100.00 ng/mL。1年前发现右侧腹股沟区包块,遂到我院就诊。多次复查PSA连续升高,调整药物为阿比特龙、地塞米松、诺雷德治疗1年余,影像学检查提示全身多处骨骼及淋巴结转移,进入mCRPC阶段。临床对前列腺、髂血管淋巴结和腹股沟淋巴结行再次活检。
患者3,72岁,3年余前因双侧肋骨及肩胛骨疼痛于外院行胸部CT检查发现肋骨转移瘤,血清PSA>100.00 ng/mL,前列腺穿刺确诊为前列腺癌。骨扫描提示全身多发骨代谢异常。给予康士德、诺雷德内分泌治疗及氯化锶核素治疗,多次复查PSA连续升高,调整药物为阿比特龙、泼尼松治疗及多西他赛化疗,服药1年余,当地医院复查肝脏磁共振成像(magnetic resonance imaging,MRI)见多个转移灶,进入mCRPC阶段。临床对前列腺、肝脏和髂骨病灶行再次活检。
1.2 免疫组化收集3例前列腺癌患者的初诊前列腺穿刺标本、mCRPC后前列腺再次穿刺及不同转移灶的穿刺组织石蜡标本,行AR-V7免疫组化染色(第一抗体克隆号RM7,GTX33604;GeneTex,美国加利福尼亚州)。免疫组化采用罗氏公司BenchMark XT全自动免疫组织化学染色仪进行。AR-V7免疫组化阳性信号定位于细胞核。
2 结 果
本组3例mCRPC患者前列腺原发灶初次穿刺标本、mCRPC后前列腺二次穿刺组织及不同转移灶肿瘤组织中AR-V7的表达情况存在明显异质性(表1)。

表1 患者的临床病理特征
患者1,初诊前列腺穿刺Gleason评分4+3=7分(ISUP/WHO 2016预后分级分组:第3组),AR-V7(-)。mCRPC后二次穿刺前列腺组织查见腺癌伴轻度治疗反应,肿瘤占比约30%,Gleason评分4+5=9分(ISUP/WHO 2016预后分级分组:第5组),AR-V7免疫组化染色核弱阳性(约10%);骨盆转移灶查见腺癌,AR-V7(核+,70%);骶骨转移灶查见腺癌,AR-V7(-)(图1)。
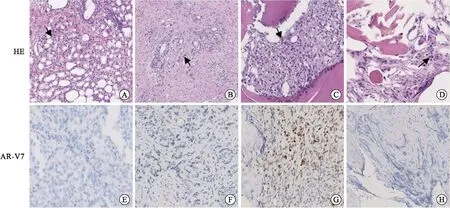
A、E:前列腺初次穿刺HE、AR-V7免疫组化染色;B、F:mCRPC后前列腺二次穿刺HE、AR-V7免疫组化染色;C、G:骨盆转移灶HE、AR-V7免疫组化染色;D、H:骶骨转移灶HE、AR-V7免疫组化染色(×200,箭头所指为肿瘤细胞)。
患者2,初诊前列腺穿刺Gleason评分4+5=9分(ISUP/WHO 2016预后分级分组:第5组),AR-V7(-)。mCRPC后前列腺二次穿刺仅见少许肿瘤组织,肿瘤占比<5%,不宜行Gleason评分,AR-V7(-);髂血管淋巴结转移灶查见腺癌,AR-V7(核+,弥漫);腹股沟淋巴结转移灶查见腺癌,AR-V7(-)(图2)。
患者3,初诊前列腺穿刺Gleason评分4+5=9分(ISUP/WHO 2016预后分级分组:第5组),肿瘤组织AR-V7(-)。mCRPC后前列腺二次穿刺组织未见癌残留;肝脏转移灶查见腺癌,AR-V7(核+,弥漫);髂骨转移灶查见腺癌,AR-V7(-)(图3)。
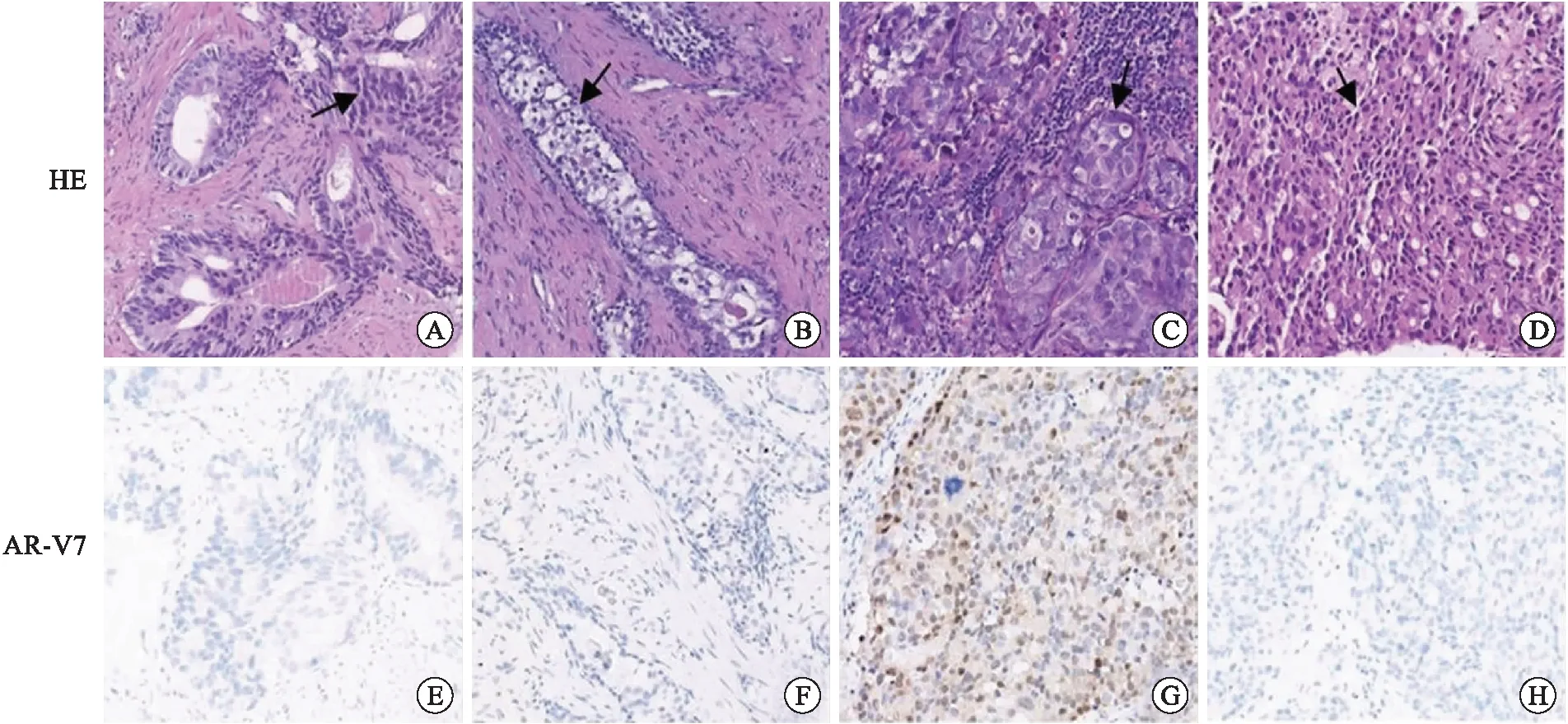
A、E:前列腺初次穿刺HE、AR-V7免疫组化染色;B、F:mCRPC后前列腺二次穿刺HE、AR-V7免疫组化染色;C、G:髂血管淋巴结转移灶HE、AR-V7免疫组化染色;D、H:腹股沟淋巴结转移灶HE、AR-V7免疫组化染色(×200,箭头所指为肿瘤细胞)。
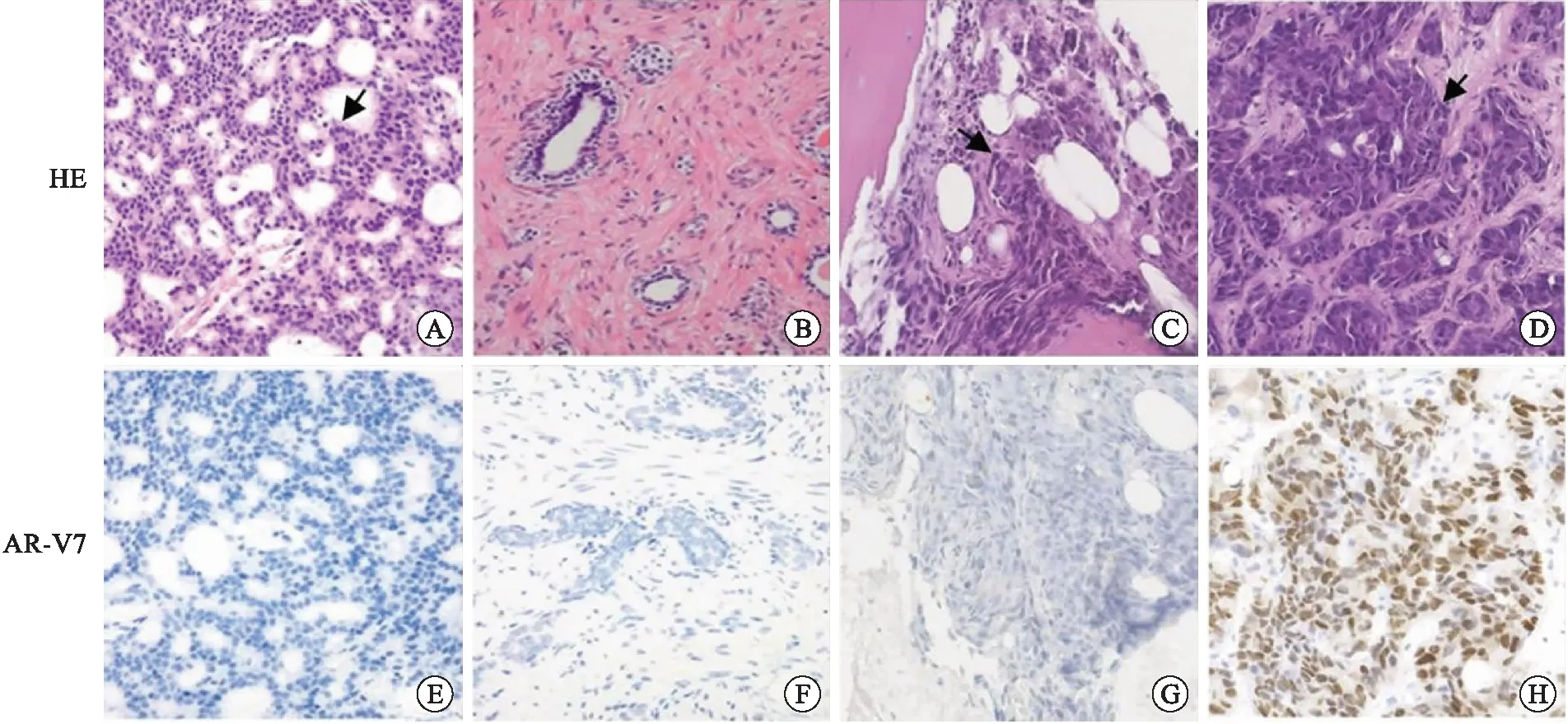
A、E:前列腺初次穿刺HE、AR-V7免疫组化染色;B、F:mCRPC后前列腺二次穿刺HE、AR-V7免疫组化染色;C、G:髂骨转移灶HE、AR-V7免疫组化染色;D、H:肝脏转移灶HE、AR-V7免疫组化染色(×200,箭头所指为肿瘤细胞)。
3 讨 论
ADT治疗为激素敏感阶段转移性前列腺癌的主要治疗方法。通过ADT治疗,大多数患者会出现血清PSA水平降低、影像学缓解或临床症状减轻等疗效。然而,随着治疗的持续,几乎所有患者都会不可避免地进展到CRPC阶段。美国食品药品监督管理局(food and drug administration,FDA)目前批准的针对CRPC的治疗方法包括化疗(如多西他赛、卡巴他赛和米托蒽醌等)、新型内分泌治疗(如阿比特龙和恩杂鲁胺等)、Sipuleucel-T疫苗、镭-223等[8-9]。尽管这些治疗能有效延长CRPC患者的生存时间,但并非所有患者均能从这些治疗中获益,且肿瘤最终会对这些治疗产生耐药[4,10]。过去认为CRPC的发生可能与雄激素通路关系不大,近年来大量研究发现,即使是在CRPC阶段,AR信号通路仍然在前列腺癌的进展和耐药中扮演着十分重要的角色[11-12]。
全长AR(AR-FL)包含4个结构域[13]:转录活性区的N端域(N-terminal transactivation domain,NTD),DNA结合域(DNA binding domain,DBD),铰链区以及配体结合域(ligand binding domain,LBD)。AR作为一个类固醇激素受体,当AR的LBD区与雄激素结合之后诱导AR活化,并与雄激素反应元件结合(androgen response element,ARE),调控一系列与前列腺癌细胞生长和生存相关基因的转录[14]。AR通路抑制剂可降低AR活性从而抑制前列腺癌细胞的增殖。文献报道前列腺癌经ADT治疗进展到CRPC阶段与AR-V7密切相关。AR-V7是一种缺乏LBD的截短的AR。AR-V7虽然没有LBD区域,但仍保留了DBD结构,能够在不与配体结合的情况下(低雄激素水平的环境)诱导AR产生非配体依赖的转录,从而导致AR信号通路持续激活,前列腺癌细胞产生去势抵抗[4]。研究表明,AR-V7不仅可通过增强AR-FL的作用促进CRPC的发生,还可以在无雄激素条件下,通过协助AR-FL或者独立激活下游通路来促进AR信号的持续活化,从而促进前列腺癌的进展[15]。AR-V7这一结构基础使其可能在雄激素缺乏的条件下发挥作用,降低癌细胞对新型内分泌治疗药物(如阿比特龙或恩杂鲁胺等)的反应并产生耐药[16-17]。
目前对AR-V7的检测尚无统一方法。多项研究显示,对前列腺癌CTC、血清外泌体或组织样本进行逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)、RNAseq或免疫组化检测能有效检测AR-V7的表达[5,18-21]。不同检测方法(如RT-PCR、RNAseq或免疫组化)或不同样本(如组织样本或CTC)之间AR-V7的检出率有所不同[12]。富集CTC检测AR-V7相比其他手段高效快速、特异性高,但技术要求严格。全血中AR-V7的检测容易取样,但有研究[22]显示AR-V7也可存在于非恶性细胞(如癌旁组织或良性腺体)中从而影响检测的准确性。通过免疫组化检测石蜡包埋组织中AR-V7的蛋白表达是较为方便直观的检测方法[23]。已有经过验证的兔单克隆AR-V7抗体能特异性结合肿瘤组织中的AR-V7[24]。多项研究显示组织中和CTC中AR-V7的表达情况可直接提示患者的预后[23-26]。因此,对前列腺癌组织进行AR-V7的免疫组化检测具有较好的临床应用价值。
目前对AR-V7在不同部位表达异质性的研究少见。本研究报道的3例mCRPC患者,初诊原发灶中均不表达AR-V7,mCRPC后部分转移灶表达AR-V7,提示AR-V7可能由药物治疗诱导产生。有研究显示AR-V7有助于ADT治疗后前列腺癌细胞的上皮-间充质转化,诱导和表达干细胞标记,从而增强前列腺癌细胞的侵袭能力,促进肿瘤的转移[27]。同一患者不同部位转移灶中AR-V7的表达存在明显差异,可能来源于不同的克隆。不同的转移灶可能对药物的反应不同,在内分泌治疗维持阶段出现药物抵抗可能由AR-V7阳性的克隆所导致。AR-V7可能作为判断ADT治疗疗效的生物标志物,也有望成为临床医生调整治疗方案的有效指标。临床需综合分析,寻找最具有侵袭性的病灶,制定个性化的治疗方案,使患者最大获益。

