糖尿病并气肿性肾盂肾炎25例诊疗分析
刘贵中,牛远杰,白文俊,吴宝军
(1.天津医科大学第二医院泌尿外科,天津 300211;2.天津市津南医院泌尿外科,天津 300350;3.北京大学人民医院泌尿外科,北京 100044)
气肿性肾盂肾炎(emphysematous pyelonephritis,EPN)是肾实质、肾周围组织和集合系统严重的感染性疾病。本病起病急骤,以肾实质弥漫性坏死为主要特征,临床以细菌感染为主,常见大肠埃希菌感染,尿路梗阻和糖尿病是本病发生的危险因素[1],如延误诊治,可发生肾实质液化坏死而最终行肾切除术,严重者可危及生命。
1 资料与方法
1.1 一般资料总结2016年1月至2020年6月治疗的25例糖尿病合并EPN患者的临床资料:其中天津医科大学第二医院9例,北京大学人民医院9例,天津市津南医院7例;男性7例,女性18例;年龄45~71岁,平均(60.2±9.7)岁。23例EPN患者在发病2周内确诊:腰痛就诊者6例,发热就诊者6例,腰痛伴发热者7例,尿路刺激征4例;其他2例病程超过2周,因肾坏死、感染性休克外院转诊。入院后测血糖(22.4±3.8)mmol/L、糖化血红蛋白(11.5±4.5)%、血白细胞(17.8±7.5)×109/L、血小板(154.7±55.1)×109/L。25例患者均经泌尿系计算机断层扫描(computed tomography,CT)确诊EPN(图1),其中右侧肾盂肾炎12例,左侧肾盂肾炎10例,双侧发病者3例;尿培养示大肠埃希菌感染15例,铜绿假单胞菌4例,肺炎克雷伯菌2例,4例培养结果阴性。
1.2 治疗方法所有患者入院后均积极给予广谱抗生素治疗,皮下注射胰岛素强化降血糖及营养支持治疗,48~72 h后行抗生素评价,抗感染效果不理想者更换厄他培南(1 g,Qd)或亚胺培南(1 g,Q12 h)抗感染治疗。25例糖尿病合并EPN患者中,病肾减压引流23例,术后2~4周复查泌尿系CT(图2),未见肾周积气积液。肾坏死行肾切除6例,其中4例减压引流术后肾坏死行肾切除,2例因肾坏死、因感染性休克由外院转诊而来的患者行肾切除。
1.3 统计学方法应用SPSS 16.0软件处理数据,应用描述性统计学方法对数据进行分析。
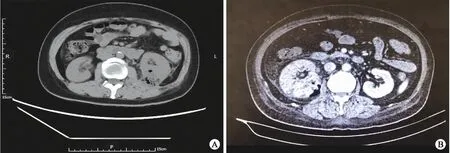
A:左侧肾周积气积液;B:右肾周积气,右肾实质多发脓肿。

A:左侧肾周积气积液消失;B:右侧肾周积气积液消失。
2 结 果
25例糖尿病合并EPN患者,21例治愈;死亡4例,其中2例因肾坏死、感染性休克转诊而来的患者行肾切除术后死亡,另2例为双侧EPN减压引流术后,单侧肾坏死行肾切除术后死亡。随诊6~59个月,21例患者病情平稳,无EPN复发,未见肾萎缩。
3 讨 论
EPN是一种致死性的肾脏感染性疾病,临床少见,本病以肾实质感染坏死、肾周和集合系统积气积液为特征性表现[2]。EPN起病急骤,病程凶险,致死率可高达20%~40%[3],好发年龄为中老年人,女性多见,男女比例约为1∶3[4]。
EPN早期症状不明显或仅有轻微的腰部不适,随着病程进展,逐渐出现腰部疼痛、寒战、高热,患者常常合并有尿路刺激征,如尿频、尿急、尿痛,部分伴有血尿、排尿困难、尿量减少或恶心、呕吐等胃肠道症状,严重者出现血小板减少、电解质紊乱、酸碱平衡失调、意识障碍、感染性休克、多脏器功能衰竭等[5]。尿路梗阻和糖尿病是EPN发生的主要危险因素,有报道EPN伴有糖尿病者占比高达96%[6]。糖尿病并EPN多以细菌感染为主,大肠埃希菌感染最为常见,有报道高达62.5%[7],其次是产气杆菌、肺炎克雷伯菌、奇异变形杆菌、铜绿假单胞菌等,容易产生耐药菌,对喹诺酮类和β内酰胺类抗生素耐药为主,少见厌氧菌、病毒或真菌感染[8-9]。
尿路梗阻、尿路感染、糖尿病控制不佳、应用免疫抑制剂等因素是本病的不利因素[10],免疫功能受损、局部组织高糖水平、产气菌滋生、肾脏集合系统高压和组织灌注受损是EPN的主要发病机制[11]。EPN临床可分为2型,Ⅰ型是肾实质破坏,伴有积气,但无积液;Ⅱ型是肾实质、集合系统和肾周围的积气积液[3]。单纯保守治疗、双侧EPN、I型EPN和血小板减少是本病致死的主要危险因素[12],本组3例双侧发病者,2例单侧肾坏死行肾切除术后死亡,双侧EPN发病者预后不佳。
确诊本病超声并不作为首选,因肾周积气干扰泌尿系超声结果判定;泌尿系CT了解肾盂积水及肾周积气积液,排查有无尿路结石等梗阻因素[13],增强CT有利于早期发现本病,了解肾实质血流情况,明确有无肾脏坏死,如疑似EPN应尽早检查。影像学检查可以鉴别EPN与普通型肾盂肾炎,后者应用广谱敏感抗生素积极干预即可,多不需手术治疗,也不会发生肾脏坏死[14],而糖尿病并EPN延误诊治,易发生不可逆的肾脏坏死。
EPN呈瀑布连锁式进展,肾实质坏死组织堵塞常常导致尿液引流不畅,造成尿路梗阻,肾盂内压力升高,由于肾小球滤过功能下降,肾积水早期表现可能并不明显,腰部明显胀痛或高热往往预示着肾盂内高压,早期干预解除梗阻是改善预后关键,针对具体情况采用个体化治疗原则,减压引流是EPN患者降低肾切除率和死亡率的关键[15-16]。早期成功置入输尿管双J管能有效引流肾盂内淤滞的尿液和坏死组织,有利于降低肾盂内高压,减少细菌毒素吸收入血,迅速缓解腰部疼痛和发热症状[17];输尿管内置入双J管失败或不宜置入输尿管双J管者,建议早期选择经皮肾穿刺造瘘减压引流控制感染;肾周感染严重或积脓较多及时行肾周穿刺引流,有助于缓解症状,缩短病程,改善预后。选择针对G-菌为主抗生素治疗,足剂量、足疗程、强效广谱的抗生素覆盖,推荐厄他培南或亚胺培南,联合胰岛素强化治疗控制血糖、纠正低蛋白血症及水电解质平衡失调,改善营养状况和提高免疫力治疗是保肾成功的重要手段。
糖尿病并EPN延误诊治致肾实质大片坏死,病灶逐渐融合成脓腔并蔓延至整个肾脏以及周围[18],导致保肾失败,如病灶未祛除,感染继续扩散诱发感染性休克、脓毒血症、败血症,严重危及生命[19-20]。早期肾切除术是糖尿病并EPN处理的积极手段,肾脏坏死早期行肾切除术有效降低本病致死率,有学者报道约1/5 EPN致肾坏死难免行肾切除手术,死亡率达18.8%[8];马军等[7]报道肾结石合并EPN积极外科手术解除尿路梗阻,病死率为12.5%;张鸣等[21]报道17例EPN经外科手术干预率为88.2%,总死亡率17.6%;LU[22]报道抗生素联合经皮肾穿刺引流术治疗51例EPN,死亡率为9.8%。本组25例糖尿病并EPN患者病死率为16.0%,肾切除率为24%,早期(2周内)确诊本病的23例积极行减压引流术后病死率为8.7%,肾切除率为17.4%。所以,早期发现、早期诊断、早期积极外科减压引流解除尿路梗阻是提高保肾成功率、降低病死率关键所在。
综上所述,糖尿病并EPN是严重的肾脏感染坏死性疾病,推荐早期泌尿系CT检查明确诊断,积极外科手术解除尿路梗阻,提高保肾成功率,联合胰岛素强化降血糖、敏感广谱抗生素及营养支持治疗,肾坏死者早期积极行肾切除术,降低病死率,改善预后。

