神经调节蛋白2 高表达于不同级别胶质瘤组织并通过Akt 信号调控胶质瘤细胞GFAP表达
赵炜疆,林佳哲
1江南大学无锡医学院细胞生物学教研室,江苏 无锡 214122;2汕头大学医学院第一附属医院神经外科,广东 汕头515041
胶质瘤在组织学上来源于异常增生的胶质细胞[1],是神经系统中最常见的原发性恶性肿瘤,约占人类原发性恶性脑肿瘤70%[2]。尽管目前普遍采用手术切除、放疗和化疗的联合治疗手段,但由于肿瘤复发等因素,总生存率仍然有限[1,3]。
神经调节蛋白(NRGs)是与多种肿瘤恶性程度密切相关的类表皮生长因子超家族[4-6],由NRGl-4四个亚型组成,以主要成员NRG1的功能研究最为系统[7]。NRGs可结合并激活由ErbB1-4组成的ErbB酪氨酸激酶受体家族成员,启动多个下游信号转导通路,从而诱导细胞增殖、分化、凋亡、迁移和黏附[8,9]。NRG1可通过自分泌或旁分泌方式激活ErbB受体信号通路,增强胶质瘤细胞存活[10]。我们既往研究亦证实NRG1可高表达于中低级别胶质瘤,通过调控细胞黏附分子L1 和CHL1,促进胶质瘤细胞的迁移和转移[11,12]。GFAP通常作为星形胶质细胞和胶质源性肿瘤的可靠标记物,与胶质瘤高侵袭性相关,具有潜在临床意义[13]。然而,NRG2在胶质瘤发生和发展中的作用及其与GFAP表达相关性仍不清楚。
本研究通过生物信息学手段比较分析低级别胶质瘤(LGG)和胶质母细胞瘤(GBM)样本中NRG2 和GFAP基因表达水平变化,LGG和GBM样本中两个分子与患者生存率的关系,以及两个分子表达的相关性。综合运用免疫组化和免疫荧光观察不同级别人胶质瘤组织芯片样本中NRG2表达水平变化,以及NRG2与GFAP的共定位情况,应用Western blot法探讨Akt信号通路在NRG2调控GFAP表达中的作用。
1 材料和方法
1.1 材料
1.1.1 组织芯片及细胞株 人胶质瘤组织芯片(DSBra01027,西安艾维拉生物科技有限公司)分别含有癌旁正常(CAN)组织10个,LGG组织48个,GBM组织20个;U-87 MG人胶质母细胞瘤细胞(武汉普诺赛生物科技有限公司)。
1.1.2 主要试剂 小鼠抗NRG2抗体、小鼠抗Akt、GAPDH抗体(Santa-Cruz Biotech);兔抗p-ErbB2抗体(ABclonal);兔抗GFAP 和p-Akt 抗体、辣根过氧化物酶(HRP)标记山羊抗小鼠、兔二抗以及水溶性封片剂(武汉博士德生物工程有限公司);重组人神经调节蛋白2(rNRG2)(Creative Biomart);Akt抑制剂Perifosine(碧云天);DylightTM488 标记驴抗小鼠抗体及Dylight-TM594 标记驴抗兔抗体(Jackson ImmunoResearch Laboratories);AEC显色液、磷酸盐缓冲液(PBS)、柠檬酸盐缓冲液、通用二步法试剂盒(北京中杉金桥生物技术有限公司);ProLong®Gold抗荧光淬灭封片剂(含DAPI)(Life Technologies);通用型抗体稀释液(新赛美生物科技有限公司);博冠生物电子显微镜(广州BOSMA);FR-4A型正置落射荧光显微镜(北京世纪科信科学有限公司);凝胶图像分析仪(Multiimage Ⅲ,Alpha Innotech)。
1.2 实验方法
1.2.1 生信分析 进入GEPIA 网站(http://gepia.cancerpku.cn/),在“Enter gene name”一栏中分别输入相应基因:NRG2 和GFAP,然后点击“GoPIA”。在新界面“Expression DIY”一栏中点击“Boxplot”,并在Datasets Selection中分别选择LGG和GBM,得到所查询LGG和GBM样本中相关分子与正常组织差异。在“Survival”一栏中点击“Survival Plot”,分别绘制LGG和GBM样本中两分子低表达和高表达与生存率的关系;使用“correlation analysis”分析LGG和GBM样本中NRG2与GFAP在基因表达水平相关性。
1.2.2 免疫组织化学染色 将石蜡切片置于60 ℃烤片机烤片60 min后,行二甲苯脱蜡和100%~70%酒精梯度水化。先将抗原修复液(pH6.0柠檬酸盐缓冲液)置于99 ℃水浴锅中预热15 min,再将水化后石蜡切片置于修复液中抗原修复60 min,并自然冷却至室温。加入0.3%过氧化氢酶阻断剂于组织芯片,室温孵育10 min,再使用通用型抗体稀释液封闭10 min,滴加按1∶50稀释的小鼠抗NRG2单克隆抗体,并放入湿盒于室温下孵育48 h。弃掉一抗,滴加反应增强剂室温孵育1 h后,滴加增强酶标记山羊抗小鼠/兔IgG聚合物室温孵育3 h。使用AEC显色液显色,并使用水溶性封片剂封片,静置于避光通风处,24 h后于可见光显微镜下观察拍照。使用Image J软件(美国国立卫生研究院),通过光密度灰阶值测量,对NRG2染色强度进行量化分析。
1.2.3 免疫荧光化学染色 将石蜡切片脱蜡、水化、抗原修复后(方法同1.2.2),滴加通用型抗体稀释液封闭10 min,之后分别滴加小鼠抗NRG2(1∶50)/兔抗GFAP(1∶200)抗体混合液进行荧光双标染色,室温孵育过夜。滴加驴抗小鼠(1∶500)和驴抗兔(1∶500)荧光二抗混合液并避光孵育3 h,之后滴加含有DAPI 的Pro-Long®Gold抗荧光淬灭封片剂并封片,室温避光放置24 h后使用落射荧光显微镜进行拍照。
1.2.4 细胞培养 U-87 MG细胞常规培养于75 cm2培养皿,DMEM 低糖培养液含10%胎牛血清,50 U/L 青霉素/链霉素;温度37 ℃,5%CO2。
1.2.5 Western blot 取对数生长期细胞铺于24孔板中(1×105/孔),分成3组:无血清培养液容积对照组、5 nmol/L重组人神经调节蛋白2(rNRG2)组、5 μmol/L Perifosine+5 nmol/L rNRG2组;处理24 h,每组各有3个样品。将上述细胞置于冰上,弃培养基,加入适量体积的PBS重复洗涤3次,之后加入40 μL/孔裂解液+蛋白酶抑制剂混合物,置于冰上反应30 min,高速冷冻离心取上清收集蛋白。BCA法测定蛋白含量,按3∶1的比例加入4×上样缓冲液,于100 ℃加热10 min。每孔上样约30 μg蛋白,经10%SDS-PAGE 电泳后,采用湿转法300 mA 转膜2.5 h。以5%BSA封闭液室温封闭1 h后,分别加入小鼠抗GAPDH、Akt抗体、兔抗GFAP、p-Akt和p-ErbB2抗体,4 ℃孵育过夜。二抗室温孵育2 h后,使用超敏发光法检测蛋白表达,凝胶图像分析仪采集化学发光信号。使用ImageJ 软件获得各条带光密度值,再通过内参蛋白进行归一化处理,最后比较样本间目标蛋白表达的相对倍数变化。
1.3 统计学分析
采用SPSS16.0软件进行数据分析,数据以均数±标准误表示,使用独立样本t检验检测组织芯片中不同级别胶质瘤与CAN相比,NRG2表达水平差异;使用单因素方差分析比较Western blot结果中各组间蛋白水平差异。P<0.05表示差异有统计学意义。
2 结果
2.1 LGG和GBM样本中NRG2水平比较
GEPIA分析显示,LGG(n=518)和GBM(n=163)样本中,NRG2 mRNA水平均高于正常对照组(n=207),以LGG样本较为显著(图1A)。生存率分析结果显示,在LGG样本中的50~150月生存期间,低NRG2水平患者生存率低于高NRG2 水平患者;GBM 样本中,低NRG2水平患者的生存率在30月之后略高于高NRG2水平患者(图1B)。
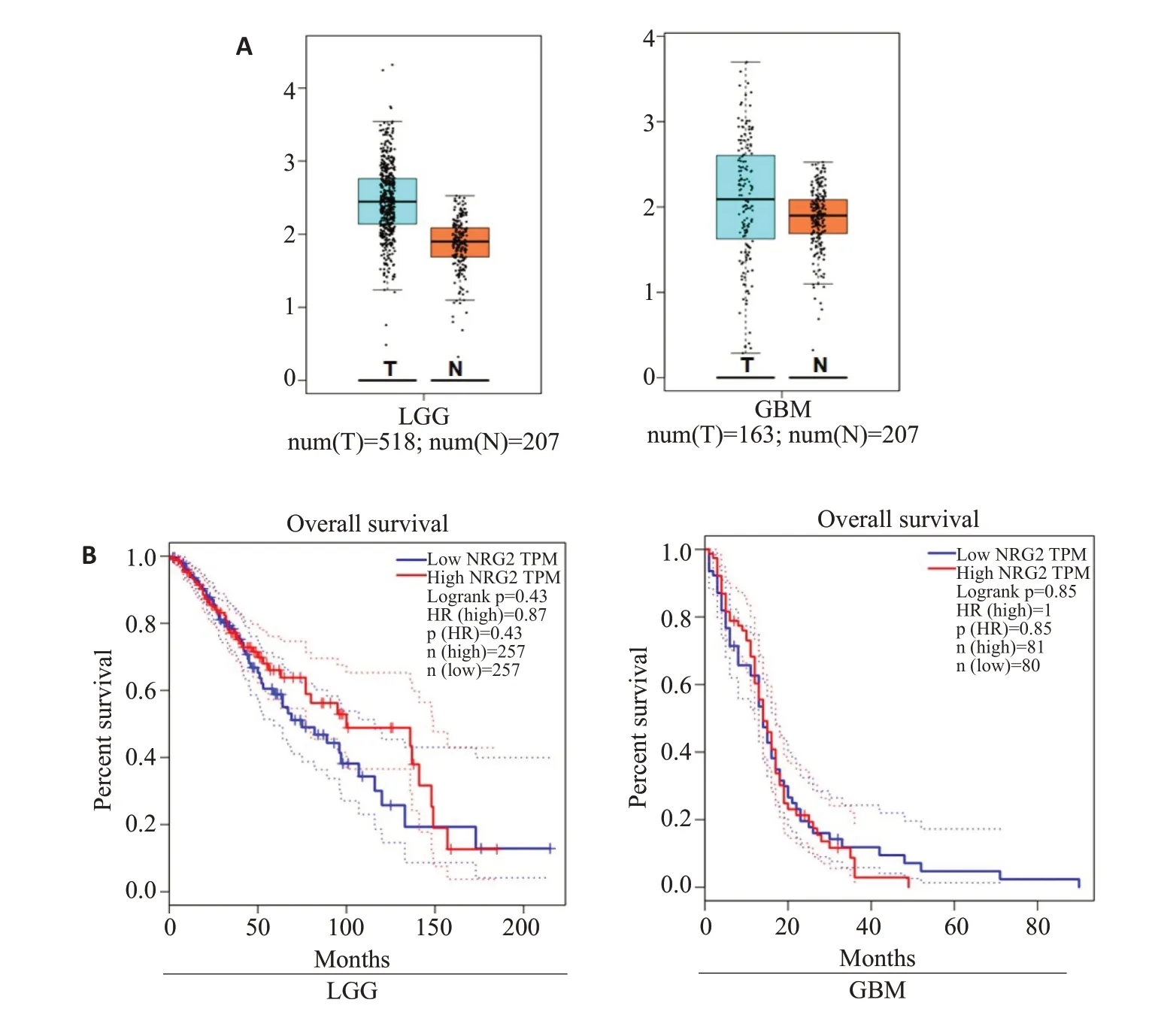
图1 GEPIA分析LGG 和GBM样本中NRG2基因表达水平变化及与患者生存率关系Fig.1 GEPIAanalysis of NRG2 expression level and its association with overall survival of patients with LGG and GBM.T:tumor;N:normal.LGG:Low-grade glioma;GBM:Glioblastoma multiforme.
2.2 人胶质瘤组织芯片NRG2免疫组化染色
不同级别胶质瘤CAN组织中NRG2的免疫组化染色结果显示,CAN组织中NRG2染色弱,主要位于于形态上接近小胶质细胞的细胞中。LGG和GBM组织中均可见增强NRG2染色信号,以LGG组织中信号水平较高(图2)。LGG组织中,与CAN组相比,NRG2免疫组化强度显著增高(P<0.05);与CAN组织相比,GBM组织中NRG2表达水平略升高,但差异无统计学意义(P=0.11,图2B)。
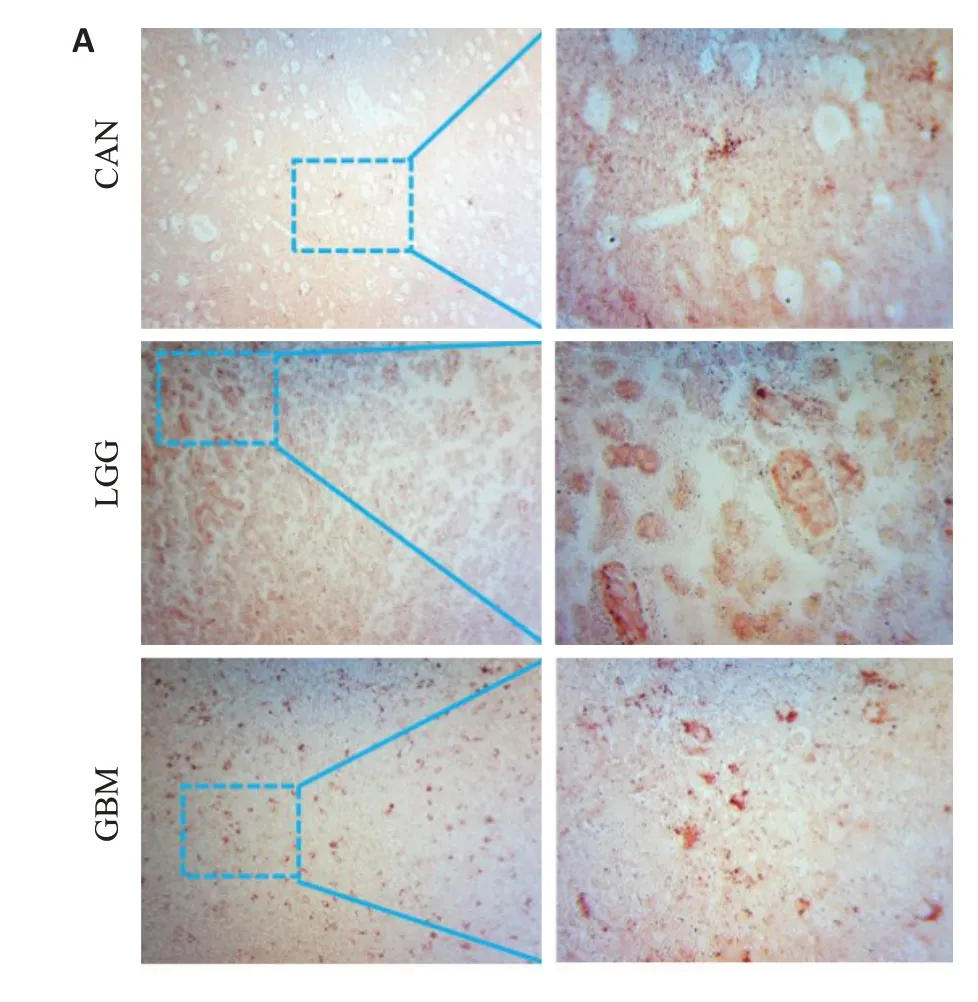
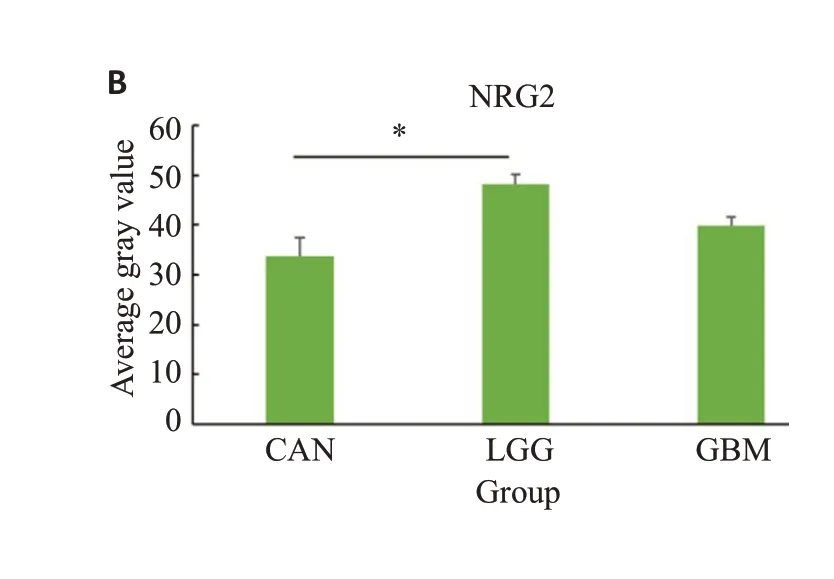
图2 NRG2在不同级别脑胶质瘤组织及癌旁组织中表达Fig.2 Immunohistochemical staining of NRG2 (A) and quantification of its expression levels(B)in cancer adjacent normal(CAN),LGG and GBM tissues.*P<0.05.
2.3 不同级别人胶质瘤组织中NRG2与GFAP表达相关性
LGG 和GBM样本中,GFAP mRNA水平均高于正常对照组(P<0.05,图3A)。生存率分析结果显示,在LGG样本中,100月生存时间内,低GFAP水平患者生存率高于高GFAP水平患者;GBM样本中,低GFAP水平患者生存率仅在50月之后略高于高GFAP水平患者(图3B)。相关分析结果显示,LGG样本中,NRG2与GFAP水平呈负相关(r=-0.19,P<0.01);而在GBM样本中,NRG2则与GFAP水平呈正相关(r=0.19,P<0.05;图3C)。免疫荧光双标染色结果显示,CAN中NRG2与GFAP荧光信号均较弱,无明显共定位。在LGG组织样本中,NRG2与GFAP荧光信号均较强,且存在明显共定位;在GBM组织样本中,NRG2与GFAP荧光信号虽均较强,但共定位程度减弱(图3D)。
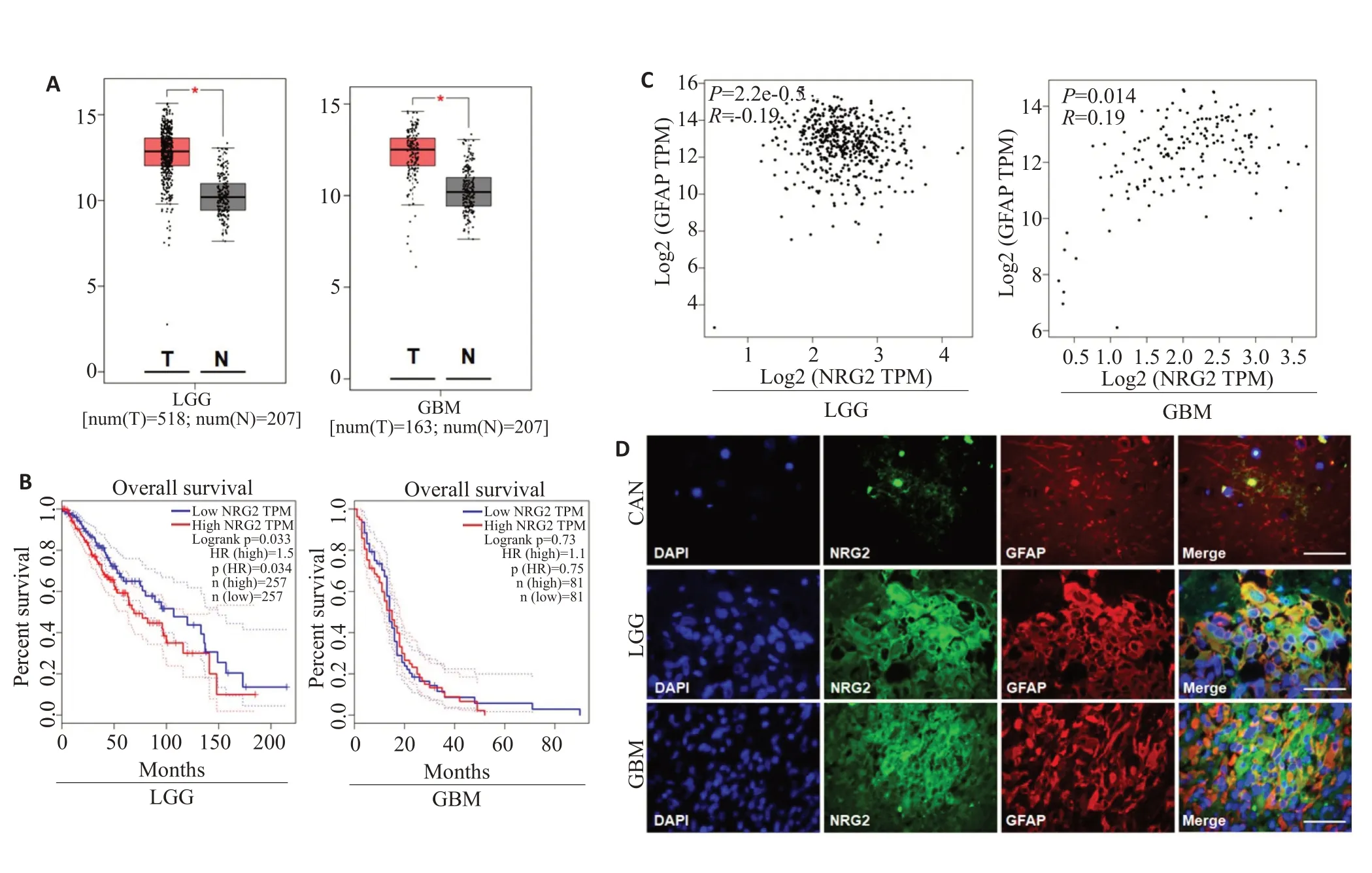
图3 NRG2与GFAP表达相关性分析Fig.3 Relationship between NRG2 and GFAP expression.A:GEPIA-based analysis of the gene expression level of GFAP in LGG and GBM samples.B:Correlation between NRG2 and GFAP in LGG and GBM samples.C:Correlation of GFAP expression with the overall survival of LGG and GBM patients.D:Double-labeling immunofluorescence staining of NRG2 and GFAP in CAN,LGG,and GBM tissues.T:Tumor;N:Normal(Scale bar=50 μm).
2.4 Akt信号通路对NRG2调控GFAP蛋白表达的影响
给予rNRG2后24 h,p-Akt蛋白水平与对照组相比增高(P<0.01),而同时给予Akt抑制剂,其水平与rNRG2处理组相比降低(P<0.01,图4A)。给予rNRG2后24 h,GFAP 蛋白水平与对照组相比增高(P<0.001),而同时给予Akt抑制剂,GFAP水平与rNRG2处理组相比降低(P<0.001,图4B)。给予rNRG2 后24 h,p-ErbB2水平与对照组相比升高(P<0.001),而同时给予Akt抑制剂,其水平与rNRG2处理组相比降低(P<0.001,图4C)。
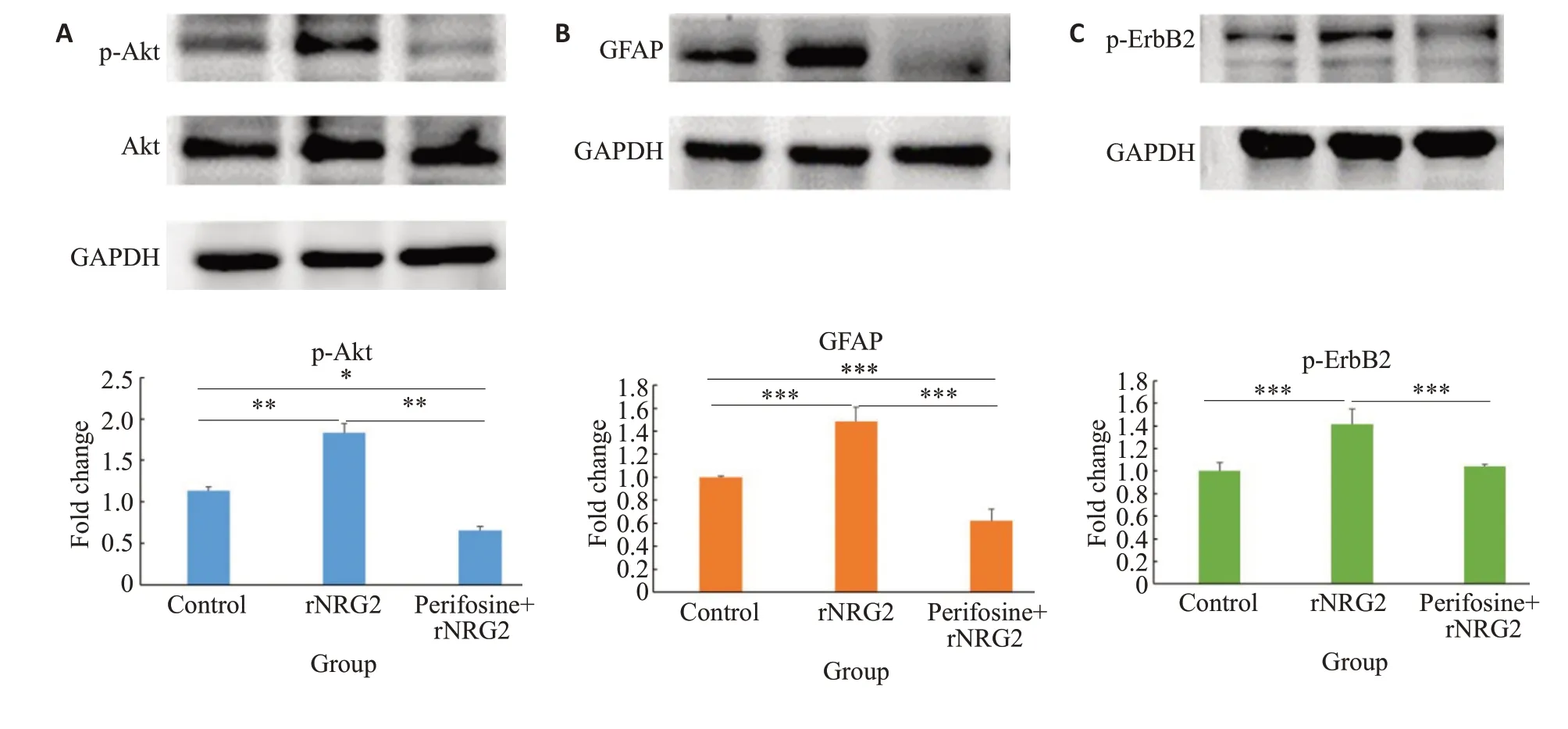
图4 重组人源神经调节蛋白rNRG2对U-87MG受体激活及相关信号通路的影响Fig.4 Effects of recombinant human-derived neuregulin 2(rNRG2)on GFAP and related signaling pathways in U-87 MG cells.Changes in the protein level of p-Akt,GFAP and p-ErbB2 are shown in A,B and C,respectively.Data are shown as Mean±SE.GAPDH was used as the loading control.*P<0.05,**P<0.01,***P<0.001.
3 讨论
胶质瘤细胞侵袭和迁移是其难以通过放射治疗和手术切除加以根除的主要原因[14]。本研究观察评价NRG2 在不同级别人脑胶质瘤样本中的表达及其在GFAP表达调控中的作用,为进一步探究胶质瘤治疗和药物筛选提供参考。神经调节蛋白是调控神经系统等器官生理功能以及肿瘤发生发展的重要细胞因子[15,16]。生信免疫评分分析显示,NRG1-4参与免疫细胞浸润,与肿瘤免疫微环境显著相关[17]。自分泌或旁分泌的NRG1可通过活化磷脂酰肌醇-3激酶(PI3K),增强胶质瘤细胞存活和运动能力,参与胶质瘤细胞增生和侵袭[10,18]。miR-125a-3p可通过直接靶向降低NRG1表达,抑制胶质瘤细胞存活,进一步表明NRG1是恶性胶质瘤治疗的潜在靶点[19]。不同于以往报道中NRG1在Ⅲ级和Ⅳ级胶质瘤/胶质母细胞瘤组织中表达水平最高[11,20],本研究观察到NRG2 在LGG 组织中表达水平最高,提示NRG2可能在胶质瘤中的作用有别于NRG1。
有报道脑室内输注NRG2可增加成年小鼠脑室下区(SVZ)GFAP阳性前体细胞数量,提示NRG2亦可在生理条件下作用于GFAP阳性细胞[21]。有研究表明,随胶质瘤级别增加,GFAP表达呈进行性下降[22,23]。与上述结果不同,本研究中生信分析显示,LGG和GBM组织中GFAP在基因表达水平均显著高于正常对照组。有研究显示,经年龄、切除范围、术前Karnofsky表现状况量表、IDH1突变和MGMT甲基化水平校正后的多变量分析表明,GFAP阳性率75%以上的GBM患者生存期较差,显著低于GFAP阳性率小于75%的GBM患者,表明GFAP阳性率75%对总生存率具有独立预测价值[24]。
本研究显示,LGG样本中高NRG2和低GFAP表达水平与总体生存率降低相关,NRG2与GFAP表达水平呈负相关,提示在LGG中NRG2可负向调节GFAP表达。结合免疫荧光双标染色推测,可能与大量NRG2以膜结合方式积聚于GFAP 阳性胶质瘤细胞有关。与LGG样本相反,GBM样本中高NRG2和高GFAP表达水平均与总生存率降低相关,NRG2与GFAP表达水平呈正相关。结合免疫荧光双标结果推测,表达NRG2的胶质瘤细胞,可能通过酶切方式释放游离型NRG2,以邻分泌及旁分泌方式作用于邻近和周边GFAP阳性胶质瘤细胞,进而促进GFAP表达。有研究发现NRG2通过特异性激活同型二聚化的ErbB4受体来触发不同的受体磷酸化激活模式[25,26]。大鼠年龄增加,其耳蜗神经干细胞中NGR1和ErbB2的表达亦随之增加,且外源性NRG1可通过激活PI3K/AKT通路,增加GFAP阳性细胞数[27]。本研究显示,Akt抑制剂可显著抑制GBM细胞中NRG2诱导的ErbB2受体磷酸化激活以及NRG2对GFAP表达的促进作用,提示Akt信号可在受体激活和蛋白质合成两个水平影响NRG2对GFAP表达的调控。
综上所述,本研究认为NRG2可高表达于不同级别胶质瘤组织中,可能部分通过Akt信号通路调控胶质瘤细胞GFAP表达,影响患者生存率,靶向NRG2信号通路的治疗对改善某些恶性胶质瘤患者生存率具有一定参考价值。