原花青素B2通过调控P13K/Akt/Nrf2信号通路减轻氯氰菊酯所致神经元损伤
周礼华,常见荣,高扬丽,王朝凯
蚌埠医学院1公共卫生学院,2科研中心,安徽 蚌埠233030
氯氰菊酯(CYP)是Ⅱ型拟除虫菊酯(Py)类杀虫剂,神经系统是Py类杀虫剂毒性效应的主要靶器官,按照Py类引起的周围或中枢神经系统症状将其分为I型(周围神经系统症状)和Ⅱ型(中枢神经系统症状)[1,2],其中,Ⅱ型Py杀虫剂对机体造成的影响高于Ⅰ型[3]。作为Ⅱ型Py的代表,CYP可轻易跨过血脑屏障,进入脑组织,诱导ROS自由基损伤和DNA损害,进而导致细胞凋亡,即使低剂量暴露也会对机体产生免疫毒性和遗传毒性[4-6]。原花青素(PC)属于多酚类化合物,原花青素B2(PCB2)特有的二聚体结构使其具有最强的抗氧化活性[7]。既往研究表明,PCB2通过清除ROS自由基保护小脑颗粒神经元免于化学物质诱导的细胞损伤[8]。PC对CYP诱导的大脑皮层神经元损伤是否具有保护作用及其机制未见报道。PCB2 能否干预CYP诱导的神经毒性及相关机制尚未明确。我们前期研究发现,在CYP诱导C57BL/6小鼠大脑皮层神经元氧化损伤与凋亡过程中Nrf2/ARE信号通路参与调控[9],而Nrf2/ARE的上游通路P13K/Akt通路是否参与这一调控,仍然未知。本实验采用原代培养的新生鼠大脑皮层神经元作为实验模型,采用P13K/Akt信号通路抑制剂LY294002抑制P13K 的激活,研究PCB2 是否能够活化P13K/Akt 通路,调节Nrf2抗氧化防御通路,干预CYP对大脑皮层神经元的毒性效应。作为神经系统的中枢,大脑皮层参与高等生物的学习、记忆、情感等一系列生命过程[10-12]。原代培养的新生鼠大脑皮层神经元,无论是形态结构还是生理功能与活体小鼠大脑皮层生物活性相似度很大,能够间接反映生物体内状态[13]。本文研究PCB2对CYP诱导损伤的保护作用能够为从植物性食物中寻找消除或减轻杀虫剂残留对机体影响的天然物质提供理论依据。
1 材料和方法
1.1 动物、试剂和仪器
1.1.1 动物和试剂 C57BL/6乳鼠,雌雄不限,由蚌埠医学院实验动物中心提供,动物使用通过蚌埠医学院实验动物伦理审查。PCB2(Extrasynthese);CYP、多聚-L-赖氨酸(Sigma-Aldrich);Neurobasal Medium、B27、胎牛血清(Gibco);线粒体膜电位试剂盒(JC-1)、ROS检测试剂盒(Beyotime);LY294002(MCE);anti-NSE antibody(Affinity)、anti-Akt antibody、anti-β-actin antibody(CST)、anti-TBP antibody(Proteintech)、anti-p-Akt antibody、anti-Nrf2 antibody、anti-HO-1 antibody(Abcam)。
1.1.2 主要仪器 荧光显微镜、激光共聚焦显微镜(Olympus)、Synergy 2 酶标仪(BioTek)、化学发光凝胶成像分析系统(Bio-Rad)。
1.2 方法
1.2.1 神经元原代培养与鉴定 取新生1~2 d小鼠,75%酒精消毒,预冷D-hank'液冲洗,剪开颅骨,分离大脑皮质,0.25%胰酶(内含0.1%DNaseⅠ)消化10 min后终止消化,轻吹打,取上清离心,离心后弃上清,加入DMEM/F12培养基,调细胞密度至1×106,接种于多聚-L-赖氨酸处理的培养板。24 h换成Neurobasal-B27无血清培养基,之后每2 d半量换液。
采用神经元特异性烯醇化酶(NSE)细胞免疫荧光染色对神经元进行鉴定。神经元培养至第5天,细胞爬片经多聚甲醛固定、Triton破膜,山羊血清封闭后滴加NSE抗体及FITC荧光二抗,最后滴入含DAPI的抗荧光淬灭封片剂,激光共聚焦显微镜观察并随机拍照。
1.2.2 实验分组 神经元体外培养5 d后随机分组为:正常对照组(Control),Neurobasal-B27无血清培养基培养;PCB2处理组,将5 μg/mL的PCB2加入无血清培养基与细胞共培养24 h;CYP 暴露组,将50 μmol/L 的CYP 加入培养基与细胞共培养24 h;PCB2 预处理组(PCB2+CYP),将5 μg/mL的PCB2与细胞预处理30 min后加入CYP 50 μmol/L共培养24 h;LY294002处理组(PCB2+CYP+LY294002),将20 μmol/L 的LY294002与细胞预处理30 min,然后给与PCB2预处理30 min,最后加入CYP共培养24 h。
1.2.3 细胞活性分析 将细胞按照100 μL/孔接种于96孔细胞培养板,分别设置实验各组同上,同时设空白对照组。按说明书要求滴加CCK-8试剂,每组设3个复孔,采用酶标仪检测各组细胞吸光度值A450nm。
1.2.4 细胞核形态观察 细胞分组处理后,按说明书要求均匀滴加Hoechst 33342活细胞染液,10 min后吸除含染料的培养液,PBS清洗,荧光显微镜下观察细胞核形态变化。
1.2.5 JC-1检测 分组处理后,采用线粒体膜电位试剂盒(JC-1)检测线粒体膜电位(MMP)变化。严格按说明书步骤装载JC-1荧光探针,探针装载完毕30 min内完成检测。荧光显微镜观察、拍照,采用ImageJ 软件对荧光强度进行分析。
1.2.6 ROS分析 细胞分组处理后(阳性对照及阴性对照),每孔加入终浓度为10 μmol/L的DCFH-DA,孵育20 min后PBS洗涤,分别采用荧光显微镜及流式细胞仪进行分析。
就现有文献来看,不仅黄庭坚本人没有整理过其词作,而且其亲友和后人也都没有参与,外甥洪炎编《内集》、表弟李彤编《外集》、从孙黄编《别集》都与词无涉。因此,词集的质量无法与处于正统地位的黄庭坚内集、外集、别集相提并论,此为造成后世黄庭坚词集版本淆乱、所收作品数量不一的主要原因。
1.2.7 Western blot 检测 分组提取细胞总蛋白及细胞核蛋白,采用BCA法测定蛋白浓度,电泳、转膜、封闭、一抗及二抗孵育。凝胶成像系统检测ECL化学发光并采集图像,采用ImageJ 软件对条带灰度值进行分析。
1.3 统计学分析
应用统计软件SPSS 22.0进行分析,定量资料以均数±标准差表示(不同批次细胞重复3次),采用方差分析及SNK法进行组间差异比较,P<0.05为差异具有统计学意义。
2 结果
2.1 神经元培养与鉴定
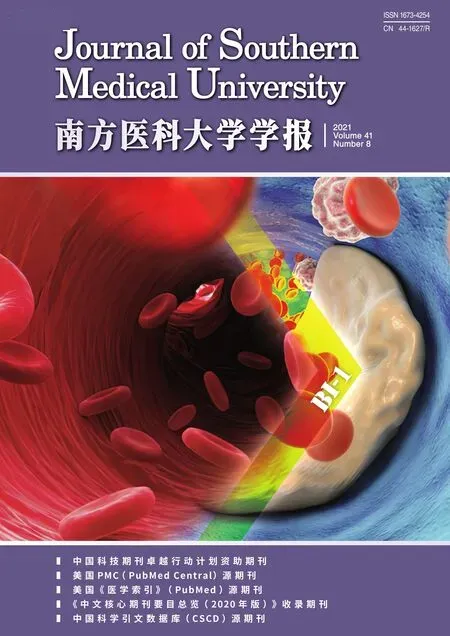
C57BL/6乳鼠大脑皮层神经元种板后分散均匀,24 h神经元开始呈现梭形或锥形,细胞突起逐渐延伸(图1A);第3天,细长弯曲的树突紧密连接,形成神经网络(图1B);培养第5天,神经元胞体变大,神经元树突延伸,形成密集的神经网络(图1C)。NSE可特异地表达于神经元细胞,神经元胞质、轴突及树突呈现绿色荧光被定义为阳性细胞。结果显示,原代培养的小鼠大脑皮层神经元纯度较高(图1D)。
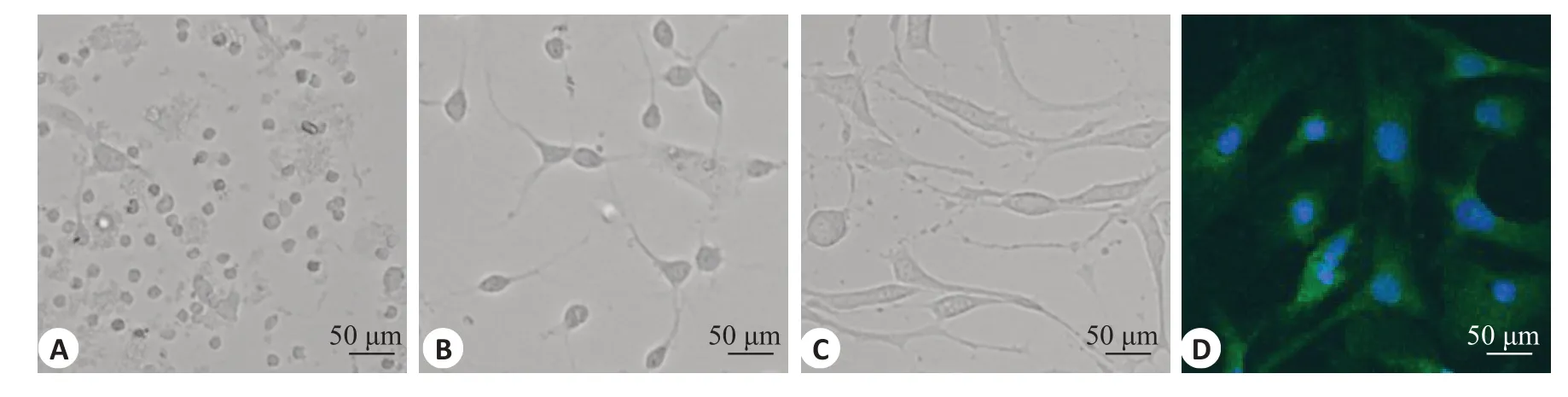
图1 神经元形态变化及NSE免疫荧光染色Fig.1 Morphological changes of mouse neurons in primary culture over time and immunofluorescence staining of the neurons.A:24 h.B:3 days.C:5 days.D:Neuron purity.
2.2 CCK-8分析神经元活性
CYP暴露组神经元细胞A值为0.642±0.060,Control组细胞A值为0.802±0.044,与Control组相比,CYP暴露组细胞活性受到抑制(P<0.001);PCB2预处理组细胞A值为0.749±0.047,与CYP暴露组相比,PCB2预处理能够提高细胞活性(P=0.006);LY294002处理组细胞A值为0.626±0.044,与Control组相比,细胞活性明显受到抑制(P<0.001);PCB2处理组与Control组的细胞A值接近,两者差异无统计学意义(P>0.05,图2)。
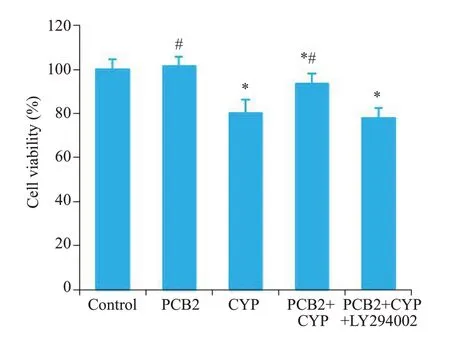
图2 CCK-8检测神经元细胞活性Fig.2 Viability of neurons detected by CCK-8 assay(n=3).*P<0.05 vs control group;#P<0.05 vs CYP exposure group.
2.3 Hoechst 33342观察细胞核形态特征
Control 组细胞核大而圆,均匀蓝染,形态完整;PCB2处理组核形态变化与Control相似;CYP暴露组细胞核体积变小、浓染致密;PCB2预处理改善了CYP导致的细胞核形态异常;LY294002处理组细胞核形态出现凋亡特征(图3)。
图3 Hoechst 33342染色观察细胞核形态变化Fig.3 Morphological characteristics of the nuclei of the neurons with different treatments(Hoechst 33342 staining).
2.4 JC-1分析MMP变化
Control组MMP较高,荧光显微镜下呈现明亮的红色或黄色;PCB2处理组红绿荧光比例与Control组相似;CYP暴露组MMP下降,细胞中绿色荧光显著增强;PCB2预处理在一定程度上逆转了CYP导致的MMP;LY294002阻断了PCB2对CYP的拮抗作用(图4)。
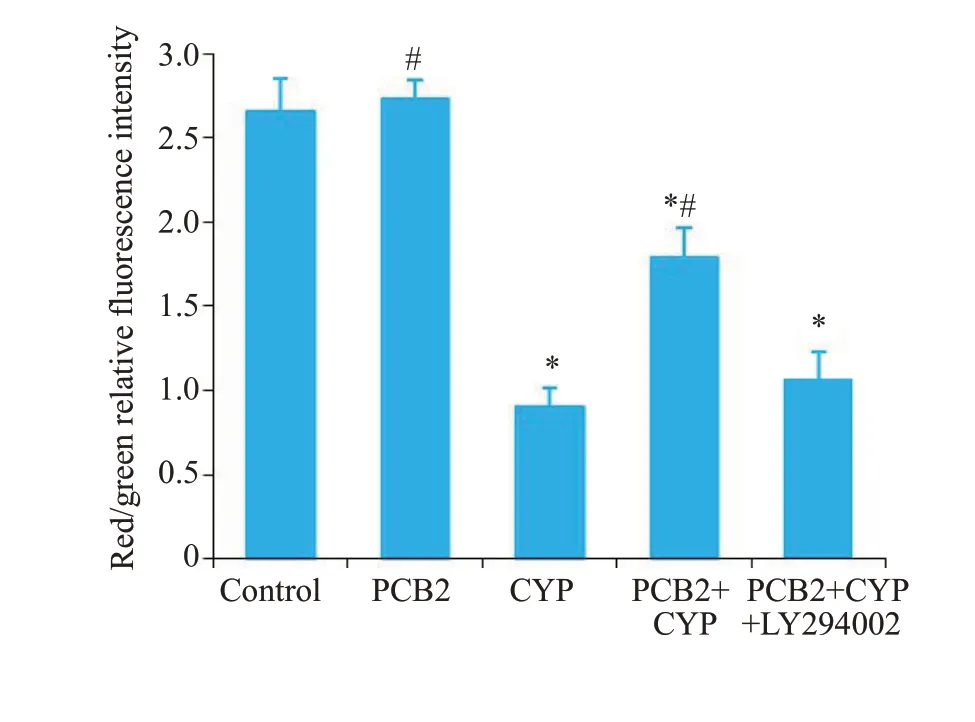
图4 JC-1分析神经元线粒体膜电位变化Fig.4 Changes of mitochondrial membrane potential in the neurons with different treatments(JC-1 staining).*P<0.05 vs control group;#P<0.05 vs CYP exposure group.
2.5 ROS分析
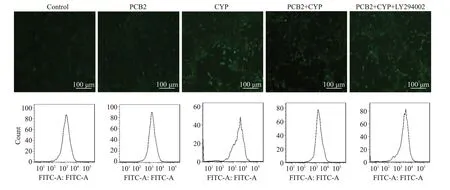
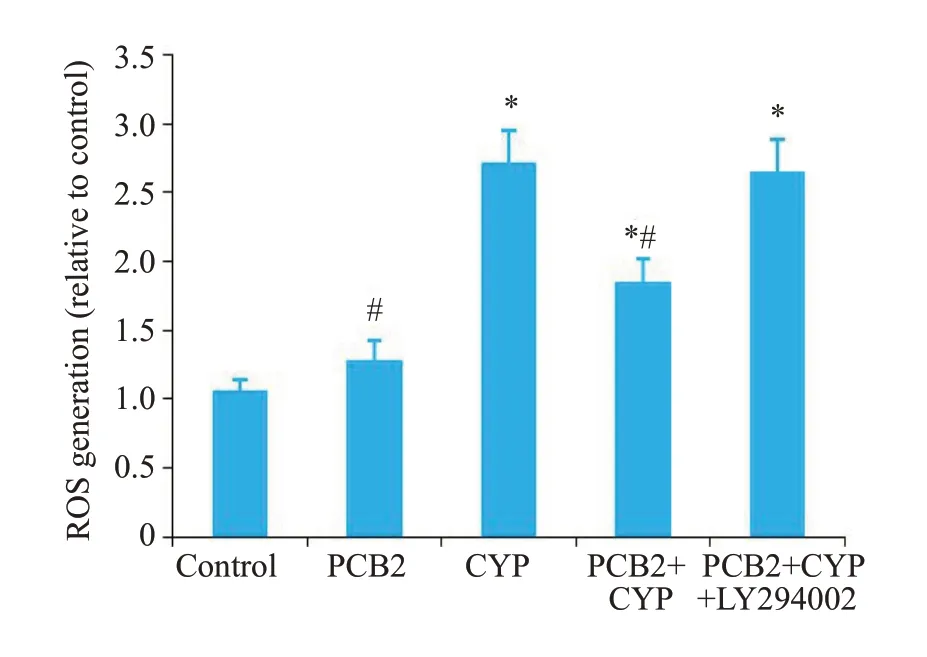
图5 流式细胞术与DCFH-DA检测细胞活性氧水平Fig.5 Production of reactive oxygen species in the neurons detected by flow cytometry and DCFH-DA.*P<0.05 vs control group;#P<0.05 vs CYP exposure group.
2.6 Western blot检测Nrf2、HO-1、p-Akt、Akt蛋白表达
与Control组相比,CYP暴露组Nrf2及HO-1蛋白表达明显上调(P<0.001);PCB2预处理组蛋白表达较CYP暴露组明显下调(P=0.01,P=0.015);与Control组相比,LY294002处理组Nrf2及HO-1蛋白表达上调(P<0.001);PCB2处理组Nrf2蛋白表达较Control组上调(P=0.03)。
与Control组相比,CYP暴露组p-Akt蛋白表达上调(P<0.001);PCB2预处理组p-Akt蛋白表达较CYP暴露组下调(P=0.004);与Control组相比,LY294002处理组p-Akt蛋白表达上调(P<0.001)。各处理组Akt蛋白表达变化差异无统计学意义(P>0.05,图6)。
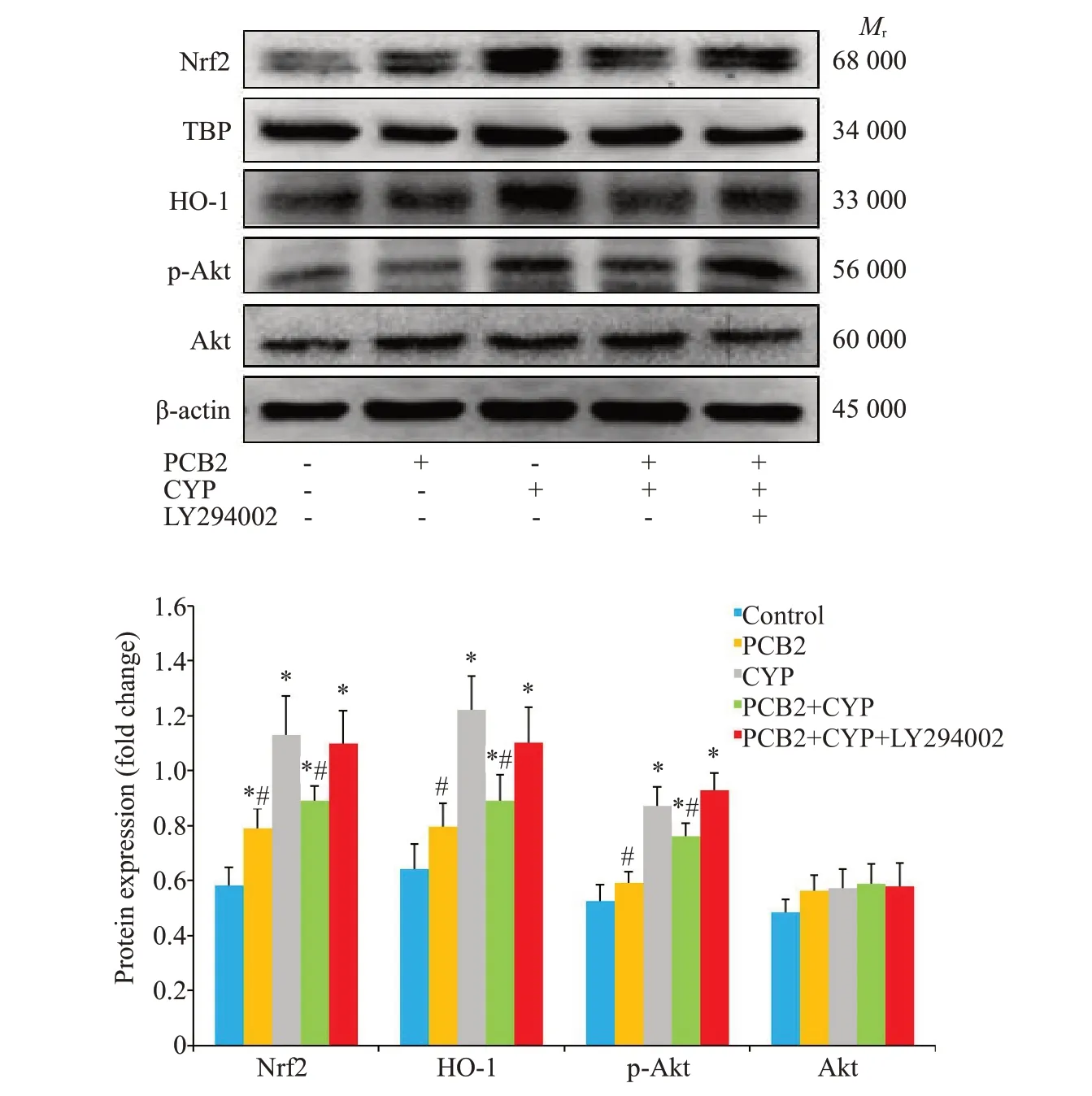
图6 Western blot分析Nrf2、HO-1、p-Akt、Akt蛋白表达Fig.6 Nrf2,HO-1,p-Akt,and Akt protein expressions in the neurons in different groups analyzed by Western blotting.*P<0.05 vs control group;#P<0.05 vs CYP exposure group.
3 讨论
植物活性物质一直以来被证明具有神经保护作用,植物活性物质的神经保护作用依赖于对细胞内信号通路的调控[14-17]。萝卜硫素通过激活P13K信号通路,保护皮层神经元免于内源性神经毒素造成的损伤[18];白藜芦醇通过调节Nrf2蛋白表达,保护乙醇诱导的小脑颗粒神经元损伤[19]。CYP已成为环境和农产品中普遍存在的残留农药[20,21],如果能够从植物性食物中寻找到减轻CYP残留对神经系统影响的天然物质,将为应对日益严重的农药残留问题提供新的思路。Nrf2在调节细胞氧化还原状态和保护细胞免受氧化损伤中发挥核心作用[22]。磷脂酰肌醇-3-激酶/丝氨酸-苏氨酸蛋白激酶(P13K/Akt)通路是机体内重要的信号转导通路,在细
胞存活、凋亡及增殖等活动中发挥重要的生物学功能[23]。本实验采用P13K/Akt信号通路抑制剂抑制P13K的激活,研究P13K/Akt 通路在Nrf2/ARE 通路参与CYP和PCB2介导的细胞损伤和保护作用过程中是否参与调控及调控机制。
细胞内氧化还原稳态通过细胞抗氧化防御系统平衡ROS的产生和清除。CYP暴露损伤抗氧化防御系统,导致ROS产生过多,清除能力下降。线粒体是ROS的主要来源,ROS产生过量直接导致线粒体功能障碍,在氧化应激条件下,线粒体DNA更易受到损伤[24,25]。MMP下降是细胞凋亡的早期事件,本研究显示,CYP暴露导致MMP下降,小鼠大脑皮层神经元细胞核出现固缩、浓染等凋亡特征。PCB2强大的抗氧化能力能够平衡氧化应激对细胞的损伤,CYP暴露之前给与PCB2预处理显然改善了细胞核形态异常及线粒体功能障碍。但是,P13K/Akt信号通路抑制剂LY294002明显阻断了PCB2对神经元的保护作用。
我们在进一步研究PCB2对CYP所致小鼠大脑皮层神经元损伤的保护机制中发现,CYP暴露引起Nrf2核易位、Nrf2 及其下游靶激酶HO-1 蛋白表达上调;PCB2预处理Nrf2及HO-1蛋白表达没有持续上调,而是向着基础水平回调。Nrf2与HO-1相互刺激、相互调节增强抗氧化通路[26]。HO-1通过降解细胞内促氧化血红素,产生胆红素的前体胆绿素(一种强力过氧化自由基清除剂)发挥抗氧化和细胞保护作用,HO-1的适度上调能够发挥强大的抗氧化和细胞保护作用。然而,HO-1的上调并不总是对细胞有益,因为血红素的消耗、胆红素的积累具有潜在毒性[27,28]。从分子角度来看,Nrf2/ARE信号通路的调控应处于稳态。这提示PCB2通过调节Nrf2/ARE信号通路保护神经元免于CYP诱导的氧化损伤。本研究显示,当采用LY294002抑制P13K的激活后,PCB2的保护作用被抵消,p-Akt蛋白表达由于LY294002的存在也发生改变。这些表明,PCB2对神经元的保护机制与激活P13K/Akt 信号通路,调控Nrf2/ARE信号通路密切相关。
PCB2处理组Nrf2及HO-1蛋白表达较Control组也呈现上调趋势,在应对内源性或外源性氧化应激时,有复杂的反应机制保护细胞免受氧化还原状态和能量代谢的改变[29]。一定水平的氧化应激可以诱导细胞防御信号通路的激活,这是程序性细胞生存设置的一部分,以平衡更严重的应激情况[30]。因此,PCB2处理组Nrf2与HO-1蛋白表达上调,对细胞是一种保护效应。
综上所述,我们认为PCB2通过激活P13K/Akt信号通路,调控Nrf2/ARE信号通路,抑制ROS产生,逆转MMP下降,保护CYP诱导的小鼠大脑皮层神经元氧化损伤。