蒙药七味清肝散抗肝纤维化的作用机制:基于UHPLC-TOF-MS和网络药理学方法
张春艳,颜羽昕,高晓阳,马月宏
内蒙古医科大学基础医学院,内蒙古自治区 呼和浩特010059
蒙药七味清肝散又称额力根-7,由蓝盆花、红花、香青兰、人工牛黄、瞿麦、石膏、五灵脂七味药材组成,其中起主要作用的为蓝盆花。蓝盆花蒙药名“陶森-陶日莫”又称“蒙古山萝卜花”,具有“燥协日乌素”、清肝热、止痛的功效[8,10];红花蒙药名“亢港乌拉干”、“弓谷玛”[11],具有保肝、调血脂、抗炎、阵痛、抗衰老的作用[12,13];香青兰蒙药名“毕日阳谷”[14],具有清胃热、泻肝火、止痛、止血、“燥协日乌素”的作用[15];人工牛黄具有抗炎、抗氧化、清热解毒、利胆保肝的功效[16];瞿麦蒙药名“高优-巴沙嘎”,在抗肝病毒、兴奋子宫平滑肌、扩张血管上具有重要作用[17,18];石膏蒙药名“道竹冈”,具有泻火、止渴、止痛、抗病毒的作用[19];五灵脂蒙药名“巴日格顺”,具有活血化瘀、调节三根、抗溃疡、清肝热、清胃热、“燥协日乌素”的作用[20]。
蒙药七味清肝散在蒙医实践中具有很好的抗肝纤维化作用,但具体机制尚不明确。因此,进一步阐明蒙药七味清肝散抗肝纤维化作用的药效成分和作用机制对肝纤维化的防治具有重要意义。目前大多数治疗肝纤维化的方法是突出对一个细胞或一个信号分子的作用,没有考虑到肝纤维化是一个复杂的过程[21]。随着科学技术的发展网络药理学把系统生物学、多向药理学和计算机分析技术,融合在一起,通过多层次阐明药物的作用机制,具有整体性,系统性的特点[22]。本文利用UHPLC-TOF-MS方法对蒙药七味清肝散的成分进行鉴定,运用网络药理学方法寻找多通路、多靶点,通过分子对接、动物模型实验和离体细胞实验明确蒙药七味清肝散抗肝纤维化的作用机制和其准确性。
1 材料和方法
1.1 材料
UHPLC-TOF-MS(岛津高效液相色谱飞行时间质谱仪器)、BT125Dd分析天平((Saryorius),KQ5200DE超声波清洗器(昆山市超声仪器有限公司)、Microfuge22R 台式高速冷冻离心机(Beckman Coulter)、M16710-33漩涡振荡器(Thermo Scientific)、蒙药七味清肝散(内蒙古天盛蒙中医责任有限公司),醋酸铵、甲酸、甲醇、超纯水;Masson三色染色试剂盒(索莱宝);RIPA裂解液(索莱宝)、苯甲基磺酰氟(PMSF)(索莱宝)、5×蛋白上样缓冲液(索莱宝)、、兔抗大鼠α-平滑肌肌动蛋白(α-SMA)抗体(博奥森);兔抗大鼠I型胶原蛋白(Collagen1)抗体(博奥森);兔抗大鼠甘油醛-3-磷酸脱氢酶(GAPDH)抗体(博奥森);兔抗大鼠磷脂酰肌醇3-激酶(PI3K)抗体(博奥森);兔抗大鼠蛋白激酶B(Akt)抗体(博奥森);Dylight 800标记的山羊抗兔免疫球蛋白G(IgG)抗体(Abbkine);AnnexinV-FITC细胞凋亡试剂盒(碧云天)、10%胎牛血清(Gibco)、DMEM高糖培养基(Gibco)。
1.2 方法
1.2.1 化学成分鉴定 称取蒙药七味清肝散0.3 g样品于15 mL离心管中,加入5 mL 50%甲醇浸泡4 h,40 ℃超声提取40 min,4 ℃,12 000 r/min下离心10 min,取上清液放于25 mL容量瓶,重复操作1次,将两次上清液合并到一起,摇匀,取10 μL 上清进液相检测。在含有0.1%甲酸,0.2 mol/L醋酸铵溶液-乙腈质谱条件下进行梯度洗脱。将UHPLC-TOF-MS的原始数据导入MSDLAL4.12软件进行预处理,其中主要包括提取、去噪音、反卷积、峰对齐等重要步骤,最后导出CSV格式。将提取的峰信息在MassBank,Respect,GNPS三个库进行全库检索和对比,从而得出可能的分子式。
1.2.2 关键靶点富集 在Pubchem数据库检索成分的结构,并在chemDrawV14.00.117软件中转化成Canonical SMILES结构,在Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/)筛选相关性≥70%作为蒙药七味清肝散相关靶点;在治疗靶点数据库(TTD)和GeneCards(https://www.genecards.org/)数据库筛选相关性≥60%作为肝纤维化相关靶点。蒙药七味清肝散相关靶点和肝纤维化相关靶点取交集后得到蒙药七味清肝散抗肝纤维化靶点。
1.2.3 网络构建分析 将蒙药七味清肝散抗肝纤维化靶点导入到STRING(https://www.string-db.org/)数据库,获得PPI互作信息,再将信息导入到Cytoscape3.6.0软件,应用Network Analyzer进行网络拓扑指标分析,筛选抗肝纤维化的核心靶点。为了清晰分析相关指标,将蒙药七味清肝散的活性成分、靶点、通路导入到Cytoscape3.6.0构建活性成分-靶点-通路网络图。
端村排闸,孔深15m。闸基高程6.9~7.9m为第②层壤土,构成地基直接持力层,具中等压缩性,微透水性,稳定性较好。高程6.9~5m为②2层砂壤土,具中等压缩性,中等透水性,渗透稳定性较差,具有液化潜势。高程5~-1.1m为第③3层粉砂、③4层细砂,饱和,中密,中等透水性,渗透稳定性较差,具液化潜势。
1.2.4 GO与KEGG富集分析 将蒙药七味清肝散抗肝纤维化靶点上传到Metascape 平台中筛选排名靠前的GO 和KEGG 关键信息,在微生信(http://www.bioinformatics.com.cn/)网站进行GO和KEGG富集分析可视化。
1.2.5 分子对接验证 在PDB(http://www1.rcsb.org/)数据库下载肝纤维化核心靶点,运用PyMOL软件对蛋白进行修饰,除去小分子和配体,保存为PDB格式。在Open Babel2.4.1软件获取蒙药七味清肝散活性成分的2D结构,将其保存为mol2格式,最后运用AutoDock平台进行分子对接验证。一般分子与靶点结合能低于0时,说明活性成分与靶点的结合活性高,抗肝纤维化作用越强。
1.2.6 动物模型实验验证 清洁级Wistar雄性大鼠60只,体质量160~180 g,7周,分为空白、HF模型组、蒙药七味清肝散低、中、高剂量组[135、270、405/(kg·d)];本药成人临床剂量为1.5~3.0 g/d,每个给药组剂量按照种属间剂量折算表进行,并按照成人剂量的1、2、3倍计算。进行给药。除空白组,其他组用2 mL/kg的50%四氯化碳花生油溶液灌胃,2次/周,10周,在造模的过程中,空白组和模型组均采用0.5%CMC-Na灌胃,对给药组进行灌胃,10周后取肝脏组织进行后续实验。
1.2.6.1 肝组织的病理学观察 取适量肝组织放在盛有4%甲醛的容器中固定48 h,把肝组织放入70%、80%、90%的梯度酒精及无水乙醇中进行脱水、石蜡包埋、切片后用Masson三色染色,并在显微镜下观察肝组织的形态。
1.2.6.2 Western blotting检测α-SMA、Collagen1、PI3K、Akt蛋白表达 将肝组织剪碎后加入PMSF,数分钟后加入RIPA,使其充分裂解并在12 000 r/min 下离心10 min,上清液测蛋白浓度后按照1:4加入5×蛋白上样缓冲液,100 ℃煮沸5 min,在-80℃冰箱中保存。通过电泳、转膜后用5%脱脂奶粉室温封闭1 h,加入一抗室温2 h孵育,TBST洗涤3次,10 min/次,室温孵育二抗1 h,TBST洗涤3次,10 min/次,进行显色。
1.2.7 离体细胞实验验证 Wistar大鼠20只、雄性、体质量150~170 g,分为空白组10只和七味清肝散给药10只组进行给药。将蒙药七味清肝散按照成人最低剂量10倍折算后的给药剂量为1350 mg/(kg/d),1次/d,第7天灌胃前12 h禁食,灌胃后在2 h内麻醉,采用负压血样采集容器进行腹主动脉取血,静止20 min,在3000 r/min下离心15 min,离心后得上清液在56 ℃水浴中灭活30 min,0.22 μmol滤膜过滤后得含药血清,保存于-80 ℃冰箱中。空白组用生理盐水灌胃,操作方法同前。
1.2.7.1 细胞培养 将HSC-T6细胞置于含有10%胎牛血清的DMEM高糖培养基,温度为37℃、5%的CO2培养箱中进行培养。
1.2.7.2 蒙药七味清肝散含药血清对HSC-T6凋亡的影响 设置无染色孔、单染孔、对照组、蒙药七味清肝散含药血清低、中、高剂量组,每组5个复孔。将HSC-T6贴壁培养12 h后,各组加入相应浓度(10%、15%、20%)的含药血清连续培养24 h,将细胞消化下来12 000 r/min离心5 min,弃掉上清液后加入AnnexinV-FITC结合液重悬细胞,加入AnnexinV-FITC混匀,加入PI混匀。室温孵育20min后进行流式检测。
1.3 统计学方法
本文采用SPSS22.0软件对数据进行分析。计量资料采用均数±标准差,大于两组比较采用单因素方式差分析,组间两两比较具有正态性和方差齐性后采用LSD检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 化学成分鉴定
根据总离子流图、一级和二级碎片信息得到化合物准确分子量。通过保留时间、质荷比、加合离子等鉴定出蒙药七味清肝散的化学成分。共鉴定出45个化合物,包括黄酮类、生物碱、香豆素、萜类、酚类、脂肪酸等(表1)。

表1 蒙药七味清肝散化学成分的UHPLC-TOF-MS鉴定Tab.1 Identification of chemical constituents of the Mongolian medicine Qiwei Qinggan Powder by UHPLC-TOF-MS
2.2 关键靶点的富集
将化学成分的Canonical SMILES 号输入Swiss Target Prediction选择物种为“Homo sapiens”,选取相关性≥70%作为蒙药七味清肝散化学成分相关靶点共159个,在GeneCards、TTD数据库输入“Hepatic Fibrosis”选取相关性≥60%作为肝纤维化相关靶点共1852个。通过Venny.2.1.0网站获得蒙药七味清肝散抗肝纤维化靶点62个(图1)。
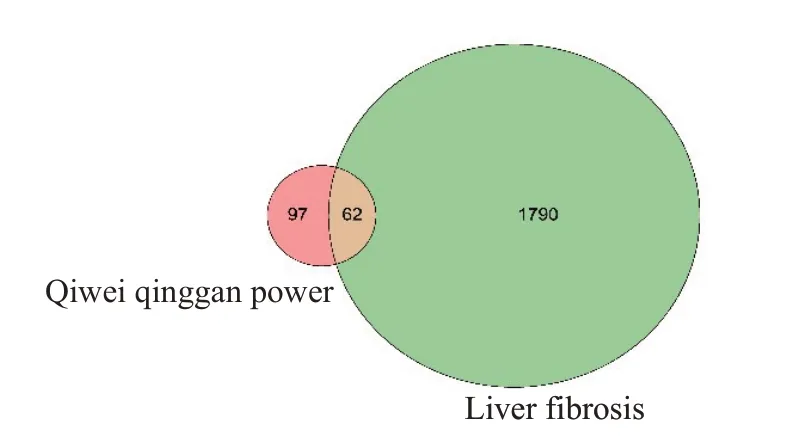
图1 成分相关靶点与疾病相关靶点韦恩图Fig.1 Venn plots of composition-related targets and disease-related targets.
2.3 PPI网络分析
将蒙药七味清肝散抗肝纤维化靶点上传至STRING数据库,选取“Multiple Proteins”模式,限定物种为“Homo sapiens”,置信度为0.9,得到PPI 互作信息。图中共有节点62个,133条边,平均节点度为4.29(图2)。“节点”代表靶点,“边”代表靶点与靶点之间相互作用关系,“combine score”代表边的粗细,combine score值越大,代表其结合度越强。
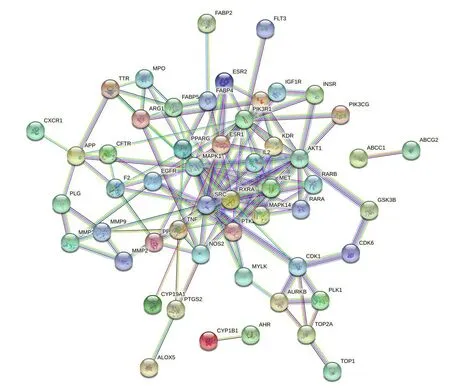
图2 蒙药七味清肝散抗肝纤维化的PPI网络Fig.2 PPI network of Qiwei Qinggan Power against liver fibrosis.
2.4 “活性成分-靶点-通路”网络构建
将蒙药七味清肝散的活性成分、靶点、通路导入到Cytoscape3.6.0 构建活性成分-靶点-通路网络(图3)。采用Network Analyzer计算网络拓扑参数,其中绿色代表靶点、红色代表活性成分、紫色代表通路。节点的大小由Degree值决定,由拓扑异构分析筛选节点紧密度(compactness)≥中位数3.1,Degree值≥2倍中位数8,节点中介中心性(Mediation centrality)≥中位数0.009,筛选出Akt1、PIK3R1、MAPK1、GSK3B、EGFR等10个核心靶点(表3)。根据Degree 值排序发现Quercetin、Luteolin、Kaempferol、Apigenin、Naringenin、Retinoic acid、Palmitic acid等活性相对较高。
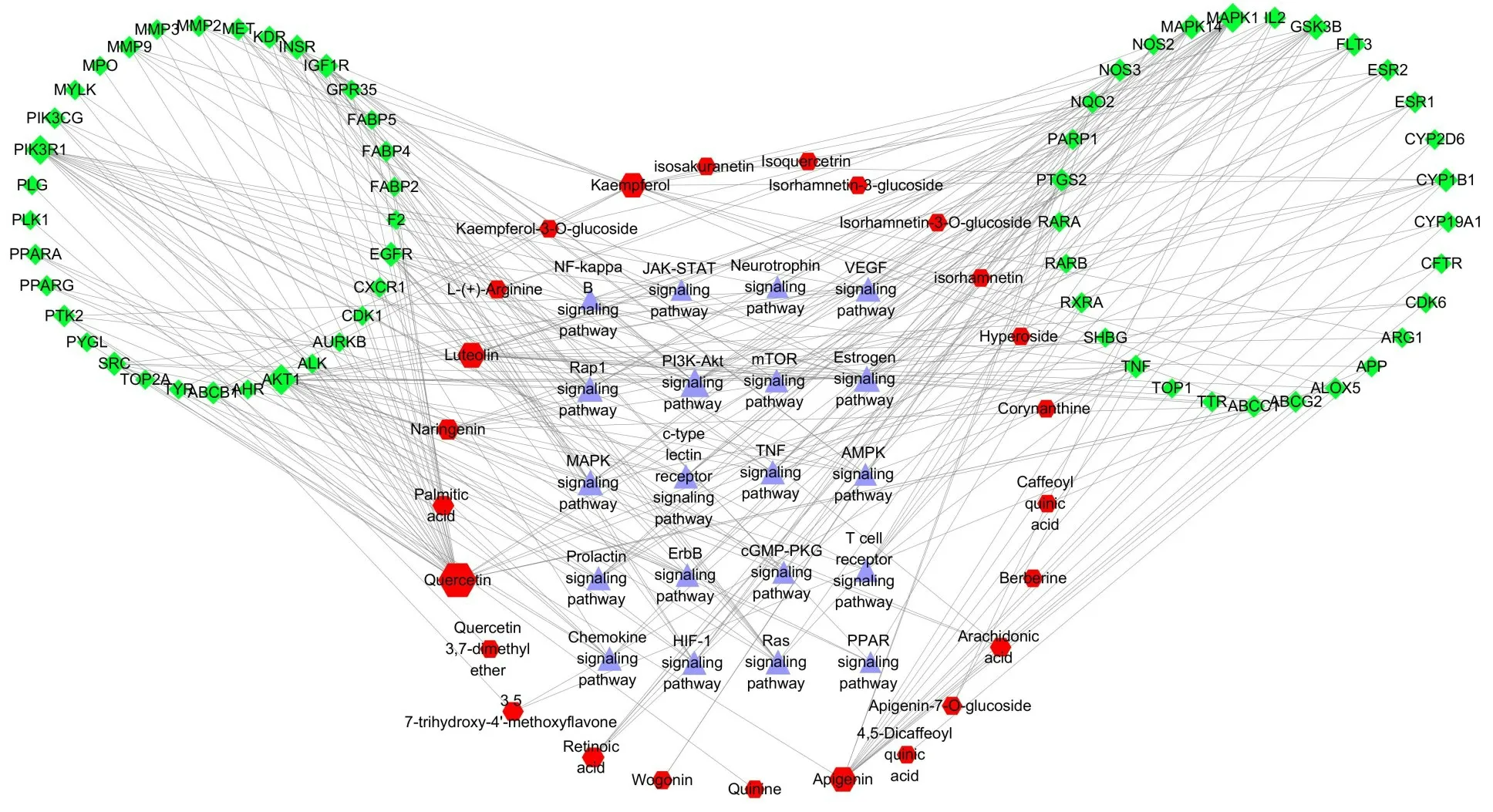
图3 蒙药七味清肝散抗肝纤维化的“活性成分-靶点-通路”网络Fig.3 The"Active Ingredients-Targets-Pathways"network of Qiwei Qinggan Power against liver fibrosis.

表2 蒙药七味清肝散抗肝纤维化的核心靶点Tab.2 Core targets of Qiwei Qinggan Power against liver fibrosis
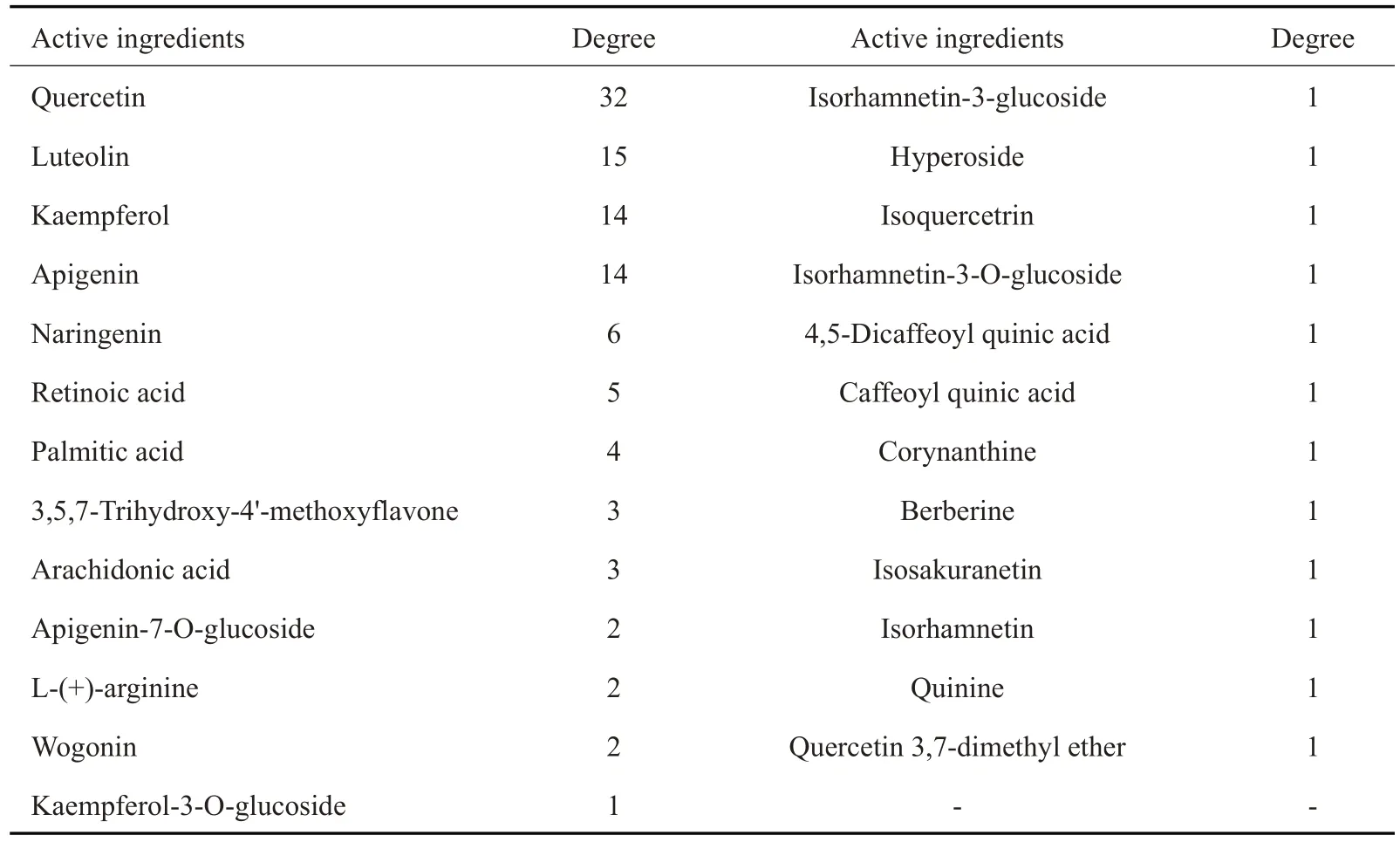
表3 蒙药七味清肝散活性成分参数Tab.3 Active ingredient parameters of Qiwei Qinggan Power
2.5 GO功能分析
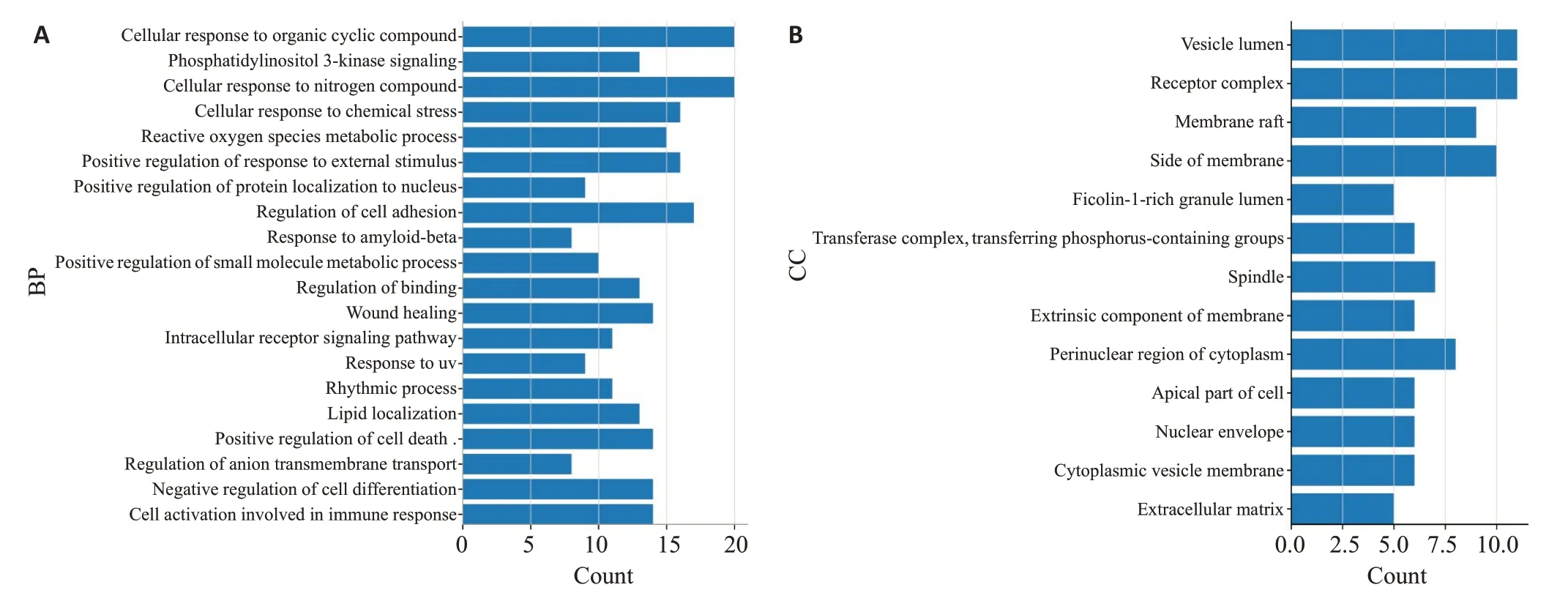
将蒙药七味清肝散抗肝纤维化靶点输入Metascape平台,进行GO注释分析,研究背景为“Homo sapiens”选择生物过程(BP)、细胞组分(CC)、分子功能(MF),并对每个组排名靠前的信息在微生信网站进行可视化分析(图4)。BP主要涉及转移酶活性的正调节、细胞的氧化应激反应、磷脂酰肌醇3-激酶信号通路。CC主要涉及膜微域组分、胞质囊腔、基质膜等组分。MF主要涉及跨膜受体蛋白酪氨酸激酶活性、核受体的活动、跨膜受体蛋白激酶活性等。

图4 BP、CC、MF生物功能富集Fig.4 Enrichment analysis of biological functions in terms of biological process (A),cell components (B),and molecular function(C).
2.6 KEGG通路分析
将蒙药七味清肝散抗肝纤维化靶点在Metascape平台进行KEGG通路富集分析,筛选出具有统计学意义的通路(P<0.05)。将排名靠前的20个通路在微生信网站进行可视化分析(图5),“纵坐标”代表信号通路名称,“气泡大小”代表基因的富集数目。这些通路主要涉及疾病信号通路、细胞凋亡、炎症相关通路。例如,PI3K/Akt信号通路、Rap1信号通路、MAPK信号通路都是典型的肝纤维化相关通路。
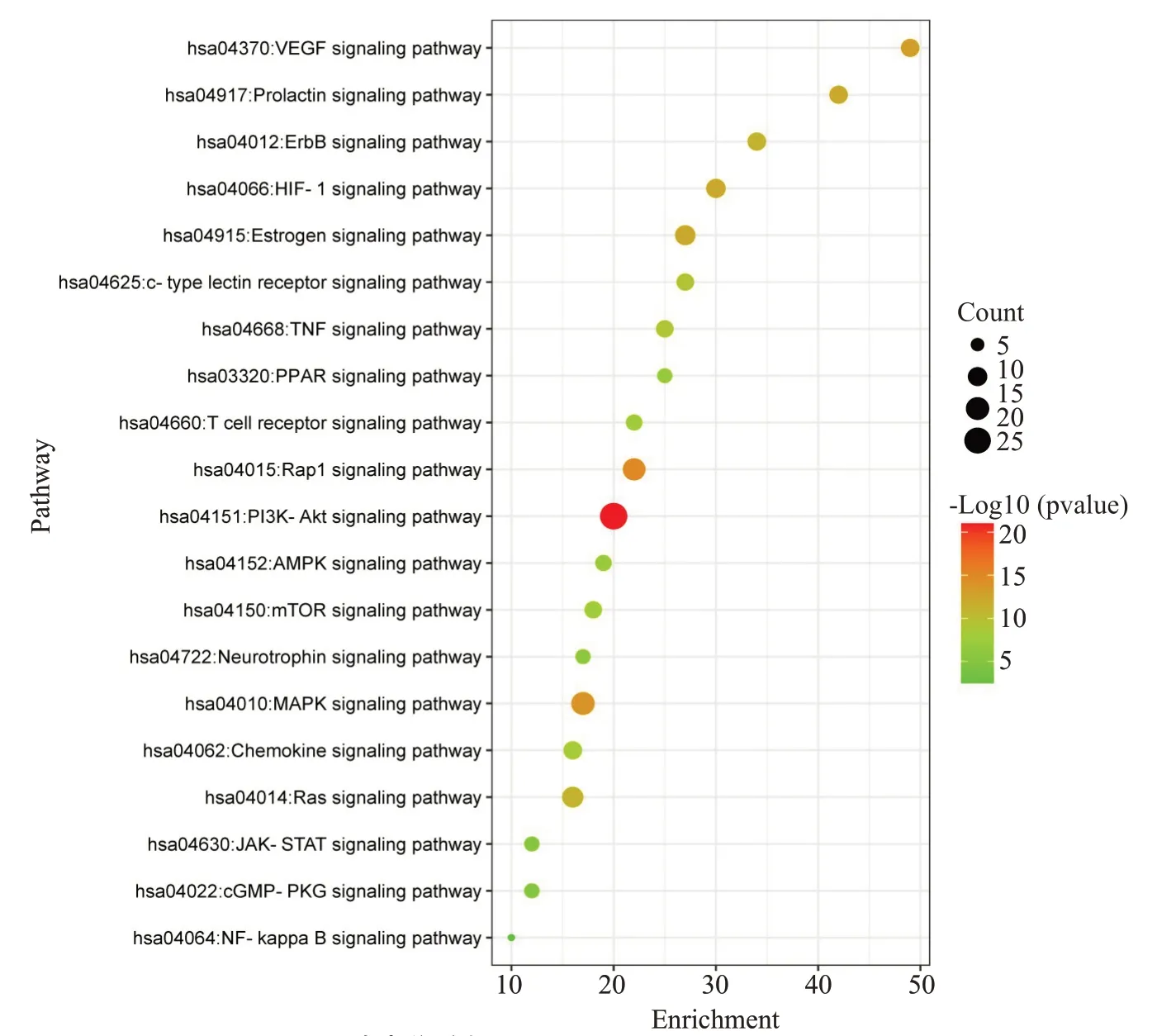
图5 KEGG通路富集分析Fig.5 KEGG pathway enrichment analysis.
2.7 分子对接
选取Degree 值排名靠前的3 个活性成分Quercetin、Luteolin、Kaempferol再选取Degree值排名靠前的3个靶点Akt1、PIK3R1、MAPK1进行分子对接验证。由对接结果可知(表5),Quercetin分别与Akt1、PIK3R1、MAPK1具有很好的结合性;Luteolin分别与Akt1、PIK3R1、MAPK1具有很好的结合性;Kaempferol分别与Akt1、PIK3R1、MAPK1具有很好的结合性。
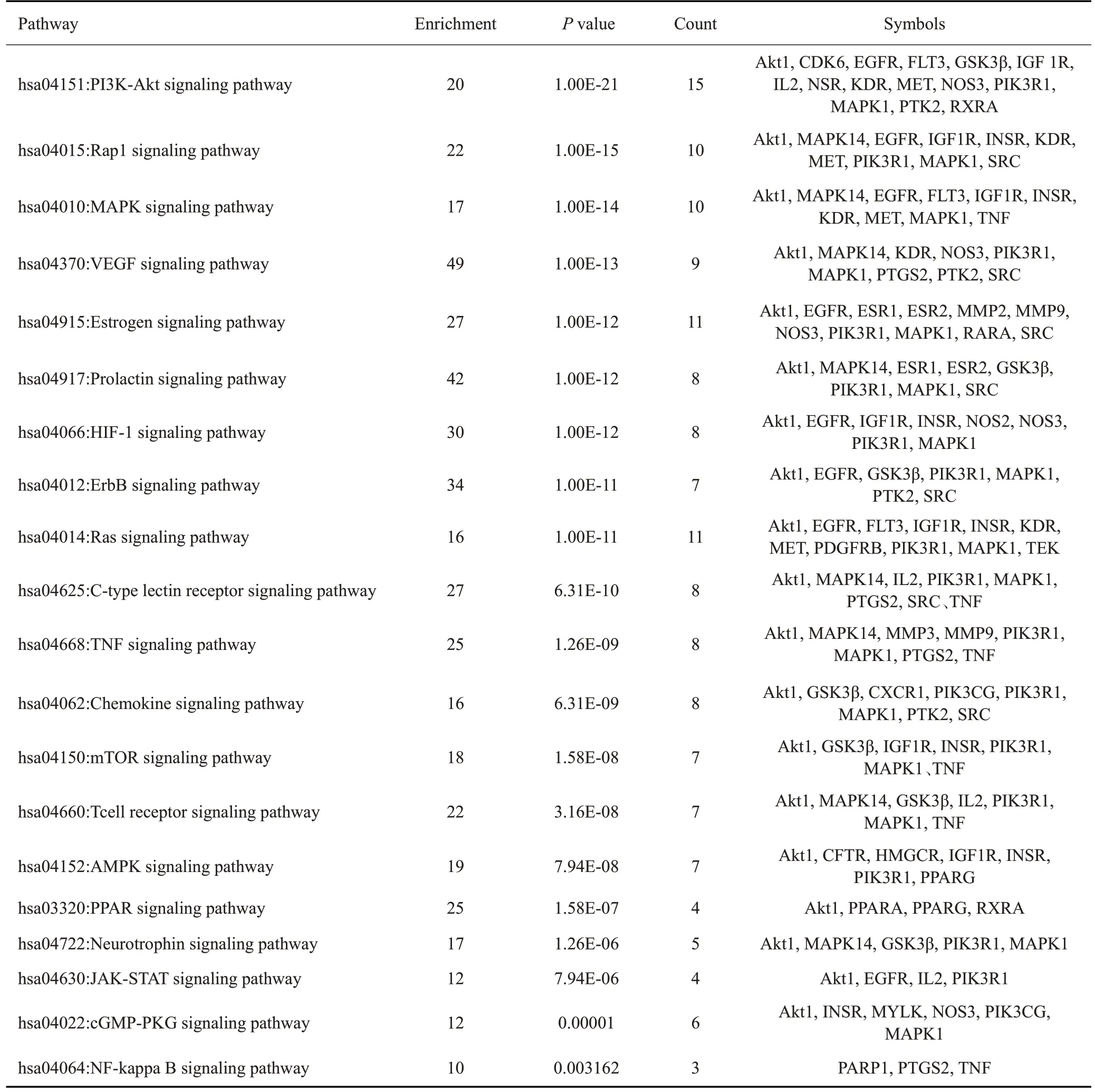
表4 蒙药七味清肝散抗肝纤维化信号通路Tab.4 Signaling pathways involved in the therapeutic mechanism of Qiwei Qinggan Powder against liver fibrosis
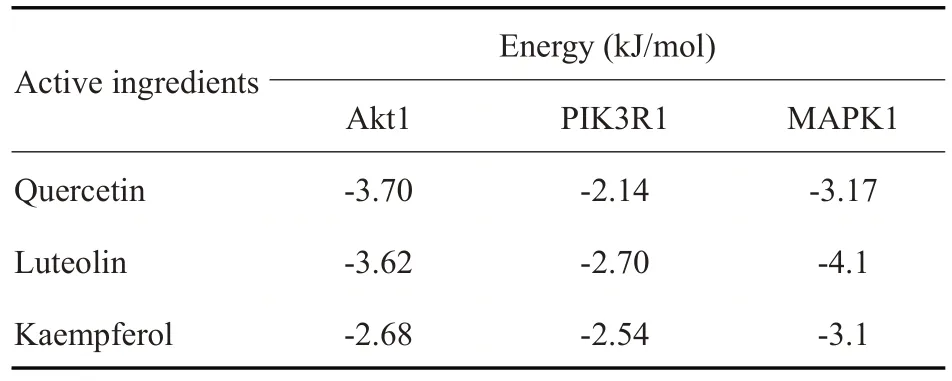
表5 活性成分与核心靶点对接结果Tab.5 Docking results of active ingredients and core targets
2.8 动物模型实验验证
2.8.1 肝组织病理学观察 通过Masson染色观察到空白组无纤维增生,模型组有大量胶原沉积,出现纤维增生。与模型组对比蒙药七味清肝散各治疗组病理改变有所恢复(图6)。
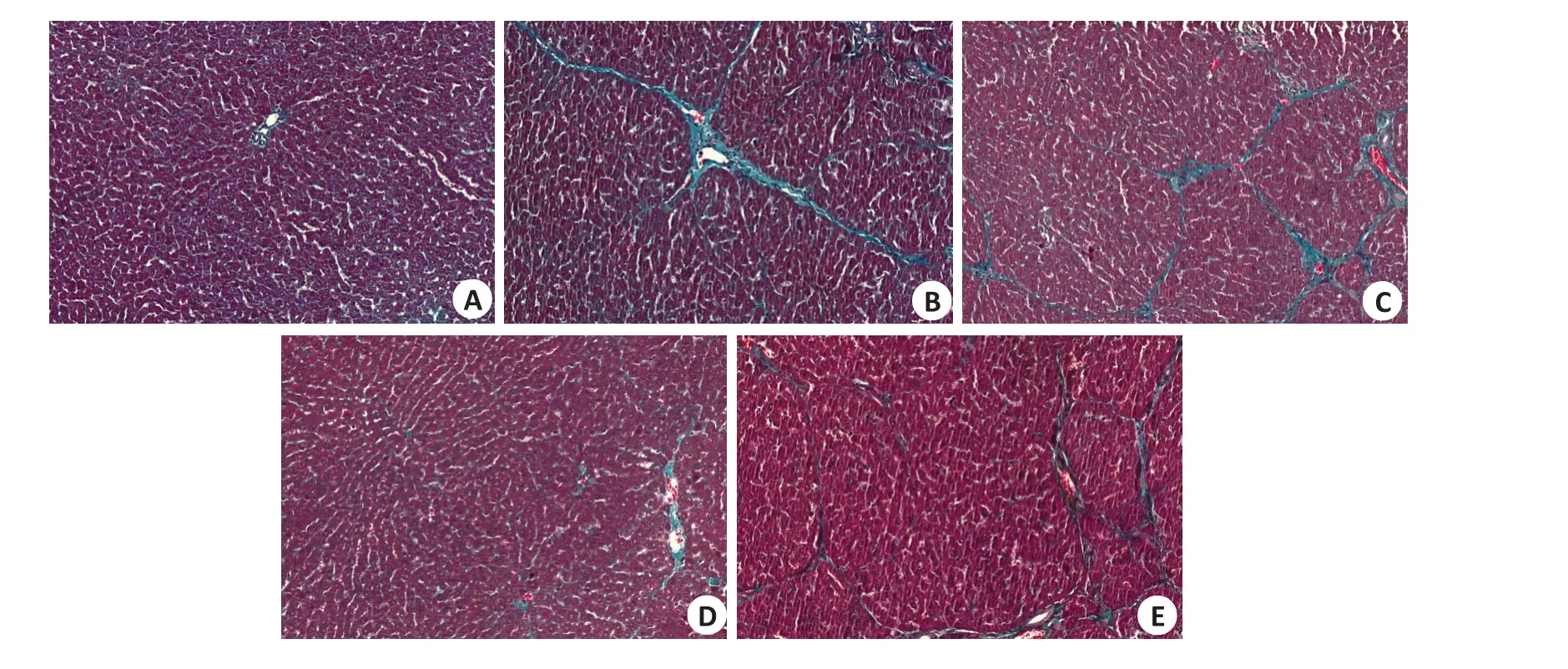
图6 蒙药七味清肝散对小鼠肝脏病理改变的影响Fig.6 Effect of Mongolian medicine Qiwei Qinggan Powder on pathological changes of liver in mice (Masson staining,original magnification:×200).A:Blank group.B:Model group.C:Low-dose group.D:Medium-dose group;E:High-dose group.
2.8.2 Western blotting 检测α-SMA、Collagen1、PI3K、Akt蛋白表达 根据KEGG通路富集和筛选出的核心靶点,对肝纤维化密切相关的PI3K/Akt信号通路中的PI3K和Akt蛋白进行验证,并对α-SMA和Collagen1进行验证,两者是大鼠肝纤维化的显著标志。与空白组比较,模型组肝组织中α-SMA(P<0.01)和Collagen1(P<0.01)蛋白表达量升高;与模型组比较,α-SMA在低、中(P<0.001)、高(P<0.001)剂量组表达量均明显下降,Collagen1在低(P<0.05)、中(P<0.001)、高(P<0.01)剂量组表达量均明显下降(图7)。
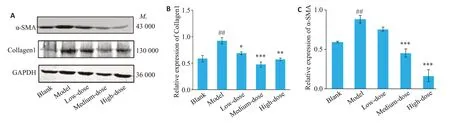
图7 不同剂量蒙药七味清肝散对肝组织中α-SMA和Collagen1表达的影响Fig.7 Effect of different doses of Qiwei Qinggan Powder on liver tissue α-SMA and collagen1 expression.A-C:Levels of α-SMA,Collagen1 were measured by western blotting and quantitatively analyzed(n=3/group).##P<0.01vs Blank group;*P<0.05,**P<0.01,***P<0.001 vs Model group.
与空白组比较,模型组肝组织中PI3K(P<0.001)、Akt(P<0.01)蛋白表达量明显升高;与模型组比较,PI3K、Akt(P<0.01)在低剂量组表达下降,PI3K(P<0.001)、Akt(P<0.001)在中剂量组表达显著下降,PI3K(P<0.001)、Akt(P<0.01)在高剂量组表达明显下降(图8)。
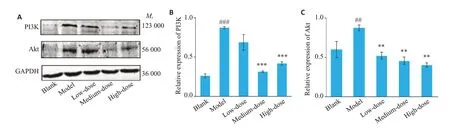
图8 不同剂量蒙药七味清肝散对肝组织中PI3K、Akt表达的影响Fig.8 Effect of different doses of Qiwei Qinggan Powder on liver tissue PI3K and Akt expression.A-C:Levels of PI3K,Akt were measured by western blotting and quantitatively analyzed(n=3/group).##P<0.01,###P<0.001 vs Blank group;**P<0.01,***P<0.001 vs Model group.
2.9 离体细胞实验验证
2.9.1 蒙药七味清肝散含药血清对HSC-T6凋亡的影响根据流式检测结果可知,含药血清与对照组比较,蒙药七味清肝散含药血清低剂量(P<0.01)组导致HSC-T6凋亡率增加,蒙药七味清肝散含药血清中、高剂量组(P<0.001)导致HSC-T6凋亡率明显增加。结果显示,蒙药七味清肝散含药血清的浓度越高抗肝纤维化作用越明显(图9)。
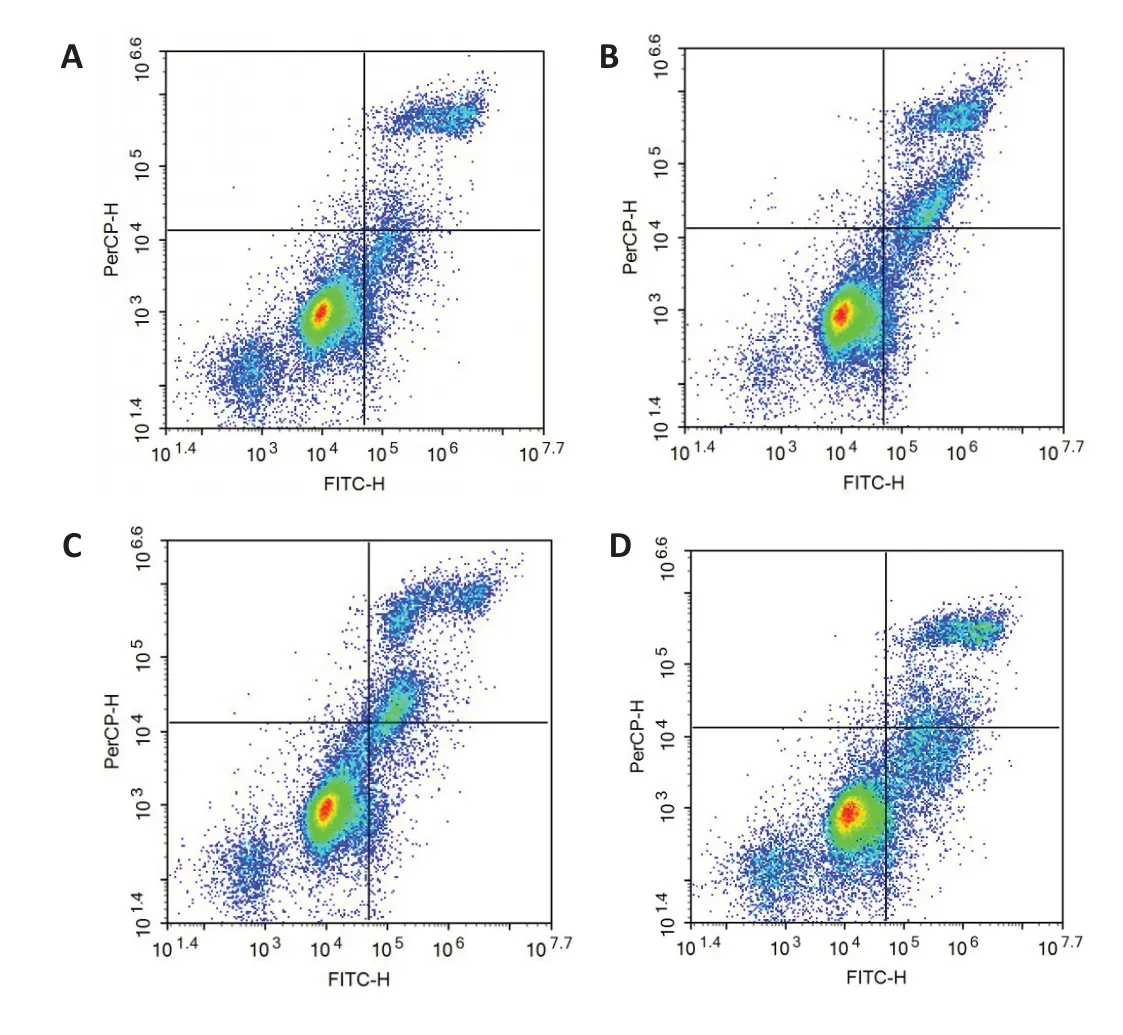
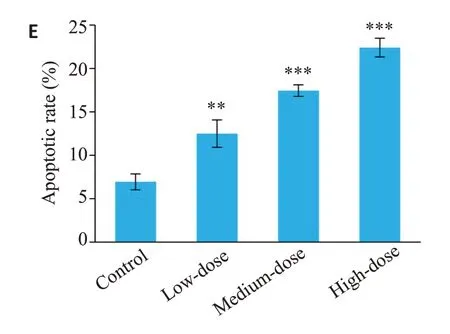
图9 蒙药七味清肝散含药血清对HSC-T6凋亡的影响Fig.9 Effect of serum from Qiwei Qinggan Power-treated rats on apoptosis of HSC-T6 cells (n=3).A:Control group.B:Low-dose group.C:Medium-dose group.D:High-dose group.E:Apoptotic rate.**P<0.01,***P<0.001 vs control group.
3 讨论
肝纤维化是慢性肝病常见的病理特征,是慢性肝损伤导致肝纤维化发生的原因之一[23]。各种化学和微生物因素都是导致肝纤维化发生的诱因[24],包括酒精、病毒、药物和自身免疫过程,而肝纤维化一旦发展成肝硬化将不可逆转[25]。在变成晚期肝硬化或肝癌之前,尽早寻找解决方案[26,27]。在目前的研究中没有直接减轻或者逆转肝纤维化的药物。
本文采用UHPLC-TOF-MS技术从蒙药七味清肝散中鉴定了45个成分,包括黄酮类、生物碱、香豆素有机酸、萜类、酚类、脂肪酸等。筛选出25个活性成分参与调控网络、其中排名靠前的Quercetin、Luteolin、Kaempferol等在网络中的影响较大并且在抗肝纤维化作用中具有显著作用。通过网络药理学分析得到10个蒙药七味清肝散抗肝纤维化的核心靶点(Akt1、PIK3R1、MAPK1、GSK3β、EGFR、INSR、MAPK14、CYP1B1、IGF1R、SRC)等。通过GO功能分析得出,BP主要涉及转移酶活性的正调节、细胞的氧化应激反应、磷脂酰肌醇3-激酶信号通路。CC主要涉及膜微域组分、胞质囊腔、基质膜等组分。MF主要涉及跨膜受体蛋白酪氨酸激酶活性、核受体的活动、跨膜受体蛋白激酶活性等。通过富集分析结果得出,PI3K/Akt、Rap1、MAPK、AMPK、PPAR信号通路都参与肝纤维化的发生发展。其中PI3K/Akt信号通路是重要的凋亡抑制信号转导通路,在胃癌[28]、宫颈癌[29]、肝癌[30]等肿瘤的生长代谢中发挥重要作用。PI3K被激活后可以激活下游Akt蛋白,Akt调节下游的凋亡基因,从而使凋亡基因失活,达到抑制细胞凋亡的目的[31]。结合图3活性成分-靶点-通路分析,在PI3K 通路中涉及到6 种关键活性成分(Apigenin-7-O-glucoside、Quercetin、Apigenin、Luteolin、Kaempferol、L-(+)-arginine)和15 个关键靶蛋白(Akt1、CDK6、EGFR、FLT3、GSK3β、IGF 1R、IL2、NSR、KDR、MET、NOS3、PIK3R1、MAPK1、PTK2、RXRA)。这些关键的靶蛋白主要参与物质代谢、细胞凋零和炎症等。
分子对接结果显示,Quercetin、Luteolin、Kaempferol分别与Akt1、PIK3R1、MAPK1具有很好的结合能。在动物模型实验中,通过Masson染色结果显示,蒙药七味清肝散减少肝细胞变性、肝细胞坏死、减少假小叶的形成,使纤维化的肝脏组织得到改善。同时,Western blotting结果显示,蒙药七味清肝散在体内能够减少α-SMA 和Collagen1 的蛋白表达量,能够降低PI3K/Akt通路中PI3K、Akt蛋白的表达。证实了蒙药七味清肝散是通过作用于关键通路中的关键靶点发挥抗肝纤维化作用。在离体细胞实验中,通过流式检测得出蒙药七味清肝散含药血清能够促进HSC-T6的凋亡率增加,在规定的范围内浓度越高HSC-T6凋亡率越高抗肝纤维化作用越明显。
综上分析,蒙药七味清肝散可以使纤维化的组织恢复正常。通过调控PI3K/Akt信号通路中的关键靶点起到抗肝纤维化的作用。七味清肝散的含药血清随着浓度的升高可以明显促HSC-T6 的凋亡。本研究采用UHPLC-TOF-MS联合网络药理学和实验验证的方法对蒙药七味清肝散抗肝纤维化作用机制进行了研究,证实了蒙药七味清肝散通过调控重要靶点,从整体协同发挥抗肝纤维化的作用。

