Bax抑制因子1可抑制体外培养的大鼠血管平滑肌细胞的钙化
陈韦任,杨 霞,周玉杰,马 茜,吴雪萍,沙 媛,钱 赓
1首都医科大学附属北京安贞医院心内12病房,北京市心肺血管疾病研究所,冠心病精准治疗北京市重点实验室,北京 100029;中国人民解放军总医院2第二医学中心心血管内科,3第一医学中心心血管内科,北京100853
血管钙化是动脉粥样硬化、糖尿病、终末期肾病等多种疾病的病理生理基础,它可以导致动脉粥样硬化斑块破裂、血栓形成等严重后果,是心血管疾病的重要危险因素[1-3]。血管钙化主要表现为血管硬度增加和顺应性下降,其机制和骨发育相似,是主动的、可以调节的过程[4-6]。研究发现血管钙化机制包括细胞凋亡、血管平滑肌细胞(VSMC)由收缩型向成骨样细胞表型分化、钙磷沉积、氧化应激等[7-11]。Bax抑制因子-1(BI-1)是抑制程序性坏死信号通路的关键性调节因子[12-14]。最新研究证实BI-1和心血管疾病密切相关[15-17]。心肌缺血再灌注损伤中,BI-1表达降低,细胞凋亡增加,而激活BI-1能下调线粒体分裂蛋白表达,保护线粒体结构和功能,抑制氧化应激和细胞凋亡,减轻再灌注损伤[18]。BI-1对血管钙化的具体作用目前尚不清楚。本研究通过建立VSMC钙化模型,观察钙化时BI-1的表达和BI-1对钙磷沉积、VSMC骨型分化和细胞凋亡的作用,为临床研究提供实验依据。
1 材料和方法
1.1 材料
雄性SD大鼠30只(中国人民解放军总医院动物试验中心提供),4周龄,体质量80~100 g;主要试剂:β磷酸甘油;氯化钙;磷酸盐缓冲液(PBS);胎牛血清(Hyclone);DMEM(Gibco);茜素红S染色试剂盒、碱性磷酸酶试剂盒(Sigma);钙测定试剂盒(北京中生北控生物公司);BI-1、骨形态发生蛋白2(BMP-2)、Runt相关转录因子2(Runx-2)、半胱氨酸天冬氨酸蛋白酶3(caspase-3)和β-肌动蛋白(β-actin)(Abcam)。动物实验规程已获批准,符合首都医科大学实验伦理委员会的伦理标准。
1.2 细胞培养、模型建立和实验分组
在洁净台内分离4周SD大鼠胸主动脉,剥去外膜,使用眼科剪将血管剪成小碎块(1 mm2)接种于细胞培养瓶中,置于10%胎牛血清和DMEM培养液中,在37 ℃、5%CO2孵箱中培养[19-21]。3~5 d换液传代1次。经免疫组织化学法和形态学检测VSMC纯度>95%。
VSMC钙化模型的制作:将细胞接种于6孔细胞培养板中,待细胞贴壁后加入10 mmol/L β磷酸甘油和7.2 mmol/L氯化钙诱导14 d,每隔2 d换1次液体[22,23]。
实验采用随机方法分为4组:对照组(10%胎牛血清的DMEM液培养14 d)、BI-1过表达组(过表达BI-1蛋白后,10%胎牛血清的DMEM液培养14 d)、钙化组(钙化培养基培养14 d)、钙化+BI-1过表达组(过表达BI-1蛋白后,钙化培养基培养14 d)。每组检测均重复6次实验。
1.3 BI-1过表达质粒的构建
建立BI-1过表达的重组质粒(江苏吉玛基因技术有限公司),将VSMC 接种至6 孔板,以脂质体Lipofectamine 2000转染BI-1,24 h后裂解细胞提取蛋白,使用Western blot法验证转染效果。
1.4 茜素红S染色
钙化诱导14 d后,使用4 ℃PBS缓冲液冲洗3次,多聚甲醛固定15~20 min,PBS冲洗3次。标本中加入l%茜素红S(1 g茜素红S,100 mL蒸馏水),室温下孵育20 min,PBS冲洗细胞3次,显微镜下观察红色钙化结节并拍照。
1.5 Western blot法检测蛋白的表达水平
建模成功后收集细胞,加入细胞裂解液,然后提取细胞总蛋白,使用BCA定量试剂盒检测蛋白浓度,计算各组上样量。常规进行8%聚丙烯酰胺凝胶(SDSPAGE)蛋白电泳,然后将蛋白转移至PVDF膜。5%牛奶封闭1 h后,加入一抗室温孵育30 min、4 ℃孵育过夜,洗膜后使用封闭液稀释的二抗室温孵育40 min。使用化学发光试剂与膜孵育后,暗室曝光,使用Image J软件对条带进行数据分析。
1.6 钙含量的测定
建模成功后,4 ℃PBS冲洗细胞3次,使用0.6 mol/L盐酸37 ℃孵育24 h进行脱钙处理,次日取上清液用于钙含量测定。收集细胞,加入细胞裂解液,提取上清液,BCA定量试剂盒进行蛋白测定。钙含量标准化数值=样品钙含量/样品蛋白含量。
1.7 碱性磷酸酶活性测定
钙化培养基诱导14 d后,4 ℃PBS冲洗3次,加入细胞裂解液裂解细胞,取上清进行测定。按试剂盒说明书加入缓冲液,37 ℃孵育30 min,终止液终止反应,测定405 nm范围内吸光光度值。BCA方法测定细胞总蛋白含量,然后用蛋白含量校正碱性磷酸酶含量。
1.8 VSMC凋亡检测(TUNEL法)
细胞爬片中加入4%多聚甲醛室温下固定30 min,1%Triton X-100液体通透打孔,爬片加入末端脱氧核糖核酸转移酶反应液混匀,冲洗3次后,加入标记液37 ℃反应30 min,荧光显微镜下观察照相。凋亡率=阳性细胞/总细胞数×100%。
1.9 统计方法
采用SPSS19.0软件对数据进行处理。计量资料用均数±标准差表示,组间作t检验分析,多组间采用单因素方差分析,计数资料以百分数表示,比较采用χ2检验,P<0.05认为差异有统计学意义。
2 结果
2.1 VSMC钙化中BI-1蛋白表达结果
Western blot结果可见随着钙化时间的延长,BI-1蛋白水平逐渐下降。钙化培养基诱导第3d,BI-1蛋白表达开始下降;诱导第7 d,BI-1蛋白下降明显,具有统计学意义(P=0.007),诱导第14 d 下降达到最低值(P=0.001),结果提示BI-1蛋白和钙化时间存在负反馈关系(图1)。
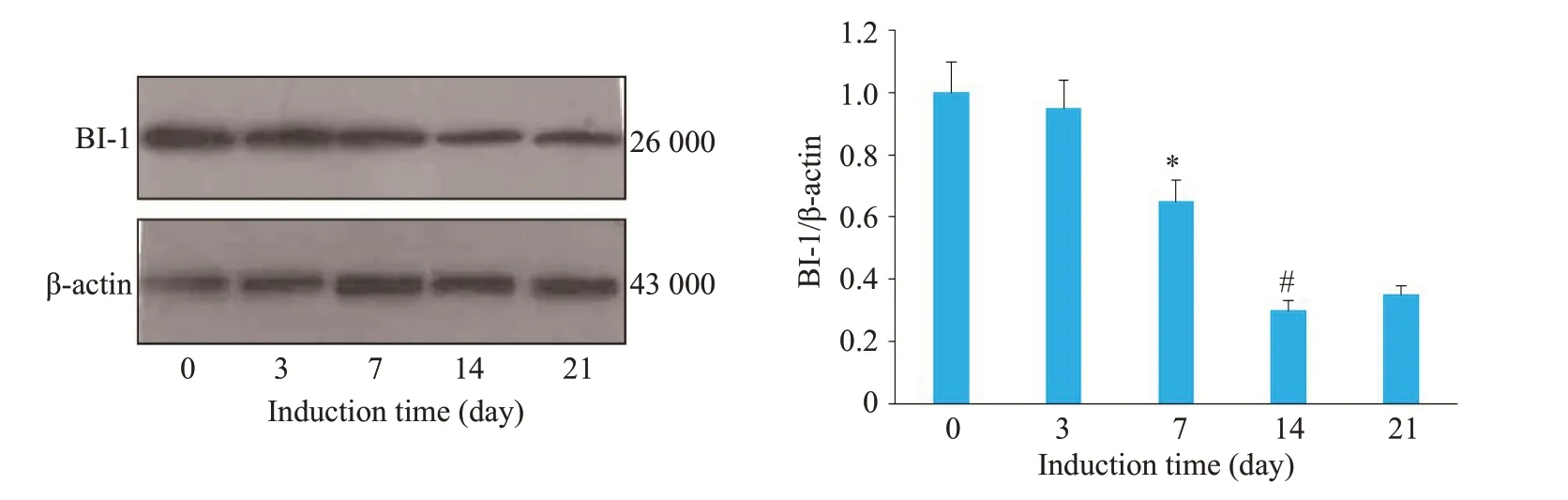
图1 钙化诱导后血管平滑肌细胞BI-1蛋白表达Fig.1 Expression of BI-1 protein in vascular smooth muscle cells with induced calcification.*P<0.01 vs 0 d,#P<0.01 vs 7 days.
2.2 过表达BI-1蛋白对细胞钙磷沉积的影响
钙化培养基诱导14 d后,钙化组茜素红S染色可见弥漫性红色钙化结节,而BI-1蛋白过表达后钙化被抑制,钙化结节消退(图2)。另外我们还测定了细胞钙含量和碱性磷酸酶活性。细胞钙含量结果提示,VSMC钙化后,钙含量明显增加,而过表达BI-1可以显著减少细胞钙含量(P=0.0002,图3)。碱性磷酸酶结果提示,VSMC钙化后,碱性磷酸酶活性明显增加,而BI-1过表达能明显降低碱性磷酸酶活性(P=0.0006,图4)。
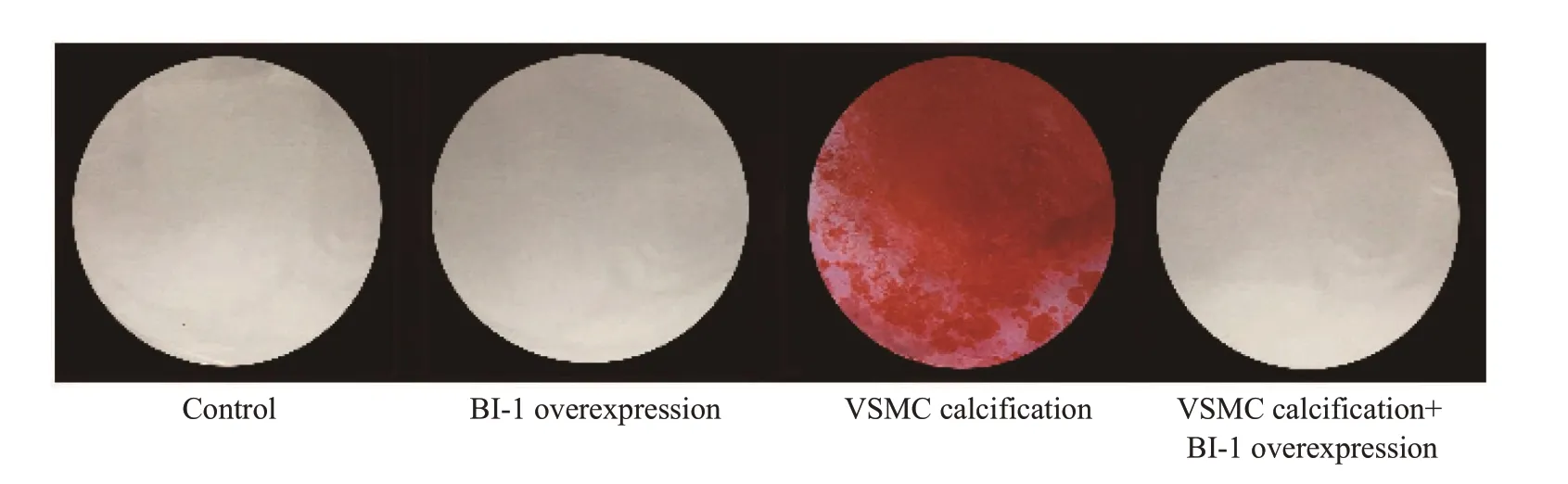
图2 各组血管平滑肌细胞茜素红S染色结果Fig.2 Alizarin red S staining of the cells in the 4 groups.
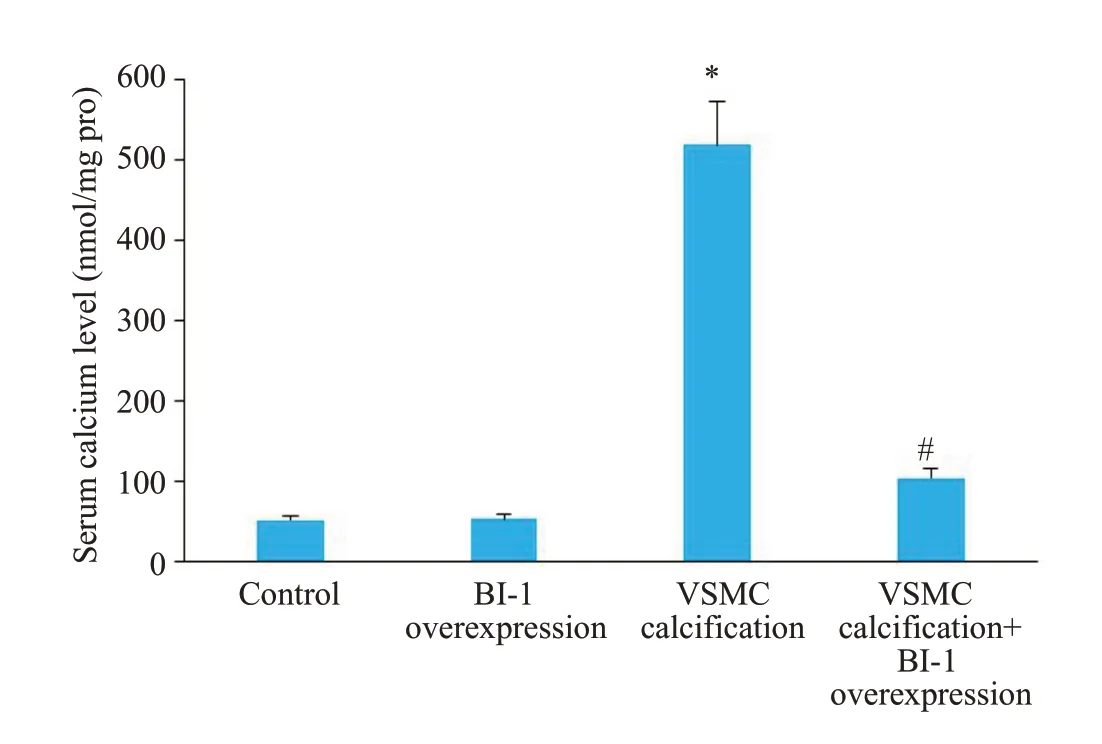
图3 各组血管平滑肌细胞钙含量Fig.3 Comparison of calcium content in the cells in the 4 groups.*P<0.01 vs control;#P<0.01 vs VSMC calcification group.
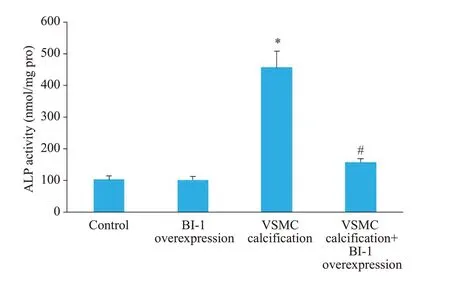
图4 各组血管平滑肌细胞碱性磷酸酶活性Fig.4 Comparison of alkaline phosphatase activity among the 4 groups.*P<0.01 vs control;#P<0.01 vs VSMC calcification group.
2.3 过表达BI-1蛋白对细胞骨型分化的影响
Runx-2和BMP-2是VSMC骨型分化重要标志性蛋白。Western blot结果显示,VSMC钙化后,Runx-2和BMP-2蛋白表达明显增加,BI-1过表达能抑制Runx-2(P=0.0003,图5)和BMP-2蛋白表达(P=0.0001,图6)。
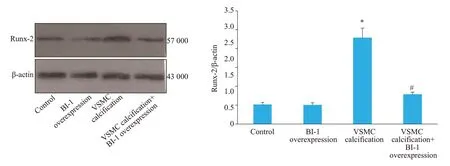
图5 各组血管平滑肌细胞Runx-2蛋白表达Fig.5 Comparison of Runx-2 protein expression among the 4 groups.*P<0.01 vs control;#P<0.01 vs VSMC calcification group.
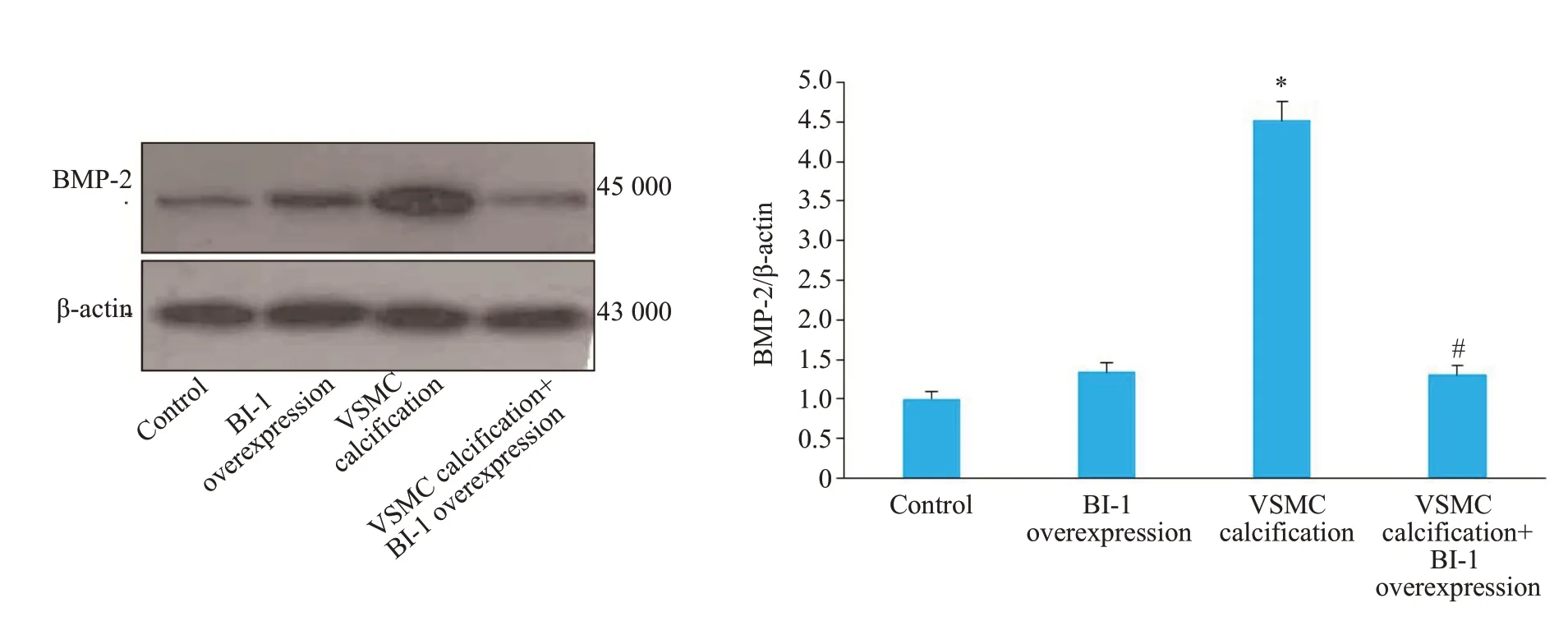
图6 各组血管平滑肌细胞BMP-2蛋白表达Fig.6 Comparison of BMP-2 protein expression among the 4 groups.*P<0.01 vs control;#P<0.01 vs VSMC calcification group.
2.4 过表达BI-1蛋白对细胞凋亡的影响
VSMC钙化后,细胞凋亡率明显升高,过表达BI-1能明显降低VSMC凋亡率(P=0.01,图7)。Western blot结果显示,VSMC钙化后,凋亡蛋白活化的caspase-3表达明显增加,而钙化+BI-1过表达组活化的caspase-3蛋白水平较钙化组明显减少(P=0.0003,图8)。
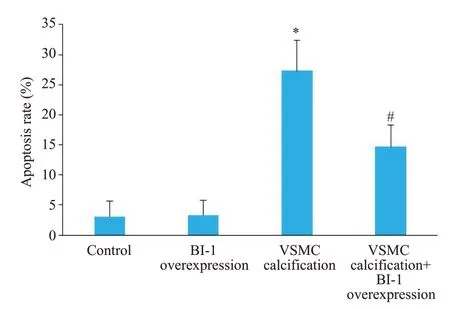
图7 各组血管平滑肌细胞凋亡率Fig.7 Comparison of apoptosis rate among the 4 groups.
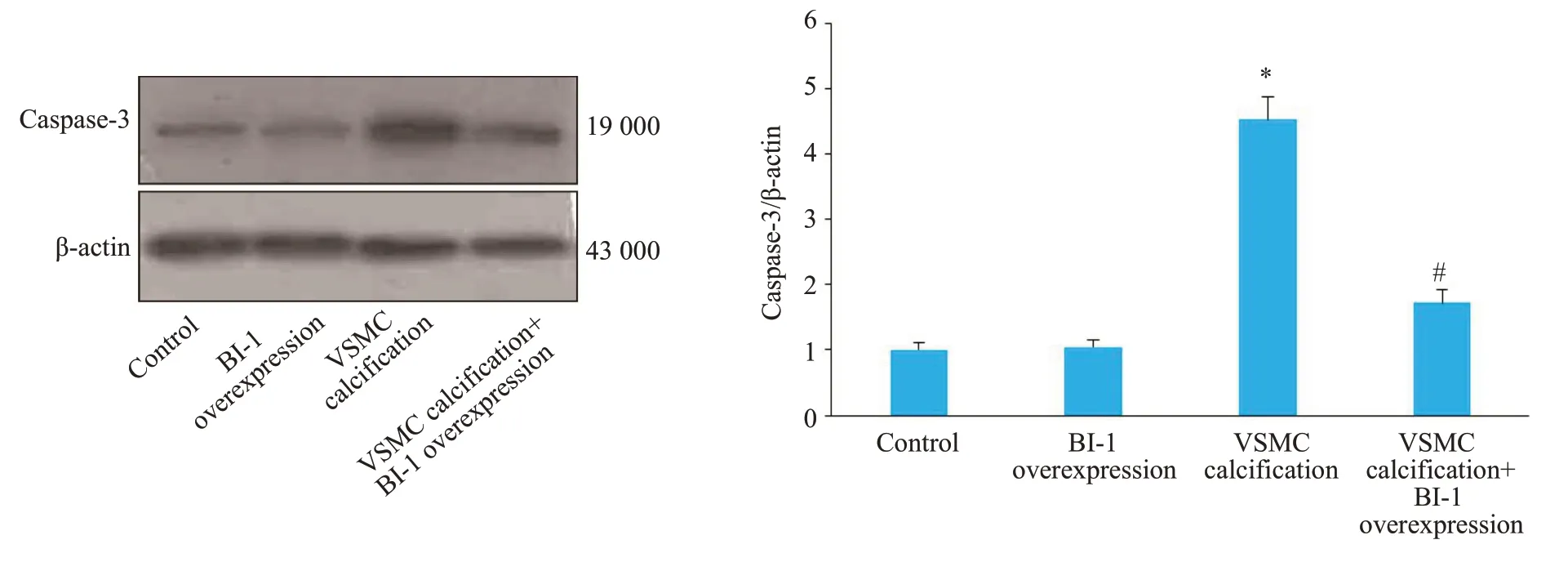
图8 各组血管平滑肌细胞活化的caspase-3蛋白表达Fig.8 Comparison of cleaved caspase-3 protein expression among the 4 groups.*P<0.01 vs control;#P<0.01 vs VSMC calcification group.
3 讨论
本研究结果发现,随着钙化时间的延长,BI-1蛋白水平逐渐下降,两者存在负反馈关系;另外BI-1表达下降,伴随着VSMC钙沉积、细胞凋亡和细胞骨型分化增加;而促进BI-1蛋白表达后,VSMC钙沉积、细胞凋亡和细胞骨型分化减少,血管钙化明显减轻。
Lisak等研究发现BI-1不仅可以减少细胞内质网钙浓度,还能降低细胞钙水平,保持细胞内钙稳态平衡[24]。大鼠免疫细胞敲除BI-1蛋白后,细胞内和内质网钙浓度明显增加,细胞坏死增多,免疫功能下降,而过表达BI-1后,细胞钙浓度恢复,免疫功能得以改善,可见BI-1调节钙平衡对免疫系统起到非常重要的作用[25]。Doycheva等认为BI-1能减少缺血缺氧引起的神经细胞凋亡。过表达BI-1能减少小鼠大脑梗死面积,抑制神经细胞凋亡,改善神经系统功能;沉默BI-1后,神经细胞凋亡增多,大脑梗死面积增加,神经系统功能恶化[26]。小鼠急性肾损伤模型中,BI-1表达下降,肾小管细胞凋亡增加,而促进BI-1表达后,肾小管细胞凋亡减少,炎症和氧化应激损伤减轻,肾功能明显改善[27]。近期研究发现BI-1对心血管疾病能起到保护性作用。心肌缺血再灌注损伤时,BI-1蛋白表达减少,而过表达BI-1能降低黄嘌呤氧化酶活性,减少线粒体活性氧爆发,抑制氧化应激,减少细胞凋亡,而抑制BI-1则加重氧化应激和细胞凋亡[28]。另一心肌梗死研究中,BI-1蛋白能抑制心肌细胞坏死,减少心肌梗死面积和改善心脏功能,而基因敲除BI-1后氧化应激增加,细胞凋亡加重,心肌梗死面积增加,心脏功能恶化[29]。本研究中,血管钙化时,BI-1表达下降,VSMC钙含量、细胞凋亡率和caspase-3分泌增多;而过表达BI-1 蛋白后,钙含量、细胞凋亡率和caspase-3分泌减少,血管钙化明显减轻。
血管钙化时,细胞凋亡能促进VSMC骨型分化,而抑制细胞凋亡则减少VSMC骨型分化,BMP-2蛋白表达明显下降[30]。另有研究发现肾脏透析患者VSMC凋亡诱发血管钙化,凋亡的VSMC通过囊泡释放羟基磷灰石促进Runx-2和BMP-2表达,进而诱发血管钙化[31]。本研究中,VSMC钙化后细胞凋亡增加,BMP-2、Runx-2表达增多,而促进BI-1蛋白表达后,BMP-2、Runx-2表达减少,血管钙化明显减轻,因此BI-1可能通过减少细胞凋亡抑制BMP-2、Runx-2表达,进而减轻血管钙化。综上所述,血管钙化抑制BI-1蛋白表达,加重细胞凋亡、钙磷沉积和VSMC骨型分化,而促进BI-1蛋白表达能抑制细胞凋亡、钙磷沉积和VSMC骨型分化,进而减轻血管钙化。由此可见,BI-1蛋白作为新的血管钙化调节蛋白,具有多重细胞保护作用,相信随着BI-1和血管钙化深入研究,将来一定为血管钙化诊断和治疗开辟新的途径。
该研究局限性在于缺乏更深机制研究和动物相关实验,比如BI-1是线粒体重要的调控蛋白,而线粒体融合蛋白(OPA1)/线粒体融合/自噬和血管钙化密切相关[21],BI-1是否通过该途径抑制线粒体损伤,进而减轻血管钙化。动物实验方面采用血管特异性BI-1过表达小鼠,建立血管斑块钙化模型,测定细胞钙含量、Runx-2、caspase-3等指标,明确BI-1的血管保护作用。另外BI-1能降低细胞钙水平,是否这一改变对细胞内外电位存在影响,进而对钙化产生作用,有待下一步深入研究。