8周有氧运动对Nrf2敲除鼠心肌纤维化的作用及机制
刘雨佳,白鹏云,张 磊,印 文
心肌纤维化可引起心肌僵硬、顺应性降低、收缩功能降低,从而降低了心脏功能。心肌的纤维化是引发心律失常的重要诱因,同时也是多种心血管疾病的共同病理过程。心肌纤维化主要表现为心肌组织中成纤维细胞的过度增殖和细胞外基质(extracellular matrix,ECM)中的胶原蛋白(Collagen)沉积过度[1]。心肌胶原蛋白以Ⅰ型和Ⅲ型为主。Ⅰ型胶原蛋白(Colla‐genⅠ)较粗,抗牵拉能力强,保持室壁的强度,约占心肌胶原总数的85%;Ⅲ型胶原蛋白(CollagenⅢ)较细,由于其较强的弹性和伸展性,在维持室壁的弹性方面起重要作用,在总胶原比例中约11%。心肌纤维化发生的分子基础主要体现在两个方面,一方面是胶原蛋白排列紊乱以及各型胶原蛋白比例失衡,另一方面是胶原蛋白表达水平异常增高[2]。研究证实,合成基质金属蛋白酶(matrix metalloproteinases,MMPs)是降解ECM的关键酶,基质金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinases,TⅠMPs)通过抑制MMP活性来调节其功能。在正常心肌组织中,MMPs和TⅠMPs维持着动态平衡,一旦MMPs和TⅠMPs比例失调,将会引起心肌纤维化的发生[3]。
研究[4]发现,氧化应激是诱发心肌纤维化的重要机制。体内活性氧(ROS)和抗氧化系统比例失衡引起氧化应激,ROS可以激活MMP,进而增加胶原纤维的生成和沉积,从而促进心肌纤维化的发展[5‐6]。核因子E2相关因子2(nuclear factor‐erythroid 2p45‐related factor 2,Nrf2)是细胞内的关键核转录因子,在调控细胞氧化还原状态中承担中枢调节作用,在多种疾病过程中起保护作用。在细胞受到氧化应激刺激时,Nrf2与胞浆蛋白伴侣分子Keap1(Keleh‐like ECH‐associat‐ed protein l)解离,从而被活化,转位进入细胞核,通过与抗氧化反应元件(antioxidant response element,ARE)相结合,启动多种抗氧化酶基因转录,促进醌氧化还原酶(NQO1)、血红素加氧酶1(HO‐1)等酶的生成。这些酶可以与细胞内多余的自由基发生反应,从而解除细胞的氧化应激状态[7]。Nrf2在防治心肌纤维化过程中的重要作用在多项研究中得到证实[8‐10]。
有氧运动对多种疾病的防治都呈现出有益的效果。有研究发现,有氧运动可以改善心肌纤维化,进而增强心肌功能[11‐12]。而有氧运动改善心肌纤维化的机制仍不明确。前期研究发现,长期有氧运动可激活骨骼肌内Nrf2,进而上调了抗氧化酶的表达,增强了机体抗氧化功能。而有氧运动是否通过Nrf2途径改善心肌纤维化?目前仍不明确。本研究以Nrf2敲除鼠为基础,建立有氧运动模型,以探讨Nrf2在有氧运动干预对心肌纤维化中的作用。
1 研究方法
1.1 研究对象
20只Nrf2基因敲除小鼠购自中国医学科学院医学实验动物研究所,8周龄,并采用同周龄野生型C57BL/6J小鼠(购自北京维通利华实验技术有限公司)20只作为对照,根据基因型随机分为野生安静组(WC)、野生运动组(WE)、敲除安静组(KC)和敲除运动组(KE),每组10只。动物饲养房内温度控制在22~24℃,室内湿度维持在40%~60%,全天24 h自然灯光照明,不限制饮食饮水,采用标准啮齿类动物常规饲料饲养。
运动训练采用小动物跑台跑步的形式。在正式训练前,WE组和KE组小鼠先进行1周适应性训练,坡度为0°,跑速为12 m/min(约75%最大摄氧量强度[13]),1次/天,每次15 min,共5次。正式训练采用相同跑速,5次/周,60 min/次,共8周。WC组和KC组小鼠不训练,笼中正常活动。
1.2 取材
所有取材距最后一次运动训练均间隔至少48 h。小鼠脱颈椎处死,打开胸腔,取小鼠心脏,采用生理盐水冲洗后称量重量,然后用锡纸包裹,标记并立刻投入液氮冷冻。然后转入超低温冰箱保存,用于后续实验。
1.3 全心质量指数测定
取材后的心脏进行称重,计算全心质量指数(全心重/体重×100)。
1.4 Western blot测定蛋白表达
将2.2中冻存的心肌组织置于离心管,加入的RⅠ‐PA蛋白裂解液和蛋白酶抑制剂。将心肌剪碎后,高速匀浆;4℃静置30 min,然后4℃下12 000 rpm离心30 min,取上清液备用。蛋白浓度采用BCA试剂盒测定。根据蛋白浓度计算蛋白上清液体积,以20μg作为每次电泳的总蛋白量。按照常规操作进行电泳样品制备、聚丙烯酰胺凝胶(SDS‐PAGE)电泳、转膜、5%BSA封闭2 h。加入用0.01 mol/L TBST稀释的一抗(Nrf2,1:200;CollagenⅠ,1:200;CollagenⅢ,1:200;MMP2,1:200;TⅠMP2,1:200;NQO1,1:500;HO‐1,1:1 000;GAPDH,1:500),室温脱色摇床上摇动孵育1 h,4℃孵育过夜;0.01 mol/LTBST漂洗3次,二抗孵育1 h。再次TBST漂洗3次,然后加入ECL化学发光液,通过荧光水平计算蛋白表达水平。
1.5 统计学分析
本研究中统计学处理均采用SPSS 22.0统计软件,数据采用平均值±标准误表示。研究中运动干预和基因型的主效应和双因素交互效应采用双因素方差分析。如果主效应不显著,干预方式或同种基因型单因素作用采用独立样本T检验,P<0.05表示有显著性差异,P<0.01表示有非常显著性差异。
2 研究结果
2.1 各组小鼠取材时全心质量指数
各组小鼠运动干预前体重无显著性差异,干预后取材时的体重、心脏重量和全心重量指数如表1所示,KC组小鼠体重显著低于WC组,而其余各组间无显著性差异。各组的心脏重量和全心重量指数无显著性差异。
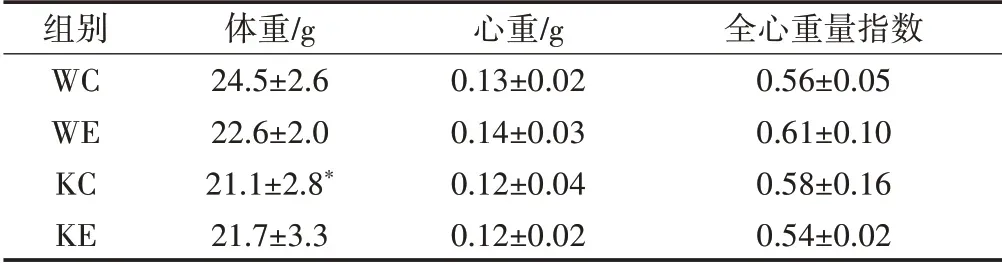
表1 各组小鼠取材时的体重、心脏重量和全心重量指数Table1 Body Weight,Heart Weight,and Heart Weight/Body Weight Index in Each Group
2.2 各组小鼠Ⅰ型和Ⅲ型胶原蛋白的表达
各组小鼠Ⅰ型和Ⅲ胶原蛋白的表达如图1和表2所示,与WC组相比,KC组CollagenⅠ表达显著增加,而KE组CollagenⅠ表达显著高于KE组,但野生型小鼠和Nrf2敲除小鼠的运动组与各自的安静组间均没有显著性差异。CollagenⅢ蛋白表达在各组间均无显著性差异。
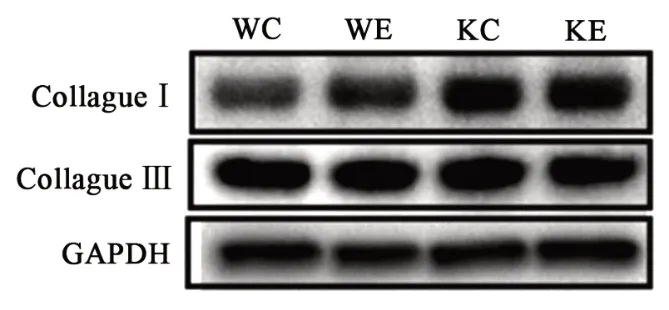
图1 Ⅰ型和Ⅲ型胶原蛋白的表达Figure1 The Expression of CollagenⅠand CollagenⅢ
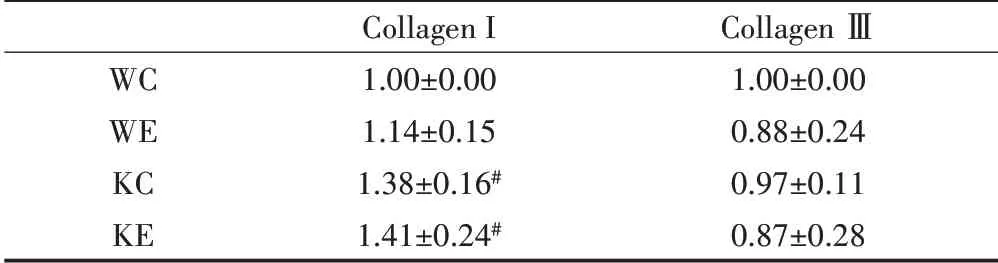
表2 Ⅰ型和Ⅲ型胶原蛋白的表达Table 2 The Expression of CollagenⅠand CollagenⅢ
2.3 各组小鼠MMP2和TIMP2蛋白的表达
如图2和表3所示,KC组MMP2表达显著高于WC组,KE组TⅠMP2表达显著高于WE组。与WC组相比,KC组TⅠMP2的表达显著增加,而KE组显著高于WE组。MMP2/TⅠMP2如表3所示,KC组和KE组分别较野生鼠的同种干预方式组显著升高,而同种基因型小鼠在运动干预后并没有呈现显著性差异。
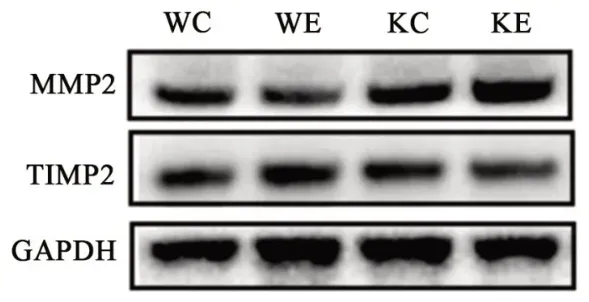
图2 MMP2和TIMP2蛋白表达Figure2 The Expression of MMP2 and TIMP2
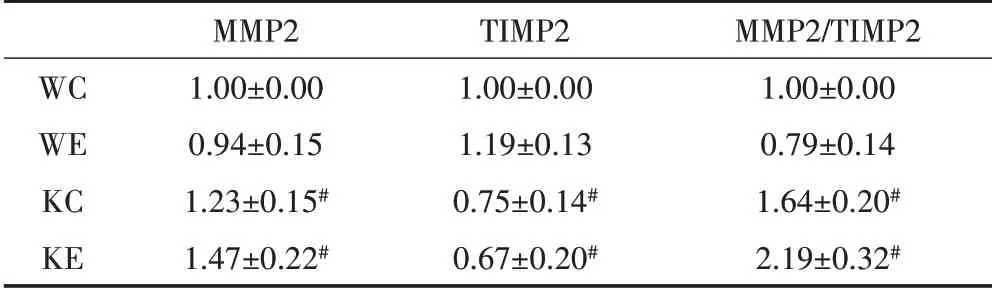
表3 各组小鼠的MMP2、TIMP2和MMP2/TIMP2Table3 The Expression of MMP2,TIMP2,and MMP2/TIMP2.
2.4 各组小鼠Nrf2的蛋白表达
各组小鼠心肌Nrf2的蛋白表达如图3和表4所示,与WC组相比,WE组显著增加,而KC组显著减少;KE组显著低于WE组,而KE组和KC组间无显著性差异。
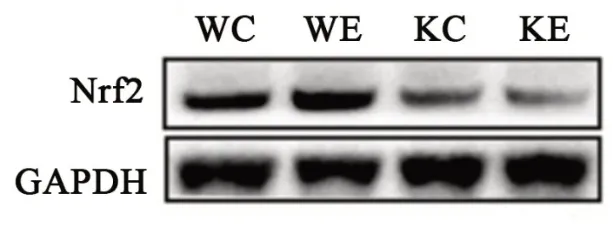
图3 各组小鼠Nrf2蛋白表达Figure3 The Expression of Nrf2 in Each Group

表4 各组小鼠Nrf2蛋白的表达Table4 The Expression of Nrf2 in Each Group
2.5 各组小鼠心肌抗氧化酶的表达
通过对抗氧化酶NQO1和HO‐1的蛋白表达检测发现,Nrf2敲除鼠NQO1和HO‐1蛋白表达均显著低于野生鼠的同种干预组,而有氧运动训练增加了野生鼠HO‐1的蛋白表达,而对于Nrf2敲除鼠无明显效果(见图4、表5)。
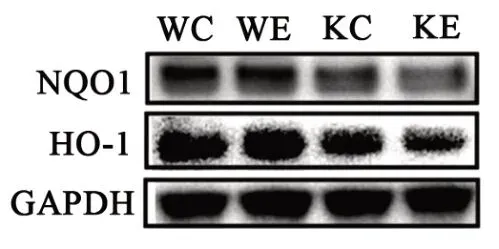
图4 各组小鼠NQO1和HO-1蛋白表达Figure4 The Expression of NQO1and HO-1 in Each Group
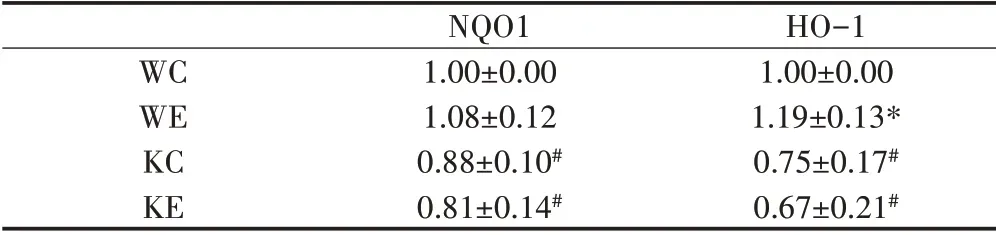
表5 各组小鼠NQO1和HO-1蛋白表达Table5 The Expression of NQO1and HO-1 in Each Group
3 分析讨论
通过对Nrf2敲除鼠胶原蛋白的研究发现,Nrf2的缺失引起了胶原蛋白含量的紊乱,以Ⅰ型胶原蛋白的含量增多为主,Ⅰ/Ⅲ胶原纤维比例失调。S.A.CAⅠ等人[8]的研究证实葛根素通过激活Nrf2,减轻了心肌纤维化;鸢尾素同样通过激活Nrf2,抑制了血管紧张素Ⅱ诱导的氧自由基(ROS)生成,减缓了心肌纤维化的进程[9];积雪草酸通过Nrf2/HO‐1和TGF‐β1/Smads信号通路抑制了自发性高血压大鼠的心肌纤维化[10];L.LⅠ等人[14]的结果显示,Nrf2激活可以通过抑制TGF‐β1/Smad3通路的激活改善心肌纤维化。这些结果均证明,Nrf2的激活可以改善心肌纤维化。本研究结果显示Nrf2的缺失直接影响了胶原蛋白的比例,从而影响了心肌纤维化的进程。
MMP2/TⅠMP2是导致心肌纤维化的可能机制,可作为判断心肌纤维化的标准。有研究[15]发现,MMP2与心肌纤维化的程度呈现明显的正相关。在本研究中发现,Nrf2敲除鼠的MMP2表达增加,且MMP2/TⅠMP2显著高于野生鼠。这一结果可能是由于Nrf2的缺失导致心肌内氧化应激状态失衡所引起的。A.D.KANDASAMY[5]等人的研究证实了MMP2可以受到氧化应激的激活,从而引起心肌损伤。L.DANG等人[16]研究也认为,ROS的生成是诱发MMP2表达增多的关键因素。ROS同时又促进了炎症反应的发生。炎症反应与心肌纤维化存在着密切的关系[17]。炎症细胞在炎症反应发生时,大量分泌ⅠL‐1β、TNF‐α和TGF‐β1等一系列炎症因子和促纤维化因子,成纤维细胞受到刺激而增殖,ECM的合成增强。如果ECM进一步的积聚,则促进了心肌纤维化的发生[18]。ROS可以通过作用于TGF‐β1/Smad通路促进ECM的沉积进而加重心肌纤维化[19]。Nrf2与纤维化的多项研究也呈现出与本研究相似的结果。Nrf2敲除鼠较野生鼠呈现出增多的MMP2表达和炎症反应,并且Nrf2在调节ECM降解过程中具有保护作用[20];Y.GUAN等人[21]证实了Nrf2通过ROS/TGF‐β1/Smad途径抑制了肠纤维化;Nrf2通过使ROS失活,降低了ROS对TGF‐β1的作用,从而在减轻器官纤维化过程中起保护作用[22]。因此综合推测,Nrf2的敲除引起细胞内氧化还原状态的失衡,ROS生成以及炎性反应增加,刺激了心肌内胶原蛋白紊乱,与心肌纤维化相关的MMPs/TⅠMPs比例失衡,从而促进了心肌纤维化的进程。
研究结果显示有氧运动可以促进心肌Nrf2的表达,且有氧运动可以增强下游抗氧化酶HO‐1的表达。而对于Nrf2敲除鼠,有氧运动对抗氧化酶的作用并不显著,由此说明有氧运动对HO‐1的激活是Nrf2依赖性的。S.S.GOUNDER等人[23]通过6周中等强度的跑台运动训练发现,有氧运动增强了青年小鼠心肌Nrf2的表达,抗氧化酶NQO1、HO‐1和过氧化氢酶(CAT)表达也增加,并且有氧运动训练同样增强了老年小鼠心肌Nrf2的表达,抗氧化酶CAT和谷胱甘肽还原酶表达受到有氧运动的增强;M.SUN等人[24]采用8周中等强度跑台运动训练发现,有氧运动训练增强了SD大鼠心肌Nrf2的作用,NQO1、CAT和SOD表达增加;有氧运动对衰老心肌Nrf2和抗氧化系统的增强效果也得到了证实[25]。这些都与本研究结果相一致。有研究证实,有氧运动可以改善心肌纤维化的进程。X.XU等人[26]研究结果显示,运动可以可改善MMPs和TⅠMPs之间的平衡,减轻了心肌纤维化并维持心肌梗死后的心脏功能;N.MA等人[27]通过对老年大鼠进行12周中等强度有氧运动发现,运动通过增强心肌H2S的生物活性改善了衰老引起的心肌纤维化;L.XⅠAO等人[28]采用间歇性的研究也发现,运动可以抑制TGFβ通路,导致心肌组织纤维化和瘢痕形成减少;P.H.LⅠAO等人[29]采用游泳的运动干预方式同样证明了运动训练可以减轻衰老引起的大鼠心脏的心脏炎症,肥大和纤维化损伤;尹懿等人[30]在高血压模型中也证实,有氧运动可以改善高血压诱导的心肌纤维化;H.WANG等人[11]的研究结果显示,运动训练可以通过激活PGC‐1α和Akt通路改善了糖尿病模型小鼠的心肌纤维化;在肥胖小鼠模型中也发现运动对心肌纤维化的显著改善[31‐32]。在本研究中有氧运动并没有显著改善Nrf2敲除鼠的心肌纤维化,这说明有氧运动对心肌纤维化的作用可能对Nrf2具有依赖性,也可能有氧运动对Nrf2缺失引起的心肌纤维化无显著作用。因此,Nrf2在有氧运动对心肌纤维化的调节作用仍待于进一步研究。
4 结论与建议
Nrf2的缺失能够引起胶原蛋白紊乱和MMPs/TⅠMPs比例失衡,促进小鼠心肌纤维化的进程;有氧运动可以增强Nrf2及其下游抗氧化酶表达,这一机制可能在有氧运动改善心肌纤维化过程中起决定性作用。
为进一步验证Nrf2通路在有氧运动对心肌纤维化的决定性作用,建议在今后的研究中通过构建心肌纤维化的有氧运动模型,检验Nrf2通路在其中的作用以确认其作用,并对其机制进一步探索,为运动改善心肌纤维化提供充分依据。

