肿瘤外泌体促进高糖难愈创面的愈合*
张 超, 李晨辉, 王晓林, 陈层层, 马家豪, 孙彤彤, 贾增宇, 南文滨
(新乡医学院生命科学技术学院纳米生物医用材料研究中心,河南新乡453003)
创面愈合是一个复杂的动态过程,受到多种因素的影响,包括细胞迁移、增殖和血管生成等[1-2]。慢性顽固性创面可由多种因素引起,如高龄、营养不良、糖尿病、感染、压力和药物治疗[3-4]。糖尿病足溃疡引起的截肢和死亡率在逐年上升。糖尿病伤口的病因包括高血糖引起的内皮功能障碍和血管生长受到抑制[5],以及成纤维细胞增殖和迁移减少等[6]。而成熟的血管网络需要细胞迁移和增殖、胶原合成和沉积的协调统一[7]。因此,增加创面部位新生血管的形成有利于伤口部位的细胞迁移、增殖和胶原沉积,从而加速糖尿病伤口的愈合。
外泌体(exosomes)是细胞分泌的一种直径约为40~150 nm的囊泡,能通过将原细胞内含的mRNA、miRNA和蛋白质转移到靶细胞的方式参与细胞交流。近年来多项研究表明,肿瘤细胞分泌的外泌体(即肿瘤来源的细胞外囊泡,tumor-derived extracel⁃lular vesicles,tEVs)在肿瘤的发生、发展及转移过程中发挥了重要的作用。有研究指出胶质母细胞瘤分泌的外泌体可以促进内皮细胞的增殖,而且含有丰富的血管生成相关蛋白,能有效促进新生血管生成;黑色素瘤来源的外泌体中也含有血管内皮生长因子(vascular endothelial growth factor,VEGF)、白细胞介素6(interleukin-6,IL-6)、基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)等血管生成相关蛋白[8-9]。基于此,我们设想将tEVs的这些调控功能应用于皮肤组织缺损的修复过程,希望其也能发挥相关的调控作用,并进一步促进皮肤组织修复。本研究以此为切入点,评价小鼠乳腺癌4T1细胞分泌的外泌体对糖尿病小鼠难愈创面愈合过程的影响,探讨其作用机制及应用潜能。
材料和方法
1 动物
本研究所用动物为C57BL/6(C57)雄性小鼠,6~7周龄,购自河南斯克贝斯生物科技股份有限公司,许可证号为SCXK(豫)2020-0005。小鼠乳腺癌4T1细胞、小鼠成纤维细胞系L929和人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)均购自武汉普诺赛生物科技有限公司。
2 主要试剂和仪器
DMEM高糖培养液、RPMI-1640培养液、0.25%胰蛋白酶、BCA蛋白检测试剂盒、苏木精-伊红(he⁃matoxylin-eosin,HE)染色液、抗CD9抗体、抗TSG101抗体和抗CD31抗体购自Servicebio;胎牛血清购自Scitecher;无外泌体血清购自SBI;链脲佐菌素(strep⁃tozocin,STZ)购自源叶生物科技公司;Matrigel购自BD。透射电子显微镜购自Hitachi;低温高速离心机和多功能酶标仪购自Thermo;超高速离心机购自Beckman Coulter;血糖仪购自Roche。
3 主要方法
3.1 细胞培养 4T1细胞在含10%无外泌体血清的RPMI-1640培养液中培养。L929细胞用含有10%胎牛血清的DMEM高糖培养液,在37℃、5%CO2的细胞培养箱中培养,培养液中均含有1×105U/L青霉素和100 mg/L链霉素。
3.2 细胞外泌体的分离及鉴定 采用超速离心法分离tEVs。将4T1细胞上清液于300×g、4℃离心10 min,弃去细胞沉淀,保留上清液;然后2 000×g、4℃离心10 min,保留上清液;10 000×g、4℃离心10 min,保留上清液;再用0.22µm滤膜过滤,然后将上清液转移到超高速离心管中,140 000×g、4℃离心120 min,去掉上清液后用4℃的PBS重悬沉淀,140 000×g、4℃离心120 min,去掉上清液,最后用50µL的PBS重悬沉淀,−80℃保存备用。用透射电镜检测tEVs的形态及分布;Western blot检测tEVs相关蛋白的表达。
3.3 CCK-8法检测tEVs对L929细胞活力的影响将L929细胞按每孔2×103个接种到96孔板中,每孔加90µL无血清培养液。实验组加入10µL浓度为100 mg/L的外泌体;对照组加入等体积的PBS;没有细胞的一组作为空白组,每孔只加100µL无血清培养液。每组做5个复孔。培养1、2、3、4和5 d后,分别向每孔中加入100µL含10%CCK-8的培养液,将孔板放入培养箱中孵育2 h后,用酶标仪测定450 nm处的吸光度(A)并计算出每组的平均值。
3.4 划痕法检测tEVs对L929细胞迁移能力的影响 将处于对数生长期的L929细胞以2×108L−1的密度接种于6孔板,加入2 mL含10%胎牛血清的DMEM培养液在37℃细胞培养箱中培养,当融合度达到80%以上时,用200µL的枪头轻轻在孔板底部均匀划一道痕迹,PBS清洗滑脱的细胞,再加入含有tEVs(100 mg/L)和PBS的2 mL无血清培养基与之共培养。在第0、6和24 h时进行拍照,每组做3个复孔。
3.4 Matrigel实验检测HUVEC小管形成 96孔板中加入60µL左右Matrigel充分摇匀,37℃孵育60 min使Matrigel充分凝固。实验组向Matrigel包被过的孔板中加入100µL tEVs(100 mg/L)和HUVECs混合的细胞悬液,每孔约(1~2)×104个细胞,对照组加入等体积的PBS。8 h后显微镜下观察成管情况,通过Image-Pro Plus 6.0软件计算形成总分支点和总管数来判断tEVs促进HUVECs成管的能力。
3.5 小鼠高血糖难愈创面模型的建立及治疗 本实验使用6周龄雄性C57小鼠20只,体重约为18~22 g。小鼠腹腔注射STZ(55 mg/kg),连续注射5 d,注射前一天晚上,小鼠禁食不禁水;注射当天开始,小鼠改为高糖高脂饮食并持续到实验结束。STZ诱导3 d后检测血糖水平,当血糖水平高于16.67 mmol/L时,视为成功的高血糖动物模型。将STZ诱导成功的小鼠用4%水合氯醛麻醉,用脱毛膏给小鼠背部皮肤脱毛,之后用无菌手术剪在小鼠背部剪切出均匀的直径约为0.7 cm的全层皮肤创面。将小鼠分为:(1)tEVs组:在第0、3和6天时,向高糖小鼠创面四周皮下注射0.2 mL含100µg tEVs的PBS;(2)对照组(PBS组):在同样的时点向高糖小鼠创面四周皮下注射0.2 mL的PBS。在创面建立的第1、7、18和25天,拍照并记录小鼠创面的愈合情况。在第7和14天时取小鼠新生皮肤用于后续实验的研究。
3.6 组织学和免疫荧光分析 在第7和14天每组取3只小鼠,颈椎脱臼处死后取小鼠创面组织,4%的多聚甲醛固定,分别用70%、80%和90%的乙醇及无水乙醇脱水,二甲苯透明,石蜡包埋,制备4~7µm厚的切片进行HE染色,评估伤口愈合情况;CD31进行免疫荧光染色,观察各组的血管生成情况。
4 统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Tukey检验。以P<0.05为差异有统计学意义。
结 果
1 tEVs的观测及鉴定
利用透射电镜观察tEVs,如图1A所示,4T1细胞的外泌体呈圆环的双层膜囊泡,直径在70 nm左右。Western blot检测结果如图1B所示,外泌体表达标志物CD9和TSG101。
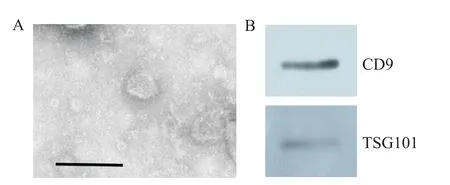
Figure 1.Identification and characterization of exosomes.A:transmission electron microscopic observation of exo⁃somes(×40 000,scale bar=200 nm);B:Western blot was used to detect the marker proteinsof exosomes.图1 外泌体的鉴定及表征
2 tEVs对L929细胞活力和迁移能力的影响
分别采用CCK-8法和划痕实验检测tEVs对L929细胞活力和迁移能力的影响。结果显示,从第2天开始tEVs处理组的L929细胞活力均显著高于对照组(P<0.05),见图2A。在tEVs处理24 h后,L929细胞的迁移率明显高于对照组(P<0.05),见图2B。
3 tEVs在体外促进HUVECs小管生成
体外Matrigel小管形成实验结果显示,与对照组相比,tEVs组生成了更多的管腔结构,见图3A。定量分析显示,与对照组相比,tEVs组有更多的小管分支点和管腔数,以及更长的小管长度(P<0.05),见图3B。
4 tEVs促进创面愈合
如图4所示,在愈合前期,创面皮肤组织结痂,瘢痕挛缩明显;第18天时,对照组创面仍处于愈合期,而tEVs处理组创面基本愈合,且结痂自然脱落;至第25天时,对照组创面结痂自然脱落,但创面新生组织仍不完整,而tEVs组创面已基本完全愈合,且可见新生毛发。
5 皮肤组织HE染色结果
对第7和14天小鼠创面全层皮肤组织进行HE染色的结果显示,7 d时对照组和tEVs组创面均被新生皮肤组织覆盖,但2组新生皮肤组织均主要为表皮层,且厚度较薄;14 d时,对照组基底层厚度有所增加,但新生皮肤组织结构单一仍不完善,而tEVs组创面上皮化程度高,覆盖物与创面边缘融合较好,基底层厚度明显大于对照组,且可见棘层、颗粒层等结构,新生表皮下胶原分布均匀,排列较整齐,与基底贴附紧密,创面愈合效果明显优于对照组,见图5。

Figure 2.tEVs promoted the viability and migration of L929 cells.A:CCK-8 assay was used to test the viability of L929 cells treated with tEVs and PBS;B:the migration of L929 cells treated with tEVs or PBSwas observed by scratch assay(scale bar=200µm).Mean±SD.n=5.*P<0.05,**P<0.01 vs PBSgroup.图2 tEVs能增强L929细胞的活力和迁移能力
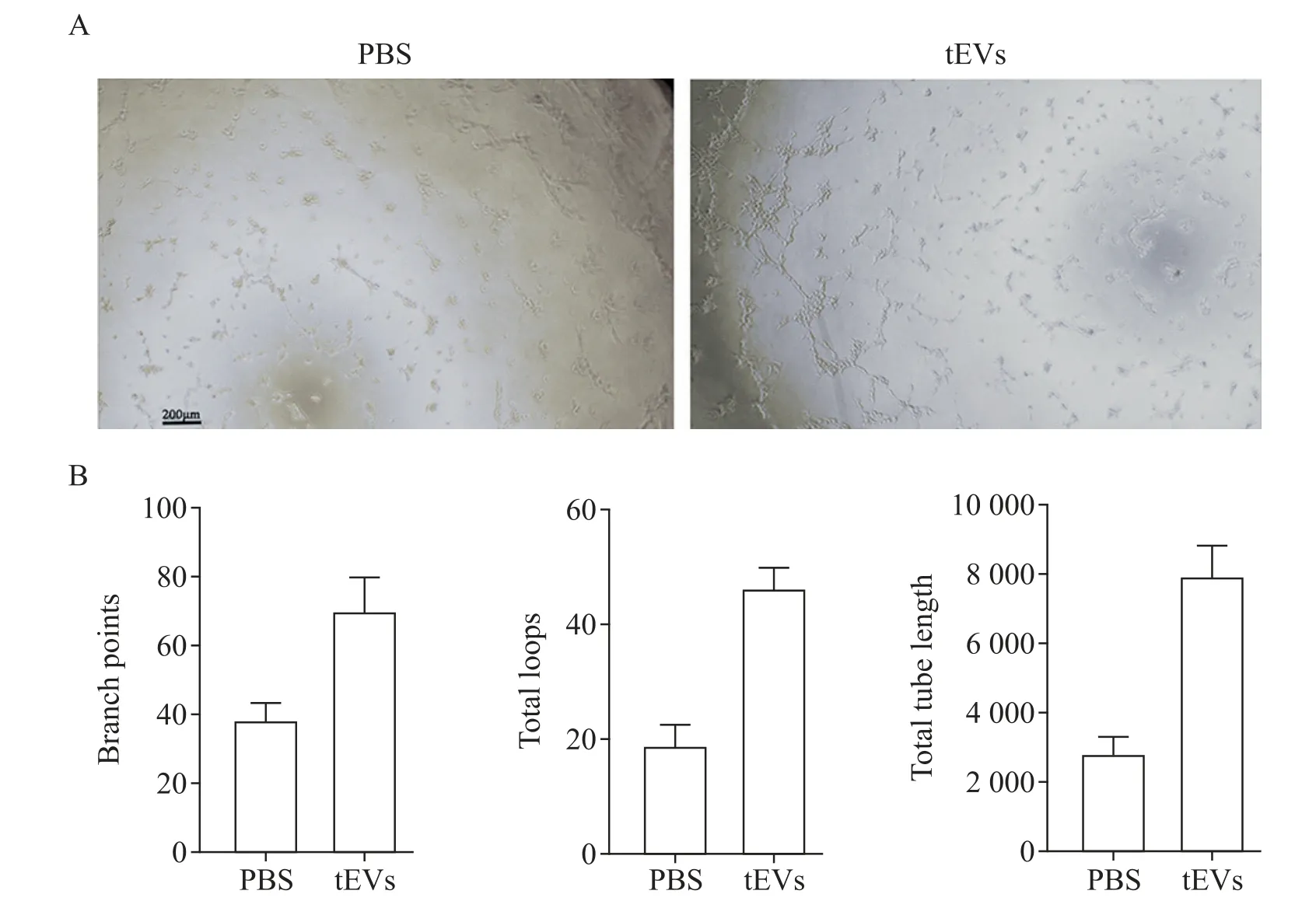
Figure 3.Effect of tEVs on tube formation of HUVECs.A:representative images of the tube formation of HUVECs treated with PBS or tEVs(scale bar=200µm);B:quantitative analysis of the branch points,total loops,and total tube length in A.Mean±SD.n=3.**P<0.01 vs PBSgroup.图3 tEVs对HUVECs成管的影响
6 创面愈合过程中细胞活力和血管再生的变化
组织免疫荧光检测第7和14天时小鼠创面全层皮肤组织CD31的表达情况见图6。结果显示,CD31表达主要集中在新生皮肤组织基底层;第7天时tEVs组小鼠新生皮肤组织CD31表达明显高于对照组;第14天时对照组CD31表达较第7天有所升高,2组小鼠新生皮肤组织基底层均有明显CD31表达。
讨 论
糖尿病创面作为一种慢性顽固性开放性伤口,在愈合过程中,由于创面处新生血管不足,不能为伤口周围的细胞提供充足的氧气和营养物质,细胞的增殖和迁移变得缓慢,这是导致创面愈合迟缓的主要方面之一,多项研究表明糖尿病患者的伤口难以愈合,与血管生成障碍、成纤维细胞的增殖和迁移以及胶原形成密切相关[10]。因此着眼于促进组织细胞增殖和迁移以及血管生成是解决高血糖难愈创面的有效途径。我们同时关注到,肿瘤细胞来源的外泌体在血管生成及细胞增殖和迁移方面发挥着重要作用,而这些作用能有效促进肿瘤的生长和转移[11-12]。那么,是否能够利用肿瘤外泌体的相关调控功能,促进糖尿病难愈创面的修复呢?我们以此为切入点,在本文中评价4T1细胞分泌的外泌体对高糖难愈创面的修复效果,并探讨其作用机制。
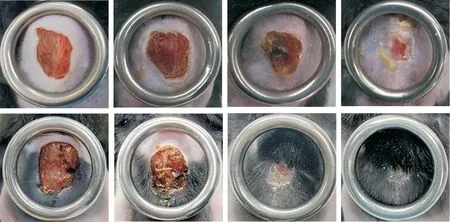
Figure 4.tEVs accelerated wound healing in diabetic mice.The gross healing images of mouse wounds treated with PBSor tEVs at 1,7,18 and 25 d.The diameter of the metal ring was 1.5 cm.图4 tEVs促进糖尿病小鼠创面愈合
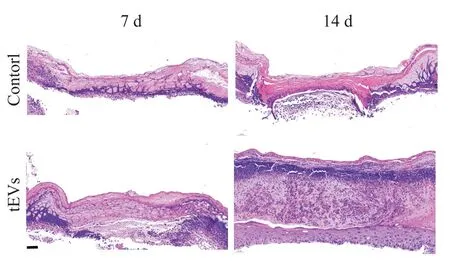
Figure 5.Observation of HE staining of wound tissues at 7 and 14 d in tEVs group and control group.The scale bar=50µm.图5 创面组织HE染色的观察
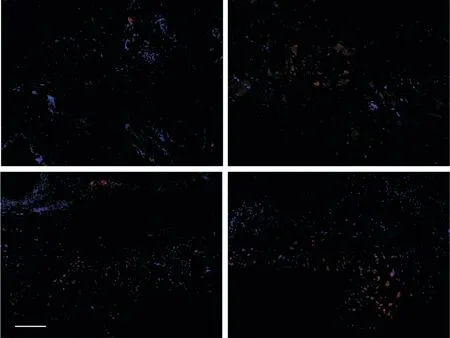
Figure 6.Observation of CD31 immunofluorescence staining.The CD31 expression in wound tissues at 7 and 14 d in tEVs group and control group was observed by im⁃munofluorescence staining.The scale bar=100µm.图6 CD31免疫荧光染色的观察
首先,我们提取了tEVs,透射电镜结果显示tEVs呈圆环的双层膜囊泡,且Western blot结果显示其表达标志物CD9和TSG101,表明我们成功提取了4T1细胞的外泌体,可应用于后续的研究;其次,在体外实验中,我们用tEVs干预L929细胞和HUVECs,发现tEVs能有效促进成纤维细胞的活力和迁移能力且可以提高内皮细胞成管的特性。Richards等[8]在一项研究中显示,化疗药物gemcitabine可以促进肿瘤纤维母细胞分泌外泌体,而这些外泌体可进一步增强上皮细胞的活力并产生对gemcitabine的耐药性。该结果与我们的结果类似,即肿瘤来源的外泌体可增强细胞的活力并促进其迁移,也同时提示了tEVs可能具有促进创面组织愈合的潜能;最后,在体内实验中,我们利用tEVs干预糖尿病小鼠创面的模型,结果证明tEVs可以加速高血糖难愈创面的愈合,并且tEVs跟对照组相比可以促进创面部位基底层的形成以及形成更完整的皮肤结构。进一步的免疫荧光结果显示,tEVs组小鼠新生皮肤组织CD31表达在第7天时明显高于对照组,结合之前的体外实验结果,我们认为tEVs可能调控了创面愈合早期血管生成的过程。最近也有相关研究展示了类似的结果,即肿瘤来源的外泌体可以促进肿瘤内部血管生成[14-15],而这也可能是我们实验中,tEVs促进血管生成的潜在机制。
综上所述,本研究证实了来源于肿瘤细胞4T1的外泌体可以有效促进糖尿病难愈创面的愈合,其潜在的机制可能与增强细胞活力和迁移能力及促进血管生成有关。该结果可为解决高血糖难愈创面的问题提供了一种新的思路。尽管我们目前尚未发现肿瘤外泌体在用于组织修复过程中有任何“副作用”,但其安全性评价仍需进一步深入系统地探讨,同时其促进难愈创面愈合的具体分子机制也是我们下阶段研究的重点。

