补肾调经方激活ERK信号通路抑制内质网应激促进血管生成的研究*
河北中医学院 河北省中西医结合肝肾病证研究重点实验室
曹 璨 周玉玲 杜澍金 贺 明 范丽洁 何 莲 张 宇(石家庄 050200)
提要 目的:研究补肾调经方对子宫内膜微血管内皮细胞内质网应激(ERS)状态的影响,探讨其促进子宫内膜血管生成改善子宫内膜容受性的作用。方法:将人子宫内膜微血管内皮细胞(HEMECs)分为对照组、雌激素(E2)组、补肾组和E2+补肾组,Western blot和实时荧光定量聚合酶链式反应(RT-PCR)检测细胞中葡萄糖调节蛋白78(GRP78)的蛋白和mRNA表达变化;Western blot方法检测细胞外信号调节蛋白激酶(ERK)以及磷酸化细胞外信号调节激酶(p-ERK)的表达变化。结果:在给予补肾调经方预孵育后,GRP78的蛋白和mRNA水平均降低(P<0.05),p-ERK的蛋白水平升高(P<0.05);在给予ERK信号通路抑制剂后,GRP78的蛋白和mRNA水平升高(P<0.05)。结论:补肾调经方通过激活ERK通路抑制ERS以促进子宫内膜血管生成。
子宫内膜容受性是保证胚胎成功着床的关键因素。在众多评价子宫内膜容受性的条件中,血管生成尤为重要,良好的血供保证胚胎正常着床;而内质网应激(ERS)是导致血管损伤的因素,研究证实,雌激素(E2)可以改善ERS造成的血管内皮细胞损伤并促血管生成[1]。在胚胎着床阶段,E2具有促进胚胎滋养层细胞生长和血管生成的作用[2]。因此,临床上外源性给予E2可以用于改善子宫内膜的厚度不佳导致的子宫内膜容受性低下。
中医认为,肾主生殖,肾精充盛,胞宫得以滋养,才能保证胚胎的生长发育。因此补肾法在临床上多用于治疗子宫内膜容受性低下引起的不孕[3],且本课题组大量的前期实验已经表明补肾法可以促进子宫内膜血管生成以改善子宫内膜容受性,但补肾法是否通过影响ERS促进血管生成有待于进一步研究。
1 材料
1.1 细胞 人子宫内膜微血管内皮细胞(HEMECs)购自ScienCell公司。
1.2 药物 补肾法的代表方补肾调经方组成:熟地黄20 g,当归10 g,山茱萸15 g,山药12 g,丹参、覆盆子、淫羊藿、紫河车各10 g,枸杞子、菟丝子各12 g,白芍、女贞子各9 g,香附6 g。药物均购于乐仁堂药房,制成精致混悬液,生药浓度为1.5 g/mL,4 ℃冰箱保存。
1.3 主要试剂和仪器 GRP78抗体(ab21685, abcam);ERK抗体(16443-1-AP, Proteintech);p-ERK抗体(YP0101, Immunoway);GAPDH抗体(10494-1-AP, Proteintech);HRP鼠二抗(sc-516102, Santa Cruz);Total RNA Kit Ⅱ(R6934-01, OMEGA);M-MLV逆转录试剂盒(R021-01, Vazyme);SYBR Green Ⅰ荧光定量聚合酶链式反应(PCR)试剂盒(Q311-02, Vazyme);引物由上海生工生物工程股份有限公司合成。
实时荧光定量PCR仪(7500 Fast,美国赛默飞公司);分光光度计(NanoDrop 2000,美国赛默飞公司);激光共聚焦显微镜(SP8,德国莱卡公司);化学发光系统(LAS4000,美国GE公司);半干转膜仪(Trans-Blot SD,美国伯乐公司)。
2 方法
2.1 细胞分组与处理 HEMECs用含10%胎牛血清(FBS)ECM培养基在37 ℃、5% CO2培养箱培养,隔天换液,待HEMECs密度约为90%左右时用0.25%胰酶(含EDTA)消化传代,传3代后用于实验。待细胞长至80%,给予雌激素(E2)或补肾含药血清刺激12 h,收细胞用于后续实验。实验分组:对照组、E2组、补肾组、E2+补肾组。
2.2 Western blot分析 用RIPA裂解液裂解HEMECs,从HEMECs分离的蛋白在10%SDS-PAGE凝胶上电泳,并转移到PVDF膜上。将膜用8%的TTBS牛奶在37 ℃环境下封闭2 h,并在4 ℃与以下一抗孵育过夜:葡萄糖调节蛋白78(GRP78),磷酸化细胞外信号调节激酶(p-ERK),细胞外信号调节蛋白激酶(ERK),甘油醛-3-磷酸脱氢酶(GAPDH)。TTBS洗涤膜后,在室温下与相应的HRP标记的二抗(1∶1 000)孵育1 h。使用化学发光仪对抗体-抗原复合物进行成像。
2.3 实时荧光定量PCR 采用Total RNA Kit Ⅱ试剂盒从HEMECs中提取总RNA,使用分光光度计检测RNA总浓度。逆转录反应及实时荧光定量RT-PCR检测按照试剂盒说明书进行。所用引物序列如表1。

表1 所用引物序列

3 结果
3.1 HEMECs各组GRP78蛋白和mRNA水平比较 Western blot分析结果显示,E2组、补肾组以及E2+补肾组中GRP78的表达与对照组相比明显降低(P<0.05)。GRP78的mRNA变化与蛋白表达一致,与对照组相比,E2组、补肾组和 E2+补肾组中明显降低(P<0.05)。见图1。

注:A. Western blot条带结果; B. GRP78蛋白表达灰度值; C. GRP78 mRNA表达水平。与对照组(Con)相比,*P<0.05。
3.2 HEMECs各组ERK信号通路的变化 检测HEMECs各组p-ERK和ERK的蛋白表达,补肾组和 E2+补肾组中p-ERK的表达与对照组相比明显升高(P<0.05),差异具有显著性,E2+补肾组的p-ERK的蛋白表达最高。ERK表达与正常组相比差异无显著性。见图2。
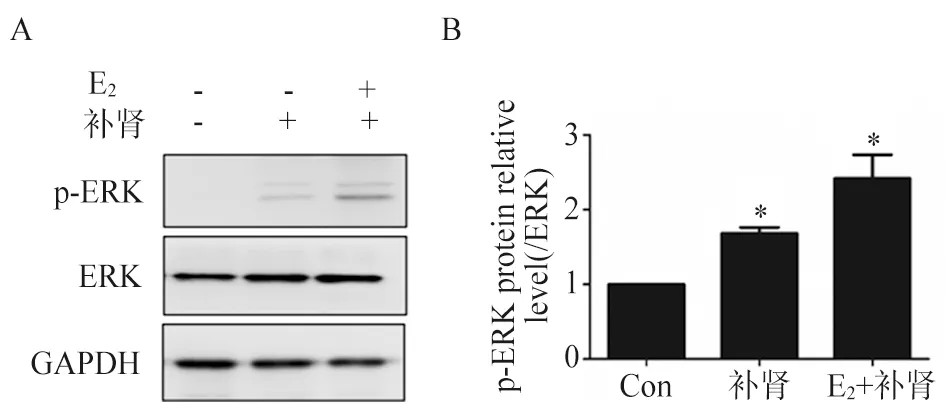
注:A. Western blot条带结果; B. p-ERK蛋白表达灰度值。与对照组(Con)相比,*P<0.05。
3.3 添加ERK信号通路抑制剂后HEMECs各组GRP78表达变化 为证实ERK信号通路与ERS之间的关系,笔者采用ERK抑制剂PD98059抑制该信号通路,观察GRP78的变化。Western blot分析结果发现:与对照组相比,补肾组和E2+补肾组的GRP78的蛋白表达降低(P<0.05),而E2+补肾组+PD98059组与E2+补肾组相比,GRP78的蛋白表达明显升高(P<0.05),差异具有显著性。RT-PCR结果与Western blot分析结果相一致:补肾组和E2+补肾组的GRP78的mRNA水平明显要低于对照组(P<0.05),E2+补肾组+PD98059组的GRP78的mRNA水平明显高于E2+补肾组(P<0.05)。结果表明:在HEMECs中,补肾调经方通过激活ERK信号通路抑制GRP78的蛋白和mRNA水平。见图3。

注:A. Western blot条带结果;B. GRP78蛋白表达灰度值;C. GRP78 mRNA表达水平。与对照组(Con)相比,*P<0.05;与E2+补肾+PD98059组相比,# P<0.05 。
4 讨论
子宫内膜作为母胎界面主要的构架,与胚胎植入着床息息相关。在现代医学中,辅助生殖技术得以迅速发展,这使得胚胎的植入率得以提高,但是妊娠率仍不理想,子宫内膜容受性低下是其中的关键。临床上多采用E2以改善子宫内膜容受性的不良状态,本课题组猜测这可能与E2改善血管生成,提供充分的养料有关,但其中的机制尚未明确。
ERS是一种大量错误折叠蛋白在内质网聚积引起的应激反应,会在氧化应激、缺血等情况下发生而影响血管内皮细胞的功能进而导致血管损伤[4]。生理状态下,内质网膜上的跨膜蛋白可以与GRP78结合形成稳定复合物,并处于失活状态,以维持内质网稳态。但当内质网内部错误蛋白大量折叠累积达到内质网承受阈值时,细胞会启动未折叠蛋白反应的信号转导途径(UPR)试图纠正这种行为,以促进蛋白质的正确折叠,进行内质网的自我修复[5]。
E2可以逆转由葡萄糖引起的氧化应激而导致的ERS,这可能与其抗氧化活性相关。E2可以通过细胞核内核外效应,减弱未折叠蛋白反应,降低GRP78和磷酸化JNK的表达[6]。GRP78是一种分子伴侣,可以与相关跨膜蛋白结合而抑制其活性,在ERS发生时,GRP78则会与未折叠蛋白结合激活相关通路。所以,GRP78在一定意义上是响应ERS的重要因子。本实验证明,在子宫内膜微血管内皮细胞中,E2可以抑制GRP78的蛋白表达和mRNA水平,进而改善子宫内膜微血管内皮细胞中的ERS状态。
ERK信号通路在子宫内膜容受性中具有重要的作用[7-9],研究发现,细胞外骨架蛋白Talin1可以通过促进VTN/ITGAV-复合物的形成和激活下游的FAK/Src/ERK信号通路来增强子宫内膜上皮细胞的粘附能力,提高子宫内膜容受性[10]。Xie等人[11]发现在给予p38、ERK1/2和AKT的抑制剂后,发现FOXM1的表达水平降低,OPN能够调节FOXM1的表达通过激活p38、ERK1/2和AKT通路促进HEC-1A细胞的增殖,以此改善子宫内膜容受性。雌激素促进血管生成可能与快速激活了雌激素受体α(ERα)有关,ERα与下游ERK相互作用[12]。本研究发现,E2是通过参与ERK通路来进行对ERS的调节的。
《素问·六节脏象论》中提及“肾者主蛰,封藏之本,精之处也”,肾藏精,主生殖,肾气充盛,肾精充沛,才能固摄冲任,使胞宫血供丰沛,为子宫内膜的发育生长提供良好的环境,以保证胚胎的着床成功。补肾调经方是由归肾丸合养精种玉汤加减而成,作为补肾法的代表方在调节女性生殖疾病中发挥了重要作用。汤锶锶等人[13]采用补肾活血法辅助宫腔灌流能够增加子宫内膜厚度,削弱细胞外基质的沉淀,提高妊娠率。耿丹丹等人[14]发现补肾助孕方能够改善子宫内膜的形态并提高内膜中胞饮突的数量以改善子宫内膜容受性。薛淼淼等人[15]采用补肾疏肝健脾方,可以提高子宫内膜厚度,改善子宫内膜的血流状态,子宫灌注上升,提高妊娠率。补肾法能够有效改善肾虚薄型子宫内膜大鼠内膜腺体的数量及形态,促进内膜相关因子的分泌以及雌、孕激素在内膜中的表达[16];补肾法还可以促进血管生成因子VEGF的表达,增加血管通透能力,促进子宫内膜微血管生成,改善子宫内膜容受状态[14]。本课题组的前期研究结果也已证明补肾法可通过调节小鼠子宫内膜GRP78的表达水平,改善ERS状态,提高子宫内膜容受能力[17]。本研究从细胞水平进一步阐明,补肾法的代表方补肾调经方可以显著降低子宫内膜微血管内皮细胞GRP78的表达水平,改善子宫内膜的ERS状态,促进子宫内膜血管生成,改善子宫内膜容受性;另一方面,补肾调经方可以激活ERK信号通路,抑制GRP78的表达,促进血管生成。本研究在前期研究基础上深入探讨了补肾法促进血管生成改善子宫内膜容受性的作用机制,对于丰富“肾主生殖”理论具有重要的意义。
综上所述,E2和补肾调经方能够激活ERK信号传导通路下调GRP78的表达,抑制ERS状态,从而促进血管生成,使子宫内膜处于容受状态,支持胚胎着床。但是补肾法对子宫内膜其他细胞如上皮细胞、基质细胞的影响的分子机制,还有待于进一步研究。

