乙型合并丙型肝炎病毒感染患者的临床特征及抗病毒治疗策略
刘春
HBV 合并HCV 感染时,病毒之间会发生相互干扰状况,主要表现为两种病毒复制水平下降,但肝损伤程度却明显大于单独病毒感染,极其容易诱发肝癌及肝硬化,不仅严重影响疾病的发展及预后,同时还对患者的身心健康构成威胁[1,2]。为此,对HBV 合并HCV感染患者的临床特征进行详细研究,并探讨相关的抗病毒治疗策略,改善患者的预后,是当前传染科临床工作人员重点关注的内容[3]。本文作者对50 例HBV 合并HCV 感染患者与50 例单纯HBV 感染患者作出以下报告,以期为临床有关研究提供部分参考资料。
1 资料与方法
1.1 一般资料 选取本院2016 年3 月~2019 年3 月期间收治的50 例HBV 合并HCV 感染患者设为研究组,并将同期收治的50 例单纯HBV 感染患者设为对照组。对照组,男29 例,女21 例;年龄34~69 岁,平均年龄(48.45±6.86)岁。研究组,男28 例,女22 例;年龄33~68 岁,平均年龄(48.32±6.76)岁。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 HBV、HCV 血清标志物检测 ①采取微粒子免疫法联合酶联免疫法对患者的HBV 血清标志物进行检测,检测仪器选择自动酶标抗原体测试仪,型号为JC506-SM-3,分析仪器及试剂均为配套产品。乙型肝炎表面抗原(HBsAg)和HBeAg 半定量,测试值≥2.10 S/N 时判断为阳性。②使用酶联免疫吸附实验法对患者的HCV 血清标志物进行检测,试剂盒则为SBJ-H0219 型号试剂盒以及相关配套试剂,同时按照详细说明书开展操作,定量测试值≥30 IU/ml 时判断为阳性。
1.2.2 抗病毒治疗策略 两组患者均给予利巴韦林联合人工重组干扰素治疗。利巴韦林胶囊,口服,1.5 g/次,1 次/d,30 d 为1 个疗程,治疗6 个疗程。人工重组干扰素,皮下注射,180 μg/次,1 次/周,30 d 为1 个疗程,治疗6 个疗程。
1.3 观察指标及判定标准 ①比较两组患者的病毒学特征。②比较两组患者的病毒学应答效果。病毒学应答效果判定标准:治疗结束后,患者的HBsAg 和HBeAg 定量检测值与HCV-RNA 检测值均显著降低,并且HCV-RNA 检测值降低程度≥2 log10,判断为完全应答;治疗结束后,患者的HBsAg 和HBeAg 定量检测值与HCV-RNA 检测值均有所降低,但HCV-RNA 检测值降低程度<2 log10,判断为部分应答;治疗结束后,患者的HBsAg 和HBeAg 定量检测值与HCV-RNA 检测值均无显著改变,判断为无应答;治疗结束后,患者的HBsAg 和HBeAg 定量检测值与HCV-RNA 检测值均上升,判断为反弹。总应答率=(完全应答+部分应答)/总例数×100%。③比较两组患者的肝功能指标。肝功能指标包括ALT、AST,分别于治疗前与治疗后晨起空腹采血,运用全自动生化分析仪及配套试剂进行检测。④比较两组患者的不良反应发生率,包括白细胞减少、甲状腺功能减退、溶血、血小板减少。⑤比较两组患者的复发情况。
1.4 统计学方法 采用SPSS20.0 统计学软件进行统计分析。计量资料以均数±标准差()表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 两组患者的病毒学特征比较 观察组患者中,HCV 优势病毒株45 例(90.00%),混合优势病毒株8 例(16.00%)。观察组患者HBeAg 定量检测显示阳性12 例,HBeAg 阳性率为24.00%;对照组患者HBeAg 定量检测显示阳性22 例,HBeAg 阳性率为44.00%。观察组患者的HBeAg 阳性率低于对照组,差异有统计学意义(χ2=4.456,P=0.035<0.05)。
2.2 两组患者的病毒学应答效果比较 观察组患者中,完全应答38 例,部分应答10 例,无应答2 例,反弹0 例,总应答率为96.00%;对照组患者中,完全应答20 例,部分应答16 例,无应答10 例,反弹4 例,总应答率为72.00%。观察组患者的总应答率高于对照组,差异有统计学意义(χ2=10.714,P=0.001<0.05)。
2.3 两组患者的肝功能指标比较 治疗前,两组患者的ALT、AST 比较,差异均无统计学意义(P>0.05);治疗后,两组患者的ALT、AST 均较本组治疗前降低,且观察组降低幅度大于对照组,差异均具有统计学意义(P<0.05)。见表1。
表1 两组患者的肝功能指标比较(,U/L)
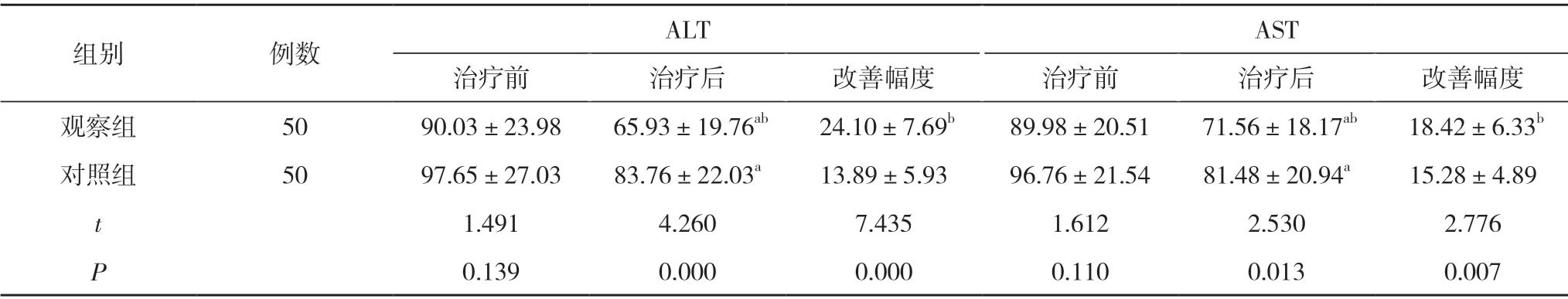
表1 两组患者的肝功能指标比较(,U/L)
注:与本组治疗前比较,aP<0.05;与对照组比较,bP<0.05
2.4 两组患者的不良反应发生率比较 观察组患者发生白细胞减少6 例,甲状腺功能减退5 例,溶血2 例,血小板减少5 例,不良反应发生率为36.00%;对照组患者发生白细胞减少2 例,甲状腺功能减退2 例,溶血1 例,血小板减少1 例,不良反应发生率为12.00%。观察组患者的不良反应发生率高于对照组,差异有统计学意义(χ2=7.895,P=0.005<0.05)。
2.5 两组患者的复发情况比较 观察组患者复发23 例,复发率为46.00%;对照组患者复发7 例,复发率为14.00%。观察组患者的复发率高于对照组,差异有统计学意义(χ2=12.190,P=0.000<0.05)。
3 讨论
当前专家们尚未对HCV 病毒机制形成统一看法,通常认为该病主要由肝细胞内HCV 基因复制严重影响肝细胞正常的功能及结构,对蛋白合成造成阻碍,从而致使肝细胞受损、变性坏死,严重损害肝脏[4]。HBV属于嗜肝DNA 病毒科感染病毒之一,传染性极强,母婴传播、血液传播以及性传播均为该病毒的传播方式,当前国内HBV 人数>9000 万[5]。另外,因为HBV 与HCV 均能够经过血液传播方式进行传播,出现合并感染的几率很高,再加上该两种病毒之间的相互干扰或者相互牵制现象十分明显,由此致使感染该类病毒的患者极其容易发生肝脏损害或者肝细胞癌等并发症,对患者的生命安全构成严重威胁[6]。
本文研究结果显示,HBV 合并HCV 感染患者的HBeAg 阳性率低于单纯HBV 感染者,该结果说明了HBV 合并HCV 感染时,两种病毒可能存在相互抑制的现象。同时,HBV 合并HCV 感染患者中,有90.00%的患者出现HCV 优势病毒株,仅有16.00%的患者出现混合优势病毒株,该结果说明HCV 对HBV 的抑制作用占据了更大的优势。
虽然HBV 合并HCV 感染后,两种病毒的复制水平会有所降低,但是当其中一种病毒遭受抑制时,占据优势的另外一种病毒依旧会将其取代,并且转变为肝炎持续发展的因素,加大了抗病毒治疗的难度。国外现有临床研究报道指出,普通干扰素单药治疗HBV 合并HCV 感染患者时,总应答率要明显低于单纯HCV感染者[7]。分析原因可能在于合并感染者应用干扰素治疗时,干扰素受体基因表达下调,HCV 的NS5 蛋白增强HBV 复制,从而致使应答率下降。联合利巴韦林和应用长效干扰素治疗后,便能够消除该影响。同时,当前还有部分研究报道指出,利巴韦林联合人工重组干扰素治疗HBV 合并HCV 感染,患者的不良反应发生率及复发率均显著高于单纯HCV 病毒感染者,这可能和HBV 对HCV 的抑制作用存在一定的关联[8,9]。虽然临床尚无明确的报道指出复发率高的机制,但有可能是受相似快速病毒学应答(RVR)的状况下,高部分早期病毒学应答(pEVR)的影响,又或者是重叠HBV感染影响。HBV 合并HCV 感染患者接受抗病毒治疗后,其HCV-RNA 下降速度会变慢,还会发生延迟应答的现象,为此,患者接受固定疗程的抗病毒治疗时,其疗程相对来说会比较短,从而致使患者出现极高的复发率。由此,临床可以适当对获得pEVR 患者延长其抗病毒治疗的疗程,一般可以延长到1.5~2.0 年,从而增强治疗效果[10]。本研究结果中,观察组患者的总应答率96.00%高于对照组的72.00%,差异有统计学意义(P<0.05)。治疗后,两组患者的ALT、AST 均较本组治疗前降低,且观察组降低幅度大于对照组,差异均具有统计学意义(P<0.05)。观察组患者的不良反应发生率36.00%高于对照组的12.00%,差异有统计学意义(P<0.05)。观察组患者的复发率46.00%高于对照组的14.00%,差异有统计学意义(P<0.05)。
综上所述,HCV 为HBV 合并HCV 感染的优势病毒株,同时HCV 还能够对HBV 的复制进行抑制,临床采取利巴韦林联合人工重组干扰素治疗HBV 合并HCV 感染时虽然可以取得明显的应答效果,且能有效改善患者的肝功能指标,但不良反应发生率高,易复发,值得临床重点关注。

