慢性乙型肝炎患者核苷(酸)类似物停药后复发预测因素meta分析
王艳 姚甜甜 钱建丹 程浩 王贵强
慢性乙型肝炎(chronic hepatitis B,CHB)在中国是疾病负担最重的传染病之一[1]。目前的指南推荐患者使用强效、低耐药的一线核苷(酸)类似物(nucleos(t)ide analogues,NA)进行长期治疗[2]。但各指南对于无肝硬化CHB患者的NA停药标准尚不完全统一,部分患者由于不良反应、生育、费用等原因自行停药,导致复发[3-5]。目前大多数探讨NA停药后复发风险因素的研究规模较小,停药和复发的标准不一,得出的结论也不一致。本研究收集国内外NA停药后复发风险因素评估数据进行meta分析,为判断复发高危人群提供相对可靠的理论依据。
资料与方法
一、文献纳入及排除标准
纳入标准:①除病例报告、病例系列报告、横断面研究以外所有实验性或观察性研究;②确诊为CHB并接受NA治疗,根据美国肝病学会(American Association for the Study of Liver Diseases,AASLD)、欧洲肝病学会(European Association for the Study of the Liver,EASL)、亚太肝病学会(Asian Pacific Association for the Study of the Liver,APASL)或中国慢性乙型肝炎防治指南标准停药,或至少NA治疗12个月后停药的成人患者;③针对患者因素、治疗因素或实验室指标进行分析的研究;④针对病毒学复发或临床复发结局进行分析的研究。
排除标准:①未涉及复发风险因素的随机对照临床试验;②未明确描述停药标准且NA疗程少于12个月;③干扰素类和NA联合治疗;④综述、述评、读者来信和无法提取数据的文献;⑤非英文非中文文献。
二、检索策略
在Pubmed、Cochrane图书馆、EMBASE和CBM数据库进行电子检索,检索时间为从数据库成立至2018年3月。检索关键词包括“慢性乙型肝炎”、“核苷”、“核苷酸”、“拉米夫定”、“阿德福韦”、“替比夫定”、“恩替卡韦”、“替诺福韦”、“复发”等。
补充检索途径:阅读所有相关系统综述的参考文献列表,确定与本系统综述相关的研究。
三、数据提取
由2名独立评审员使用标准化方式从每项研究中提取数据,通过讨论解决分歧,并由第3名评审员仲裁。必要时联系研究作者获得更多信息或说明。
四、纳入研究的偏倚风险评估
采用预后研究质量评估(Quality In Prognosis Studies,QUIPS)工具,从6个方面评估纳入研究的偏倚风险:参与、失访、预后因素评估、混淆因素评估与解释、结局评估、统计分析和报告[6]。
五、数据合成和报告
采用RevMan软件(5.3版),计数资料采用比值比(odds ratio,OR),或风险比(hazard ratio,HR)为效应指标,各效应量均给出点估计值和95%可信区间(confidence interval,CI)。
异质性评估:采用χ2检验分析纳入研究结果间的异质性(检验水准为α=0.1),同时结合I2定量判断异质性大小。若各研究结果间无统计学异质性,则采用固定效应模型;若各研究结果间存在统计学异质性,则进一步分析异质性来源,在排除明显临床异质性的影响后采用随机效应模型。
对以下亚组进行效应量差异评估:HBeAg阳性比HBeAg阴性;有肝硬化比无肝硬化;年龄、性别或人种(亚洲人比非亚洲人)、合并症、合并感染;NA药物类型;停药标准;NA治疗时间;复发的不同定义。
结 果
一、文献筛选
检索发现3 031条文献,在删除重复项后剩余2 404条记录。最终纳入64项研究[7-70]和70项完整报告(图1)。
二、NA治疗方案及停药标准
纳入的64项研究中,21项(33%)发表于2002~2012年,43项(67%)发表于2013~2018年。报告最多的治疗方案为拉米夫定单药治疗(24/64,38%)和恩替卡韦单药治疗(11/64,17%);仅1项研究使用阿德福韦单药治疗,2项研究使用替诺福韦单药治疗,26项研究(41%)未根据治疗药物分组(包括不同核苷类药物的单药、序贯和联合治疗)。不同研究中平均NA疗程为12.86个月~ 43个月。最常使用的停药标准依次为研究者指定标准(27/64,42%)、APASL(21/64,33%;其中4项使用2005年或更早标准,8项使用2008年标准,9项使用2012年标准)、中国慢性乙型肝炎防治指南(12/64,19%;其中11项使用2010年标准,1项使用2005年标准)和AASLD(2/64,3%;分别使用2009年和2004年标准),2项研究(3%)未明确停药标准。
三、meta分析结果
(一)年龄
1.开始抗病毒治疗时的基线年龄与病毒学复发风险相关:6项评估HR的研究[10,11,13,20,41,48]显示,开始抗病毒治疗时基线年龄越大,病毒学复发率越高(每增加1岁,HR=1.04,95%CI: 1.03 ~ 1.05),提示基线年龄每增加1岁,病毒学复发风险平均相对升高4%。该meta分析有显著异质性(χ2=15.77;df=7.0;P=0.03;I2= 56%)(图2)。亚组分析显示,不同HBeAg状态、肝硬化状态和停药标准均对结果无明显影响。3项评估OR的研究[34,49,57]得出的结论相同(每增加1岁,OR=1.07,95%CI:1.05 ~ 1.08)。meta分析中未发现明显异质性。亚组分析中HBeAg状态、是否有肝硬化、人类免疫缺陷病毒(human immunodeficiency virus,HIV)合并感染、停药标准和复发标准对结果无明显影响。
2.停药时年龄与病毒学复发风险分析结果不统一:2项评估HR的研究[45,55]显示,停药时年龄越大,病毒学复发率越高(每增加1岁,HR=1.03,95%CI:1.01 ~ 1.06)。该meta分析有显著异质性(χ2=2.4;df=1.0;P=0.12;I2= 58%)。亚组分析显示,HBeAg状态和是否有肝硬化的差异对结果无明显影响,当病毒学复发定义为HBV DNA>1000拷贝/mL时,停药时年龄较大也与病毒学复发率升高相关。而1项评估OR的研究[47]显示,停药时年龄与病毒学复发率无相关性(每增加1岁,OR=1.09,95%CI: 1.01~1.18)。

注:*64项研究包括70项完整报告
图1PRISMA 研究流程图

图2 开始抗病毒治疗时的基线年龄与病毒学复发的相关性(每增加1岁,HR)
(二)性别与病毒学复发风险分析结果不统一
7项评估OR的研究[8,31,34,37,42,50,64]显示,男性患者的病毒学复发率高于女性(OR=1.64,95%CI: 1.14 ~ 2.36)。但不同亚组分析中得出的结果不一致。在HBeAg阳性、HBeAg阴性、无肝硬化患者、根据APASL、AASLD指南或特定标准停药的患者亚组中,性别因素与病毒学复发率无相关性。病毒学复发定义不同,分析结果不同。当病毒学复发定义为HBV DNA>2 000 IU/mL时,性别与病毒学复发率相关;但在病毒学复发定义为>10 000拷贝/mL或100 000拷贝/mL的研究中,性别与病毒学复发率不相关。使用不同抗病毒药物的研究分析性别与病毒学复发率相关性的结果亦不一致。5项评估HR的研究[11,17,29,41,54]显示,性别与病毒学复发率无相关性(HR=0.89,95%CI:0.46 ~ 1.72)。该meta分析有显著异质性(χ2=13.59;df=4.0;P=0.01;I2=70%)。亚组分析显示,HBeAg状态、是否合并HIV感染、停药标准以及对病毒学复发定义的差异对结果均无明显影响。
(三)HBV DNA基线水平和动态变化与病毒学复发相关
1.基线HBV DNA水平与病毒学复发风险:2项研究[28,61]显示,治疗开始时HBV DNA水平较高的患者病毒学复发率也较高(>2 000 000 IU/mL比≤2 000 000 IU/mL,OR=9.28,95%CI:1.55 ~ 55.8;>12 000 U/L比≤12 000 U/L,OR=3.61,95%CI:1.4 ~ 9.32)。
2.治疗开始后达到完全病毒学应答所需时间与病毒学复发风险:3项评估HR的研究[17,39,41]显示,治疗开始后达到完全病毒学应答(HBV DNA检测不到)所需时间较长的患者病毒学复发率较高(每延长1个月,HR=1.13,95%CI: 1.04~1.22)(图3),提示该时间每延长1个月,病毒学复发风险平均相对升高13%。亚组分析显示,在HBeAg阴性、采用研究者自行定义停药标准,以及采用HBV DNA>104拷贝/mL定义复发的研究中,这一因素与病毒学复发率无相关性。而在HBeAg阴性和阳性混合人群、无肝硬化、无HIV合并感染、APASL停药标准、复发定义为>1000拷贝/mL的分析中,达到完全病毒学应答所需时间与病毒学复发相关。在1项使用拉米夫定单药(HR=1.21,95%CI:0.97~1.51)的研究中,达到病毒学应答所需时间与病毒学复发率不相关;在2项使用不同NAs的单药和联合治疗,未根据药物分组(HR=1.11,95%CI:1.02 ~ 1.22)的研究中,该因素与病毒学复发率相关。1项评估OR的研究[42]得出的结论相同(每延长1个月,OR=1.31,95%CI:1.01~1.70)。
3.治疗开始后3个月内达到完全病毒学应答与病毒学复发风险:1项研究[29]显示,治疗开始后3个月内达到完全病毒学应答的患者病毒学复发率较低(HR=0.16,95%CI: 0.07~0.37)。
4.HBeAg转阴时的HBV DNA水平与病毒学复发风险:1项研究[53]显示,HBeAg阳性CHB患者在HBeAg转阴时的HBV DNA水平相对较高与病毒学复发相关(≥60 IU/mL比< 60 IU/mL,OR=5.10,95%CI:1.30~20.01)。
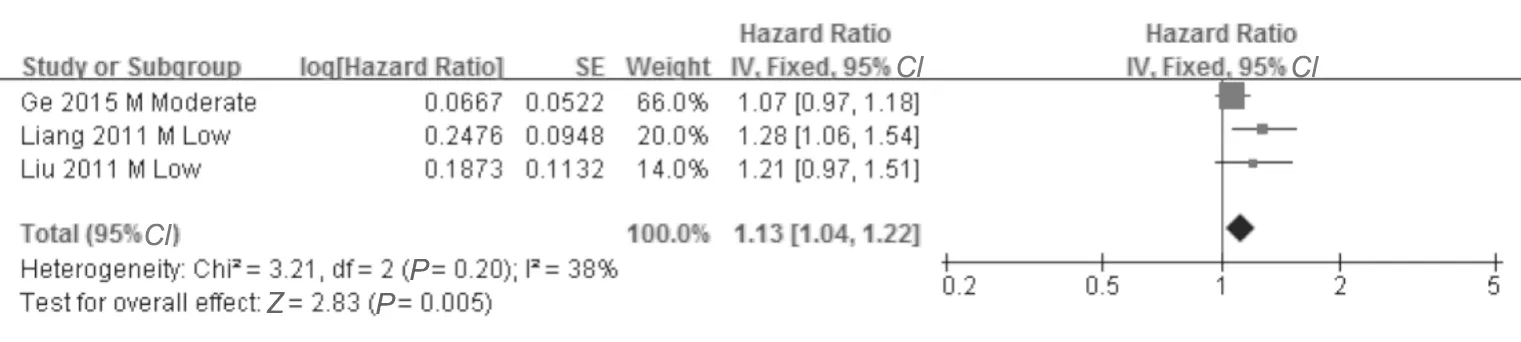
图3 治疗开始后达到完全病毒学应答所需时间与病毒学复发率的相关性(每延长1个月,HR)
(四)停药时HBsAg定量水平与病毒学复发相关
1.HBeAg血清学转换时的HBsAg水平与病毒学复发风险:1项研究[48]显示,HBeAg阳性CHB患者HBeAg血清学转换时的HBsAg水平越高,病毒学复发率越高(每升高1 lg IU/mL,HR=2.16,95%CI:1.34~3.49)。
2.停药时HBsAg水平与病毒学复发风险:7项评估HR的研究[11,17,20,39,48,55,57]显示,停药时HBsAg水平越高,病毒学复发率越高(每增加1 lg IU/mL,HR=1.81,95%CI:1.57 ~ 2.08)(图4)。该meta分析中未发现明显异质性。亚组分析显示,HBeAg状态、是否肝硬化、是否合并HIV感染、停药标准,以及病毒学复发定义的差异对结果均无明显影响。在1项使用拉米夫定单药(HR=2.04,95%CI:1.59 ~ 2.62)、3项使用恩替卡韦单药(HR=1.66,95%CI:1.35 ~ 2.04),和3项不同NAs的单药和联合治疗,未根据药物分组(HR=1.84,95%CI:1.36 ~ 2.48)的研究中,停药时HBsAg水平与病毒学复发率之间的相关性与总分析一致。
1项评估OR的研究[47]得出的结论相同(每增加1 lgIU/mL,OR=2.73,95%CI: 1.27~5.88)。此外还有1项研究[60]显示,停药时HBsAg≤100 IU/mL的患者病毒学复发率较低(≤100 IU/mL 比>100 IU/mL,OR=0.09,95%CI:0.04~0.19)。
(五)药物选择和治疗时间
1.药物选择与病毒学复发风险:不同研究的治疗药物分组不同,因此未进行数据合并。Fong等[16]的研究显示,与恩替卡韦单药治疗相比,替诺福韦单药治疗与复发率较高相关(OR=13.10,95%CI:2.18~78.73)。另2项研究[52,54]显示,治疗药物类型与病毒学复发率无相关性。
2.总疗程与病毒学复发风险:2项评估OR的研究[34,59]显示,NA总疗程与病毒学复发率无相关性(每延长1个月,OR=0.98,95%CI:0.91~1.06)。该meta分析无显著异质性(χ2=1.80;df=1.0;P=0.18;I2=44%)。1项评估HR的研究[17]显示,拉米夫定治疗总疗程与病毒学复发率无相关性(每延长1个月,HR=1.02,95%CI:0.99~1.04)。
3.巩固治疗时间与病毒学复发风险:1项评估OR的研究[59]显示,巩固治疗时间较短的患者复发率较高(每缩短1个月,OR=1.23,95%CI:1.05~1.43)。2项评估HR的研究[41,45]显示,巩固治疗时间与病毒学复发率无相关性(每延长1个月,HR=0.97,95%CI:0.95~1.0)。亚组分析显示,HBeAg状态、是否合并HIV感染、停药标准,以及病毒学复发定义的差异对结果均无明显影响。
此外,还有一项研究[54]显示,巩固治疗<15个月的患者病毒学复发率高于巩固治疗≥15个月的患者(HR=11.3,95%CI:2.05~62.16)。
(六)其他风险因素
对其他风险因素的分析显示,有CHB家族史[39](HR=2.09,95%CI:1.28~3.4)、基线时存在前C区基因突变[49](OR=2.97,95%CI: 1.04~8.48)、治疗结束时前S1抗原阳性[68](OR=14.67,95%CI:4.46~48.19)、治疗结束时HBcrAg水平较高[28](>3.7 lg IU/mL比≤3.7 lg IU/mL,OR=3.75,95%CI:1.19~11.85)的患者病毒学复发率较高。基因型[10,17](B型比C型,HR=1.63,95%CI:0.58~4.59)、基线ALT(每升高1倍正常上限,HR=1.03,95%CI:0.96~1.10[13,41,45];OR=1.0,95%CI:0.99~1.01[34])、是否合并肝硬化(OR=0.89,95%CI:0.25 ~ 3.09[31,50];HR=5.26,95%CI:1.11 ~ 25.00[13])、治疗过程中的YMDD突变[67](OR=1.04,95%CI:0.28~3.83)和治疗结束时抗HBc抗体水平[55](每升高1 lg IU/mL,HR=0.97,95%CI:0.58~1.62)等因素与病毒学复发风险不相关或结果不一致。

图4 治疗结束时HBsAg水平与病毒学复发的相关性(每增加1 log IU/mL,HR)
讨 论
2018年AASLD指南指出,无论是HBeAg阴性还是阳性患者,在制订关于NA停药决策时均应充分权衡利弊,需要考虑患者的复发风险、并发症发生风险以及有无停药后密切监测的条件等[71]。但对于复发风险预测因素目前尚缺乏设计良好的大规模前瞻性研究证实。
本研究分析结果显示,患者的基线年龄(年龄每增加1岁,病毒学复发风险平均相对升高4%)、基线HBV DNA高水平与病毒学复发均相关,与其他既往相关报道相符[3,10,72-75]。 另外,本meta分析对治疗开始后达到完全病毒学应答所需时间、停药时HBsAg水平与停药后病毒学复发的相关性进行了分析;同时对一些新指标如:治疗结束时HBcrAg水平、HBV RNA以及抗HBc定量检测等也尝试进行了分析。结果显示,达到完全病毒学应答所需时间每延长1个月,HR为1.13,提示该时间每延长1个月,病毒学复发风险平均相对升高13%。停药时HBsAg水平每增加1 lg IU/mL的HR为1.81,提示停药时HBsAg每增加1 lg IU/mL,病毒学复发风险平均相对升高81%。对于新型标志物的分析亦显示其预测潜力:治疗结束时HBcrAg水平较高者病毒学复发率较高;接受NA治疗>3年停药的CHB患者中,停药时HBV RNA阳性患者均在停药后24周内病毒反跳,阴性患者中该比例仅为25%[76]; NA治疗结束时抗HBc定量水平较高的患者临床复发风险较低[77]。但目前关于HBcrAg、HBV RNA、抗HBc定量检测的相关文献较少,仍需扩大研究进一步证实其与停药后病毒学复发的相关性。以上meta分析结果提示,在CHB治疗过程中,未获得早期病毒学应答的患者需要密切监测,不能轻易停药;停药时HBsAg水平越低(尤其是转阴或发生血清学转换),在停药后患者的复发率越低。治疗结束时HBsAg水平可能是指导NA停药相对可靠的指标[60,74,75]。
其他可能有意义的病毒学复发预测因素包括:有CHB家族史、基线时存在前C区基因突变和治疗结束时前S1抗原阳性等,但由于大多数仅有一项研究,进一步的相关性分析将有待更大规模的前瞻性研究进行验证。
本文中关于NA疗程的分析未明确显示总疗程或巩固治疗时间与病毒学复发率的相关性,可能与meta分析中纳入研究的药物选择和停药或复发标准不同有关,也与meta分析的数据合成策略有关。例如Chi等[13]报告,与巩固治疗<1年组相比,巩固治疗≥3年的HBeAg阳性和阴性患者病毒学复发率较低(校正HR=0.51;95%CI: 0.25~0.99),但由于该研究采用三层的分层方式,合并数据会导致偏倚过大,因此未被纳入本文巩固治疗时间的meta分析。本研究中采用不同方法评估的性别因素对病毒学复发风险的影响得出的结论不一致,而且OR分析中大多数亚组分析结论也与总分析不一致,可能与研究之间异质性较高,各亚组分析研究数量和样本量较少有关。
本研究的优势在于遵循Cochrane标准,由两位审查员独立筛选研究和提取数据,通过讨论解决争议,并由第三位审查员重复检查提取的数据。因此,研究筛选、数据提取和分析是合格的。而且研究预先定义了一些亚组分析来解释异质性。本研究的局限性在于,虽然纳入64项研究,但由于各项报告的潜在风险因素各异,针对每个风险因素中可用数据较少。而且由于不同研究中NA停药标准、复发标准、巩固治疗时长、患者特征不一,不同研究之间存在异质性。
总之,本文通过meta分析对病毒学复发风险预测因素进行系统分析,为NA停药决策的风险获益评估提供一定参考。单一因素对病毒学复发的预测意义有限,更应在不同治疗时间点对不同因素进行综合评估[75,78],以对CHB患者停药的可能性和复发风险进行更准确的评估。
志谢:Systematic Review Solutions Ltd提供数据分析支持。

