Peg-IFNα-2a联合ADV治疗对高病毒载量e抗原阳性乙肝的疗效观察
周 娟, 张文芳
(湖北省武汉市第五医院内科, 湖北 武汉 430050)
乙型肝炎多由乙型肝炎病毒(HBV)感染所引起,HBV长期可持续的感染可导致肝纤维化或肝硬化,增加肝癌风险。临床针对高病毒载量e抗原(HBeAg)阳性乙肝治疗是将最大限度抑制病毒复制,以达到延缓病情,减少肝脏失代偿,改善预后的目的[1]。聚乙二醇干扰素α-2a(Peg-IFNα-2a)具有发挥抗病毒和调节免疫功能的双重作用,能够实现持久控制机体自身免疫功能,但对高HBV载量HBeAg阳性乙肝的治疗效果不甚满意[2]。阿德福韦酯(ADV)虽抑制病毒复制作用较差,起效缓慢,但却是唯一被证实为可降低肝内共价闭合环状DNA(cccDNA)的核苷(酸)类似物[3]。近年来,Peg-IFNα-2a与ADV联合治疗用于慢性乙型肝炎研究报道相对较多,虽取得一定疗效,但联合治疗时机、疗程及不良反应的报道不一,且停药后HBV-DNA极易反弹甚至恶化,长期应用可能面临耐药性等问题。本研究将上述两者药物联合治疗高病毒载量e抗原阳性乙型肝炎患者,探讨其联合治疗疗效及对血清干扰素-γ(INF-γ)和白细胞介素-10(IL-10)水平和安全性的影响,旨在为临床研究补充数据理论,现报告如下。
1 资料与方法
1.1病例资料:选取2016年3月至2020年3月在我院收治的高病毒载量e抗原阳性乙型肝炎患者132例。纳入标准:符合慢性乙型肝炎的诊断标准[4],HBsAg和HBeAg阳性在6个月及以上,血清丙氨酸氨基转移酶(ALT)升高,血清总胆红素不足3倍正常值上限(ULN),血清HBV DNA≥1×107copies/mL,符合高HBV载量HBeAg乙肝阳性者;年龄在18~70岁者;经医院伦理委员会批准,签署知情同意书者。排除标准:合并其他肝炎病毒等感染者;伴有其他肝脏器质性疾病者;合并恶性肿瘤者;糖尿病未控制者;严重器质性疾病者;精神疾患或认知功能障碍者;妊娠、哺乳期者;近6个月既往抗病毒及免疫调节治疗史者;对本研究药物存在禁忌症或过敏体质者。将入组的132例患者依照入院时间进行编号,由电脑生成随机数字表,以1∶1∶1比例均分为三组(干扰素组、ADV组和联合组),每组44例。三组患者基线资料分布均衡,差异无统计学意义(P>0.05)。见表1。
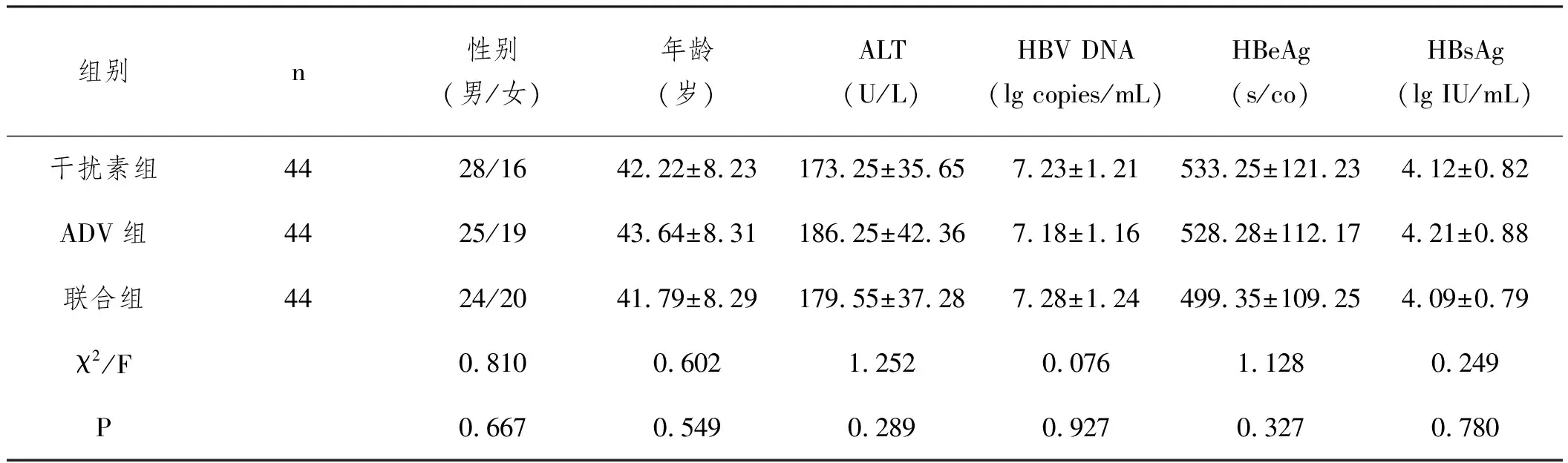
表1 两组基线资料对比
1.2方法: 干扰素组单纯给予聚乙二醇干扰素α-2a(Peg-IFNα-2a)(瑞士 Roche Pharma (Schweiz) Ltd.,注册证号:S20120050,规格:180 μg/支)皮下注射180 μg/次,1次/周;ADV组单纯给予阿德福韦酯(悦康药业集团有限公司,国药准字H20110088,规格:10 mg)(ADV)10 mg/次,口服,每日1次;联合组参照《慢性乙型肝炎抗病毒治疗专家共识》[5]的用药标准,给予Peg-IFNα-2a联合ADV治疗,首先服用ADV 10 mg,qd,检测HBV-DNA 1次/周,当HBV-DNA在(4~5)logl0U/mL时,便可给予Peg-IFNα-2a皮下注射180 μg/次,1次/周。三组治疗周期均为48周。ALT复常率、HBV-DNA阴转率、HBsAg阴转率、HBeAg血清学转换率。
1.3观察指标:于治疗前及治疗48周后,采集三组空腹静脉血,经离心、分离,取上清液冷藏待检。①乙肝病毒标志物转化、血清学标志物转化情况:应用全自动生化分析仪(美国Beckman)及其配套试剂血清ALT水平(ALT<1.0×ULN记为ALT复常);检测采用荧光定量PCR法检测血清乙肝病毒脱氧核糖核酸(HBV-DNA)定量(HBV-DNA定量<2.5lg copies/mL记为HBV-DNA阴转);采用双抗体夹心酶联免疫标记法(ELISA)检测血清HBeAg(测量值为0~0.05IU/mL为阴性),采用化学发光免疫分析法(CLIA)检测HBeAg(测量值为0~1s/co为阴性,样本吸光度值/cut off值)。统计ALT复常率、HBV-DNA阴转率、HBsAg阴转率、HBeAg血清学转换率。②当ALT复常和HBV-DNA阴转、乙型肝炎表面抗原(HBsAg)阴转率、乙型肝炎e抗原(HBeAg)血清学转换共4项指标均符合,即可记为完全应答;上述4项指标中有1项及以上符合者,记为部分应答;未达到以上任何一项者记为无应答。③采用双抗体夹心ELISA法检测干扰素-γ(INF-γ)和白细胞介素-10(IL-10)水平。④安全性评估:治疗期间,密切观察三组患者的症状、体征及不良反应。

2 结 果
2.1乙肝病毒标志物转化、血清学标志物转化情况:联合组的ALT复常率、HBV-DNA阴转率、HBsAg阴转率显著高于干扰素组和ADV组(P<0.0167),HBeAg血清学转换率显著高于ADV组(P<0.0167),见表2。

表2 三组治疗后乙肝病毒标志物转化血清学标志物转化情况对比n(%)
2.2病毒学、血清学应答情况:三组间病毒应答程度对比,差异有统计学意义(P<0.05),其中联合组完全病毒应答程度显著优于干扰素组和ADV组(P<0.0167),见表3。

表3 三组病毒学血清学应答情况对比n(%)
2.3血清INF-γ和IL-10水平:治疗后,三组血清INF-γ显著上升(P<0.05),IL-10水平显著降低(P<0.05),联合组变化幅度显著大于干扰素组和ADV组(P<0.05),见表4。

表4 三组治疗前后血清INF-γ和IL-10水平对比
2.4安全性评估:联合组和干扰素组的流感样症状、失眠、脱发、中性粒细胞数减少、血小板计数减少的发生率对比,差异无统计意义(P>0.0167),均显著高于ADV组(P<0.0167),见表5。
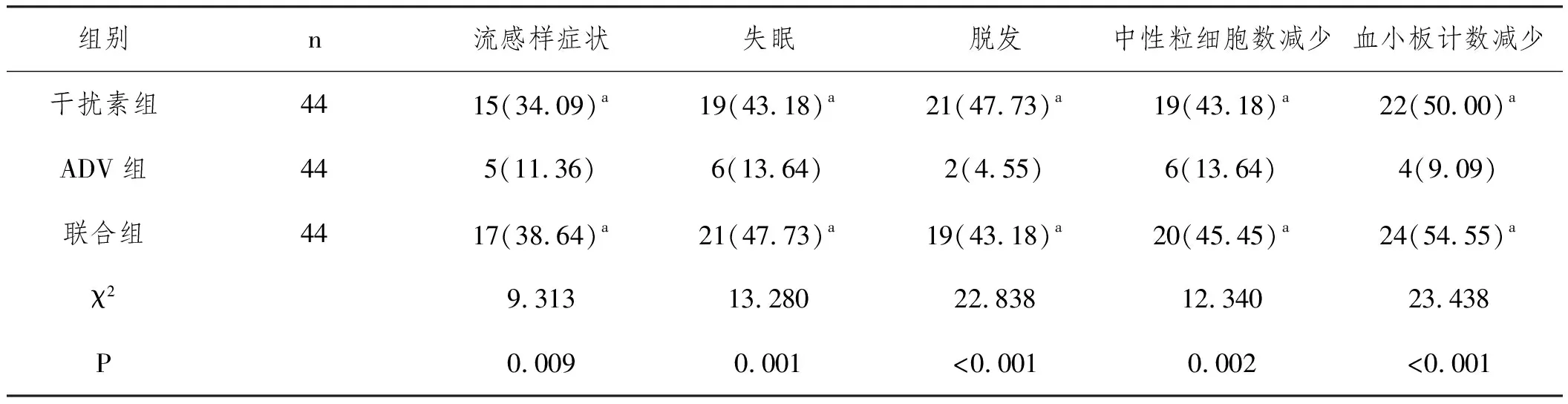
表5 三组安全性评估n(%)
3 讨 论
HBV-DNA持续感染机体是乙肝患者病情进展的关键,由于慢性HBV感染的宿主免疫系统功能紊乱,极易发生持续性感染,进而介导细胞内信号传导通路,刺激后调控免疫活性细胞、炎性介质、细胞因子等表达,在参与肝组织病理损伤过程中发挥重要作用。我国《慢性乙型肝炎防治指南》(2010版)明确指出,慢性乙肝患者在适应证且条件允许下,应接受规范的抗病毒治疗。Peg-IFNα-2a是目前治疗HBV的一线抗病毒药物,属于目前,临床针对乙肝患者的抗病毒药物主要分为干扰素一和核苷(酸)类两大类,其一种长效干扰素,可作为高HBV载量HBeAg阳性乙肝患者的首选治疗药物,能够获得较满意的病毒学及血清学转换,药物安全性良好,但单纯使用效果不佳[6]。ADV则是一种核苷(酸)类(NUCs)抗病毒药物,进入机体内可迅速代谢为阿德福韦(PMEA),经磷酸化二磷酸盐-PMEApp,并竞争性抑制HBV-DNA聚合酶合成,同时,PMEA还可整合至HBV-DNA链中,引起DNA链延长终止,阻止HBV-DNA链持续性复制,达到良好抗病毒效果,ADV可作为目前唯一能够降低cccDNA的NUCs,但抗毒效果不及比拉米夫定、替比夫定等药物,起效较缓慢[7]。相关研究[8]表明,HBeAg阳性乙肝患者无论选择单纯治疗还是联合治疗均提高HBeAg的血清学转换率,但采用联合治疗可降低随访后的病毒学反弹率。陈若雷等[9]也报道了针对耐药慢性乙肝患者的优化治疗,应选用抗病毒良好、调节免疫、低耐药突变率、安全性良好的联合方案十分必要,能有效改善肝脏功能。本文针对我院高HBV载量HBeAg阳性乙肝患者,首先采用ADV降低HBV高载量,再联合pegIFNat-2a抗病毒治疗,取得满意疗效。
ALT复常、HBV-DNA阴转率、HBeAg血清学转换和(或)HBsAg阴转率是评价高HBV载量HBeAg阳性乙肝患者抗HBV疗效满意的理想终点。本文将Peg-IFNα-2a联合ADV治疗,其ALT复常率、HBV-DNA阴转率、HBsAg阴转率显著高于上述两者单纯用药组,HBeAg血清学转换率明显高于单纯ADV治疗组,病毒学、血清学应答情况改善优于以上两者单纯用药组,分析其作用机制可能在于ADV对高病毒载量起到明显抑制作用的同时,还可增加机体对Peg-IFNα-2a的应答,以发挥协同作用,可获得高病毒学应答和高血清学应答的双重疗效。王波等[10]学者指出,ADV联合pegIFNat-2a抗病毒治疗能明显提高前C区/BCP突变慢性乙型肝炎患者的随访后联合应答率,但关于pegIFNat-2a联合的时机仍有待探究,且提高联合应答率的结论是否能推广pegIFNat-2a和拉米夫定、恩替韦卡等其他药物联合治疗仍尚不十分明确。武晓丽[11]报道称,先ADV降低HBV高载量水平,再给予pegIFNat-2a的序贯治疗,能获得满意的HBe Ag消失和血清转换率,且效果优于两者药物同时联合干预,对降低pegIFNat-2a用药时间和剂量具有一定指导意义。
其次,本文中联合组的血清INF-γ明显上升,IL-10水平显著降低,均低于干扰素组和ADV组,分析原因,IL-10高水平表达可拮抗INF-γ的分泌,进而削弱INF-γ对HBV的杀灭作用,而Peg-IFNα-2a可增强INF-γ的活性表达,并抑制IL-10合成,促使Th0细胞分化为Thl细胞,有效调节Thl/Th2细胞平衡的分子学机制。因此,进一步说明,上述两者药物联合使用能够明显提高机体免疫应答能力,提高抑制病毒复制能力和病毒学应答率。最后,既往研究发现,联合组和干扰素的流感样症状、失眠等不良反应发生率虽高于ADV组,但联合组并未增加不良反应发生率,且以上不良反应无需特殊处理,经1~2周后患者可自行改善,提示Peg-IFNα-2a和ADV联合用药安全性良好。
综上所述,临床针对高HBV载量HBeAg阳性乙肝患者,首先给予ADV治疗控制病毒载量下降后,再进行联合Peg-IFNα-2a治疗,可有效调节机体免疫应答能力,提高抑制病毒复制能力和病毒学应答率,药物安全性良好。

