普通白菜薹茎亮绿性状遗传规律研究及基因定位
胡 阳 宋莉萍 汪爱华* 梁红艳 邱文兵 蔡美仲 崔晓培 高长斌 周国林 李 平*
(1 荆州农业科学院,湖北荆州 434007;2 武汉市农业科学院,湖北武汉 430070)
普通白菜〔Brassica campestrisL.ssp.chinensis(L.)Makino var.communisTsen et Lee〕为十字花科芸薹属白菜亚种一年生或二年生草本植物,俗称小油菜、青菜。常规普通白菜的叶片和薹茎表皮覆有较厚的蜡质,色泽多为绿色或暗绿色且无光泽,而亮绿普通白菜的叶片和薹茎表皮蜡质极少、呈亮绿色有光泽。亮绿突变体的发现对于丰富普通白菜种质资源和新品种选育具有十分重要的意义,研究其遗传规律并定位突变基因可为普通白菜薹茎亮绿性状在育种中的应用和基因的克隆提供理论基础。
植物表皮蜡质可分为内表皮蜡质和外表皮蜡质,内表皮蜡质填充于角质层内,外表皮蜡质在角质层外层组装成不同形态的蜡质晶体(包括片状、丝状、棒状、管状、颗粒状等)(Eglinton & Hamilton,1967;Barthlott et al.,1998;Jenks et al.,2002;Jetter et al.,2006)。许多植物表皮均覆有一层蜡质,其蜡质组成和含量会因为物种及其器官的不同而有所变化,同一植物因生长时期、组织器官不同,其蜡质成分和含量也有所差异(Post-Beittenmiller,1996;Jetter & Schäffer,2001)。植物表皮的蜡质生物合成及运转调控机制十分复杂,突变体材料由于蜡质总量的减少或组分的改变而呈现亮绿有光泽的表型(Aarts et al.,1995)。Dellaert(1979)报道了第1 个拟南芥蜡质突变体eceriferum(cer),此后在许多植物中均开展了蜡质遗传和基因方面的研究。对不同植物的蜡质遗传规律研究发现,蜡质缺失或减少的遗传以单基因隐性遗传为主(Anstey & Moore,1954;Tatlioglu,2006;Farnham,2010;Zhang et al.,2013a;Liu et al.,2017a),单基因显性遗传(Mo et al.,1992;Pu et al.,2013;Tang et al.,2015;Liu et al.,2017b)、不完全显性遗传(Priestley & Wills,1966)和双基因隐性遗传(周熙荣 等,1995;Zhang et al.,2013b)较少。对蜡质合成及代谢相关基因的研究发现,在拟南芥中的CER1、CER2、CER3、CER4、CER6/CUT1、CER8、WAX2、WIN1等基因(Aarts et al.,1995;Hannoufa et al.,1996;Negruk et al.,1996;Xia et al.,1996;Fiebig et al.,2000;Hooker et al.,2002;Chen et al.,2003;Broun et al.,2004;Rowland et al.,2006;Lü et al.,2009;Bernard et al.,2012),水稻中的WSL1、WSL2、WSL3、WSL4、OsGL1-1等基因(Yu et al.,2008;Qin et al.,2011;Mao et al.,2012;甘露,2016),玉米中的GL1、GL2、GL8等基因(Xu et al.,1997;Velasco et al.,2002;Sturaro et al.,2005)参与编码蜡质合成或代谢相关的酶或蛋白质。本试验以2015 年3 月在武汉市农业科学院蔬菜研究所试验基地发现的薹茎亮绿的普通白菜突变体自交系Q161 和常规有蜡质自交系Q195 为亲本,构建6 世代群体,对普通白菜薹茎亮绿性状遗传规律进行分析;利用BSA-seq 技术结合双亲的InDel 标记开发,对控制薹茎亮绿性状的基因进行初定位研究,以期为普通白菜薹茎亮绿基因的克隆和功能分析奠定基础。
1 材料与方法
1.1 试验材料
试验于2017—2019 年在武汉市农业科学院蔬菜研究所试验基地进行。参试普通白菜自交系Q161 和Q195 均为武汉市农业科学院蔬菜研究所收集并经多代自交选育获得,其中Q161 薹茎亮绿、无明显蜡质,抽薹期早,薹茎较细,叶片较小,植株开展度较小,植株生长势弱于有蜡质材料;Q195薹茎有蜡质、灰绿色,抽薹期晚,薹茎粗大,叶片较大,植株开展度较大。
1.2 试验方法
1.2.1 6 世代群体构建及表型鉴定 2017 年8 月底在武汉市农业科学院蔬菜研究所试验田播种Q161(P1)和Q195(P2)种子,12 月底定植于大棚,2018 年3 月杂交获得F1种子;5 月对双亲及F1种子进行催芽,并利用4 ℃冰箱低温春化15 d,春化完成后播种于加代温室,待植株开花后利用F1自交并分别和双亲回交获得F2、BC1P1、BC1P2群体;9 月将亲本和各群体材料种子播于穴盘中,幼苗3~5 片真叶时定植于露地,2019 年3 月植株经过低温春化后抽薹,薹茎高度50 cm 左右时进行表型鉴定,记录各群体中有、无蜡质植株数,采用Excel 软件进行卡方测验。
1.2.2 DNA提取、PCR扩增和Qsep400TM分析采用CTAB 法(Murray & Thompson,1980)提取植株幼嫩叶片DNA,浓度稀释到40~50 ng·μL-1备用。PCR 反应体系为20 μL:DNA 模板2 μL,上下游引物各1 μL,PCR Mix 8 μL,ddH2O 8 μL。PCR 反应程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,循环35 次;72 ℃延伸10 min。PCR 扩增产物通过Qsep400TM核酸蛋白分析仪进行检测。
1.2.3 BSA-seq 分析 在F2群体中挑选24 株薹茎亮绿单株和24 株薹茎有蜡质单株,分别提取DNA并通过琼脂糖凝胶电泳分析DNA 的纯度和完整性,采用Qubit 荧光计对DNA 浓度进行精确定量,检测合格的DNA 样品备用。将稀释后的24 株薹茎亮绿单株DNA 等量混合构建混池1,24 株薹茎有蜡质单株DNA 等量混合构建混池2。同时提取双亲DNA,质检合格后备用。利用Illumina HiSeqTMPE150 对2 个子代池进行基因组30×重测序,对2个亲本进行基因组20×重测序。参考基因组选择白菜基因组Brapa_genome_v3.0(http://brassicadb.org/brad/datasets/pub/Genomes/Brassica_rapa/V3.0/),大小为353 140 194 bp。将测序所得数据与白菜基因组进行比对,分析测序深度及覆盖度,数据质量和比对均合格后用于后续分析。选择亲本重测序数据作为参考,分析2 个混池在亲本间的SNP 和InDel频率并预测候选区间。
1.2.4 InDel 标记开发 利用普通白菜参考基因组作为“桥梁”,结合双亲的基因组重测序数据分析双亲之间的InDel 差异;根据亲本的InDel 信息,提取InDel 上下游各100 bp 的序列,并根据上下游序列设计引物,引物的TM 值在55 ℃左右,长度18~22 bp。最后通过Blast 比对,筛选特异扩增的多态性InDel 标记。
2 结果与分析
2.1 普通白菜薹茎亮绿性状的遗传规律分析
2019年3月,在植株抽薹期对F1、F2、BC1P1、BC1P2群体进行薹茎亮绿和有蜡质性状调查。其中,F1共4 株,薹茎均有蜡质;F2共328株,薹茎有蜡质植株256 株,薹茎亮绿植株72 株,分离比例为3.56∶1,经卡方检验符合3∶1(χ2=1.47 <=3.84);BC1P1共71 株,薹茎有蜡质植株41株,薹茎亮绿植株30株,分离比例为1.37∶1,经卡方检验符合1∶1(χ2=1.41 <=3.84);BC1P2共72 株,薹茎均有蜡质(表1)。推测普通白菜薹茎亮绿性状由1 对隐性基因控制。

表1 普通白菜薹茎亮绿性状的遗传分析
2.2 BSA-seq 分析及候选区间预测
通过基因组重测序技术共产生原始数据62.545 Gb,过滤后的有效数据为62.431 Gb,各样本的原始数据量在12~20 Gb 之间,测序质量高(Q20 ≥95.72%、Q30 ≥89.54%),GC 含量在38.59%~38.72%之间。4 个样本的比对率在96.93%~97.71%之间,对参考基因组(排除N 区)的平均覆盖深度在29.35×~47.74×之间,1×覆盖度(至少有1 个碱基的覆盖)在90.70%以上。基于基因分型的结果,在2 个亲本间共筛选出910 350 个多态性SNP 位点和243 311 个多态性InDel 位点。分析2 个混池的InDel 频率差异分布,将A09 染色体的末端作为候选区间(图1)。同时根据子代和亲本的SNP 和InDel 频率比较,结合ANNOVAR 注释信息共筛选到101个候选SNP位点和56 个候选InDel 位点,位于A09 染色体的44.1~45.0 Mb 区间。
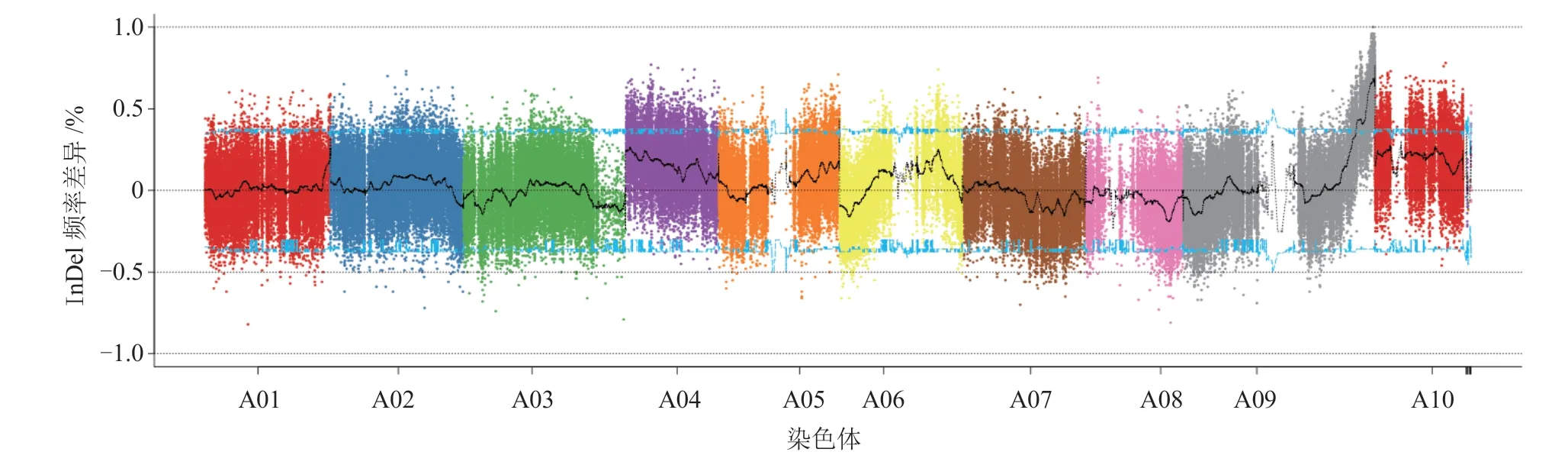
图1 2 个混池的InDel 频率差异在染色体上的分布
2.3 基因定位结果验证
在A09 染色体的末端30~45 Mb 区间开发设计116 对InDel 引物,利用这116 对InDel 引物对亲本和F2单株极端混池进行PCR 扩增,并通过Qsep400TM检测筛选到特异性引物Br100、Br112、Br116(表2、图2)。在F2群体中检测发现这3 对引物扩增片段的基因型和表型共分离(图2)。利用这3 对引物对BC1P1的30 株薹茎亮绿单株和F2的72 株薹茎亮绿单株进行检测,在Br100 上筛选到20 个重组单株,在Br112 上筛选到4 个重组单株,在Br116 上筛选到1 个重组单株,Br100和Br112 在目的基因的同侧(图3)。在Br112 和Br116 染色体区段内继续设计合成18 对引物,通过对双亲和混池的PCR 扩增筛选到3 对较好的特异性引物Br117、Br119、Br134(表2、图4),利用这3 对引物对F2和BC1P1群体中的薹茎亮绿单株进行检测,在Br117 和Br119 上分别筛选到4 个重组单株和1 个重组单株(重组单株位于Br112 同侧),Br134 未筛选到重组单株。综上,初步将普通白菜薹茎亮绿基因定位在A09 染色体的标记Br119和Br116 之间,2 个标记间的物理距离为380 kb(图3)。
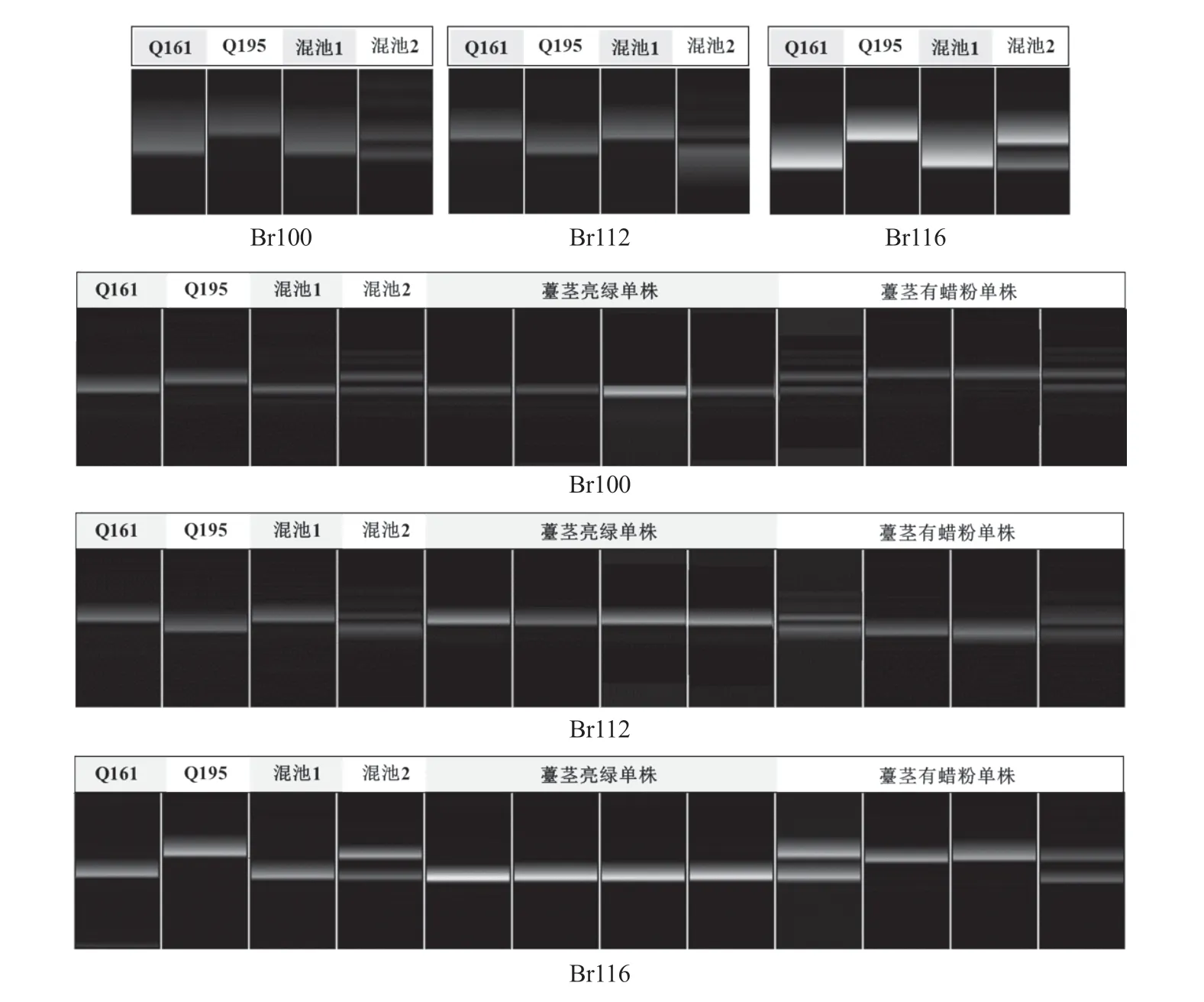
图2 引物Br100、Br112、Br116 在双亲、极端混池及F2 群体中的扩增结果
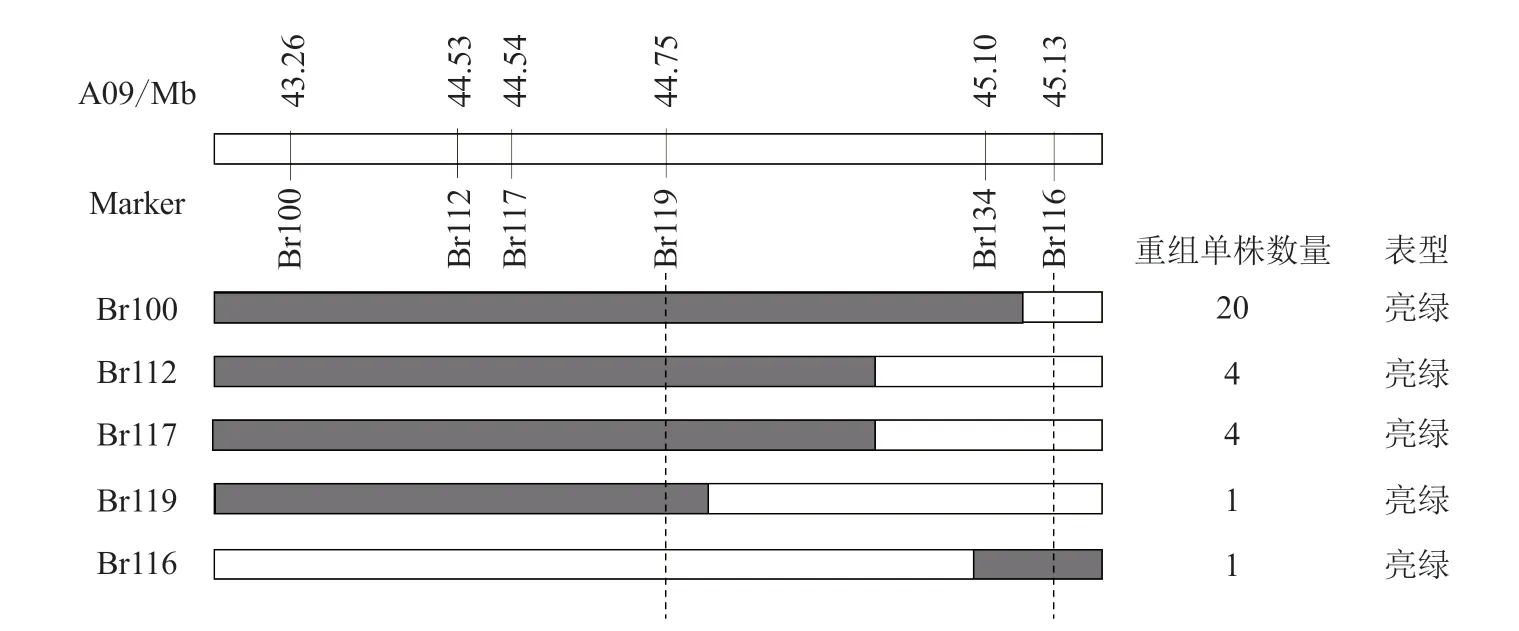
图3 普通白菜薹茎亮绿性状基因定位物理图谱
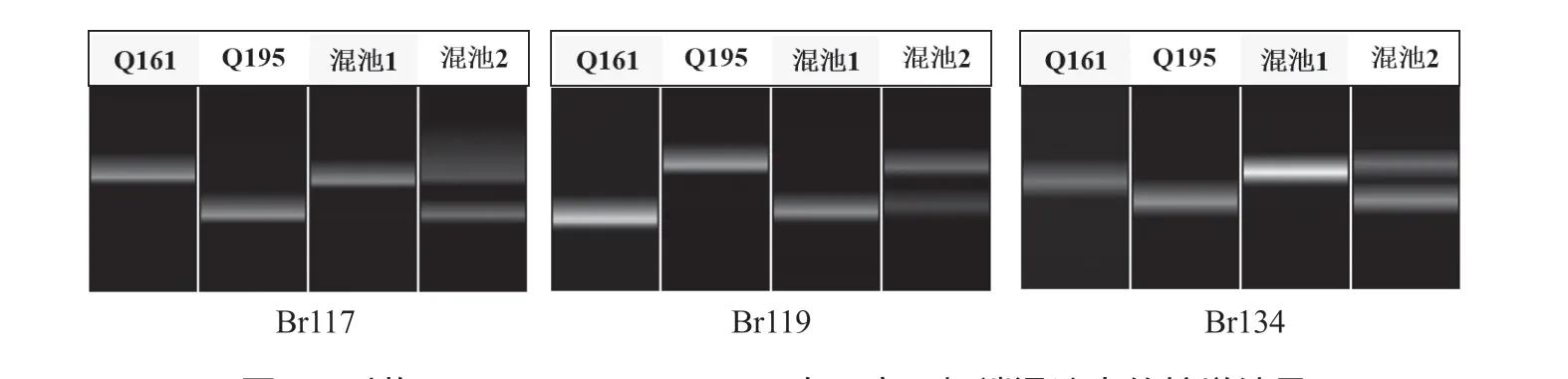
图4 引物Br117、Br119、Br134 在双亲、极端混池中的扩增结果

表2 6 对InDel 特异性引物及其序列
3 结论与讨论
十字花科芸薹属作物中白菜类、结球甘蓝、甘蓝型油菜、青花菜等均有关于蜡质研究的报道。其中在青花菜、普通白菜、青梗菜、红菜薹中发现蜡质缺失性状受1 对隐性基因控制(Anstey & Moore,1954;冯辉 等,2010;Zhang et al.,2013a;李红莲,2014);在甘蓝型油菜中发现蜡质缺失性状受1 对显性基因控制(Pu et al.,2013);在结球甘蓝中发现蜡质缺失性状有隐性遗传(刘东明 等,2014;Tang et al.,2015;Liu et al.,2017b),也有显性遗传(Liu et al.,2017a)。上述研究表明芸薹属不同作物和同种作物的不同材料之间蜡质性状遗传有所差异。本试验中,普通白菜自交系Q161 的薹茎亮绿蜡质缺失性状受1 对隐性基因控制,与曹阳等(2008)、Wang 等(2017)的研究结果一致。
本试验在明确普通白菜薹茎亮绿性状遗传规律的基础上,利用BSA-seq 分析预测候选区间,并开发InDel 标记验证候选区间,最终将薹茎亮绿基因定位在A09 染色体末端380 kb 的区间内,与其最近的标记分别为Br119 和Br116。根据白菜基因组注释信息,定位区间内有1 个与拟南芥蜡质合成基因CER1同源的基因Bra032670(即BrCER1)。CER1基因主要在茎、花和果实的表皮中表达,CER1 蛋白包含铁结合(富含组氨酸)结构基元(Aarts et al.,1995),参与醛脱羧成烷烃的生物合成(Hannoufa et al.,1993)。Wang 等(2017)利用同源克隆方法克隆普通白菜的BrCER1基因,序列比对发现在无蜡质突变体13S126 中Brcer1基因发生1 个39 bp 的缺失,引起mRNA 转录错乱,进而导致BrCER1基因的表达量在13S126 中下降。孙红等(2017)通过RT-PCR 对大白菜蜡粉合成基因进行分析,也初步证实了基因Bra032670与大白菜叶片表皮蜡粉合成有关。在结球甘蓝中,控制无蜡质性状的Cgl1基因(CER1同源基因)在第1 个内含子上有1 个2 722 bp 的插入,导致Cgl1起始密码子发生移位(Liu et al.,2017a)。Pu 等(2013)在研究甘蓝型油菜的无蜡质基因BnA.GL时,将BnA.GL基因定位在9 号染色体末端,但对定位区间内BnCER1基因(CER1同源基因)克隆时发现野生型和突变体材料之间该基因序列没有明显差异,仅在第5 个内含子内部有3 个SNP 的差异,基因表达分析发现在无蜡质亲本中BnCER1基因的表达量下降。总结前人研究发现,CER1的同源基因是芸薹属作物中参与蜡质合成的重要基因,但在不同作物中该基因变异位点差异很大,可能和物种基因进化及突变有关。这些结果为研究芸薹属作物的蜡质基因和功能分析代谢提供了一定的理论研究基础,同时也为相关作物育种提供了应用研究基础。

