营养性肥胖高血压大鼠动物模型的建立与评价
王 静,董振华,符德玉,桂明泰,姚 磊,芦 波,李建华,周训杰
(上海中医药大学附属岳阳中西医结合医院心内科,上海 200437)
肥胖和高血压是心血管疾病发病和病死的主要原因,肥胖促使多种心血管疾病危险因素聚集,加速高血压及心血管并发症的发生发展进程[1]。超重和肥胖及相关糖脂代谢紊乱已成为我国高血压患病率快速增长的主要原因之一[2]。肥胖高血压的发病机理及干预防治已成为相关领域研究的热点与难点。自发性高血压大鼠(SHR)与Wistar-Kyoto(WKY)大鼠是常用的疾病模型大鼠,都属于突变系大鼠,均由封闭群大鼠Wistar品系繁殖而来[3-4]。SHR是20世纪60年代由日本科学家提出的一种不需药理或手术干预的实验性高血压动物模型[5],是通过选择性近亲交配获得稳定遗传的高血压后代。WKY大鼠作为SHR的正常血压对照组,是20世纪70年代美国NIH从日本京都引进Wistar大鼠后,通过近亲繁殖培育而成的。本研究采用高脂定制饲料喂养自发性高血压大鼠,以期复制出与人类肥胖高血压相似的疾病动物模型,并从行为学、理化指标等方面进行评价,以期为相关实验研究奠定前期基础。
1 实验材料
1.1 实验动物
120只5周龄SPF级雄性自发性高血压大鼠(spontaneous hypertensive rat,SHR),体质量(150±20)g,12只SPF级周龄/性别相匹配的正常血压京都种大鼠(Wistar-Kyoto Rat,WKY),体质量(150±20)g,二者均购自北京维通利华实验动物技术有限公司[动物许可证号:SCXK(北京)2016-0006]。所有大鼠自由饮水摄食,饲养于上海中医药大学附属岳阳中西医结合医院实验动物中心的局部屏障系统中,温度(22±2)℃,光照/黑暗周期12/12 h。
1.2 实验饲料
普通饲料及高脂定制饲料均由上海普路腾生物科技有限公司提供[生产许可证编号:沪饲证(2014)04001]。普通饲料主要原料:鱼粉、小麦、玉米、豆粕、麸皮、维生素、矿物质、氨基酸等;高脂定制饲料配方参考文献[6]进行改进:普通饲料60%、猪油12%、蔗糖5%、蛋黄粉10%、奶粉3%、生花生4.7%、麻油1%、食盐2%、胆固醇2%、胆盐0.3%。高脂饲料置于冰箱保存,每日投放。
1.3 主要仪器材料
智能无创血压计-鼠仪(北京软隆生物技术有限公司),全自动生化分析仪(科华生物工程有限公司),大鼠胰岛素酶联免疫检测试剂盒(上海源叶生物科技有限公司)。
2 实验方法
2.1 造模与分组
适应性喂养1周后,12只WKY继续喂食普通饲料(WKY-ND组,n= 12),120只SHR根据体质量随机分为SHR普通饲料组(SHR-ND组,n=12),SHR高脂饲料组(SHR-HF组,n= 108)。造模干预10周。
2.2 造模成功标准
10周后,将SHR-HF组体质量位于上游前1/3大鼠判定为肥胖高血压大鼠(OBH-HF组,n= 36)[7]。
2.3 生理指标测定
造模前及造模后每2周测量所有大鼠体质量、腹围(腹部经剑突与后肢间垂直距离中点一周的长度[8])及体长(鼻尖至肛门长度[9]),结合对应体质量计算Lee指数[Lee指数=体质量(g)1/3 ×103/体长(cm)],做好记录。
2.4 收缩压测定
造模前及造模后每2周测量所有大鼠收缩压并记录。测定方法:13时至17时将大鼠放至保温装置中固定并预热约15 min,使用尾动脉加压法测量大鼠日间清醒状态下收缩压,连续测量3~5次,取平均值并记录。
2.5 易激惹程度测定
造模前后分别进行易激惹程度观察并积分。易激惹程度的积分标准参考文献[10-11]拟定:1分,捉持颈部时尖叫、惊跳;2分,捉持颈部时激怒欲咬人;3分,提尾部时即尖叫、惊跳,甚至欲咬人或同笼大鼠频繁打斗,频咬铁笼;上述情况不明显为0分。
2.6 糖脂代谢指标测定
造模结束时,WKY-ND组大鼠、SHR-ND组大鼠分别随机选取6只,OBH-HF组大鼠随机选取18只,禁食12 h处理,行眼眶后静脉丛采血0.5~1 mL,离心3 000转,8 min,吸取上层血清,采用全自动生化分析仪测定TG、TC、LDL-C、HDL-C、FBG水平,ELISA法检测FIN水平并计算HOMA-IR。
2.7 统计学方法
采用SPSS 25.0进行数据统计分析,计量资料以均数±标准差(±s)表示,多样本均数比较,符合正态分布及方差齐性时采用单因素方差分析,等级资料采用Ridit分析。以P<0.05表示差异有统计学意义。
3 结果
3.1 各组大鼠造模前后收缩压比较
见表1。
表1 各组大鼠造模前后收缩压比较(±s) mm Hg
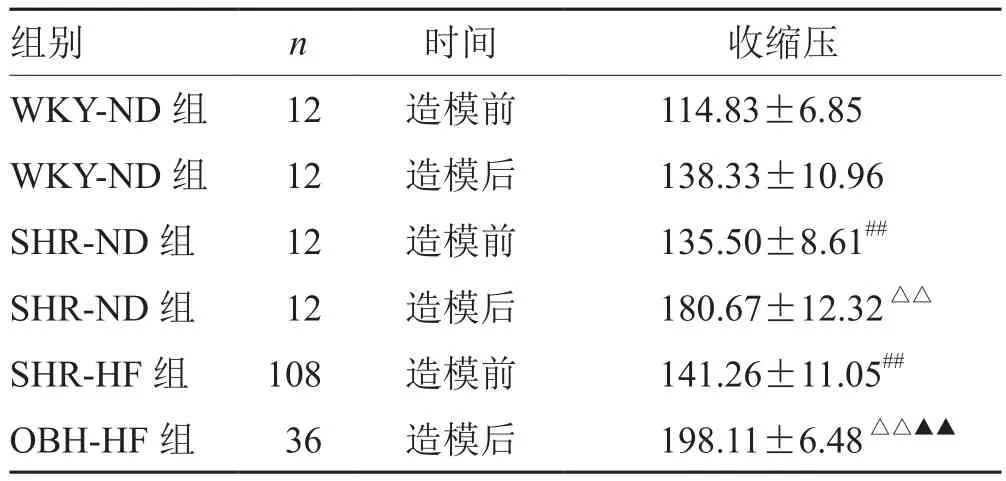
表1 各组大鼠造模前后收缩压比较(±s) mm Hg
注:与WKY-ND组比较,## P<0.01,△△P<0.01;与SHR-ND组比较,▲▲P<0.01
组别 n 时间 收缩压WKY-ND组 12 造模前 114.83±6.85 WKY-ND组 12 造模后 138.33±10.96 SHR-ND组 12 造模前 135.50±8.61##SHR-ND组 12 造模后 180.67±12.32△△SHR-HF组 108 造模前 141.26±11.05##OBH-HF组 36 造模后 198.11±6.48△△▲▲
3.2 各组大鼠造模前后易激惹程度积分比较
见表2。
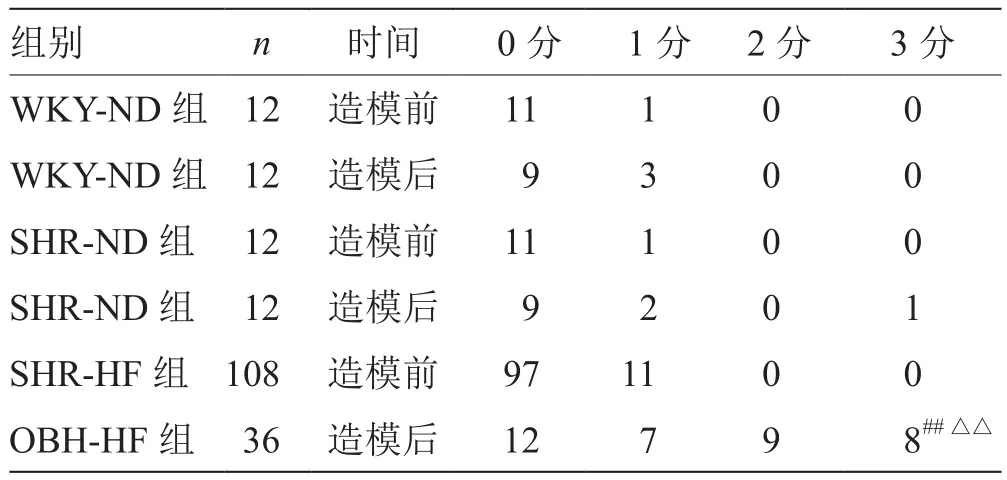
表2 各组大鼠造模前后易激惹程度积分比较 只
3.3 各组大鼠造模前后体质量、Lee指数、腹围比较
见表3。
表3 各组大鼠造模前后体质量、Lee指数、腹围比较(±s)
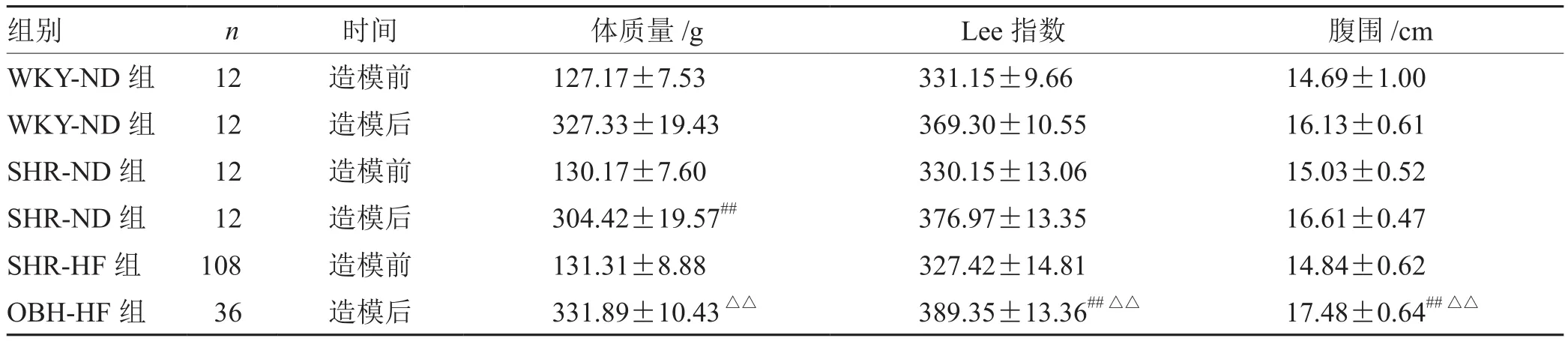
表3 各组大鼠造模前后体质量、Lee指数、腹围比较(±s)
注:与WKY-ND组比较,## P<0.01;与SHR-ND组比较,△△P<0.01
组别 n 时间 体质量/g Lee指数 腹围/cm WKY-ND组 12 造模前 127.17±7.53 331.15±9.66 14.69±1.00 WKY-ND组 12 造模后 327.33±19.43 369.30±10.55 16.13±0.61 SHR-ND组 12 造模前 130.17±7.60 330.15±13.06 15.03±0.52 SHR-ND组 12 造模后 304.42±19.57## 376.97±13.35 16.61±0.47 SHR-HF组 108 造模前 131.31±8.88 327.42±14.81 14.84±0.62 OBH-HF组 36 造模后 331.89±10.43△△ 389.35±13.36##△△ 17.48±0.64##△△
3.4 各组大鼠造模后糖脂代谢指标比较
见表4。
表4 各组大鼠造模后糖脂代谢指标比较(±s)
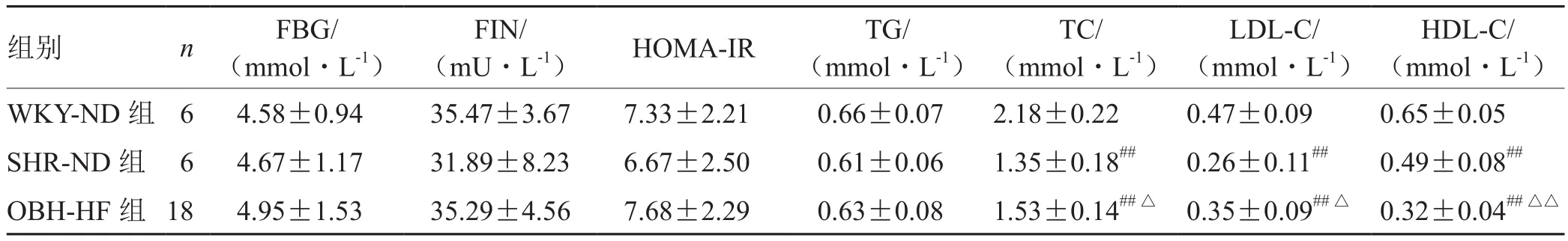
表4 各组大鼠造模后糖脂代谢指标比较(±s)
注:与WKY-ND组比较,## P<0.01;与SHR-ND组比较,△P<0.05,△△P<0.01
组别 n FBG/(mmol·L-1)FIN/(mU·L-1) HOMA-IR TG/(mmol·L-1)TC/(mmol·L-1)LDL-C/(mmol·L-1)HDL-C/(mmol·L-1)WKY-ND 组 6 4.58±0.94 35.47±3.67 7.33±2.21 0.66±0.07 2.18±0.22 0.47±0.09 0.65±0.05 SHR-ND 组 6 4.67±1.17 31.89±8.23 6.67±2.50 0.61±0.06 1.35±0.18## 0.26±0.11## 0.49±0.08##OBH-HF组 18 4.95±1.53 35.29±4.56 7.68±2.29 0.63±0.08 1.53±0.14##△ 0.35±0.09##△ 0.32±0.04##△△
4 讨论
SHR血压升高与人类高血压类似,均由多基因遗传决定并受环境因素(包括饮食中的钠、压力、肥胖等)影响[12]。SHR出生后血压随鼠龄不断升高,早期出现血管阻力增加,交感神经过度激活[13],4周龄时出现心脏重量增加,之后随血压升高进一步出现心血管并发症[14]。因此,本研究以目前国际公认的接近人类原发性高血压的疾病动物模型SHR为基础进行研究。
基因与环境相互作用在人类疾病的病因学研究中越来越受到重视[15-17],大鼠的自发突变和选择性繁殖为肥胖、高血压、高脂血症等疾病提供了互补模型[18-19]。在啮齿类动物中,热量摄入增加导致肥胖及代谢并发症的发生与人类肥胖相关疾病的发生发展类似[15]。针对肥胖高血压动物模型,有研究者利用高脂饲料喂养Sprague-Dawley大鼠品系,但后期仅部分大鼠出现血压升高、血脂异常及肥胖,亦有研究者从Sprague-Dawley品系与SHR品系杂交出的后代中分离出一种新的突变鼠系,虽表现出血压升高及高度肥胖,但不能较好地模拟肥胖作为血压升高的后天因素[20-21]。肥胖Zucker大鼠(OZRs)是一种具有瘦素受体基因自发突变的大鼠品系,虽然会表现出遗传性肥胖及高血压,并伴有胰岛素抵抗等代谢紊乱,但瘦素受体基因突变在人类中极为罕见[22],人类肥胖及相关性疾病涉及多基因,Zucker 大鼠的研究结果就不能简单应用于人类肥胖高血压的研究。研究[23-24]表明,SHR高脂饮食喂养后会出现体质量增加、血清胆固醇升高、血压升高并伴随心血管功能障碍,亦有报道其出现体质量增加、收缩压升高但不伴随血脂、胰岛素抵抗异常者,这是因为各代谢参数的变化与实验持续时间、开始喂养的年龄及膳食成分的不同有关。总之,利用高脂饮食喂养SHR诱导建立肥胖高血压疾病模型是可行且有依据的。
本研究参考相关文献改进高脂饲料配方喂养SHR,干预10周结束后,筛选体质量位于上游前1/3大鼠为肥胖高血压模型大鼠。除体质量外,本研究选取Lee指数及腹围衡量大鼠的肥胖程度。Lee指数被称为“营养比”或“李指数”,可以综合反映体质量与体长的比例关系,能更好地反映大鼠肥胖程度,腹围大小可更好衡量腹型肥胖与否。本研究还发现肥胖高血压大鼠伴随血压升高,易激惹程度较普通饲料喂养的SHR更为明显,曾出现打斗致伤(后颈部、耳部等)。以上从大鼠行为学(易激惹程度)及各生理指标包括体质量、Lee指数、腹围、收缩压等方面支持模型成功建立。肥胖高血压常伴随多种心血管危险因素如代谢综合征、血脂异常、血糖异常等[25]。本研究生化指标检测结果提示:10周后,肥胖高血压大鼠较普通饲料高血压大鼠TC、LDL-C升高,HDL-C降低,出现了脂代谢紊乱,可佐证模型成功建立,TG及FBG虽没有统计学差异,但呈现出上升趋势,且本研究后续观察到高脂饲料喂养20周后,肥胖高血压大鼠较普通饲料高血压大鼠FBG明显升高并表现出了胰岛素抵抗。WKY普通饲料大鼠TC、LDL-C、HDL-C与其余2组的差异,在综合考虑大鼠品系、膳食成分、干预周期等不同的前提下,与相关文献报道基本一致[26-27]。此外,本研究虽充分考虑到人类肥胖高血压中遗传因素的主导地位及后天环境因素影响,但还存在不足之处,针对后天饮食因素对肥胖高血压影响,补充WKY高脂饲料组,会使实验设计更加完善。
综上所述,本研究以高脂饲料喂养自发性高血压大鼠成功诱导建立肥胖高血压疾病动物模型,并在行为学、理化指标等方面与临床肥胖高血压病理特点基本相符,对研究肥胖高血压及相关并发症,值得借鉴利用。

