CXCL12/CXCR4与子痫前期及其肝功能异常的相关性研究*
蒋晓敏 周小娟 李意
子痫前期(preeclampsia,PE)是妊娠期一种特有的高血压疾病,有调查表明其影响全球0.2%~9.2%的孕妇,是导致母婴发病及死亡的主要原因之一[1],其早期被定义为在妊娠20周后出现的妊娠特异性综合征,除高血压外,其他临床表现如蛋白尿、全身性水肿也是子痫前期患者最常见的症状和体征[2,3]。子痫前期的发病机制尚未完全明确,目前被大众认可的学说是滋养细胞侵袭不足,释放免疫-炎症细胞因子,导致血管内皮损伤及全身炎症反应[4]。目前已有大量研究[5-8]表明趋化因子与其受体结合在胚胎发育、血管生成及母体免疫-炎症反应等多种生理或病理过程中发挥重要作用。其中趋化因子12(CXC chemokine ligand,CXCL12)又称为基质细胞衍生因子-1(stromal cell-derived facror-1),与趋化因子受体4(CXC chemokine receptor 4,CXCR4)结合可以通过调控下游信号分子通路,促进Th1类细胞分泌抗炎细胞因子,使母胎界面保持免疫耐受状态[9],且CXCL12/CXCR4已被证实广泛表达于脑、心脏、肝、肾、脊髓等部位,参与细胞免疫调控的过程[10]。国内有报道[11]显示CXCL12/CXCR4表达下调造成母体免疫-炎症失衡、滋养细胞侵袭不足及子宫螺旋动脉重塑不全,从而导致子痫前期的发生。同时相关研究发现CXCL12/CXCR4水平的变化与肝功能异常也有一定相关性[12-13],并且CXCL12/CXCR4信号通路在慢性肝病中发挥重要的保护作用[14]。本研究通过检测血清中CXCL12/CXCR4、ALT及AST水平,探讨CXCL12/CXCR4在子痫前期中的作用及参与子痫前期患者肝功能异常的发病机制。
资料与方法
1 一般资料 选择2018年5月~2019年5月在安徽医科大学附属妇幼保健院住院分娩的子痫前期患者65例为PE组,将PE患者进一步分为轻度PE患者23例(轻度PE组)和重度PE患者42例(重度PE组),选择同时期正常晚期妊娠孕妇51例为对照组。入组标准:(1)符合子痫前期、轻度子痫前期及重度子痫前期的诊断标准,参照全国统编教材第9版《妇产科学》[15];(2)单胎,孕>20周;(3)年龄18~45岁(4)无其他产科合并症及并发症;(5)既往无炎症性疾病及内分泌系统、自身免疫系统疾病;(6)所有孕妇均以剖宫产终止妊娠;(7)以上病例均未经特殊药物治疗,并经副主任医师及以上人员诊断后纳入研究对象。参与研究对象均知情同意,已获得医院伦理委员会批准,伦审批件号为Fyllhwk2018zd013。
2 研究方法
2.1 标本采集:随访两组研究对象至分娩,收集相关临床资料。符合条件的研究对象在入院后完善相关检查,在未使用特殊药物治疗前空腹抽取静脉血4~5 mL,3 500 r/min离心5 min,取上清于EP管中,置于–80℃冰箱保存待测。采用ELISA法检测各组血清中CXCL12、CXCR4水平,检测时严格按照相关ELISA试剂盒的操作步骤,同时记录研究对象入院后空腹血ALT及AST的结果。
2.2 标本检测:采用武汉基因美科技公司CXCL12/CXCR4因子ELISA试剂检测盒(JYM1707Hu&GR2019-12/JYM0103Hu&GR2019-12)进行检测。操作步骤:①标准品的稀释;②加样:分别设置空白孔及待测样品孔,其中空白对照孔内不加样品和酶标试剂,其余各操作步骤均相同。先将样品稀释液40 μL加入酶标包被板上的待测样品孔当中,之后再将待测样品10 μL加入其中,样品的最终稀释度为5倍。之后取样品加于酶标板孔的底部,加样的操作过程中不要触及孔壁,之后轻轻晃动混合均匀;③加酶:除空白孔外将酶标试剂50 μL分别加入每个孔当中;④温育:使用封板膜封板,并置于37℃的条件下温育,时间为30 min;⑤配液:使用蒸馏水将浓缩洗涤液稀释30倍(48T的20倍)备用;⑥洗涤:揭掉封板膜,在弃去液体之后甩干,然后在每孔加满洗涤液静置,时间约为30 s,之后再弃掉,反复操作5次,拍干;⑦显色:先将显色剂 A(ZLI-9018&108038A08)50ul加入每孔当中,之后再将显色剂 B(ZLI-9018&108038A08)50 μL加入到每孔中,轻轻晃动混合均匀,置于37℃进行避光显色,时间约10 min;⑧终止:将终止液50 μL分别加入到每个孔当中,终止反应,蓝色立即转为黄色;⑨测定:采用空白孔调零,450 nm 波长按序测每个孔的吸光度,即OD值,此操作在加入终止液后的15 min内进行。
3 统计学处理 利用统计软件SPSS23.0进行统计学分析,数值变量资料采用Shapiro-Wilk(S-W)方法进行正态分布检验,符合正态分布的计量资料以均值±标准差()表示,多组组间比较采取方差分析,非正态分布资料采用Kruskal-wallis秩和检验;变量间的相关性用Spearman相关分析,采用受试者工作特征曲线(receiver operating characteristic,ROC)分析CXCL12/CXCR4对子痫前期的诊断价值,以P<0.05为差异有统计学意义。
结 果
1 三组间一般临床资料、血清CXCL12/CXCR4表达水平比较 三组间孕妇年龄无明显差异,但分娩孕周及新生儿体重差异有统计学意义(F=99.4、134.2,P<0.001),进一步两两比较,重度PE组分娩孕周及新生儿出生体重明显低于对照组及轻度PE组;比较轻、重度PE组与对照组间母体血清CXCL12/CXCR4水平,差异有统计学意义(F=198.1、572.9,P<0.001),两两比较,对照组、轻度PE组及重度PE组母体血清CXCL12/CXCR4水平均依次下降(P<0.017),见表1。
表1 三组间孕妇一般临床资料及血清CXCL12/CXCR4水平的比较()
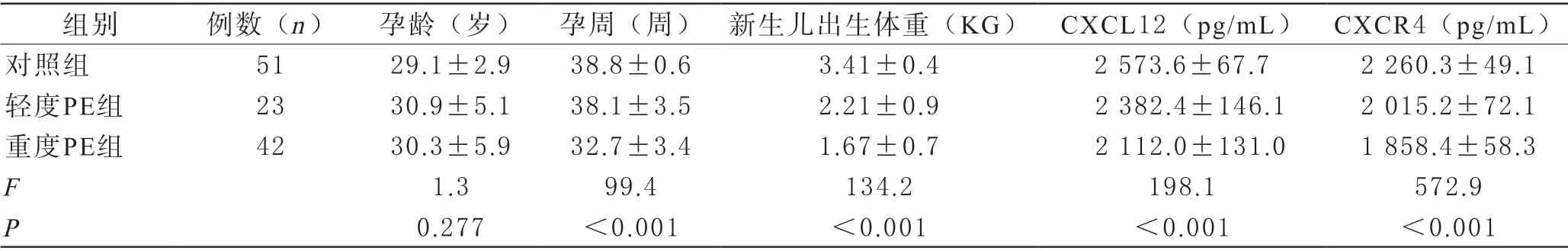
表1 三组间孕妇一般临床资料及血清CXCL12/CXCR4水平的比较()
2 正常对照组与轻、重度PE组间母体血清ALT、AST水平的比较 采用秩和检验对对照组与轻、重度PE组间母体血清ALT、AST水平进行比较,三组间母体血清ALT及AST水平不全相同(H=32.7、23.7,P<0.001),三组间两两比较,重度PE组母体血清ALT水平高于轻度PE组及对照组,且重度PE组及轻度PE组母体血清AST水平明显高于对照组(P均<0.017),轻度PE组与对照组ALT水平无统计学差异,重度PE组与轻度PE组AST水平无统计学差异(P均>0.017),见图1。
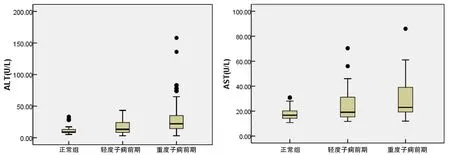
图1 正常对照组与轻、重度PE组间母体血清ALT、AST水平的比较
3 血清CXCL12/CXCR4诊断子痫前期的ROC曲线分析 ROC曲线分析结果显示,血清中CXCL12浓度以2477.68 pg/mL作为最佳截断值,诊断子痫前期的ROC曲线下面积为0.981,灵敏度为92%,特异度为94%,(95%CI:0.963-0.999),血清中CXCR4以2125.97 pg/mL作为最佳截断值,诊断子痫前期的ROC曲线下面积为0.996,灵敏度为95.4%,特异度为100%,(95%CI:0.960-1.000),见图2。
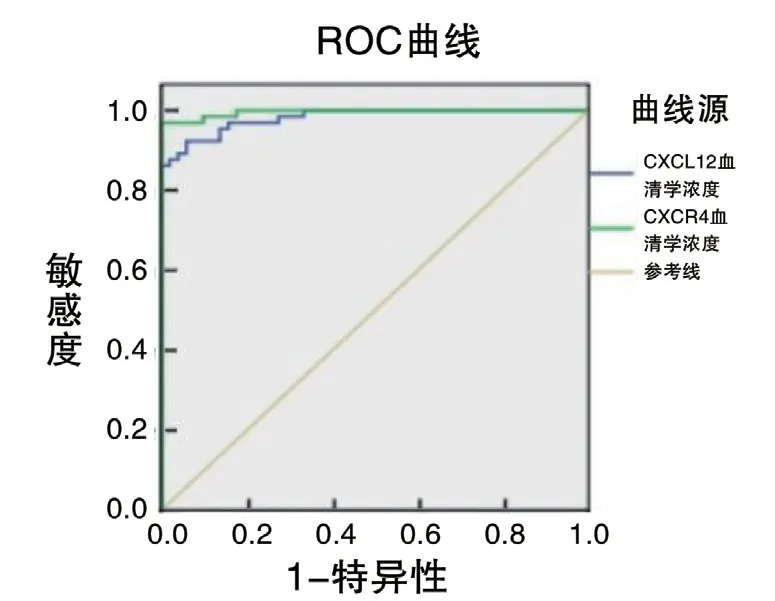
图2 CXCL12/CXCR4诊断子痫前期的ROC曲线图
4 母体血清CXCL12/CXCR4与ALT、AST的相关性 经Spearman相关分析显示,母体血清CXCL12与ALT(r=–0.486)、AST(r=–0.386)呈显著负相关,母体血清CXCR4也与ALT(r=–0.474)、AST(r=–0.403)呈负相关,差异有统计学意义(P均<0.001),见图3。
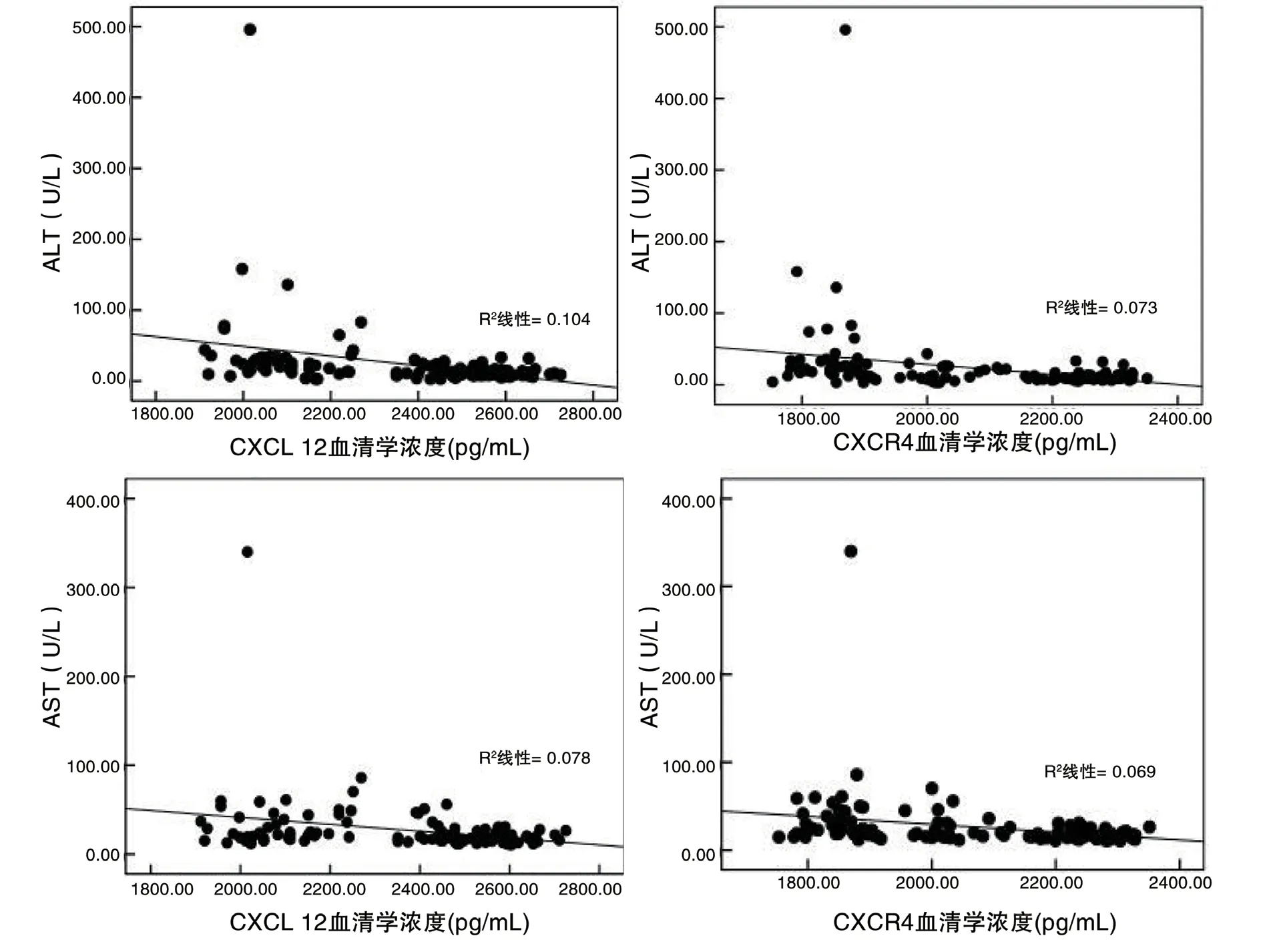
图3 母体血清CXCL12/CXCR4与ALT、AST的散点图
讨 论
目前,国内外较为公认与子痫前期患者胎盘功能异常相关的几种病因学说包括:氧化应激学说、胎盘缺血和缺氧学说及免疫-炎症学说。学者们普遍认为是由于滋养层细胞侵袭不足及子宫螺旋动脉重铸不足,导致胎盘持续性缺氧,从而释放各种炎症因子进入母体循环。其进展可分成两个阶段,第一个阶段为妊娠早期胎盘血流灌注减少,造成氧化应激,第二个阶段为妊娠中晚期母体全身血管内皮细胞广泛损伤、血管痉挛,同时全身系统性的炎症反应又进一步加重胎盘的氧化应激,其中CXCL12/CXCR4信号通路通过趋化多种细胞因子在调节免疫-炎症反应中的作用成为人们日益关注的焦点[16]。
1 血清CXCL12/CXCR4与子痫前期的相关性 有研究[17]发现与正常孕妇比较,子痫前期患者母体血清中CXCL12的表达显著降低,表明母体血清CXCL12水平异常可能参与子痫前期的发病。LU等[18]学者的研究结果也证实子痫前期患者胎盘组织中滋养层细胞凋亡趋势较正常胎盘组织更加明显,且通过免疫组化法检测到子痫前期患者胎盘组织中CXCL12/CXCR4水平与正常对照组的显著差异,表明CXCL12/CXCR4异常表达可能是子痫前期发病的重要机制。此外,ZHAO等[19]证实CXCL12/CXCR4/CXCR7轴可以活化表皮生长因子受体进一步激活ERK信号通路,促进滋养细胞的存活,抑制滋养细胞的凋亡,提示CXCL12/CXCR4及CXCR7的水平降低与子痫前期滋养细胞凋亡有一定的相关性。在本研究中,轻、重度PE组母体血清CXCL12/CXCR4水平较正常对照组明显降低,且重度PE组母体血清CXCL12/CXCR4水平明显低于轻度PE组。血清CXCL12以2477.68 pg/mL作为最佳截断值,诊断子痫前期的ROC曲线下面积为0.981,灵敏度为92%,特异度为94%,(95%CI:0.963-0.999),血清CXCR4以2125.97 pg/mL作为最佳截断值,诊断子痫前期的ROC曲线下面积为0.996,灵敏度为95.4%,特异度为100%,(95%CI:0.960-1.000),显示出较高的诊断效能。因此,在高血压及蛋白尿等临床表现并不明显的子痫前期患者或者HELLP综合征者中,检测母体血清CXCL12/CXCR4水平有助于更加准确地诊断出子痫前期。
2 血清CXCL12/CXCR4与子痫前期患者肝功能异常的相关性 近年来有报道表明机体全身炎症反应引起的周围血管收缩和内皮细胞损伤不仅可导致子痫前期的发生,也是造成大多数急性肝脏损伤的发病机制,其中趋化因子通过吸引和激活免疫炎症细胞,并协调细胞之间的相互作用而在疾病的发生、发展中起重要作用。有研究报道[20]趋化因子CXCL12在与受体CXCR4结合后,诱导分子构象发生改变,通过激活下游ERK1/2,MAPK,JNK 及AKT等信号通路,招募间充质干细胞至肝损伤部位进行修复。也有研究[13]证实CXCL12/CXCR4信号通路通过诱导肝前体细胞及卵圆细胞的扩增,从而实现了CXCL12在肝脏损伤过程中的保护作用,另一方面SAIMAN等[21]人通过小鼠模型发现特异性抑制CXCL12/CXCR4信号通路后可使小鼠肝脏内中性粒细胞含量明显增加,引起肝脏炎症反应的加重,导致肝脏的进一步损伤。此外,CHALIN等[12]学者通过研究急性肝损伤的炎症生物标志物,意外发现循环血清中CXCL12异常表达的产科组病人,其血清ALT及AST水平均有不同程度的升高,同时病人多合并有子痫前期,这一研究结果更加证实血清CXCL12水平与子痫前期患者肝功能异常的发生存在一定的相关性。本研究结果与上述报道相符,轻、重度子痫前期组血清中CXCL12/CXCR4水平显著低于对照组,且子痫前期患者血清中ALT、AST水平明显增高,同时相关分析显示母体血清CXCL12及CXCR4水平与肝功能之间呈负相关,提示子痫前期患者血清中CXCL12/CXCR4水平的降低可能参与其肝功能异常的发病机制,这一变化也可同时反映出患者的病情呈加重的趋势。
综上所述,本研究结果显示母体血清CXCL12/CXCR4水平的降低可能与子痫前期的发病有着重要联系,其表达量的异常也可能是导致子痫前期患者肝功能异常的发病机制。本研究为进一步探讨子痫前期发病机制及诊治子痫前期患者肝功能异常提供了新的思路。但本研究尚有局限性,一是样本量小,尚需多中心、前瞻性、大样本的研究证实CXCL12/CXCR4在诊断子痫前期中的应用价值,二是本研究未检测趋化因子受体CXCR7的水平,后续研究可联合血清CXCR7的检测以提高CXCL12/CXCR4/CXCR7在子痫前期诊断中的准确性,为治疗子痫前期肝功能异常提供一定的理论依据。
利益冲突所有作者均声明不存在利益冲突

