BAP1、FOXO3和ITPR2基因表达变化与葡萄膜黑色素瘤转移和预后关联分析
李洋 冯宇 刘月明 魏文斌
首都医科大学附属北京同仁医院 北京同仁眼科中心 眼内肿瘤诊治研究北京市重点实验室 北京市眼科学与视觉科学重点实验室 100730
葡萄膜黑色素瘤(uveal melanoma,UM)是成年人眼内常见的原发性恶性肿瘤,其起源于葡萄膜中的黑色素细胞,约占全身黑色素瘤的5%[1-2]。UM多发于浅肤色白人,除种族因素外,UM的危险因素还包括脉络膜痣、眼(皮肤)黑色素细胞增多症[3-6]。尽管紫外线辐射是皮肤黑色素瘤的重要危险因素,但其是否促使UM的发生仍存在争议[7]。UM的常见远处转移部位为肝脏,近一半的UM患者最终发展为肝转移[8-9]。当前,对于转移性UM尚缺少明确有效的治疗策略,发生转移后患者中位生存时间不足1年[10]。既往研究发现,肿瘤大小、睫状体侵犯、眼外扩散等影像学表现和组织学上皮细胞型、有丝分裂核像、血管袢为预后不良的标志[11-12];染色体拷贝数变异水平上3号染色体短臂丢失以及8号染色体长臂扩增者的预后较差[13]。近年来,分子遗传学研究表明GNAQ和GNA11基因突变是促进细胞增生的早期事件[10];SF3B1基因突变具有中等转移风险,与晚期转移有关[14];EIF1AX基因突变患者预后较好,具有较长的无转移生存期[10]。此外,Onken等[13]通过对转移/非转移UM基因表达谱的差异分析筛选出12个差异表达基因(differentially expressed genes,DEGs),并根据上述基因表达谱将肿瘤分为恶性程度低、不易转移的1型和恶性程度高、易转移的2型,相较基于肿瘤临床特征的预后评估更加准确、可靠。UM的发生和发展与基因突变和基因表达异常密切相关,而目前UM的临床分期仍以肿瘤大小和肿瘤所在区域为主要依据,且UM转移的诊断也主要依靠肝功能和影像学检测结果。因此,亟需鉴定出UM转移性相关的分子标志物,在UM微转移灶的潜伏期进行有效干预。此外,尽管既往研究已鉴定出UM影像学、组织学、染色体拷贝数变异水平上的预后指标,但目前仍缺乏分子遗传学水平的深入研究。本研究基于TCGA数据库对80个转移/非转移UM样本的基因突变、DEGs进行生物信息学分析,筛选并寻找新的UM预后指标,以期为探讨其发生和转移机制、提高患者远期预后提供参考。
1 材料与方法
1.1 UM样本基因突变数据来源
本研究基于美国国家癌症研究所(NCI)和国家人类基因组研究所(NHGRI)共同建立的肿瘤基因组图谱(the cancer genome atlas,TCGA,https://tcga-data.nci.nih.gov/tcga/),对该共享基因组图谱中2007—2019年全部80例UM样本的基因突变信息Maf文件和基因表达矩阵数据进行生物信息学分析。患者中男45例,占56.2%,女35例,占43.8%;年龄的中位数为60岁;白人55例,占68.8%,未知人种者25例,占31.2%;转移患者18例,非转移患者62例;病理分期Ⅰ、Ⅱ、Ⅲ、Ⅳ期及未知分期者分别有0、39、36、4、1例,分别占0.0%、48.8%、45.0%、5.0%和1.2%;有远处转移者26例,占32.5%,无远处转移者54例,占67.5%;进行、未进行、未知是否进行放射治疗者分别有3、76和1例,分别占3.8%、95.0%和1.2%;进行化学治疗者4例,占5.0%,未进行化学治疗者76例,占95.0%;死亡病例23例,占28.8%,存活病例57例,占71.2%。
1.2 方法
1.2.1UM样本基因突变分析 采用R软件中的maftools函数包分析UM样本中的基因突变种类、变异类型、单核苷酸变异(single nucleotide variants,SNV)类型和基因突变比例并作图。每兆碱基的平均突变数,即样本总突变位点个数/外显子区域长度(40 Mb),定义为每个患者的肿瘤突变负荷(tumor mutation burden,TMB)数值。

1.2.2转移性和非转移性UM间DEGs分析 采用R软件中的edgeR软件包分析源自转录组的DEGs。首先去除表达矩阵平均测序个数小于10的基因(测序个数小于10,其峰度较低,研究价值较低)。以肿瘤是否发生转移的临床信息为依据,将样本分为转移组和非转移组,并以错误发现率(false discovery rate,FDR)<0.05和|log2FC|>1作为阈值筛选DEGs。
1.2.3DEG功能富集分析 采用在线数据库KOBAS工具对筛选出的DEGs进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。以经过“BH”法校正过的P值<0.05为标准筛选显著富集的KEGG通路。
1.2.4UM预后与相关因素分析 采用R软件中的survival包及survminer包进行生存分析。采用survival包进行Cox回归模型的建立,探讨性别、TMB、GNAQ、GNA11、BAP1、SF3B1、EIF1AX基因突变及FOXO3、ITPR2和BAP1的差异表达量对生存时间的影响,并绘制森林图。以P<0.10为阈值筛选预后相关因素,并采用survminer软件包绘制生存曲线。
1.3 统计学方法
采用R软件(v3.6.3)对数据进行统计分析。计量资料数据经Shapiro-Wilk检验证实不符合正态分布,以M(Q1,Q3)表示。采用Kaplan-Meier方法估计2个组的整体生存率,采用Log-rank检验比较2个组间生存率差异的显著性;采用Wilcoxon秩和检验比较2个组基因表达差异。P<0.10为差异有统计学意义。
2 结果
2.1 转移性和非转移性UM样本中基因突变率
转移组和非转移组UM均以错义突变为主,突变类型为SNV,基因突变形式以C>T居多(图1)。UM基因突变负荷低,仅个别样本中存在相对较高的基因突变负荷。进一步对突变率前10位的基因分析发现,2个组样本的突变基因不完全相同:在非转移组UM样本中,GNAQ、GNA11、BAP1、SF3B1和EIF1AX基因具有较高的突变率;在转移组UM样本中,GNA11、PLCB4、SF3B1、BAP1和ARHGDLA基因具有较高突变率,GNA11和PLCB4基因的突变率分别高达67%和33%。
2.2 转移性和非转移性UM样本间基因表达差异
在转移性和非转移性UM样本间进行DEGs分析,以FDR<0.05和|log2FC|>1作为阈值筛选出562个DEGs。与非转移性UM样本相比,转移性UM样本中218个基因显著下调,344个基因显著上调(图2)。
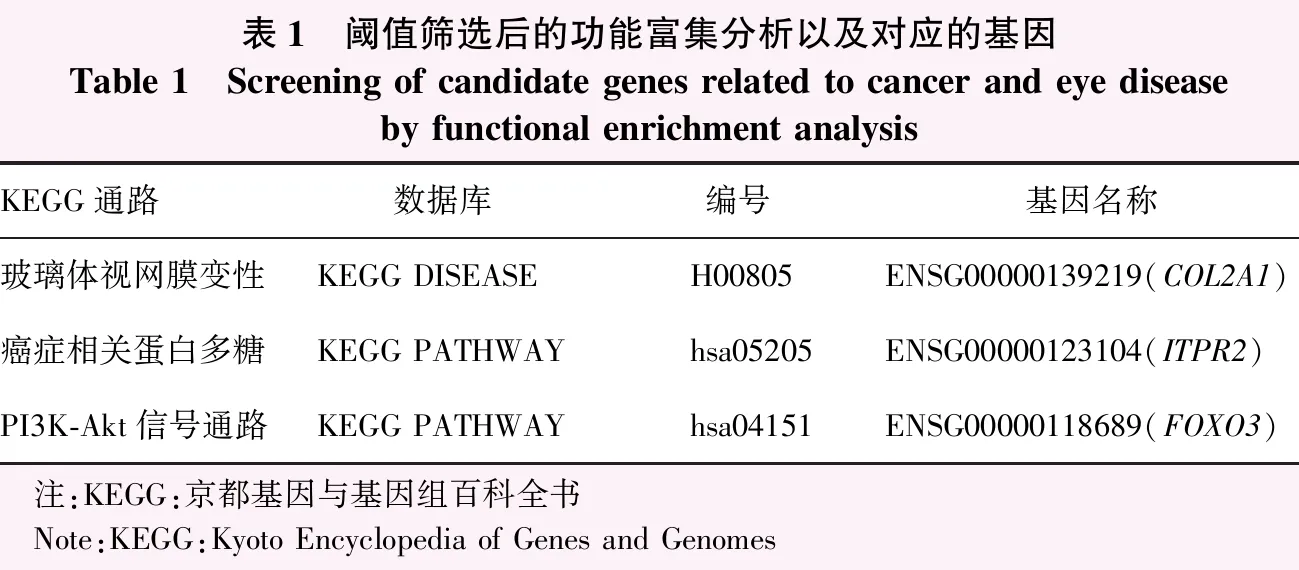
表1 阈值筛选后的功能富集分析以及对应的基因Table 1 Screening of candidate genes related to cancer and eye disease by functional enrichment analysisKEGG通路数据库编号基因名称玻璃体视网膜变性KEGG DISEASEH00805ENSG00000139219(COL2A1)癌症相关蛋白多糖KEGG PATHWAYhsa05205ENSG00000123104(ITPR2)PI3K-Akt信号通路KEGG PATHWAYhsa04151ENSG00000118689(FOXO3) 注:KEGG:京都基因与基因组百科全书 Note:KEGG:Kyoto Encyclopedia of Genes and Genomes


2.3 DEG功能通路富集分析
KEGG通路功能富集分析结果显示,其中3条与眼部疾病和癌症相关的通路显著富集,分别为玻璃体视网膜变性、癌症相关蛋白多糖和PI3K-Akt信号通路。进一步筛选出此3条通路对应的基因,分别为ENSG00000139219(COL2A1)、ENSG00000123104(ITPR2)和ENSG00000118689(FOXO3)(表1)。
2.4 转移性和非转移性UM样本中FOXO3、ITPR2和BAP1基因表达差异
2个组突变率较高的基因(GNAQ、GNA11、BAP1、SF3B1、EIF1AX)、与癌症和眼部疾病相关的基因(FOXO3、ITPR2、COL2A1)表达差异如图3,4所示。2个组GNAQ、GNA11、SF3B1、EIF1AX和COL2A1基因表达量比较,差异均无统计学意义(Z=-1.613、-0.092、-1.648、-1.636、-0.259,均P>0.10);与非转移组比较,转移组BAP1和FOXO3表达量显著下调,ITPR2表达量显著上调,差异均有统计学意义(Z=-1.786、-1.982、-3.065,均P<0.10)(表2)。
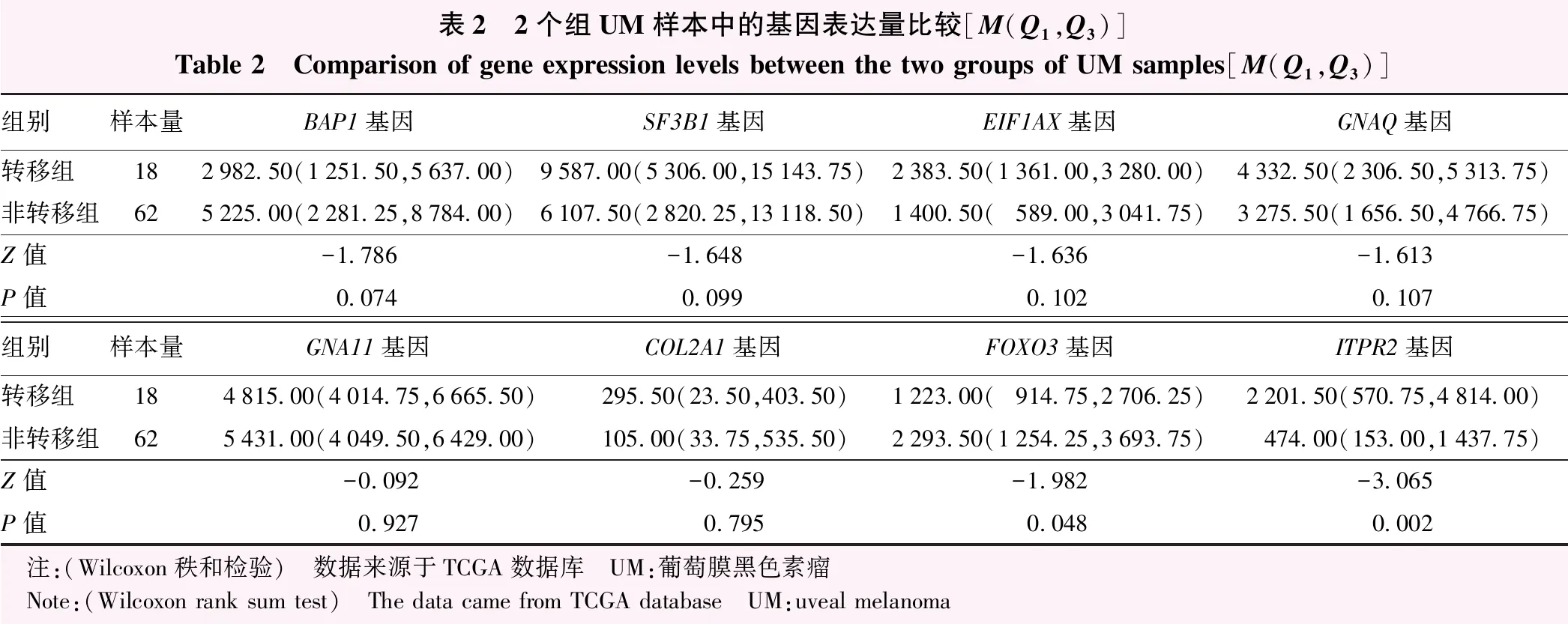
表2 2个组UM样本中的基因表达量比较[M(Q1,Q3)]Table 2 Comparison of gene expression levels between the two groups of UM samples[M(Q1,Q3)]组别样本量BAP1基因SF3B1基因EIF1AX基因GNAQ基因转移组182982.50(1251.50,5637.00)9587.00(5306.00,15143.75)2383.50(1361.00,3280.00)4332.50(2306.50,5313.75)非转移组625225.00(2281.25,8784.00)6107.50(2820.25,13118.50)1400.50(589.00,3041.75)3275.50(1656.50,4766.75)Z值-1.786-1.648-1.636-1.613P值0.0740.0990.1020.107组别样本量GNA11基因COL2A1基因FOXO3基因ITPR2基因转移组184815.00(4014.75,6665.50)295.50(23.50,403.50)1223.00(914.75,2706.25)2201.50(570.75,4814.00)非转移组625431.00(4049.50,6429.00)105.00(33.75,535.50)2293.50(1254.25,3693.75)474.00(153.00,1437.75)Z值-0.092-0.259-1.982-3.065P值0.9270.7950.0480.002 注:(Wilcoxon秩和检验) 数据来源于TCGA数据库 UM:葡萄膜黑色素瘤 Note:(Wilcoxon rank sum test) The data came from TCGA database UM:uveal melanoma
2.5 BAP1、FOXO3和ITPR2基因与UM患者生存率的关联分析
Cox模型单因素分析显示,BAP1基因突变、FOXO3基因表达下调和ITPR2基因表达上调与不良预后显著相关(均P<0.10)(表3)。此外,对BAP1基因是否突变、FOXO3、ITPR2基因不同表达水平和不同TMB的UM患者组分别进行生存分析,得出BAP1基因未发生突变组和FOXO3基因高表达组的生存率较高(P=0.076、0.004),ITPR2基因高表达组的生存率较低(P=0.006)(图5)。
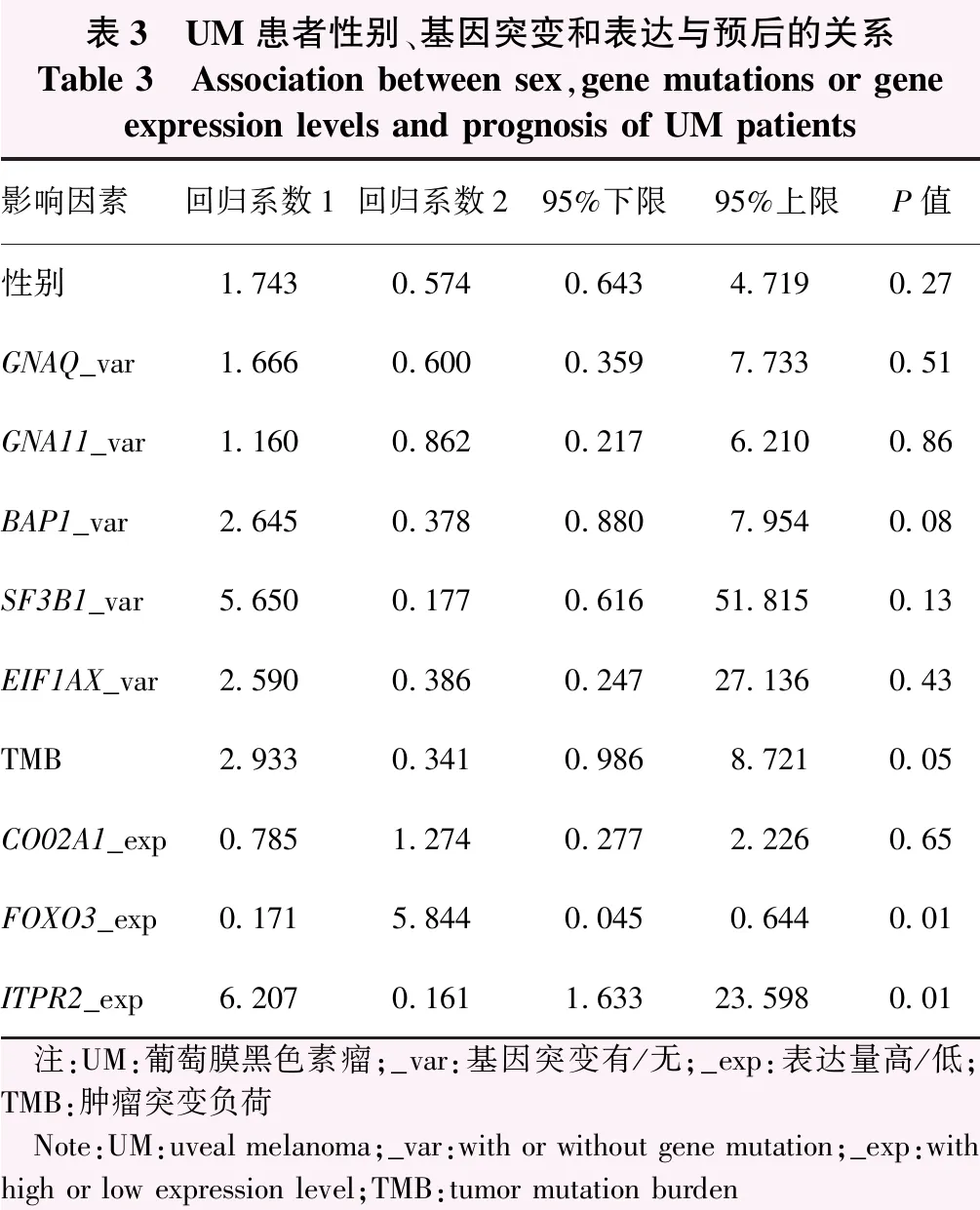
表3 UM患者性别、基因突变和表达与预后的关系Table 3 Association between sex,gene mutations or gene expression levels and prognosis of UM patients影响因素回归系数1回归系数295%下限95%上限P值性别1.7430.5740.6434.7190.27GNAQ_var1.6660.6000.3597.7330.51GNA11_var1.1600.8620.2176.2100.86BAP1_var2.6450.3780.8807.9540.08SF3B1_var5.6500.1770.61651.8150.13EIF1AX_var2.5900.3860.24727.1360.43TMB2.9330.3410.9868.7210.05CO02A1_exp0.7851.2740.2772.2260.65FOXO3_exp0.1715.8440.0450.6440.01ITPR2_exp6.2070.1611.63323.5980.01 注:UM:葡萄膜黑色素瘤;_var:基因突变有/无;_exp:表达量高/低;TMB:肿瘤突变负荷 Note:UM:uveal melanoma;_var:with or without gene mutation;_exp:with high or low expression level;TMB:tumor mutation burden
3 讨论
本研究对TCGA数据库中80例UM患者的基因突变和基因表达情况进行了分析,结果显示UM基因突变以错义突变为主,主要变异类型为SNV,其中以C>T为主要形式。通过DEGs及KEGG通路富集分析,在转移性UM样本相对于非转移性UM样本的218个下调基因和344个上调基因中,鉴定出3个与眼部疾病和癌症相关的基因,即BAP1、FOXO3和ITPR2基因。生存分析结果显示,BAP1基因突变、FOXO3基因表达下调和ITPR2基因表达上调与较差预后相关,表明这3个基因能够作为UM潜在的生物标志物,对患者的预后情况预测具有临床指导意义。
通过对基因突变信息的统计分析,本研究鉴定出突变频率最高的基因中,GNAQ和GNA11基因均已被证明在人UM组织中存在突变[14],符合先前的研究结果,二者的高突变率与UM的发生紧密相关。但在本研究中,GNAQ和GNA11基因在转移组和非转移组之间的表达量比较差异无统计学意义。除了GNAQ和GNA11外,BAP1基因也在UM样本中显示出较高的突变率。BAP1是位于3号染色体3p21的核去泛素化水解酶,通过从蛋白质中去除泛素起到信号调节的作用,参与细胞增生、细胞发育和DNA损伤修复等生物过程[15-18]。BAP1基因突变首先在乳腺癌和肺癌细胞系中被发现[19],并存在于其他几种癌症中,如脑膜瘤、间皮瘤和肾细胞癌等[20-22]。种系BAP1基因突变个体患UM和皮肤黑色素瘤的风险显著上升[23-24],而体细胞BAP1基因突变未见于BAP1基因野生型UM进展过程中,表明体细胞BAP1基因突变是UM发生的早期事件,而非在转移过程中获得[25-27]。本研究结果发现,BAP1基因在转移组中的表达量较非转移组显著下调,生存分析表明BAP1基因突变是影响UM预后不良的因素。亦有研究表明,敲除BAP1基因可使UM细胞系失去典型的黑色素细胞形态,且基因表达谱向预后不良的2型转化[25,28]。尽管有很多研究探索BAP1蛋白的功能,但BAP1基因突变如何促进UM的转移尚不清楚。有研究表明,BAP1的缺失抑制同源介导的DNA修复,迫使细胞依赖于更容易出错的非同源末端连接[29]。此外,一些与BAP1相互作用的蛋白,如叉头转录因子FOXK1、FOXK2和多梳家族蛋白ASXL1、ASXL2,已被证明参与到转录等相关过程的调控[30-31],因此BAP1的缺失会影响下游的级联过程。正是由于这些潜在的相关蛋白和复杂的相互作用网络,BAP1在UM转移中的关键作用并未被阐明,因此对BAP1及其相互作用蛋白的进一步研究有助于开发针对UM中BAP1缺失的治疗方法。
本研究对转移组和非转移组的DEGs进行功能富集分析,筛选出了与眼部疾病和癌症通路相关的基因FOXO3和ITPR2,其中FOXO3基因在转移组的表达量明显下调,ITPR2基因在转移组的表达量明显上调。FOXO3是FOXO家族转录因子的重要成员,是Akt激酶活性的主要下游靶点,通过激活或抑制多个靶基因的表达,参与调节细胞增生、分化、DNA修复和凋亡等过程[32]。Akt磷酸化FOXO3使其在细胞质中保留,防止其细胞核中的细胞调节作用,而Akt失活导致FOXO3a去磷酸化,并促使其从细胞质向细胞核的转移。已有研究表明,FOXO3受IGF-1R/PI3K/Akt通路调控,并与横纹肌肉瘤、肝细胞癌、乳腺癌等肿瘤的转移密切相关[33-34]。此外,FOXO3还可以通过上调Bim和CDKN1B,抑制cyclin D1的转录和表达,发挥抑制细胞增生的作用[35]。本研究发现,FOXO3表达下调与UM远处转移相关,生存分析显示FOXO3下调为UM预后不良的因素,可能的机制如下:IGF-1受体在UM中过度表达并持续激活,FOXO3受IGF-1R/PI3K/Akt通路激活后磷酸化,转移出细胞核失去调节能力,从而使UM细胞的侵袭和迁移能力增强[36-37];相反,抑制PI3K/Akt通路可增强FOXO3活性[9]。FOXO3参与了IGF-1诱导的UM细胞增生,因此该通路相关蛋白可能成为抑制UM远处转移的潜在治疗靶点。
ITPR2蛋白是IP3受体的成员,是钙离子跨膜转运活性的关键调节蛋白,在细胞周期和增生中起关键作用[38-39]。在肝癌干细胞中,ITPR2作为内质网钙离子通道蛋白,通过调控细胞钙信号,增强肝癌干细胞的自我更新能力[40]。此外,有研究报道ITPR2可作为细胞遗传学正常型急性髓细胞白血病不良预后的新型生物标志物[39]。然而,尚未有研究探索ITPR2蛋白的表达与UM之间的联系。本研究发现ITPR2基因在转移性UM中表达显著上调,生存分析显示ITPR2的表达增加与不良预后相关,这为未来探讨钙信号参与调控UM增生、转移的相关机制提供了新的思路。
本研究通过对TCGA数据库中UM样本的基因突变信息的统计分析发现,BAP1基因在转移组和非转移组突变率均较高,BAP1基因的突变是影响UM预后不良的因素,这与之前的研究结果相符合,但BAP1是如何影响UM的转移性还需要进一步研究。此外,本研究通过筛选转移组和非转移组的DEGs,也阐释了FOXO3基因表达下调和ITPR2基因表达上调与转移性UM有很强的相关性,其中FOXO3与UM的关系报道较少,据目前报道仅有1篇研究显示FOXO3a的过度表达减弱了UM的基底侵袭和迁移[9],这与本研究中发现在转移性UM中FOXO3基因表达显著下调这一结果可以相互验证和补充。对于ITPR2,本研究表明了其与UM之间的关联,在转移性UM中ITPR2的表达显著上调。本研究也统计了数据库中这80例患者的预后信息,数据分析结果也能够支持这3个基因对转移性UM的影响。本研究从突变、表达和临床等多个维度阐述了这3个基因对转移性UM的重要影响。在后续研究上,会进行相关的生物学验证,建立UM关键基因突变或敲除动物模型,在体内验证这些基因对UM转移的确切意义。
综上所述,本研究通过对80例UM基因样本的分析发现,BAP1基因突变、FOXO3基因表达下调和ITPR2基因表达上调与UM远处转移相关,可作为UM患者转移预测和预后的潜在重要标志,有助于UM转移的早期监测和治疗,对提高患者的远期生存率具有重要意义。
利益冲突所有作者均声明不存在利益冲突

