LncRNA Tsix在NMDA诱导小鼠视网膜兴奋性毒性模型中的表达及其意义
李亚红 耿超 黑凯文 刘胜男 王奇 李筱荣 张琰
天津医科大学眼科医院 天津医科大学眼视光学院 天津医科大学眼科研究所 国家眼耳鼻喉疾病临床医学研究中心天津市分中心 天津市视网膜功能与疾病重点实验室 300384
谷氨酸是中枢神经系统的一种兴奋性神经递质。过多的谷氨酸可作用于离子型或代谢型谷氨酸受体而导致兴奋性毒性。兴奋性毒性是阿尔兹海默病、帕金森病以及青光眼等神经退行性病变的重要致病因素[1-2]。N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体属于离子型谷氨酸受体,在视网膜中,其与NMDA结合起到与谷氨酸类似的生物学作用,进而引起视网膜神经节细胞(retinal ganglion cells,RGCs)死亡[3]。研究表明,NMDA诱导的兴奋性毒性是糖尿病视网膜病变(diabetic retinopathy,DR)和青光眼等致盲眼病导致视网膜损伤的重要因素之一[3-4],但其具体的分子作用机制尚未完全明确。长链非编码RNA(long noncoding RNA,lncRNA)是转录本长度超过200 nt且不编码蛋白质的RNA分子。根据lncRNA与邻近基因的位置关系及其在基因组中的转录来源,可将其分为5类,即反义lncRNA、内含子lncRNA、基因间lncRNA、启动子lncRNA和非翻译区lncRNA[5-6]。反义lncRNA转录自蛋白编码基因的反义链,与正义链存在序列互补配对,通常情况下其可通过抑制正义链基因的转录而调控基因表达[7]。Tsix和Xist是2个位于X染色体的lncRNAs[8]。Xist的转录产物可致X染色体失活;而其反义lncRNA Tsix可抑制Xist基因表达,二者共同调节胚胎早期发育过程中X染色体失活的生理过程[9-10]。本课题组先前的研究中,利用猴视网膜血管内皮细胞建立内层血-视网膜屏障的体外模型,并用高糖、高脂模拟糖尿病条件下的细胞外病理环境;高通量RNA测序结果显示,在高糖、高脂的刺激下,视网膜血管内皮细胞中lncRNA Tsix的表达水平较正常对照组显著降低[11],这提示高糖、高脂刺激在视网膜血管内皮细胞中造成的氧化应激可调控lncRNA Tsix的表达;在后续的功能学实验中,本课题组还发现在视网膜血管内皮细胞中过表达lncRNA Tsix,还可起到拮抗氧化应激、抑制细胞凋亡的作用。另一方面,NMDA及其受体所介导的信号通路亦可使视网膜神经元处于氧化应激状态。因此,我们提出假说:在NMDA介导的视网膜兴奋性毒性模型中,lncRNA Tsix在视网膜中的表达可能会发生改变。为证明此假说,本研究拟建立NMDA诱导的小鼠视网膜兴奋性毒性模型,并在此模型中检测lncRNA Tsix的表达水平,为进一步研究其在视网膜兴奋性毒性状态下对视网膜的保护作用提供分子基础。
1 材料与方法
1.1 材料
1.1.1实验动物 选取7~8周龄SPF级C57B6/J小鼠105只(北京维通利华公司),于天津医科大学眼科医院动物房饲养,室内温度为22~26 ℃,循环12 h光照,并给予充足的水和食物。本研究经天津医科大学伦理委员会批准(批文号:SYXK2018-0004)。所有实验操作符合国家卫生研究所实验室动物护理和使用指南。实验动物的使用遵循天津医科大学及ARVO有关眼科与视觉科学研究中动物使用的相关规定。
1.1.2主要试剂及仪器 NMDA(美国Sigma公司);质量分数0.9%氯化钠溶液(中国大冢制药公司);盐酸奥布卡因滴眼液、左氧氟沙星滴眼液、复方托吡卡胺滴眼液(中国参天制药有限公司);卡波姆滴眼液(山东博士伦福瑞达制药有限公司);小鼠单克隆β3-微管蛋白抗体(ab78078)、兔抗小鼠二抗(ab6724)(英国Abcam公司);抗淬灭封片剂(美国Vectashield公司);常规RNA提取试剂盒(美国EZBioscience公司);RevertAid第一链cDNA合成试剂盒(美国Thermo Fisher Scientific公司);EvaGreen 2倍qPCR Master Mix(加拿大Abm公司)。33G针头、10 μl微量注射器(美国Hamilton公司);聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)硬性角膜接触镜(英国Cantor & Nissel公司);光相干断层扫描(optical coherence tomography,OCT)仪(德国海德堡公司);激光扫描共焦显微镜(德国Zeiss公司);RNAscope 2.5 HD可见光红色试剂盒、Hybez杂交炉(美国ACD公司);氧化锆研磨珠、高速组织研磨仪(武汉塞维尔生物科技有限公司);NanoDrop 2000超微量分光光度计(美国Thermo Fisher Scientific公司);7900HT real-time PCR仪(美国Applied Biosystems公司)。
1.2 方法
1.2.1NMDA诱导视网膜兴奋性毒性模型的制作及分组 使用质量分数0.9%氯化钠溶液分别制备2、10、20和40 mmol/L NMDA工作液[12]。采用随机数表法将小鼠随机分为正常对照组、2 mmol/L NMDA组、10 mmol/L NMDA组、20 mmol/L NMDA组和40 mmol/L NMDA组,每组21只。适应环境1周,腹腔内注射质量分数4%水合氯醛(0.1 ml/10 g)全身麻醉小鼠,采用盐酸奥布卡因滴眼液点眼行眼表局部麻醉。在角膜缘后1 mm处用33G针头沿45°方向刺入右眼,用微量注射器将1 μl氯化钠溶液和不同浓度NMDA溶液缓慢注入相应组别小鼠的右眼玻璃体腔内,15 s后缓慢撤针。采用左氧氟沙星滴眼液点眼,预防眼部感染。
1.2.2OCT法测定活体小鼠视网膜厚度 玻璃体腔内注射NMDA溶液后1周,每组各取10只小鼠,采用4%水合氯醛麻醉小鼠,复方托吡卡胺滴眼液点眼扩瞳。卡波姆滴眼液湿润眼表后,将定制的PMMA硬性角膜接触镜固定在小鼠正前方角膜上,使眼球对准前置镜(屈光度为+25.00 D),行频域OCT(spectral-domain OCT,SD-OCT)检查,测定活体小鼠视网膜厚度。打开HEYEX软件,选择“SD-OCT”模式和水平单线扫描方式,待眼底的图像清晰且亮度均匀时,通过调整推杆使视网膜的纵向剖面图保持水平位,确保视神经位于图像中间。拍照100张,将所拍的100张图片自动叠加为最清晰的图像。储存图像,分别测量中央及距离中央相同位置的视网膜各层厚度。
1.2.3苏木精-伊红染色法测定视网膜各层厚度和神经节细胞层细胞数量 玻璃体腔内注射NMDA溶液后1周,每组各取10只小鼠,过量水合氯醛深度麻醉小鼠,完整取出眼球,并于酸性固定液中固定过夜。石蜡包埋眼球,沿纵轴方向行3 μm厚石蜡切片,其中5只小鼠眼球的石蜡切片脱蜡、脱水后行常规苏木精-伊红染色。在每个眼球相应部位选取5~6张切片,采用Photoshop CS6软件计数各组神经节细胞层(ganglion cell layer,GCL)单位长度内的细胞数;采用CellSens Standard软件测量视网膜各层厚度。所有操作均采用双盲法。
1.2.4视网膜铺片法和免疫荧光染色法测定小鼠RGCs数量 视网膜铺片及染色参照本课题组之前的研究方法[13]。NMDA注射后1周,每组各取3只小鼠,过量水合氯醛深度麻醉小鼠,摘出眼球,置于多聚甲醛溶液中,室温下固定40 min。借助于解剖显微镜在磷酸盐缓冲液(phosphate buffered saline,PBS)中分离视网膜,置于多聚甲醛溶液中4 ℃固定过夜。次日,用PBS洗视网膜标本2次,用通透缓冲液(PBS pH 6.8,质量分数1%牛血清白蛋白,体积分数0.5% Triton X-100)4 ℃过夜。次日,用PBlec缓冲液(PBS pH 6.8,1% Triton X-100,0.1 mmol/L CaCl2,0.1 mmol/L MgCl2和0.1 mmol/L MnCl2)漂洗视网膜,加入鼠单抗β3-微管蛋白(PBlec缓冲液稀释1∶ 1 000),室温下孵育过夜。次日,PBS洗3次,加入FITC标记的兔抗小鼠二抗(PBlec缓冲液稀释至1∶ 500),室温下避光孵育2 h,PBS洗3次。将视网膜剪成3~4瓣,用含DAPI的抗淬灭封片剂封片,视网膜GCL朝上。激光扫描共焦显微镜下观察,并在相同的光学参数下拍照。采用Photoshop CS6软件计数β3-微管蛋白染色阳性的细胞数。
1.2.5RNAscope技术检测小鼠视网膜GCL中lncRNA Tsix的表达 将1.2.3中制备的另5只小鼠眼球石蜡切片脱蜡,室温下风干,滴加过氧化氢,静置10 min,蒸馏水清洗。将切片放入沸腾的抗原修复液中水浴15 min,在无水乙醇中脱水,通风橱中风干。用Immedge疏水性屏障笔在每张组织切片周围设定疏水圈,室温下晾干。按照RNAscope荧光检测试剂盒说明书进行探针杂交、信号放大及检测。在疏水圈内滴加1~2滴蛋白酶,在Hybez杂交炉中40 ℃孵育30 min。缓冲液清洗,加入美国ACD公司设计的针对小鼠Tsix序列的探针,并以枯草杆菌二氢吡啶二羧酸还原酶(dapB)作为阴性对照探针,置于杂交炉中40 ℃孵育2 h。去除多余液体,依次加入6种杂交反应液,分别反应30、15、30、15、30和15 min以进行信号放大和分子杂交,避光条件下滴加Fast Red染色液,室温下静置10 min。清洗切片,苏木素复染,用不含DAPI的抗淬灭封片剂封片。采用CellSens Standard软件在显微镜明场下观察并拍照;采用Photoshop CS6软件计数各组GCL中lncRNA Tsix阳性细胞数和GCL总细胞数。GCL lncRNA Tsix阳性细胞率=GCL lncRNA Tsix阳性细胞数/GCL总细胞数×100%。所有操作均采用双盲法。
1.2.6RNA提取及逆转录反应 玻璃体腔内注射NMDA溶液后1周,每组各取8只小鼠,过量水合氯醛腹腔内注射深度麻醉小鼠,摘出眼球,冰上迅速分离视网膜,置于液氮中速冻,-80 ℃冰箱内储存。采用常规RNA提取试剂盒提取视网膜标本的总RNA。将每个视网膜置于1个1.5 ml EP管中,加入500 μl裂解液,利用1枚直径4 mm和2枚直径3 mm的氧化锆研磨珠在高速组织研磨器中充分研磨。研磨后将液体移至另一1.5 ml EP管,加入100 μl缓冲液A,颠倒混匀后静置,4 ℃条件下15 000×g离心3 min。取上清,加入等体积无水乙醇,混匀后转移至吸附柱,4 ℃条件下4 000×g离心1 min。然后用洗液洗柱2次,吸附柱中央加入30 μl洗脱液,室温下放置2 min,4 ℃条件下12 000×g离心1 min。采用NanoDrop 2000微量分光光度计测定所得总RNA的浓度和纯度。取1 μg总RNA,按照RevertAid第一链cDNA合成试剂盒说明书,以Oligo(dT)为引物进行逆转录反应,制备cDNA。
1.2.7实时荧光定量PCR法测定小鼠视网膜中Tsix mRNA表达水平 PubMed查询小鼠Tsix和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物序列,采用Primer Express 3.0软件(美国Applied Biosystems公司)设计实时荧光定量PCR引物序列,并由北京赛百盛基因技术有限公司合成。Tsix正向引物序列:5’-CGCAATTGGTTGCTTTTATCC-3’;反向引物序列:5’-GGCTATTCTCGAGCCAGTTACG-3’。GAPDH正向引物序列:5’-TGTGTCCGTCGTGGAT CTGA-3’;反向引物序列:5’-CCTGCTTCACCACCTTC TTGA-3’。以4 μl cDNA为模板,加入Tsix和GAPDH的正向和反向引物各1.5 μl,以及12.5 μl EvaGreen 2倍qPCR Master Mix,添加无核酸酶水补足25 μl反应体系,在96孔板中进行实时PCR扩增。扩增反应条件:50 ℃孵育2 min,95 ℃变性10 min;95 ℃变性15 s,60 ℃退火和延伸1 min,进行40次循环;95 ℃变性15 s,60 ℃退火15 s,95 ℃反应15 s。以GAPDH为内参照,采用2-△△Ct法分析所得数据。
1.3 统计学方法
采用GraphPad Prism 8软件对数据进行统计分析。各组测量指标的计量数据资料经Shapiro-Wilk检验证实呈正态分布,以mean±SD表示,经Levene检验证实方差齐。视网膜各层厚度、视网膜GCL细胞密度、β3-微管蛋白染色阳性细胞数、Tsix染色阳性细胞率以及Tsix mRNA表达水平的总体比较均采用单因素方差分析,组间多重比较采用Tukey post hoc检验。P<0.05为差异有统计学意义。
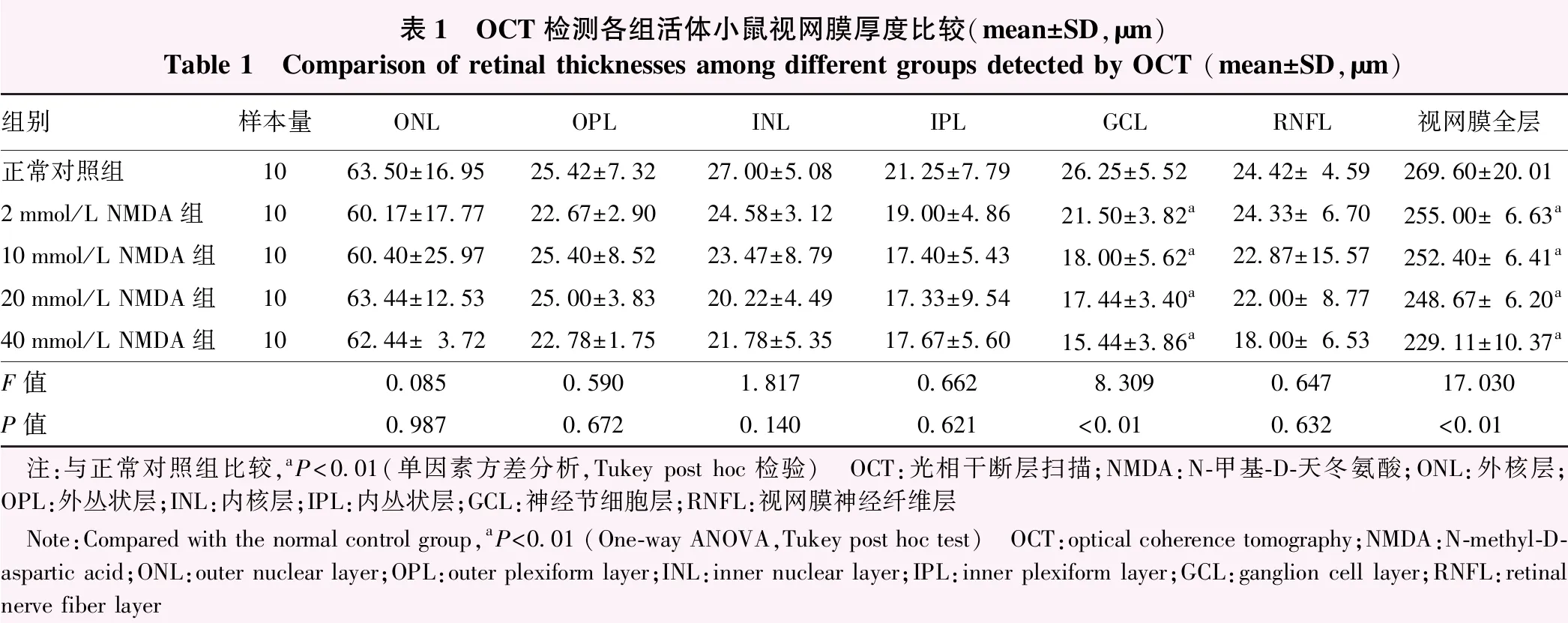
表1 OCT检测各组活体小鼠视网膜厚度比较(mean±SD,μm)Table 1 Comparison of retinal thicknesses among different groups detected by OCT (mean±SD,μm)组别样本量ONLOPLINLIPLGCLRNFL视网膜全层正常对照组1063.50±16.9525.42±7.3227.00±5.0821.25±7.7926.25±5.5224.42±4.59269.60±20.012mmol/L NMDA组1060.17±17.7722.67±2.9024.58±3.1219.00±4.8621.50±3.82a24.33±6.70255.00±6.63a10mmol/L NMDA组1060.40±25.9725.40±8.5223.47±8.7917.40±5.4318.00±5.62a22.87±15.57252.40±6.41a20mmol/L NMDA组1063.44±12.5325.00±3.8320.22±4.4917.33±9.5417.44±3.40a22.00±8.77248.67±6.20a40mmol/L NMDA组1062.44±3.7222.78±1.7521.78±5.3517.67±5.6015.44±3.86a18.00±6.53229.11±10.37aF值0.0850.5901.8170.6628.3090.64717.030P值0.9870.6720.1400.621<0.010.632<0.01 注:与正常对照组比较,aP<0.01(单因素方差分析,Tukey post hoc检验) OCT:光相干断层扫描;NMDA:N-甲基-D-天冬氨酸;ONL:外核层;OPL:外丛状层;INL:内核层;IPL:内丛状层;GCL:神经节细胞层;RNFL:视网膜神经纤维层 Note:Compared with the normal control group,aP<0.01 (One-way ANOVA,Tukey post hoc test) OCT:optical coherence tomography;NMDA:N-methyl-D-aspartic acid;ONL:outer nuclear layer;OPL:outer plexiform layer;INL:inner nuclear layer;IPL:inner plexiform layer;GCL:ganglion cell layer;RNFL:retinal nerve fiber layer
2 结果
2.1 不同剂量NMDA组小鼠视网膜厚度变化
注射后1周,各组小鼠视网膜全层厚度总体比较差异有统计学意义(F=17.030,P<0.01),其中2、10、20和40 mmol/L NMDA组视网膜全层厚度分别约为正常对照组的94.58%、93.55%、92.11%和85.11%,均显著变薄,与正常对照组比较差异均有统计学意义(均P<0.01)。此外,与正常对照组相比,不同剂量NMDA组GCL厚度均显著变薄,差异均有统计学意义(均P<0.01)。各组外核层(outer nuclear layer,ONL)、外丛状层(outer plexiform layer,OPL)、内核层(inner nuclear layer,INL)、内丛状层(inner plexiform layer,IPL)、视网膜神经纤维层(retinal nerve fiber layer,RNFL)厚度总体比较差异均无统计学意义(F=0.085、0.590、1.817、0.662、0.647,均P>0.05)(图1,表1)。
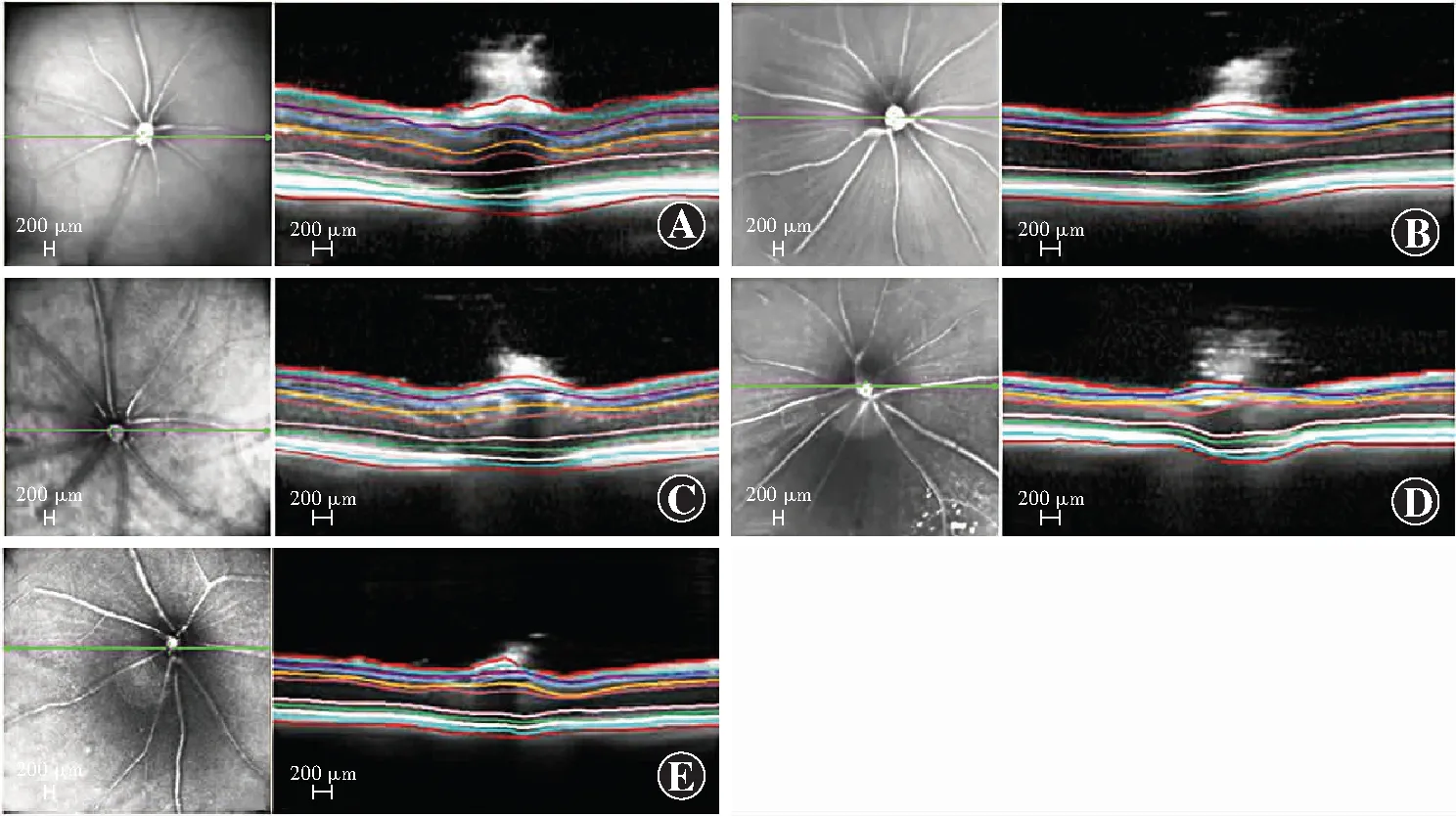
图1 玻璃体腔内注射NMDA后7 d OCT检测各组活体小鼠视网膜厚度变化 与正常对照组比较,不同剂量NMDA组视网膜全层厚度和GCL厚度均显著变薄 A:正常对照组 B:2 mmol/L NMDA组 C:10 mmol/L NMDA组 D:20 mmol/L NMDA组 E:40 mmol/L NMDA组Figure 1 Changes of retinal thicknesses in living mice detected by OCT at 7 days after intravitreal injection of different doses of NMDA Compared with the normal control group,the total retinal and GCL thickness in different doses of NMDA groups were significantly thinner A:Normal control group B:2 mmol/L NMDA group C:10 mmol/L NMDA group D:20 mmol/L NMDA Group E:40 mmol/L NMDA Group
2.2 不同剂量NMDA组小鼠GCL细胞及视网膜厚度变化
正常对照组小鼠GCL细胞均匀、紧密,单层排列,细胞核大而圆。NMDA注射后,细胞出现体积不均和空泡,有核固缩现象。正常对照组、2 mmol/L NMDA组、10 mmol/L NMDA组、20 mmol/L NMDA组、40 mmol/L NMDA组GCL细胞数量分别为(89.22±1.59)、(80.78±1.62)、(60.09±1.74)、(43.97±1.30)、(29.86±1.36)个/mm2,各组间GCL细胞数量随着NMDA剂量的增加而逐渐减少,总体比较差异有统计学意义(F=267.100,P<0.01),2 mmol/L NMDA组、10 mmol/L NMDA组、20 mmol/L NMDA组、40 mmol/L NMDA组GCL细胞数量分别约降至正常对照组的90.54%、67.35%、49.28%和33.46%,与正常对照组比较差异均有统计学意义(均P<0.01)。视网膜感光细胞外节(outer segments,OS)、ONL、INL、IPL厚度和视网膜全层厚度随玻璃体腔内注射NMDA剂量的增加而逐渐变薄,总体比较差异均有统计学意义(F=5.390、8.633、15.210、104.700、45.590,均P<0.01)。10 mmol/L NMDA组和40 mmol/L NMDA组OS厚度,2、10、20、40 mmol/L NMDA组ONL、INL、IPL厚度和视网膜全层厚度均较正常对照组明显变薄,差异均有统计学意义(均P<0.05)(图2,3,表2)。
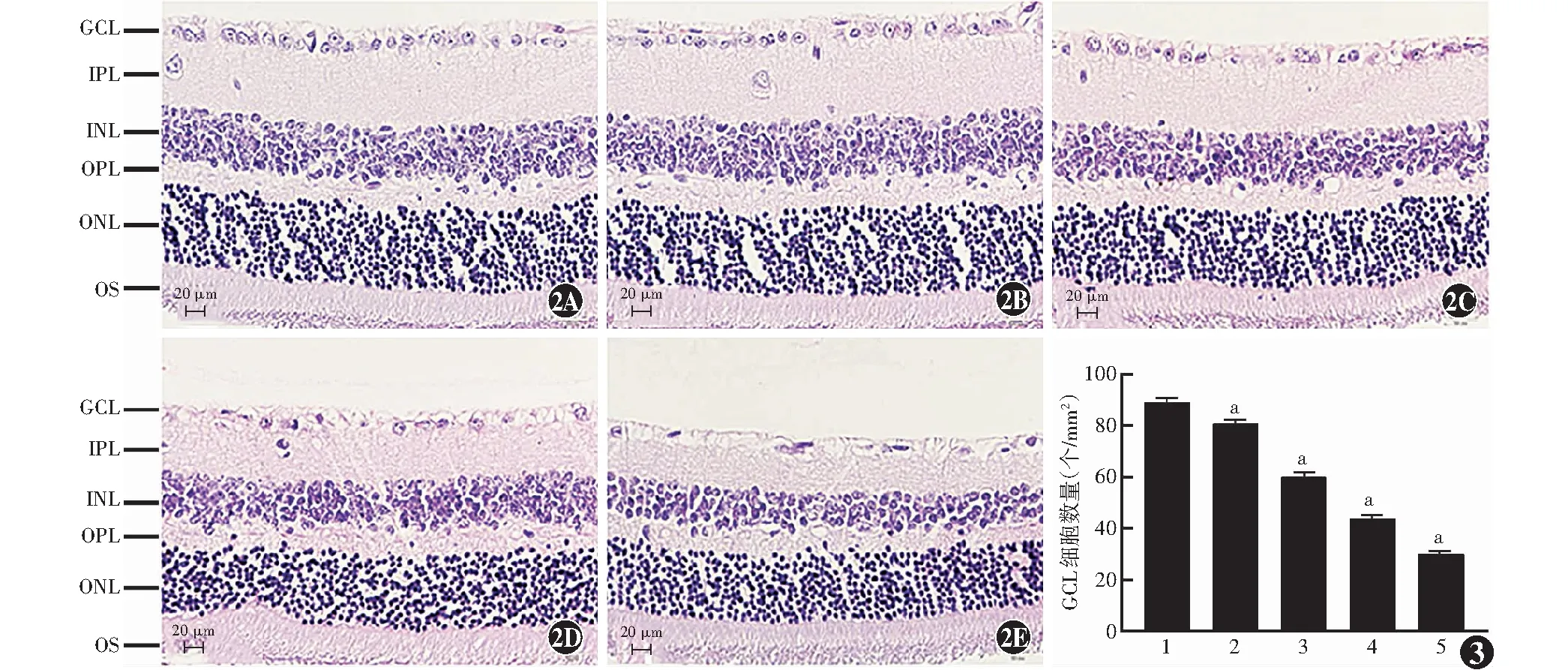
图2 玻璃体腔内注射NMDA后7 d小鼠视网膜形态变化(HE ×400,标尺=20 μm) 与正常对照组比较,不同剂量NMDA组视网膜GCL细胞数量均显著减少 A:正常对照组 B:2 mmol/L NMDA组 C:10 mmol/L NMDA组 D:20 mmol/L NMDA组 E:40 mmol/L NMDA组 图3 各组GCL的细胞数量比较(个/mm2) F=267.100;P<0.01.与正常对照组比较,aP<0.01(单因素方差分析,Tukey post hoc检验,n=5) 1:正常对照组;2:2 mmol/L NMDA组;3:10 mmol/L NMDA组;4:20 mmol/L NMDA组;5:40 mmol/L NMDA组 GCL:神经节细胞层;IPL:内丛状层;INL:内核层;OPL:外丛状层;ONL:外核层;OS:感光细胞外节Figure 2 Retinal morphological changes in mice at 7 days after intravitreal injection of NMDA (HE ×400,bar=20 μm) Compared with the normal control group,the number of GCL cells in different doses of NMDA groups were significantly decreased A:Normal control group B:2 mmol/L NMDA group C:10 mmol/L NMDA group D:20 mmol/L NMDA group E:40 mmol/L NMDA group Figure 3 Comparison of GCL cell number among different groups (pcs/mm2) F=267.100;P<0.01.Compared with the normal control group,aP<0.01 (One-way ANOVA,Tukey post hoc test,n=5) 1:Normal control group;2:2 mmol/L NMDA group;3:10 mmol/L NMDA group;4:20 mmol/L NMDA group;5:40 mmol/L NMDA group GCL:ganglion cell layer;IPL:inner plexiform layer;INL:inner nuclear layer;OPL:outer plexiform layer;ONL:outer nuclear layer;OS:outer segments
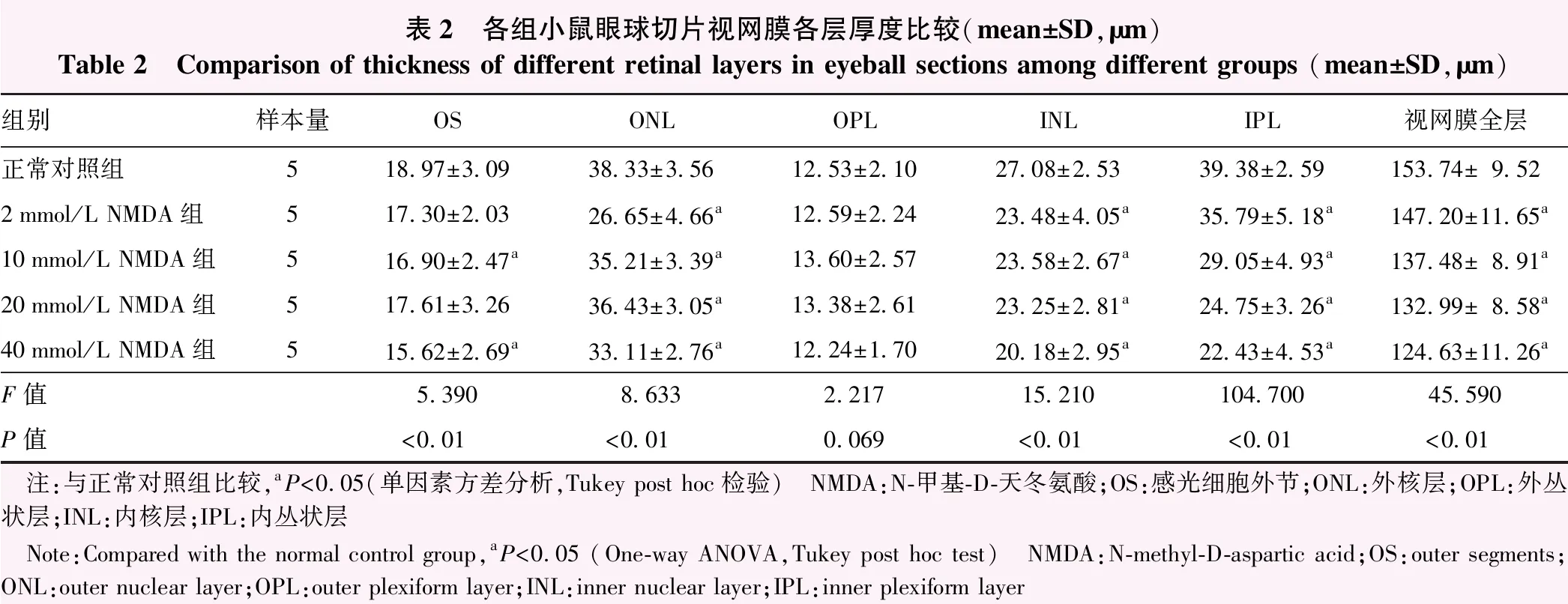
表2 各组小鼠眼球切片视网膜各层厚度比较(mean±SD,μm)Table 2 Comparison of thickness of different retinal layers in eyeball sections among different groups (mean±SD,μm)组别样本量OSONLOPLINLIPL视网膜全层正常对照组518.97±3.0938.33±3.5612.53±2.1027.08±2.5339.38±2.59153.74±9.522mmol/L NMDA组517.30±2.0326.65±4.66a12.59±2.2423.48±4.05a35.79±5.18a147.20±11.65a10mmol/L NMDA组516.90±2.47a35.21±3.39a13.60±2.5723.58±2.67a29.05±4.93a137.48±8.91a20mmol/L NMDA组517.61±3.2636.43±3.05a13.38±2.6123.25±2.81a24.75±3.26a132.99±8.58a40mmol/L NMDA组515.62±2.69a33.11±2.76a12.24±1.7020.18±2.95a22.43±4.53a124.63±11.26aF值5.3908.6332.21715.210104.70045.590P值<0.01<0.010.069<0.01<0.01<0.01 注:与正常对照组比较,aP<0.05(单因素方差分析,Tukey post hoc检验) NMDA:N-甲基-D-天冬氨酸;OS:感光细胞外节;ONL:外核层;OPL:外丛状层;INL:内核层;IPL:内丛状层 Note:Compared with the normal control group,aP<0.05 (One-way ANOVA,Tukey post hoc test) NMDA:N-methyl-D-aspartic acid;OS:outer segments;ONL:outer nuclear layer;OPL:outer plexiform layer;INL:inner nuclear layer;IPL:inner plexiform layer
2.3 不同剂量NMDA组小鼠RGCs数量变化
正常对照组小鼠β3-微管蛋白阳性RGCs排列均匀、紧密,细胞核大而圆。NMDA注射后小鼠RGCs排列松散,着色变浅。注射后7 d,正常对照组、2 mmol/L NMDA组、10 mmol/L NMDA组、20 mmol/L NMDA组和40 mmol/L NMDA组小鼠视网膜中β3-微管蛋白阳性RGCs数量分别为(1 586.67±217.37)、(1 257.22±92.60)、(730.00±128.24)、(565.56±104.73)和(340.00±43.24)个/mm2,随着NMDA剂量的增加,小鼠视网膜中β3-微管蛋白阳性RGCs数量逐渐减少。各组小鼠视网膜中β3-微管蛋白阳性RGCs数量总体比较差异有统计学意义(F=323.000,P<0.01),其中2 mmol/L NMDA组、10 mmol/L NMDA组、20 mmol/L NMDA组和40 mmol/L NMDA组小鼠视网膜中β3-微管蛋白阳性RGCs数量较正常对照组均明显减少,差异均有统计学意义(均P<0.05)(图4,5)。

图4 NMDA注射后7 d小鼠视网膜中β3-微管蛋白阳性RGCs数量变化(FITC ×200,标尺=20 μm) 与正常对照组比较,不同剂量NMDA组β3-微管蛋白阳性RGCs排列松散,数量显著减少 A:正常对照组 B:2 mmol/L NMDA组 C:10 mmol/L NMDA组 D:20 mmol/L NMDA组 E:40 mmol/L NMDA组 图5 各组β3-微管蛋白染色阳性细胞数量比较(个/mm2) F=323.000,P<0.01.与正常对照组比较,aP<0.05(单因素方差分析,Tukey post hoc检验,n=3) 1:正常对照组;2:2 mmol/L NMDA组;3:10 mmol/L NMDA组;4:20 mmol/L NMDA组;5:40 mmol/L NMDA组Figure 4 Changes of the number of retinal ganglion cells in mice at 7 days after intravitreal injection of different doses of NMDA (FITC ×200,bar=20 μm) Compared with the normal control group,β3-tubulin-positive RGCs in different doses of NMDA group were loosely arranged and significantly reduced in number A:Normal control group B:2 mmol/L NMDA group C:10 mmol/L NMDA group D:20 mmol/L NMDA group E:40 mmol/L NMDA group Figure 5 Comparison of the number of β3-tubulin-positive cells among the different doses of NMDA groups (pcs/mm2) F=323.000,P<0.01.Compared with the normal control group,aP<0.05 (One-way ANOVA,Tukey post hoc test,n=3) 1:Normal control group;2:2 mmol/L NMDA group;3:10 mmol/L NMDA group;4:20 mmol/L NMDA group;5:40 mmol/L NMDA group
2.4 不同剂量NMDA组小鼠视网膜lncRNA Tsix阳性细胞率比较
lncRNA Tsix主要表达于GCL,集中在苏木素淡染的细胞质中,苏木素深染的细胞核中未见表达,其他视网膜各层未见表达;dapB作为阴性对照探针的阴性对照组未见着色。随着NMDA剂量的增加,GCL lncRNA Tsix阳性细胞率逐渐降低。正常对照组、2 mmol/L NMDA组、10 mmol/L NMDA组、20 mmol/L NMDA组和40 mmol/L NMDA组lncRNA Tsix阳性细胞率分别为(38.13±3.25)%、(37.77±1.97)%、(33.88±2.23)%、(29.08±2.12)%和(28.43±1.33)%,各组小鼠GCL中的lncRNA Tsix阳性细胞率总体比较差异有统计学意义(F=13.670,P<0.01),2 mmol/L NMDA组、10 mmol/L NMDA组、20 mmol/L NMDA组和40 mmol/L NMDA组小鼠视网膜lncRNA Tsix阳性细胞率均低于正常对照组,其中10 mmol/LNMDA组、20 mmol/L NMDA组和40 mmol/L NMDA组小鼠视网膜中lncRNA Tsix阳性细胞率与正常对照组比较差异均有统计学意义(均P<0.05)(图6,7)。
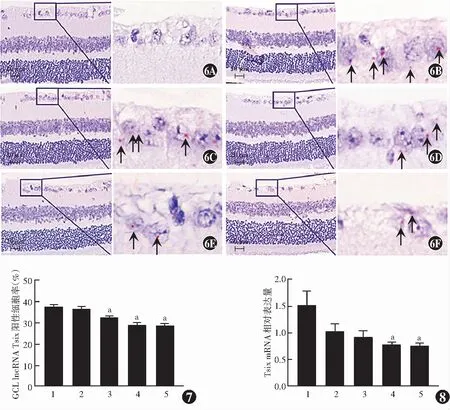
图6 玻璃体腔内注射NMDA后7 d小鼠视网膜组织中lncRNA Tsix的表达(Fast Red+苏木素 ×400,标尺=20 μm) 随着NMDA剂量的增加,GCL lncRNA Tsix染色阳性细胞率降低 黑色箭头指的红点代表lncRNA Tsix阳性染色,紫蓝色代表苏木素染的细胞核 A:阴性对照组 B:正常对照组 C:2 mmol/L NMDA组 D:10 mmol/L NMDA组 E:20 mmol/L NMDA组 F:40 mmol/L NMDA组(右侧为左侧框内局部放大图) 图7 各组GCL lncRNA Tsix阳性细胞率比较 F=13.670,P<0.01.与正常对照组比较,aP<0.05(单因素方差分析,Tukey post hoc检验,n=5) 1:正常对照组;2:2 mmol/L NMDA组;3:10 mmol/L NMDA组;4:20 mmol/L NMDA组;5:40 mmol/L NMDA组 GCL:神经节细胞层;lncRNA:长链非编码RNA 图8 各组小鼠视网膜组织中Tsix mRNA相对表达量比较 F=3.810,P=0.014.与正常对照组比较,aP<0.05(单因素方差分析,Tukey post hoc检验,n=8) 1:正常对照组;2:2 mmol/L NMDA组;3:10 mmol/L NMDA组;4:20 mmol/L NMDA组;5:40 mmol/L NMDA组Figure 6 Expression of lncRNA Tsix in retina tissue at 7 days after intravitreal injection of different doses of NMDA (Fast Red+hematoxylin ×400,bar=20 μm) The lncRNA Tsix-positive cells in the GCL was decreased with the increasing doses of NMDA The red dots (black arrows) represented the positive stained lncRNA Tsix,and purple blue dots represented the nuclear staining with hematoxylin A:Negative control group B:Normal control group C:2 mmol/L NMDA group D:10 mmol/L NMDA group E:20 mmol/L NMDA group F:40 mmol/L NMDA group (the right pictures were the enlarged frame of the left pictures) Figure 7 Comparison of the ratio of the lncRNA Tsix-positive cells in GCL among the different doses of NMDA groups F=13.670,P<0.01. Compared with the normal control group,aP<0.05(One-way ANOVA,Tukey post hoc test,n=5) 1:Normal control group;2:2 mmol/L NMDA group;3:10 mmol/L NMDA group;4:20 mmol/L NMDA group;5:40 mmol/L NMDA group GCL:ganglion cell layer;lncRNA:long noncoding RNA Figure 8 Comparison of Tsix mRNA expression levels in retina tissue among the different doses of NMDA groups F=3.810,P=0.014.Compared with the normal control group,aP<0.05(One-way ANOVA,Tukey post hoc test,n=8) 1:Normal control group;2:2 mmol/L NMDA group;3:10 mmol/L NMDA group;4:20 mmol/L NMDA group;5:40 mmol/L NMDA group
2.5 不同剂量NMDA组小鼠视网膜中Tsix mRNA相对表达量变化
在确认lncRNA Tsix主要在GCL表达后,采用实时荧光定量PCR定量验证NMDA诱导的Tsix mRNA在视网膜中的表达变化是否与RNAscoepe结果一致。实时荧光定量PCR结果显示,正常对照组、2 mmol/L NMDA组、10 mmol/L NMDA组、20 mmol/L NMDA组和40 mmol/L NMDA组小鼠视网膜组织中Tsix mRNA相对表达量分别为1.52±0.65、1.03±0.39、0.92±0.33、0.78±0.13和0.75±0.14,各组间总体比较差异有统计学意义(F=3.810,P=0.014),其中与正常对照组比较,2 mmol/L NMDA组和10 mmol/L NMDA组小鼠视网膜组织中Tsix mRNA相对表达量无明显变化,差异均无统计学意义(均P>0.05);20 mmol/L NMDA组和40 mmol/L NMDA组小鼠视网膜组织中Tsix mRNA相对表达量明显低于正常对照组,差异均有统计学意义(均P<0.05)(图8)。视网膜组织中Tsix mRNA相对表达量随NMDA剂量的增加而显著降低,总体趋势与RNAscope检测出的GCL中lncRNA Tsix的变化趋势一致。
3 讨论
玻璃体腔内注射NMDA可形成一种由于诱导RGCs兴奋性毒性而造成的视神经损伤动物模型[3],为DR和青光眼等不可逆性致盲眼病致病机制的探索以及干预手段的筛选提供良好的平台。NMDA激活NMDA受体,使神经细胞内Ca2+内流超载,触发一系列级联反应,对神经细胞产生神经兴奋性毒性,引起过量的自由基产生和RGCs凋亡[14-16]。注射不同剂量的NMDA造成视网膜损伤程度各异,NMDA剂量过高可导致RGCs损伤过多,NMDA剂量过低则损伤不明显[17],这2种情况均可造成所检测的神经保护性药物效果不明显。本研究建立视网膜兴奋性毒性模型,并评价不同剂量NMDA小鼠玻璃体腔内注射对视网膜RGCs的损伤程度,为今后神经保护性药物的筛选以及神经兴奋性毒性发病机制的研究提供了实验基础。
在本研究中,OCT检查发现不同剂量NMDA组视网膜全层厚度均较正常对照组明显变薄,各组GCL厚度的组间差异有统计学意义,其余视网膜各层厚度的组间比较差异均无统计学意义。组织病理学检查结果表明,在不同剂量NMDA组中,除视网膜全层厚度外,视网膜ONL、INL、IPL厚度均显著变薄。以上实验结果的差异可能主要是由于检测手段精度不同造成的,OCT主要反映活体动物视网膜各层的厚度及形态,但其检测精度不及石蜡切片染色和相应的显微镜下观察;而石蜡切片染色可观察到视网膜组织学上的细微变化,但不能反映活体组织的实时情况[18]。在本研究中,这2种方法虽然精度有所差异,但检测结果的趋势一致,二者分别从宏观和微观角度验证了NMDA对视网膜的兴奋性毒性作用。此外,组织病理学检查结果表明,20 mmol/L NMDA组GCL中的细胞数量约减少至正常对照组的一半;视网膜铺片免疫荧光染色结果显示,10 mmol/L NMDA组和20 mmol/L NMDA组β3-微管蛋白阳性RGCs细胞数量分别约减少至正常对照组的一半和37%。这2种方法检测结果的差异可能是由于位于GCL的细胞除了RGCs外,还包括异位无长突细胞、Müller细胞等,而RGCs对NMDA造成的兴奋性毒性比其他种类的细胞更为敏感,因而相同剂量的NMDA会造成更多的RGCs死亡[19]。
本研究中SD-OCT结果显示,2 mmol/L NMDA组IPL、GCL和RNFL厚度约降至正常对照组的90.15%,这一结果与Kimura等[20]的发现一致。此外,组织病理学检查结果显示,20 mmol/L NMDA组和40 mmol/L NMDA组GCL中的细胞个数分别下降至正常对照组的49.28%和33.46%,与Zheng等[21]的研究结果一致。但值得注意的是,本研究中玻璃体腔内注射2、10、20、40 mmol/L NMDA后1周,β3-微管蛋白标记的RGCs数量分别下降至正常对照组的79.23%、46.00%、35.64%、21.42%,这一结果与Zhao等[17]和刘诗亮等[22]的研究略有不同。Zhao等[17]在玻璃体腔内注射7.5、10、20 mmol/L NMDA后,Brn-3a标记的RGCs分别约降至对照组的80%、50%和25%;而刘诗亮等[22]发现注射30 mmol/L NDMA可使Brn-3b标记的RGCs数量约降至对照组的16.34%,这可能与标记RGCs的特异性标志物不同有关。
LncRNA可在氧化应激、兴奋性毒性等病理条件下,作为表观遗传学的一种重要调控方式,参与调控视网膜疾病的发生、发展和转归[23-25]。研究发现,lncRNA Tsix除了调控Xist的基因表达外[8],还可调控其他基因的表达,如下调miR-30a-5p的表达,从而促进小鼠体内和体外金属颗粒诱导的骨溶解过程中成骨细胞凋亡[26],以及通过“海绵”作用吸附miR-384,从而上调miR-384靶基因的表达,促进人胰腺癌细胞的增生[27]。我们在最近的研究中也发现,lncRNA Tsix在高糖、高脂刺激下的视网膜血管内皮细胞中表达显著下调[11]。研究发现,lncRNA与RNA结合蛋白的共表达分析显示,lncRNA Tsix与核受体共激活因子5(nuclear receptor coactivator 5,NCOA5)的表达呈高度正相关[11]。NCOA5是一种共调节因子,既往研究表明NCOA5在原发性肝癌的发生和发展中起到重要作用[28-29];同时,NCOA5缺乏会上调促炎因子IL-6的表达,诱发葡萄糖耐受不良,进而导致2型糖尿病[30]。因此,lncRNA Tsix可能通过结合下游的NCOA5减少RGCs凋亡以及减轻糖尿病代谢紊乱造成的氧化应激,进而减轻糖尿病所致的视网膜神经和血管的病理改变。LncRNA Tsix对糖尿病患者视网膜的保护作用及其机制仍有待进一步研究。
总之,本研究发现NMDA可剂量依赖性地诱导小鼠视网膜RGCs死亡;同时,本研究还发现了NMDA剂量与RGCs丢失及视网膜各层厚度降低的量化对应关系,为药物筛选提供了可靠的实验平台。此外,新型lncRNA Tsix的表达主要集中在视网膜GCL的细胞质,而且其表达随NMDA剂量的增加而显著下调,对RGCs发挥保护作用。本研究为进一步探索lncRNA Tsix对NMDA诱导视网膜兴奋性毒性的保护作用及其机制提供了实验基础。
利益冲突所有作者均声明不存在利益冲突

