极低频电磁场辐射干扰后小鼠成纤维细胞转录组测序的生物信息学分析
朱茂林 朱煌
上海交通大学医学院附属新华医院眼科 200092
极低频电磁场(extremely low frequency electro-magnetic fields,ELF-EMFs)辐射是一种频率低于300 Hz的非电离辐射,各类电力传输系统、日常使用的各种电子设备均释放出不同能量的ELF-EMFs[1-3]。日常生活中人们使用电子产品的时间越长,眼与ELF-EMFs接触的时间和累积剂量也越大。在眼的生长发育过程中,眼部的成纤维细胞起着重要作用,巩膜重塑、眼眶构建、脉络膜的发育与成纤维细胞的生物学行为有关,电子产品的过度使用可能会对成纤维细胞造成影响,从而促进眼部疾病的发生[4]。目前,ELF-EMFs对成纤维细胞行为的影响尚未明确。mRNA是一种重要的基因表达载体,承接着转录到翻译的功能[5]。随着技术的创新和发展以及高通量测序技术的广泛应用,可以使用生物信息学方法对不同样本之间的生物学进程、分子功能和细胞组分进行分析[6]。本研究拟对成纤维细胞受ELF-EMFs干扰后基因的差异表达和一些关键信号通路及可能参与细胞辐射后应激的差异基因mRNA表达量的变化进行分析和总结,为相关眼病的发病机制研究提供思路。
1 材料与方法
1.1 材料
1.1.1细胞来源 NIH/3T3细胞系(FH0380)购于上海富衡生物科技有限公司。
1.1.2主要试剂及仪器 DMEM高糖培养基(葡萄糖质量浓度为4 500 mg/L)、澳洲胎牛血清、质量分数0.25%胰蛋白酶-乙二胺四乙酸(ethylenediamine tetra acetic acid,EDTA)消化液、磷酸盐缓冲液(phosphate buffered saline,PBS)、青链霉素溶液、Trizol试剂、TruSeq链式mRNA文库制备试剂盒(美国Thermo Fisher公司);RNA逆转录试剂盒、实时荧光定量PCR试剂盒(日本Takara公司)。Agilent2200生物分析仪(美国安捷伦公司);倒置相差显微镜(日本Nikon公司);低温高速离心机(德国Eppendorf公司)。
1.2 方法
1.2.1细胞培养及分组 NIH/3T3细胞接种培养在6孔细胞培养板上,以DMEM高糖培养基为常规培养基,置于37 ℃、体积分数5% CO2培养箱中,隔天换液。待细胞生长至80%~90%融合,使用0.25%胰蛋白酶-EDTA消化液在37 ℃培养箱中消化1 min,以1∶ 4比例传代,倒置相差显微镜下观察细胞形态。待细胞生长至70%~80%,更换培养液,将细胞分为电磁辐射组和正常对照组,每组各3个生物学重复样本。根据前期预实验结果[7]设置辐射剂量和时间,电磁辐射组细胞置于0.2 mT、50 Hz的电磁辐射系统中,正常对照组置于同等条件未通电的相同线圈系统中,于细胞培养箱中培养24 h后收集细胞,提取RNA。
1.2.2ELF-EMFs辐射系统的建立 使用本课题组前期自制的磁场辐照系统[7],由周长60 cm、高度8 cm、168匝的Helmholtz线圈和变压器构成,其中3个线圈相互串联后叠放并与细胞培养箱外的变压器相连。使线圈所在空间产生一个恒定、均匀的50 Hz正弦磁场辐照区,该辐射系统所产生的磁场用电磁辐射分析仪测定。在细胞受磁场辐照时,培养皿中心位于辐照系统的中心轴上。
1.2.3总RNA提取 细胞培养24 h,电磁辐射组和正常对照组分别清除培养基,加入适量PBS快速冲洗细胞,用Trizol试剂抽提细胞中的总RNA,采用Agilent 2200检测RNA质量,质检合格的样品用于进一步测序、生物学分析及实时荧光定量PCR检测。

表1 PCR引物序列Table 1 PCR primer sequence引物名称引物序列(5’-3’)片段长度(bp)MAPK12正向:CGCCGTGTACCAAGACCTG19反向:GAGGCGCAACTCTCTGTAGG20NTRK3正向:TCTTTGCCCAGCCAAGTGTAG21反向:TCCTTGAGATGTCCGTAATGTTG23AGTR2正向:CGCAACTGGCACCAATGAG19反向:AGGGAGGGTAGCCAAAAGGAG21VEGF正向:AGGAGTACCCCGACGAGATAGA22反向:CACATCTGCTGTGCTGTAGGAA22β-actin正向:CGTTGACATCCGTAAAGACC20反向:TCAGTAACAGTCCGCCTAGAAG22 注:PCR:聚合酶链式反应;MAPK:有丝分裂原激活的蛋白激酶;NTRK:神经营养性酪氨酸激酶受体;AGTR:血管紧张素Ⅱ受体;VEGF:血管内皮生长因子;β-actin:β-肌动蛋白 Note:PCR:polymerase chain reaction;MAPK:mitogen activated protein kinase;NTRK:neurotrophic receptor tyrosine kinase;AGTR:angiotensin Ⅱ receptor;VEGF:vascular endothelial growth factor
1.2.4文库构建质检和测序 采用TruSeq链式mRNA文库制备试剂盒为每个RNA样品构建cDNA文库。将RNA溶于无酶水中,用Oligo dT磁珠、RNA结合缓冲液、洗涤液及Tris进行重悬和清洗,得到纯化后的mRNA,并将其片段化为200~500 bp。以切割的RNA片段为模版,进行第1链和第2链cDNA合成。dUTP混合物用于第2链cDNA合成,可去除第2链。将该cDNA片段末端修复,并加上polyA尾。纯化连接的cDNA产物,并用尿嘧啶DNA糖基化酶处理以除去第2链cDNA。通过PCR富集纯化的第1链cDNA以创建cDNA文库。选出合格的片段后,扩增15个循环,再次纯化得到最终文库。采用Agilent 2200对构建的文库进行质检。本文库中,300 bp≤库主峰长≤600 bp,质量浓度≥2 ng/μl,峰型单一,没有杂峰,符合后续上机要求。采用基于Illumina HiSeqXTen测序平台的第2代高通量测序技术,对这些文库进行150 bp的配对末端测序。
1.2.5培养细胞中转录组基因表达量测定 将高通量测序数据的基因组比对结果转换为基因表达量,根据RNA Mapping结果和基因组注释文件,将电磁辐射组和正常对照组的6个样本采用HTSeq算法统计每个基因的表达情况。将测序序列(clean data)比对到测序物种(NCBI Taxonomy ID:10090)对应的参考基因组(mm10)上,确定测序序列在基因组上的定位情况。采用RPKM(Reads Per Kilobase Million Reads)及FPKM(Fragments Per Kilobase Million Reads)对基因的表达值进行标准化。
1.2.6差异基因分析及筛选 采用EdgeR算法过滤差异表达的基因,经过显著分析和错误发现率(false discovery rate,FDR)分析后,遵循以下标准对mRNA进行筛选:表达差异倍数log2Fold Change>0.585或<-0.585,FDR<0.05。通过差异基因筛选结果中的差异倍数以及差异的统计学显著性结果,在火山图中对基因表达的差异分布情况进行展示,获得显著差异基因的数量、显著上/下调基因的数量及差异程度信息。采用基因表达聚类图直观呈现多样本多个基因的全局表达量变化,表达多样本或多基因表达量的聚类关系。
1.2.7基因功能注释和相关通路分析 基于数据库,将分析得到的差异基因分别从生物学进程、分子功能和细胞组分3个层面进行基因本体论(Gene Ontology,GO)注释,得到基因参与的所有GO,采用Fisher检验计算每个GO的显著性水平(P值),从而筛选出差异基因富集的显著性GO。关注P值<0.05的相关基因。将筛选出的差异基因基于京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库进行通路注释,得到差异基因参与的所有通路条目,采用Fisher检验计算Pathway的显著性水平(P值),从而筛选出差异基因富集的显著性通路条目。
1.2.8实时荧光定量PCR法检测差异基因的表达 按照RNA逆转录试剂盒步骤将提取的RNA逆转录合成cDNA。将获取的cDNA分别加入各引物的反应体系中进行实时荧光定量PCR,有丝分裂原激活的蛋白激酶12(mitogen activated protein kinase 12,MAPK12)、神经营养性酪氨酸激酶受体3型(neurotrophic tyrosine kinase receptor type 3,NTRK3)、2型血管紧张素Ⅱ受体(angiotensin Ⅱ receptor type 2,AGTR2)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、β-肌动蛋白(β-actin)PCR引物序列见表1,反应体系为20 μl。反应条件:95 ℃预变性1 min;95 ℃变性15 s,60 ℃退火及延伸34 s,循环40次。扩增后进行熔解曲线分析。以β-actin为内参照,采用2-△△Ct法计算各目的基因mRNA相对表达量。
1.3 统计学方法
采用SPSS 21.0统计学软件对数据进行统计分析。计量资料数据经K-S检验证实呈正态分布,以mean±SD表示。本次分析选用的差异筛选算法为EdgeR。EdgeR是基于负二项分布的统计方法,采用TMM算法进行标准化,采用多组实验的精确统计模型进行基因差异表达鉴定的算法。以FDR<0.05表示差异有统计学意义。组间数据比较采用独立样本t检验。2个组各个样本基因表达水平的相关性分析采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 RNA对比
比对到小鼠参考基因组的reads数占比(Mapped Rate)均高于90%,在本实验结果中,未见存在显著异常的染色体富集,未受到污染,结果可靠性良好。
2.2 转录组表达量的分析
根据基因在样本中FPKM密度分布图和FPKM分布箱线图可见测序样本中以中等表达的基因为主,低表达和高表达的基因占比很少,整体基因表达状况良好。电磁辐射组和正常对照组各自3个样本间的相关系数(r)在0.95~1.00(图1)。
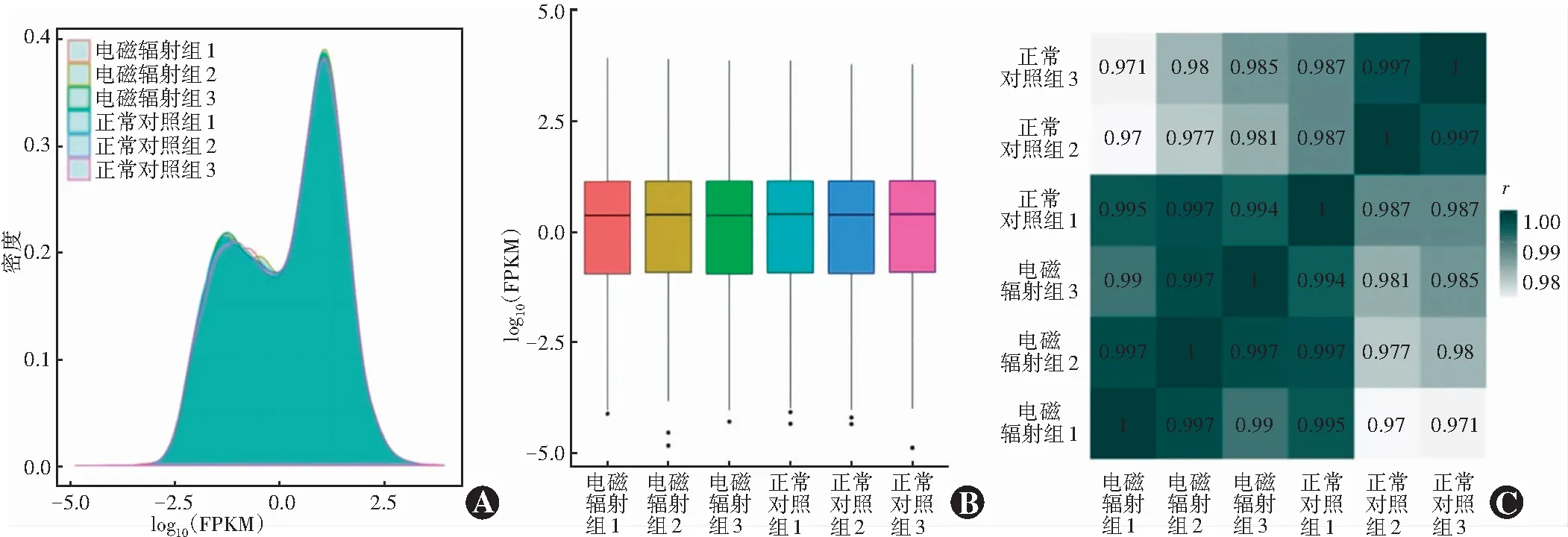
图1 ELF-EMFs作用后2个组的转录组表达量 A:基因的FPKM密度分布图 B:基因的FPKM分布箱线图 C:样本间基因表达水平相关性 颜色深浅代表Pearson相关性系数的高低,颜色越深,相关性越好Figure 1 Transcriptome expression levels of the two groups after exposure to ELF-EMFs A:FPKM density distribution map of genes B:Gene FPKM distribution boxplot C:Correlation matrix showing correlation coefficients between samples Deeper color represented higher correlation FPKM:Fragments Per Kilobase Million Reads
2.3 电磁辐射组与正常对照组中基因表达差异分析
在本次转录组测序中,共鉴定出17 980个基因,筛选出遵循表达差异倍数的共140个显著差异基因,其中120个差异基因上调,差异较大的上调基因有Neat1、ND6、MAPK12、Tle2等,多与氨基酸转运、NADH-泛醌氧化还原酶链、溶质载体家族、细胞黏附分子等功能活动相关;20个下调的基因多与泛素蛋白连接酶、选择素、真核翻译延伸因子等功能活动相关(图2)。样本的双向类聚分析结果可见电磁辐射组与正常对照组的相关性和均一性较好(图3)。
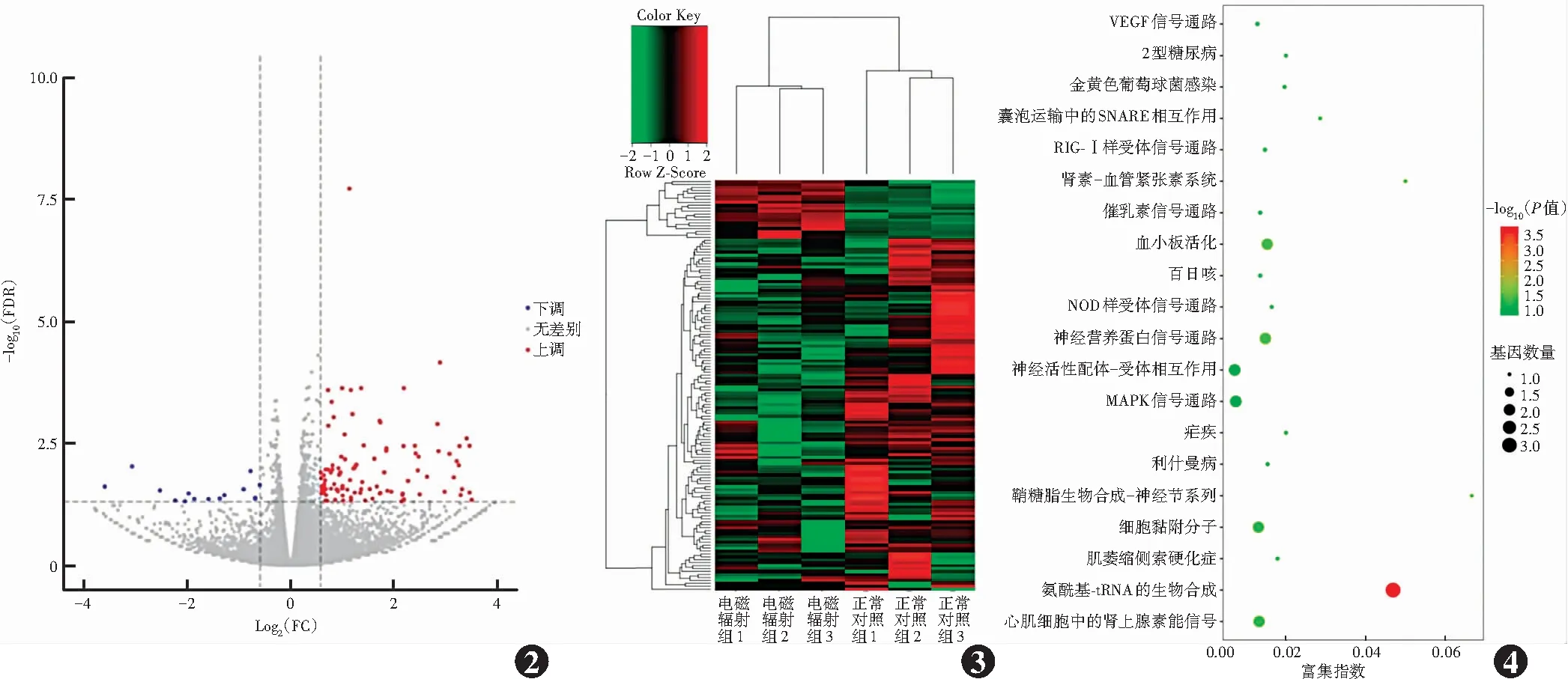
图2 ELF-EMFs作用后2个组差异基因火山图 虚线是差异基因筛选采用的阈值,虚线之外为显著差异基因;红色代表显著上调的差异基因,蓝色代表显著下调的差异基因,灰色代表非显著差异的基因 FDR:错误发现率;FC:差异倍数 图3 ELF-EMFs作用后2个组基因表达聚类图 每个格子表示每个基因在不同样本中的RPKM值。红色代表该基因在中位数值标准化后,相对于中位数值的表达较高;绿色代表基因相对于中位数值的表达较低;颜色越深,越接近黑色代表越接近中位数值 图4 ELF-EMFs作用后相关通路富集图 VEGF:血管内皮生长因子;NOD:核苷酸结合寡聚化结构域;MAPK:丝裂原活化蛋白激酶Figure 2 Volcano plots displaying differentially expressed genes between the two groups after exposure to ELF-EMFs The dashed line was the threshold used for differentially expressed genes screening,and beyond the dashed line was the significantly differentially expressed genes;color red represented the significantly up-regulated genes,and color blue represented the significantly down-regulated genes,and color gray represented non-significantly differentially expressed genes FDR:false discovery rate;FC:fold change Figure 3 Gene expression cluster diagram of the two groups after exposure to ELF-EMFs Each grid represented the RPKM value of each gene in different samples.Color red meant that the gene expression was higher than that of median after median normalization,and color green meant that the expression of the gene was lower than that of median after median normalization.The darker the color,the closer it was to color black,and the closer it was to median Figure 4 Enrichment map of related pathways after exposure to ELF-EMFs VEGF:vascular endothelial growth factor;NOD:nucleotide-binding oligomerization domain;MAPK:mitogen-activated protein kinase
2.4 基因功能分析及与ELF-EMFs有关的通路筛选
通过GO分析,从生物学进程来看,差异基因富集在翻译的延长、活性氧生物合成过程的调控、生长板软骨细胞发育、黑色素生物合成过程的调节、醛固酮分泌等方面;从分子功能来看,差异基因富集在三重密码子-氨基酸衔接子活性、1,2-二羟基萘双加氧酶活性等方面;从细胞组分来看,差异基因富集在阳离子通道配合物、线粒体丙酮酸脱氢酶复合物、血小板α颗粒膜、纤维状胶原三聚体等方面。KEGG分析显示差异基因主要涉及55条通路,其中富集显著的10条通路集中于氨酰基-tRNA的生物合成、血小板活化、神经营养蛋白信号通路、肾素-血管紧张素系统等,与细胞的生物合成密切相关(图4)。在以上通路中,结合GO分析,Col27a1、MAPK12、NTRK3、B4galnt1、AGTR2等基因改变明显,其中MAPK12和AGTR2在多条通路中均有涉及,这2个基因在ELF-EMFs作用后改变显著。
2.5 2个组MAPK12、NTRK3、AGTR2和VEGF mRNA相对表达量比较
电磁辐射组MAPK12、NTRK3、AGTR2和VEGF mRNA的相对表达量均明显高于正常对照组,2个组比较差异均有统计学意义(t=12.540、6.309、13.710、3.078,均P<0.05)(表2)。
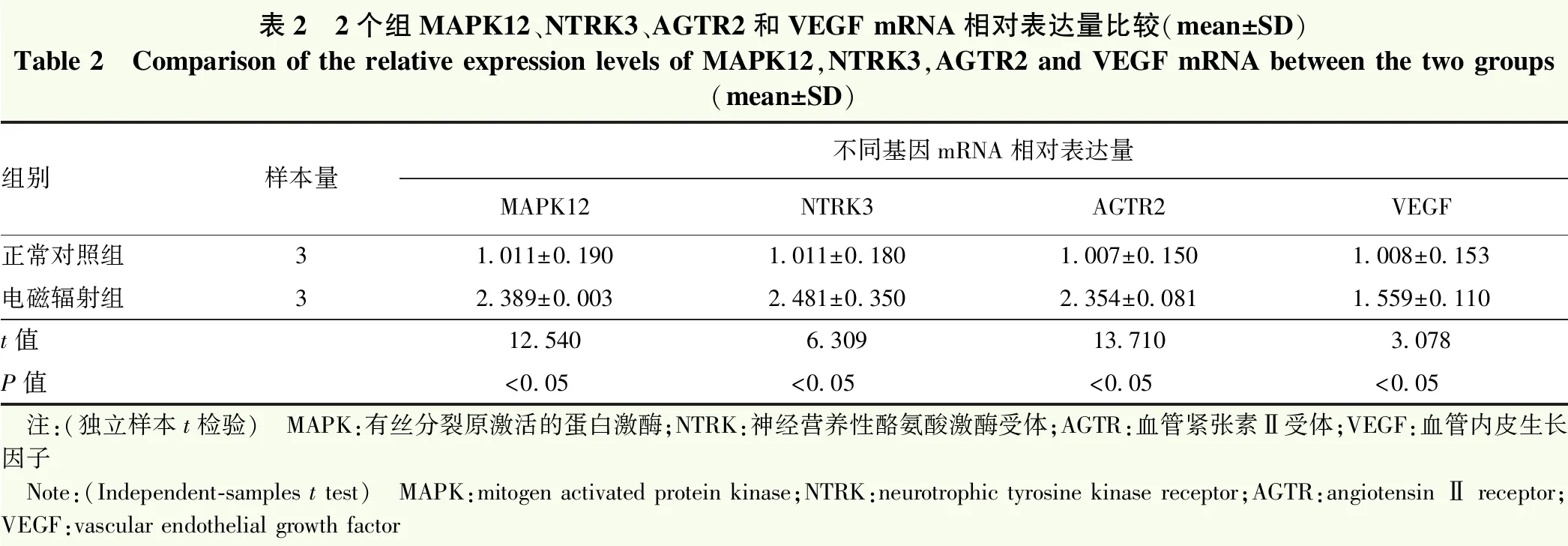
表2 2个组MAPK12、NTRK3、AGTR2和VEGF mRNA相对表达量比较(mean±SD)Table 2 Comparison of the relative expression levels of MAPK12,NTRK3,AGTR2 and VEGF mRNA between the two groups(mean±SD)组别样本量不同基因mRNA相对表达量MAPK12NTRK3AGTR2VEGF正常对照组31.011±0.1901.011±0.1801.007±0.1501.008±0.153电磁辐射组32.389±0.0032.481±0.3502.354±0.0811.559±0.110t值12.5406.30913.7103.078P值<0.05<0.05<0.05<0.05 注:(独立样本t检验) MAPK:有丝分裂原激活的蛋白激酶;NTRK:神经营养性酪氨酸激酶受体;AGTR:血管紧张素Ⅱ受体;VEGF:血管内皮生长因子 Note:(Independent-samples t test) MAPK:mitogen activated protein kinase;NTRK:neurotrophic tyrosine kinase receptor;AGTR:angiotensin Ⅱ receptor;VEGF:vascular endothelial growth factor
3 讨论
基因调控贯穿整个眼部的生长发育过程,能够精确调控细胞功能的变化。日常生活中,我们接触电磁辐射的频率变高,累积剂量增大。电子产品使用时间变长,会使眼长期暴露在这些设备所发出的ELF-EMFs中[8],关于ELF-EMFs的安全更加受到关注。近年来,国际上从多个角度进行了大量关于人体和动物的调查及试验,研究ELF-EMFs对神经、免疫、生殖等系统功能的影响[9-11]。也有多项研究发现ELF-EMFs对眼部健康有着不可忽略的影响[12-13]。
近年来,美国模式培养物集存库对人胚胎眼巩膜成纤维细胞存在部分争议,而小鼠成纤维细胞与眼部多种成纤维细胞有着较类似的生物学功能,故在本研究中使用小鼠成纤维细胞作为替代。本研究共检测到17 980个基因,140个有显著差异的基因,其中上调表达基因120个,下调表达基因20个。从GO生物学进程中可发现,差异表达基因主要富集在细胞代谢过程和生物调控等方面;从GO细胞组分来看,大部分的差异表达基因富集在生物合成和分泌等方面;从GO的分子功能来看,差异表达基因主要富集在生物合成相关酶活性等方面。KEGG分析结果显示,差异基因涉及的通路中,血小板活化、神经营养蛋白信号通路、肾素-血管紧张素系统最为显著,提示ELF-EMFs调控小鼠成纤维细胞可能涉及以上相关通路的变化,MAPK12、AGTR2、VEGF基因在以上通路中改变显著。现阶段普遍认为,AGTR2在肾素-血管紧张素系统中起着非常重要的作用,该基因除了在高血压和左心室肥厚重塑中作为重要的研究靶点之外[14-16],以AGTR2为靶标的肾素-血管紧张素系统的拮抗剂在糖尿病视网膜病变中有助于渐进改变视网膜细胞的环境,从而保护视网膜[17]。在通过激光光凝视网膜血管疾病的治疗中,AGTR2是抑制VEGF诱导血管生成的候选靶标[18]。最新的研究发现,选择性激活AGTR2可以显著阻断血管紧张素Ⅱ、脂多糖和过氧化氢诱导的核因子-κB激活和炎性细胞因子的表达,所以选择性激活AGTR2可能是视网膜疾病治疗的新途径[19],为眼科疾病的治疗提供了新的靶标。
但在本研究中,经过ELF-EMFs处理后,AGTR2和VEGF的表达均显著上调。VEGF作为眼部疾病发生的重要基因,在年龄相关性黄斑变性、中心性渗出性脉络膜视网膜病变等眼部疾病的发生过程中有重要作用。VEGF表达水平升高提示ELF-EMFs对成纤维细胞的影响可能引发眼部各类疾病的发生。
MAPK家族控制大量的细胞过程,是真核生物对环境应激和炎症应答的保守机制之一。MAPK12能够通过生长因子、促细胞分裂剂、激素、细胞因子等外部刺激诱导产生特定细胞应激,从而应对各种外部刺激,对于眼部外伤、年龄相关性黄斑变性、角膜内皮细胞增生有着重要作用[20-22]。
成纤维细胞是机体完成生物学功能的重要组成细胞,是疏松结缔组织的主要细胞成分,具有胶原形成、蛋白分泌、创伤修复等功能。在免疫耐受、组织修复等过程中有着重要作用[23-24]。在机体受到损伤时,伤口自然愈合是通过细胞外基质沉积引起的组织纤维化进行的,但过度纤维化会引起一些不良反应,甚至会引发一些新的疾病,如系统性硬化[25]。翼状胬肉的形成也与过度纤维化有着密切关系[26],通过药物处理,可抑制成纤维细胞的增生并促进细胞凋亡,从而防治复发性翼状胬肉[27]。成纤维细胞的多种功能在眼部疾病的发展过程中具有重要作用。虽然过度纤维化会影响角膜损伤后的修复[28],并与角膜上皮基底膜有着密切的关系[29];但是在最新的一项研究中发现,角膜上皮清创可以诱导细胞凋亡,使角膜基质细胞衰老,表现出非纤维化的表型,可能参与角膜纤维化的自我限制[30]。
本研究通过对转录组结果进行统计,全面分析了ELF-EMFs对小鼠成纤维细胞生物学功能的影响,为进一步的机制研究提供了方向。但本次测序仅为转录组测序,无法对非编码RNA的调控进行分析和预测,后续实验可进一步对电磁辐射后细胞进行全转录组测序,得到更加全面的结果。
综上所述,本研究发现MAPK12、AGTR2和VEGF基因对于ELF-EMFs作用后成纤维细胞应激有重要作用,这3个差异表达基因可能影响或参与了成纤维细胞损伤修复的过程,可作为探讨ELF-EMFs对眼部病变影响的候选靶标,其具体的作用机制仍需进一步实验探讨。
利益冲突所有作者均声明不存在利益冲突

