支链氨基酸分解代谢在肺癌细胞中的功能
贺艳琪,迟 锐,陈梦萍,陈 思,刘春良,刘云霞,孙海鹏
1.上海交通大学基础医学院病理生理学系,细胞分化与凋亡教育部重点实验室,上海 200025;2.上海交通大学医学院附属同仁医院虹桥国际医学研究院,上海 200050
在世界范围内,肺癌是癌症患者死亡的主要病因之一。根据世界卫生组织国际癌症研究中心发布的最新统计数据显示,2020年全球新发癌症病例1 929万例,其中肺癌病例220万(我国有82万)[1]。肺癌从形态学上分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer,NSCLC)两大类,其中NSCLC占比80%~85%且患者的5年生存率不足20%[2]。
支链氨基酸(branched-chain amino acid,BCAA)是一类R基团含有支链的必需氨基酸,包括亮氨酸、异亮氨酸和缬氨酸3种。在哺乳动物中,BCAA只能通过食物获取。支链酮酸脱氢酶(branched-chain keto acid dehydrogenase,BCKDH)是BCAA分解代谢的限速酶,为一种由多个亚基组成的复合物,其活性受到亚基支链酮酸脱氢酶E1α(branched-chain keto acid dehydrogenase e1,αpolypeptide,BCKDE1α)磷酸化的调节。而支链酮酸脱氢酶激酶(branched-chain keto acid dehydrogenase kinase,BCKDK)可磷酸化BCKDE1α,降低BCKDH活性,从而抑制BCAA的分解代谢。BCKDK抑制剂——3,6-二氯-2-苯并噻吩羧酸(3,6-dichlorobenzo[b]thiophene-2-carboxylic acid,简称BT2)是Tso等[3]发现的一种靶向BCKDK的新型小分子化合物,其能够有效下调BCKDE1α的磷酸化,以促进BCAA的分解代谢[4-5]。
P21又叫P21Waf1/Cip1或CDKN1A(cyclin-dependent kinase inhibitor 1A)[6],是周期蛋白依赖性激酶抑制因子(cyclin-dependent-kinase inhibitor,CKI)家族的成员之一,也是细胞周期的负调控因子,可通过抑制细胞周期的关键调节因子——周期蛋白依赖性激酶(cyclin dependent kinase,CDK)使细胞周期发生阻滞[7]。
近些年人们发现,BCAA与一些肿瘤的发生与发展有关。Mayers等[8]发现胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)患者血浆中BCAA水平升高,与未来胰腺癌诊断风险增加有关。Ericksen等[9]发现BCAA的分解代谢在肝癌中被抑制,且这种抑制状态可促进肝肿瘤的形成。Li等[10]发现在小鼠模型和人类PDAC中BCAA转氨酶水平明显升高,使得肿瘤细胞对BCAA的摄取增加,从而维持线粒体呼吸。上述研究均提示,在部分肿瘤的发生与发展中BCAA的分解代谢发挥了一定的作用。然而目前,关于肺癌和BCAA代谢之间的研究并不多。本研究采用NSCLC细胞株进行体外实验,探索BCAA分解代谢在肺癌细胞中的功能,以期为肺癌的临床治疗或药物开发提供实验基础和理论依据。
1 材料与方法
1.1 细胞株和主要试剂
A549、H1299、HCC827细胞株均购自美国模式培养物集存库。主要试剂:β-actin抗体(上海泊湾生物科技有限 公 司),磷 酸 化BCKDE1α(P-BCKDE1α)抗 体(Bethyl,美国),BCKDK抗体、BCKDE1α抗体(Santa Cruz Biotechnology,美国),P21抗体(Cell Signaling Technology,美国),CCK-8试剂盒[东仁化学科技(上海)有限公司],台盼蓝染色液(0.4%)(北京普利莱基因技术有限公司),碘化丙啶(propidium iodide,PI)(Sigma,美国),小干扰RNA(small interfering RNA,siRNA)、BCKDK的小干扰RNA(small interferingBCKDK,siBCKDK,序列为5′-CUGACUUUGUCGGCAUCAUTT-3′)(由上海吉玛制药技术有限公司合成),Lipo 2000转染试剂(Invitrogen,美国),胎牛血清(fetal bovine serum,FBS)、DMEM培养基(Gibco,美国),RPMI-1640培养基(上海源培生物科技股份有限公司),BCKDK的小分子抑制剂BT2(Caymanchem,美国)。
1.2 细胞培养
于37℃、5%CO2的恒温培养箱中,采用含10%FBS的DMEM培养基对A549和HCC827细胞进行培养,采用含10%FBS的RPMI-1640培养基对H1299细胞进行培养。定期观察细胞状态,每2~3 d进行1次传代。
1.3 细胞处理及分组
将处于对数生长期的上述3种细胞按照(1~2)×106的密度种板,设置3个复孔。①siRNA转染:待细胞贴壁生长后,按照Lipo 2000说明书操作步骤进行转染和换液。对照组细胞转染无义序列的siNC,处理组细胞转染siBCKDK。待细胞生长48~72 h后,收集细胞和蛋白做后续实验。②BT2处理:待细胞贴壁生长后,更换为含0μmol/L BT2、100μmol/L BT2、200μmol/L BT2的培养基,继续培养48~72 h后收集细胞及蛋白用于后续检测。
1.4 BCKDK表达、BCKDE1α及其磷酸化水平检测
分别收集经siNC、siBCKDK转染的H1299、A549、HCC827细胞,于磷酸缓冲盐溶液(phosphate buffer saline,PBS)中清洗,而后加入细胞裂解液进行充分裂解。收集裂解后的细胞悬液于100℃加热10 min,再于4℃下12 000×g离心10 min,取上清液即为蛋白样品。采用BCA试剂盒测定蛋白样品浓度,具体步骤参见该试剂盒说明书。而后,将其制成含溴酚蓝的统一浓度的蛋白样品,行蛋白质印迹法(Western blotting)检测,具体步骤参照常规操作,使用抗体包括β-actin抗体、BCKDK抗体、P-BCKDE1α抗体、BCKDE1α抗体。分别收集经0μmol/L BT2、100μmol/L BT2、200μmol/L BT2处理的上述3种细胞的蛋白,行Western blotting检测BCKDE1α及其磷酸化水平,具体检测步骤同前。
1.5 细胞增殖能力检测
①将转染siNC、siBCKDK后的H1299、A549、HCC827细胞分别按照2 000个/孔进行种板,设置5个复孔进行培养。②将上述3种细胞分别按照2 000个/孔进行种板(设置5个复孔),待细胞贴壁生长后,更换为含0μmol/L BT2、200μmol/L BT2的培养基继续培养。分别于0、24、48、72 h向①、②实验的每孔加入10μL CCK-8溶液,孵育2 h后检测吸光度值[D(450 nm)],并以时间为横坐标、吸光度值为纵坐标绘制细胞生长曲线。具体步骤参照CCK-8试剂盒说明书进行。
1.6 细胞活率检测
将H1299、A549细胞按照1×105进行种板,设置3个复孔。待细胞贴壁生长后,分别做如下处理:①转染siNC、siBCKDK。②更换为含0μmol/L BT2、200μmol/L BT2的培养基。于37℃恒温培养箱中继续培养48~72 h。分别收集上述处理后的细胞,将其制备成1 mL细胞悬液,与0.2%台盼蓝溶液(先用PBS将0.4%台盼蓝溶液按照1∶1稀释)进行混匀(比例为1∶1)。取20μL细胞混合液轻轻加入计数板中,用Countstar自动细胞计数仪进行计数,统计细胞活率并分析作图。具体步骤参考台盼蓝染料说明书。
1.7 细胞周期不同阶段的占比及P21蛋白的检测
将H1299、A549细胞分别按照4×105个/皿进行种板。待细胞贴壁生长后,分别行如下处理:①转染siNC、siBCKDK。②更换为含0μmol/L BT2、200μmol/L BT2的培养基。于37℃恒温培养箱中培养48~72 h。分别收集上述细胞并用终浓度为70%的乙醇固定过夜,室温下采用PI进行避光染色15 min。而后,用流式细胞仪检测处于细胞周期不同阶段的细胞占比,采用FLowJo_v(10.6.2)软件对细胞周期占比进行拟合作图,并在GraphPad Prism 8中计算不同阶段的细胞占比、绘制柱状图。
分别收集经siNC、siBCKDK转染的H1299、A549细胞的蛋白,以及经0μmol/L BT2、200μmol/L BT2处理的该2种细胞的蛋白,而后行Western blotting检测P21的表达,具体检测步骤同前。
1.8 统计学方法
采用GraphPad Prism 8软件对实验数据进行统计分析。所有定量资料以x±s表示,组间采用独立样本t检验进行比较。P<0.05表示差异具有统计学意义。
2 结果
2.1 Western blotting检测si BCKDK对NSCLC细胞中BCKDK表达及BCKDE1α磷酸化的影响
采用Western blotting检测经siNC、siBCKDK转染后3种NSCLC细胞中BCKDK的表达和BCKDE1α磷酸化水平的变化。结果(图1)显示,与siNC组相比,siBCKDK组BCKDK的水平受到明显抑制;同时,由BCKDK调控的BCKDE1α磷酸化水平亦有明显下调。
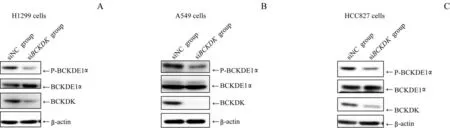
图1 si BCKDK对NSCLC细胞中BCKDK蛋白表达及BCKDE1α磷酸化水平的影响Fig 1 Effect of si BCKDK on BCKDK protein expression and BCKDE1αphosphorylation in NSCLCcells
2.2 CCK-8法检测si BCKDK对NSCLC细胞增殖能力的影响
采用CCK-8法检测经siNC、siBCKDK转染后对3种NSCLC细胞的增殖能力的影响。结果(图2)显示,在培养72 h时,与siNC组相比,siBCKDK组的细胞增殖明显下降(均P=0.000)。

图2 si BCKDK对NSCLC细胞增殖能力的影响Fig 2 Effect of si BCKDK on proliferation of NSCLCcells
2.3 Western blotting检测BT2对NSCLC细胞BCKDE1α磷酸化的影响
采用Western blotting法检测BCKDK小分子抑制剂BT2对3种NSCLC细胞中BCKDE1α磷酸化的影响。结果(图3)显示,在H1299细胞中,相较于0μmol/L BT2组,100μmol/L BT2组、200μmol/L BT2组中BCKDE1α表达水平没有变化,但BCKDE1α磷酸化水平有所下调;在A549细胞、HCC827细胞中,相较于0μmol/L BT2组,100μmol/L BT2组、200μmol/L BT2组中BCKDE1α磷酸化水平亦下调显著。
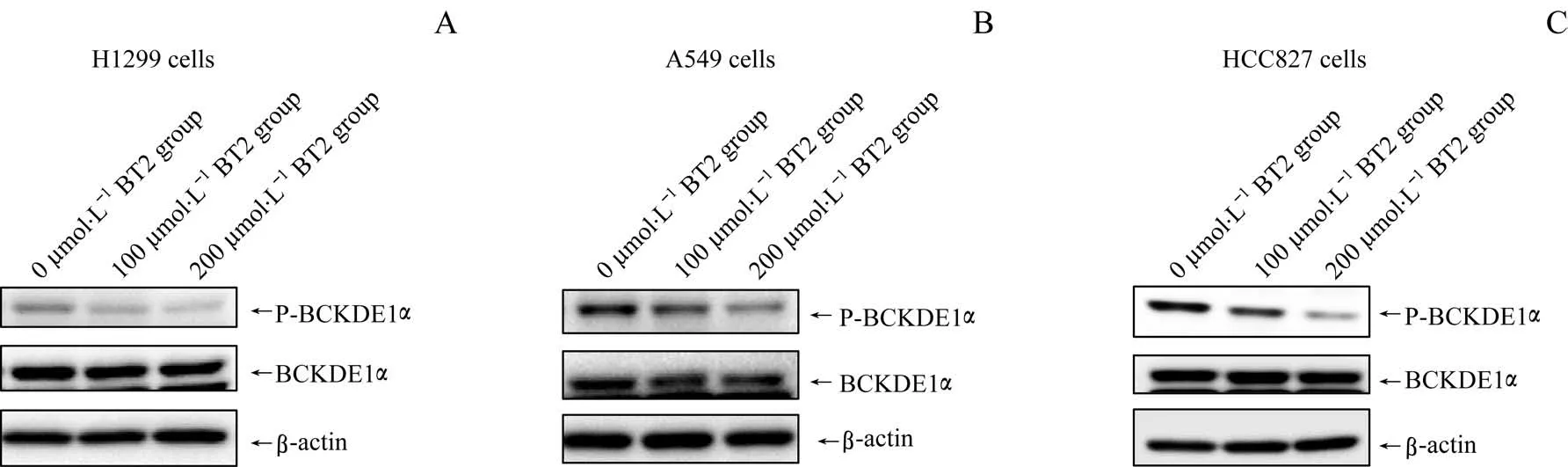
图3 BT2对NSCLC细胞中BCKDE1α磷酸化水平的影响Fig 3 Effect of BT2 on phosphorylation of BCKDE1αin NSCLCcells
2.4 CCK-8法检测BT2对NSCLC细胞增殖能力的影响
采用CCK-8法检测BCKDK小分子抑制剂BT2对3种NSCLC细胞增殖能力的影响。结果(图4)显示,将H1299细胞培养72 h时,200μmol/L BT2组相较于0μmol/L BT2组的细胞增殖能力显著下降(P=0.000);在A549细胞、HCC827细胞中,200μmol/L BT2组相较于0μmol/LBT2组的细胞增殖能力亦明显下降(均P=0.000)。
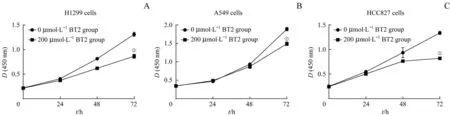
图4 BT2对NSCLC细胞增殖能力的影响Fig 4 Effect of BT2 on proliferation of NSCLCcells
2.5 台盼蓝染色检测siBCKDK或BT2对NSCLC细胞活率的影响
分别采用台盼蓝染色检测siBCKDK或BT2对NSCLC细胞活率的影响。结果(图5)显示,在H1299细胞中,siBCKDK组相较于siNC组细胞的活率无差异,且200μmol/L BT2组与0μmol/L BT2组的活率间差异亦无统计学意义;在A549细胞中,siBCKDK和200μmol/L BT2亦未影响细胞的活率。
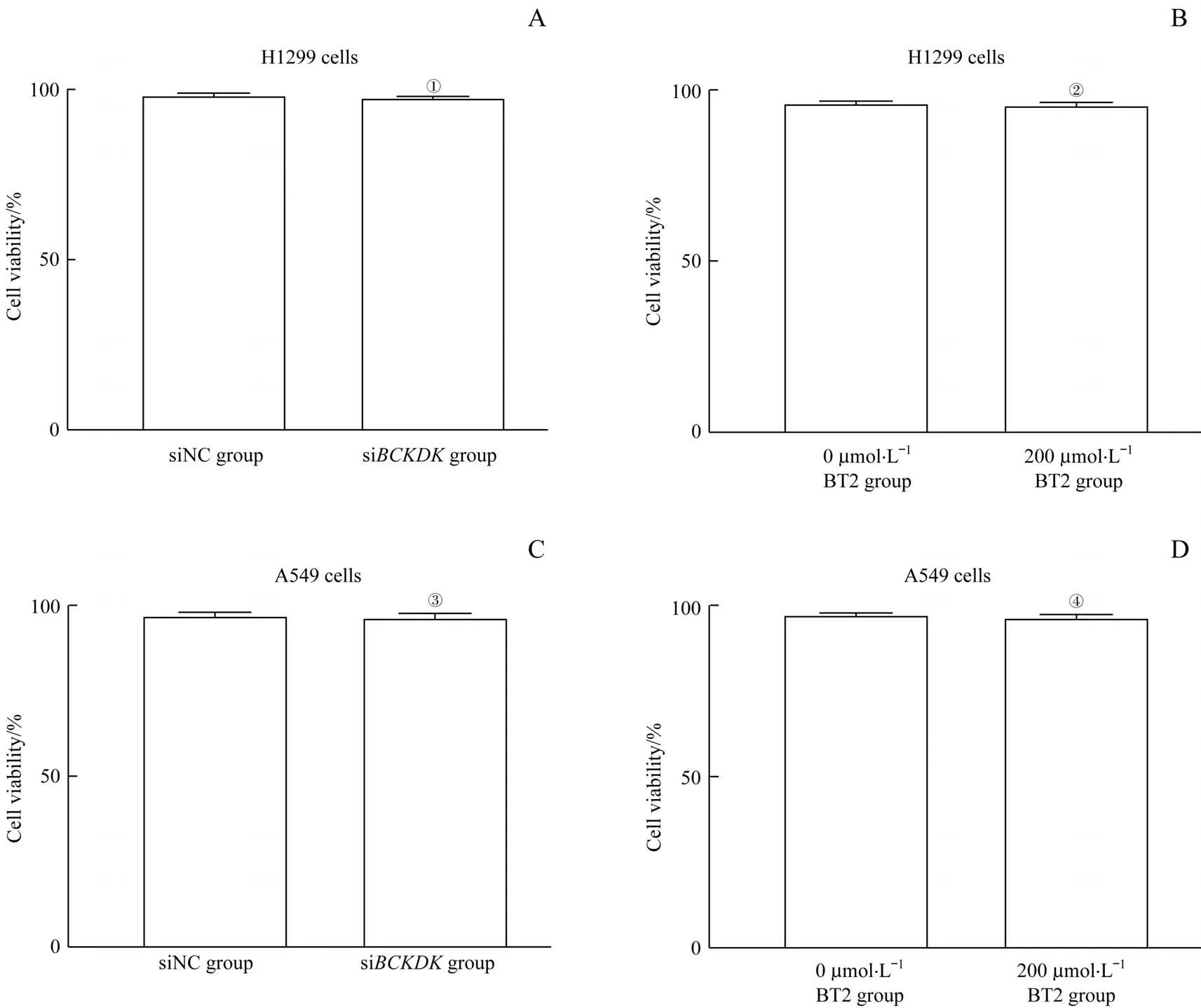
图5 si BCKDK或BT2对NSCLC细胞活率的影响Fig 5 Effects of si BCKDK or BT2 on the survival rate of NSCLC cells
2.6流式细胞术检测siBCKDK或BT2对NSCLC细胞周期的影响
采用流式细胞术检测经0、200μmol/L BT2和siNC、siBCKDK处理后H1299、A549细胞的细胞周期,并计算处于细胞周期不同阶段的细胞占比。结果显示,在H1299细胞(图6A、B)和A549细胞(图6C、D)中,200μmol/L BT2组较0μmol/L BT2组在G0/G1期细胞比例有所上调,处于S期的细胞比例下降,siBCKDK组较siNC组也出表现相同趋势。
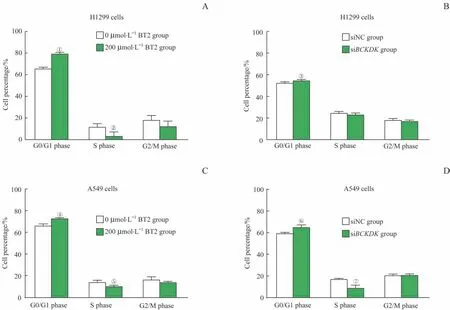
图6 si BCKDK或BT2对NSCLC细胞周期的影响Fig 6 Effect of si BCKDK or BT2 on cell cycle of NSCLCcells
2.7 Western blotting检测siBCKDK或BT2对NSCLC细胞内P21水平的影响
采用Western blotting检测经siBCKDK转染或200 μmol/L BT2抑制BCKDK后,BCAA分解代谢加快对NSCLC细胞中P21水平的影响。结果(图7)显示,在H1299细胞中及A549细胞中,siBCKDK组相较于siNC组、200μmol/L BT2组相较于0μmol/L BT2组的P21水平均有所上调。
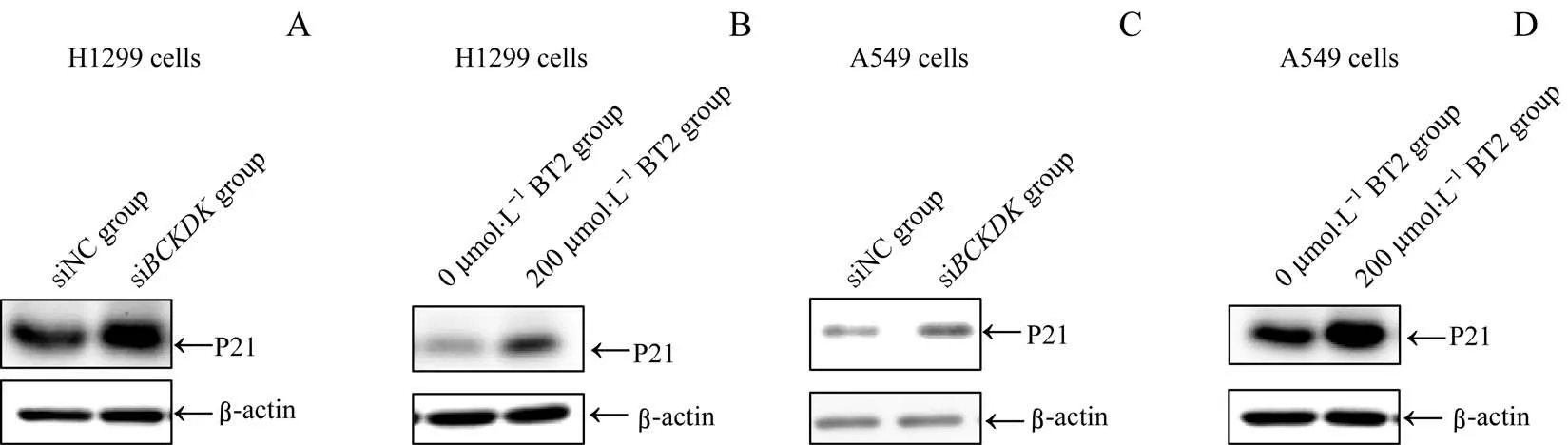
图7 si BCKDK或BT2对NSCLC细胞内P21表达水平的影响Fig 7 Effects of si BCKDK or BT2 on expression of P21 in NSCLCcells
3 讨论
肿瘤细胞具有无限分裂、增殖的能力,在这一过程中该类细胞需依赖肿瘤微环境中的必需营养物质维持其生物合成和生存发展[11]。作为必需氨基酸之一,BCAA可参与蛋白质的合成和机体能量代谢。近年来,多项研究表明BCAA及其分解代谢过程在结直肠癌[12]、胰腺导管癌[8]、肝癌[13]、神经胶质瘤[14]、慢性髓样白血病[15]和乳腺癌[16]等的发生与发展中扮演着重要的角色。
为探究BCAA的分解代谢在肺癌细胞中的功能,本研究在H1299、A549、HCC827共3种NSCLC细胞中,分析siBCKDK和BT2抑制BCKDK对BCKDH活性的影响以及对细胞增殖活力的影响,并在H1299、A549肺癌细胞中进行siBCKDK和BT2对肺癌细胞增殖影响的机制探索。结果表明,siBCKDK和BT2均能显著下调BCKDE1α磷酸化水平,达到促进BCAA分解代谢的目的;抑制BCKDK不会影响肺癌细胞的活率,但会抑制细胞的增殖;抑制BCKDK可上调细胞周期负调控因子P21的表达,导致细胞周期阻滞。上述结果与在肝癌细胞中BCAA分解代谢受到抑制会促进肿瘤进展的情况相一致[9]。
目前,有关肺癌和BCAA分解代谢的研究相对较少。Mayers等[8]发现BCAA在肺癌小鼠血浆中的水平低于正常小鼠;随后,在肺癌或胰腺癌动物中用同位素追踪BCAA发现,NSCLC组织比正常肺组织吸收了更多的游离BCAA,且NSCLC组织将这些氨基酸结合到蛋白质中,用其来源的氮合成非必需氨基酸和核苷酸。本研究发现促进BCAA分解代谢可以导致肺癌细胞分裂周期阻滞,进而抑制增殖,但BCAA分解代谢的变化如何影响细胞分裂尚需进行更深入的研究。上述研究提示,BCAA的分解代谢对肺癌的发生、发展或可起到重要作用。
大部分研究[17-19]表明,诱导P21的表达能够抑制肿瘤细胞增殖,而抑制其表达可促进肿瘤的发生与发展。本研究显示,在促进BCAA分解代谢后,细胞周期阻滞、P21表达增加。Liu等[20]发现,抑制BCAA分解代谢可下调P21的表达。该结果与本研究获得的结果相一致,即促进BCAA分解代谢可上调P21的表达。
综上所述,本研究发现促进肺癌细胞内BCAA的分解代谢可明显抑制肺癌细胞的增殖,使细胞周期发生阻滞,上调P21的表达。这些结果为BCAA在肺癌发生、发展过程中的功能研究提供了新思路,同时也提示在BCAA的分解代谢通路中BCKDK可能成为一个潜在的治疗靶点,即通过抑制BCKDK来促进BCAA的分解代谢,从而干预肺癌的发生与发展。
参·考·文·献
[1] World Health Organization.Cancer today[DB/OL].[2020-11-23].https://gco.iarc.fr/today.
[2] Osmani L,Askin F,Gabrielson E,et al.Current WHO guidelines and the critical roleof immunohistochemical markers in the subclassification of nonsmall cell lung carcinoma(NSCLC):moving from targeted therapy to immunotherapy[J].Semin Cancer Biol,2018,52(Pt 1):103-109.
[3] Tso SC,Gui WJ,Wu CY,et al.Benzothiophene carboxylate derivatives as novel allosteric inhibitors of branched-chainα-ketoacid dehydrogenase kinase[J].JBiol Chem,2014,289(30):20583-20593.
[4] Sun H,Olson KC,Gao C,et al.Catabolic defect of branched-chain amino acidspromotesheart failure[J].Circulation,2016,133(21):2038-2049.
[5] Zhou M,Shao J,Wu CY,et al.Targeting BCAA catabolism to treat obesityassociated insulin resistance[J].Diabetes,2019,68(9):1730-1746.
[6] Fu T,Liang AL,Liu YJ.Role of P21 in resistance of lung cancer[J].Chin J Lung Cancer,2020,23(7):597-602.
[7]Al-Sharaky DR,Kandil MAE,Aiad HAS,et al.ROC-1,P21 and CAIX as markers of tumor aggressiveness in bladder carcinomain Egyptian patients[J].Diagn Pathol,2020,15(1):33.
[8] Mayers JR,Wu C,Clish CB,et al.Elevation of circulating branched-chain amino acids is an early event in human pancreatic adenocarcinoma development[J].Nat Med,2014,20(10):1193-1198.
[9] Ericksen RE,Lim SL,McDonnell E,et al.Loss of BCAA catabolism during carcinogenesis enhances mTORC1 activity and promotes tumor development and progression[J].Cell Metab,2019,29(5):1151-1165.e6.
[10] Li JT,Yin M,Wang D,et al.BCAT2-mediated BCAA catabolism is critical for development of pancreatic ductal adenocarcinoma[J].Nat Cell Biol,2020,22(2):167-174.
[11] Reina-Campos M,Moscat J,Diaz-Meco M.Metabolism shapes the tumor microenvironment[J].Curr Opin Cell Biol,2017,48:47-53.
[12] Budhathoki S,Iwasaki M,Yamaji T,et al.Association of plasma concentrations of branched-chain amino acids with risk of colorectal adenoma in a large Japanesepopulation[J].Ann Oncol,2017,28(4):818-823.
[13] Nezami Ranjbar MR,Luo Y,di Poto C,et al.GC-MS based plasma metabolomics for identification of candidate biomarkers for hepatocellular carcinomain Egyptian cohort[J].PLoSOne,2015,10(6):e0127299.
[14] Tönjes M,Barbus S,Park YJ,et al.BCAT1 promotes cell proliferation through amino acid catabolism in gliomas carrying wild-type IDH1[J].Nat Med,2013,19(7):901-908.
[15] Hattori A,Tsunoda M,Konuma T,et al. Cancer progression by reprogrammed BCAA metabolism in myeloid leukaemia[J].Nature,2017,545(7655):500-504.
[16] Zhang L,Han JQ.Branched-chain amino acid transaminase 1(BCAT1)promotes the growth of breast cancer cells through improving mTORmediated mitochondrial biogenesis and function[J].Biochem Biophys Res Commun,2017,486(2):224-231.
[17] Chen M,Zhang H,Zhang G,et al.Targeting TPX2 suppresses proliferation and promotes apoptosisviarepression of the PI3k/AKT/P21 signaling pathway and activation of p53 pathway in breast cancer[J].Biochem Biophys Res Commun,2018,507(1/2/3/4):74-82.
[18] Zhou L,Sheng WW,Jia C,et al.Musashi2 promotes the progression of pancreatic cancer through a novel ISYNA1-p21/ZEB-1 pathway[J].J Cell Mol Med,2020,24(18):10560-10572.
[19] Zhou XY,Liu H,Ding ZB,et al.lncRNA SNHG16 exerts oncogenic functions in promoting proliferation of glioma through suppressing p21[J].Pathol Oncol Res,2020,26(2):1021-1028.
[20] Liu X,Zhang F,Zhang Y,et al.PPM1K regulates hematopoiesis and leukemogenesis through CDC20-mediated ubiquitination of MEIS1 and p21[J].Cell Rep,2018,23(5):1461-1475.

