抗肿瘤药物依托泊苷促进间充质干细胞成骨分化的研究
陆艳青,周 兴,李 姣,彭建平,王传东#,张晓玲#
1.广西医科大学,广西生物医药协同创新中心,广西再生医学重点实验室,南宁 530021;2.上海交通大学医学院附属新华医院骨科,上海200092
原发性骨肿瘤包括良性肿瘤和恶性肿瘤。良性肿瘤常见骨瘤、骨性骨瘤等,而恶性肿瘤中骨肉瘤尤为常见,多发生于青少年[1]。临床上对于恶性骨肿瘤及巨大良性肿瘤的治疗方法主要是外科手术联合新辅助化疗[2]。而骨肿瘤外科手术通常力求彻底,以免复发或引起恶变。对于术后巨大骨缺损,临床工作中虽然可以应用不同的技术来进行骨重建,但常常会导致骨折不连、感染等诸多问题[3-5]。术后造成较大的骨缺损或骨重建不良仍然是目前骨科临床面临的一大挑战[6-7]。寻找能够抑制肿瘤细胞并促进干细胞向成骨分化的药物是解决这一难题的有效策略。
依托泊苷(etoposide,VP-16)是植物成分鬼臼脂素的半合成衍生物,由于其具有广谱抗癌活性和相当高的治疗指数而应用于抗肿瘤治疗,于1983年由美国食品药品监督管理局批准上市[4-5]。已有研究[8-10]表明骨肿瘤对依托泊苷高度敏感,临床上主要通过与大剂量甲氨蝶呤、阿霉素、顺铂和异环磷酰胺的组合来治疗骨肉瘤。
本研究主要探究依托泊苷对间充质干细胞(mesenchymal stem cell,MSC)和成骨性骨肉瘤细胞UMR-106成骨分化的影响,并进一步通过RNA测序技术进行转录组测序和生物信息学分析,筛选出依托泊苷对UMR-106细胞向成骨转分化的作用靶点。本研究旨在为骨肿瘤切除术后骨缺损或骨重建不良提供可行的新策略及理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物及细胞 SPF级雌性C57BL/6J小鼠,6~8周龄,购自上海吉辉实验动物饲养有限公司,实验动物生产许可证号为SCXK(沪)2013-0018;小鼠饲养于上海交通大学医学院附属新华医院动物房,实验动物使用许可证号为SYXK(沪)2013-0062。大鼠成骨性骨肉瘤细胞UMR-106购自中国科学院上海细胞库。
1.1.2 主要试剂及仪器 α-MEM培养基、低糖DMEM培养基、高糖DMEM培养基(Hyclone,美国),胎牛血清、青霉素-链霉素(双抗)溶液(Gibco,美国),CCK-8试剂盒(同仁化学,日本),凋亡检测试剂盒(Invitrogen,美国),BCIP/NBT碱性磷酸酶(alkaline phosphatase,ALP)显色试剂盒(碧云天,中国),茜素红染色试剂、抗坏血酸、地塞米松及β-磷酸甘油(Sigma Aldrich,美国),实时荧光定量PCR相关试剂(TaKaRa,日本),抗甘油醛-3-磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)抗体(货号sc-166574)、鼠抗兔二抗抗体(货号sc-2357)(Santa Cruz,美国),抗矮小相关转录因子2(runt-related transcription factor 2,RUNX2)抗体(货号ab76956)、抗成骨特异性转录因子(osterix,OSX)抗体(货号ab209484)、抗DNA结合抑制因子1(inhibitor of DNA binding 1,ID1)抗体(货号ab134163)、山羊抗鼠二抗抗体(货号ab6788)(Abcam,美国)。
实时荧光定量PCR仪(LightCycler®480II,Roche,美国),正置荧光显微镜(Zeiss,德国),流式细胞仪(Guava®easyCyteTM,Luminex,美国)。
1.2 实验方法
1.2.1 细胞的分离和培养
(1)小鼠MSC的分离和培养 本研究动物实验操作经过上海交通大学医学院附属新华医院伦理委员会同意且符合相关动物实验伦理要求。将6~8周龄的小鼠颈椎脱臼处死,75%乙醇消毒10 min后,取股骨和胫骨骨髓,冲洗出骨髓腔中细胞,并经70μm滤网过滤后置于50 mL离心管,1 000×g离心5 min。取沉淀,加入α-MEM完全培养基(含10%胎牛血清、1%双抗)重悬,接种于10 cm培养皿中,置于37℃、5%CO2培养箱。3 d后首次换液,此后每2 d换液一次,约10 d后细胞铺满培养皿;细胞传至第5代开始用于后续实验。
(2)人MSC的分离和培养 人的骨髓液标本收集经上海交通大学医学院附属新华医院伦理委员会同意并征得患者的知情同意。采集新华医院骨科手术室股骨颈骨折术后患者的骨髓液,1 000×g离心5 min后,取沉淀,加入低糖DMEM完全培养基(含10%胎牛血清、1%双抗)重悬,接种至10 cm培养皿中,置于37℃、5%CO2培养箱。3 d后首次换液,此后每2 d换液一次,约10 d后细胞铺满培养皿;细胞传至第2代开始用于后续实验。
(3)UMR-106细胞的培养 UMR-106细胞使用高糖DMEM完全培养基(含10%胎牛血清、1%双抗)培养,按照1∶5传代。
1.2.2 MSC体外成骨诱导 将小鼠MSC或人MSC接种至6孔板,待细胞融合至40%后加入成骨诱导液(50μmol/L抗坏血酸、10 mmol/Lβ-磷酸甘油、100 nmol/L地塞米松),此后每3 d更换一次诱导液。
1.2.3 细胞增殖实验 小鼠MSC接种于96孔板,待细胞贴壁后更换含不同浓度的依托泊苷培养液(采用等倍稀释法),在37℃、5%CO2条件下孵育12、24、36、48和60 h后吸除培养基,按照CCK-8试剂盒说明书操作,并测量450 nm处的吸光度值[D(450 nm)]。
1.2.4 细胞凋亡检测 收集不同浓度依托泊苷处理后的UMR-106细胞,用预冷的PBS洗涤后按照凋亡检测试剂盒说明书进行操作。取5×106/L细胞100μL,加入5μL FITC-Annexin V和1μL 100μg/mL碘化丙啶共孵育15 min后通过流式细胞仪检测细胞凋亡率。
1.2.5 细胞ALP活性实验 将小鼠MSC、人MSC或UMR-106细胞接种于6孔板中,待细胞融合至40%~50%后更换成骨诱导培养基或普通培养基,按药物浓度的不同分为0、0.001、0.01、0.1、1μmol/L组,每组设3个复孔。在37℃、5%CO2培养箱中培养7 d后,按照ALP显色试剂盒说明书进行染色。
1.2.6 细胞基质矿化测定 将小鼠MSC、人MSC进行成骨诱导及加药处理14 d后,去除培养基,PBS清洗3遍,加5%多聚甲醛固定15 min后,PBS清洗3遍,向每孔细胞加入1 mL茜素红染色液进行染色。
1.2.7 实时定量PCR检测 小鼠MSC进行成骨诱导及加药处理5 d后收集细胞总RNA,按反转录试剂盒说明书的方法进行操作,得到的cDNA经稀释后加入相关引物和酶进行qPCR检测。以Gapdh作为内参,用2-ΔΔCT计算分析mRNA相对表达量。Gapdh上、下游引物分别为5′-TGACCTCAACTACATGGTCTACA-3′和5′-CTTCCCATTCTCGGCCTTG-3′,Alp上、下游引物分别为5′-TAACACCAACGCTCAGGTCC-3′和5′-TGGATGTGACCTCATTGCCC-3′,骨钙素(osteocalcin,Ocn)上、下游引物 分 别 为5′-AAGCAGGAGGGCAATAAGGT-3′和5′-TTTGTAGGCGGTCTTCAAGC-3′,Ⅰ型 胶 原α1链(collagen typeⅠα1 chain,Col1a1)上、下游引物分别为5′-ACGCCATCAAGGTCTACTGC-3′和5′-TACTCGAACGGGAATCCATC-3′,结缔组织生长因子(connective tissue growth factor,Ctgf)上、下游引物分别为5′-GCGCCTGTTCTAAGACCTGT-3′和5′-TGGCTTGGCAATTTTAGGCGT-3′。
1.2.8 Western blotting分析 小鼠MSC进行成骨诱导及加药处理7 d后收集细胞蛋白。将各组等量蛋白上样至SDS-PAGE凝胶,进行电泳分离,再将凝胶中蛋白电转移至NC膜。将膜置于封闭液中在摇床上孵育1 h后,分别与RUNX2抗体、OSX抗体及ID1抗体在4℃摇床孵育过夜。次日加入二抗,室温孵育1 h,将配置好的显影液滴加到膜表面,放入显影仪器中显影拍照。
1.2.9 RNA测序 依托泊苷处理UMR-106细胞3 d后,收集总RNA,之后由生工生物工程(上海)有限公司的Illumina Xten平台测序,使用Trimmomatic对测序得到的原始数据进行处理,得到清理过的数据,随机从这些数据中抽取10 000条序列与NCBINT数据库进行BLASTN比对,取e value≤1×10-10并且相似度>90%、coverage>80%的比对结果,计算其物种分布,进行污染检测。之后将对照组的基因组作为参考序列,使用HISAT2将质控后的测序序列与参考基因组进行比对,并通过RSeQC统计比对结果。在RNA测序分析中,使用StringTie软件,通过定位到基因组区域或基因外显子区的测序序列的计数(read)估计基因的表达水平。
1.3 统计学分析
采用SPSS 22.0软件进行统计学分析,所有数据以x±s表示,各组样本间的均数比较使用One-way ANOVA法,事后多重检验采用Bonferroni法进行两两比较。P<0.05认为差异具有统计学意义。
2 结果
2.1依托泊苷对小鼠MSC增殖及UMR-106细胞凋亡的影响
将浓度为0~12.50μmol/L的依托泊苷作用于小鼠MSC 12~60 h后,检测MSC的增殖能力。结果显示:依托泊苷对MSC增殖的影响呈现一定的浓度依赖性;当浓度≥0.20μmol/L时,依托泊苷开始抑制MSC的增殖(图1A)。作用48 h后其半数抑制浓度(half-maximal inhibitory concentration,IC50)为2.192μmol/L;60 h后,IC50为1.399μmol/L。选择浓度为0.001~1μmol/L的依托泊苷对UMR-106细胞进行凋亡检测(图1B),发现各组细胞凋亡率(16.137%~28.300%)随药物浓度升高逐渐上升,均显著高于对照组(均P<0.05)。
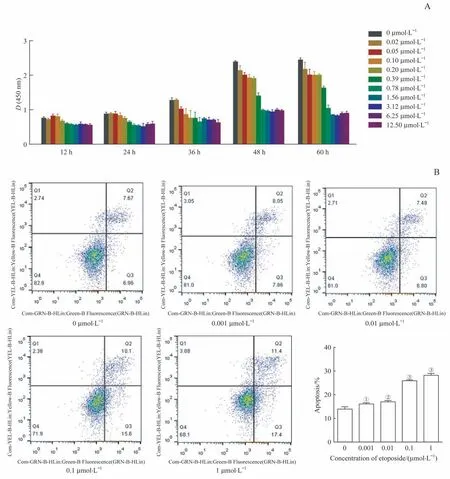
图1 依托泊苷对MSC增殖和UMR-106凋亡的影响Fig 1 Effects of etoposide on MSC proliferation and UMR-106 apoptosis
2.2 依托泊苷作用于MSC和UMR-106细胞后的ALP活性检测
根据依托泊苷对MSC增殖活力的影响,选取0.001、0.01、0.1、1μmol/L 4个浓度,对人MSC、小鼠MSC进行处理并诱导成骨7 d,检测ALP活性(图2A、B)。UMR-106细胞中也分别加入0.001、0.01、0.1、1μmol/L的依托泊苷处理,3 d后检测ALP活性(图2C)。结果显示,在人MSC中,0.01、0.1μmol/L依托泊苷组的ALP染色较未加药组显著加深;在小鼠MSC中,0.001、0.01、0.1μmol/L依托泊苷组的ALP染色较未加药组显著加深。UMR-106细胞依托泊苷组ALP染色均显著深于未加药组,说明依托泊苷能促进人MSC、小鼠MSC、成骨性骨肉瘤细胞系UMR-106的成骨分化。
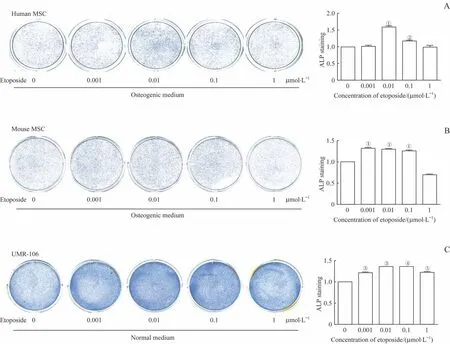
图2 ALP染色检测依托泊苷对细胞ALP活性的影响Fig 2 Effect of etoposideon the ALPactivity of thecells detected by ALPstaining
2.3 依托泊苷作用于MSC后的钙结节染色
对人MSC、小鼠MSC进行依托泊苷(0.001、0.01、0.1、1μmol/L)处理并诱导成骨14 d后,利用茜素红染色检测钙结节(图3)。结果显示与未加药组相比,在人和小鼠MSC中0.001、0.01、0.1μmol/L依托泊苷组钙结节染色显著加深,而1μmol/L依托泊苷组染色呈阴性,可能和依托泊苷导致的细胞凋亡有关。
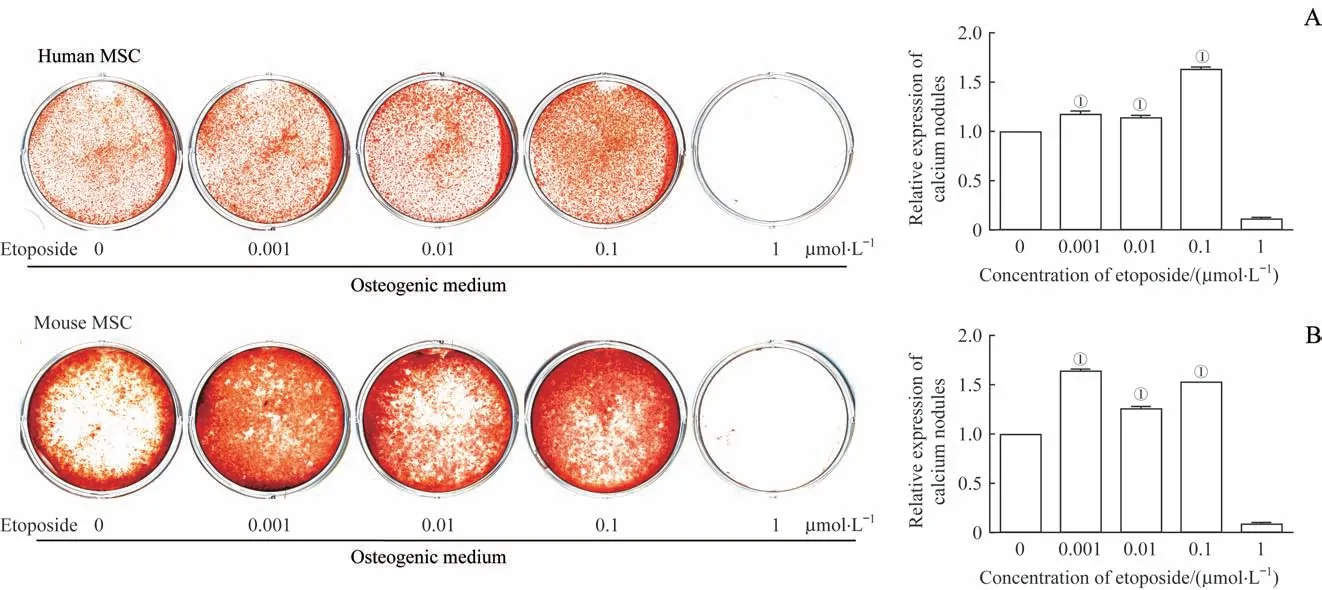
图3 茜素红染色检测依托泊苷对MSC钙结节含量的影响Fig 3 Effect of etoposideon thecontent of calcium nodules in MSCdetected by alizarin red staining
2.4 依托泊苷作用于小鼠MSC后Alp、Ocn、Col1a1的mRNA表达变化
对小鼠MSC进行依托泊苷(0.001、0.01、0.1、1μmol/L)处理并诱导成骨5 d后,与未加药诱导组相比,0.01、0.1、1μmol/L依托泊苷组成骨相关标志物Alp表达显著升高,0.001、0.01、0.1μmol/L依托泊苷组Ocn表达显著升高,4个浓度的依托泊苷组Col1a1mRNA表达均显著升高(均P<0.05,图4)。
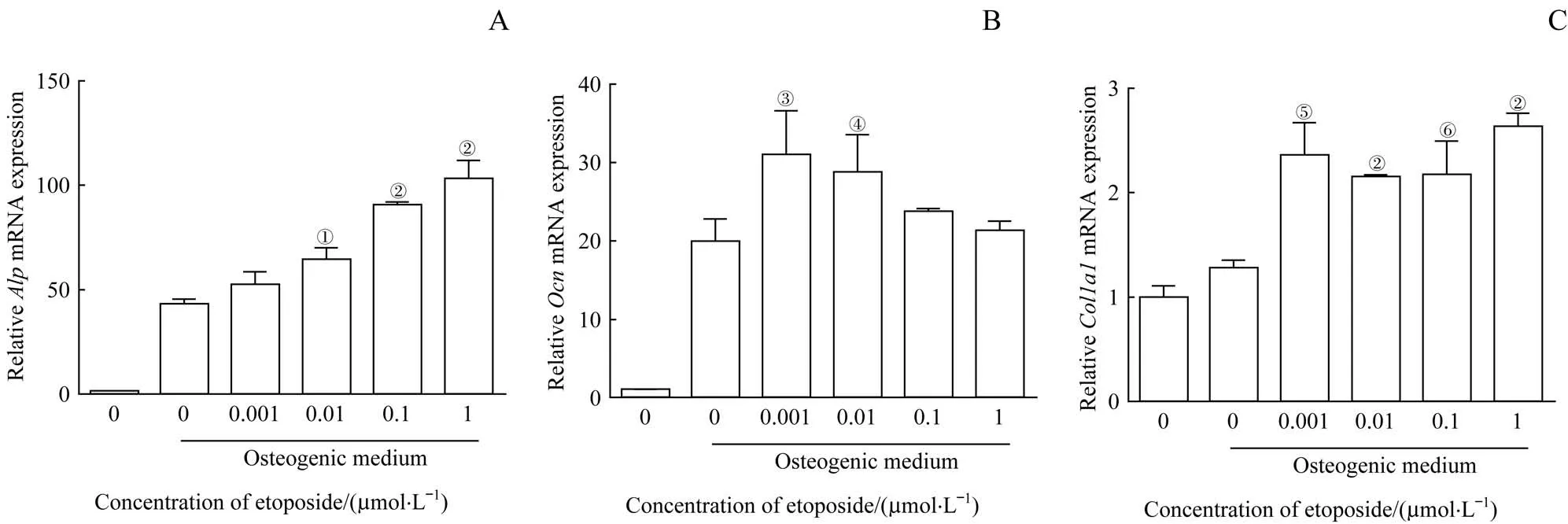
图4 实时荧光定量PCR检测依托泊苷对小鼠MSC成骨相关基因表达的影响Fig 4 Effect of etoposideon the expression of osteogenic-related genes in mouse MSCby real-timeqPCR
2.5 依托泊苷作用于UMR-106细胞后RNA测序分析
选择浓度0.001μmol/L的依托泊苷和UMR-106细胞孵育3 d后进行mRNA测序检测基因的表达变化。韦恩图结果显示与对照组相比,依托泊苷可以促进965个基因表达,同时抑制1 215个基因表达(图5A)。将表达变化大于2倍并且P值小于0.05的基因筛选出来并利用散点图和热图展示,结果显示,依托泊苷组有31个基因表达上调,49个基因表达下调(图5B、C)。表1罗列出了依托泊苷组表达上调倍数最高的前13个基因名称、上调倍数和P值。其中Ctgf因对成骨调控基因Id1具有调节功能而对其进行了验证,证实依托泊苷可促进Ctgf表达(图5D)。
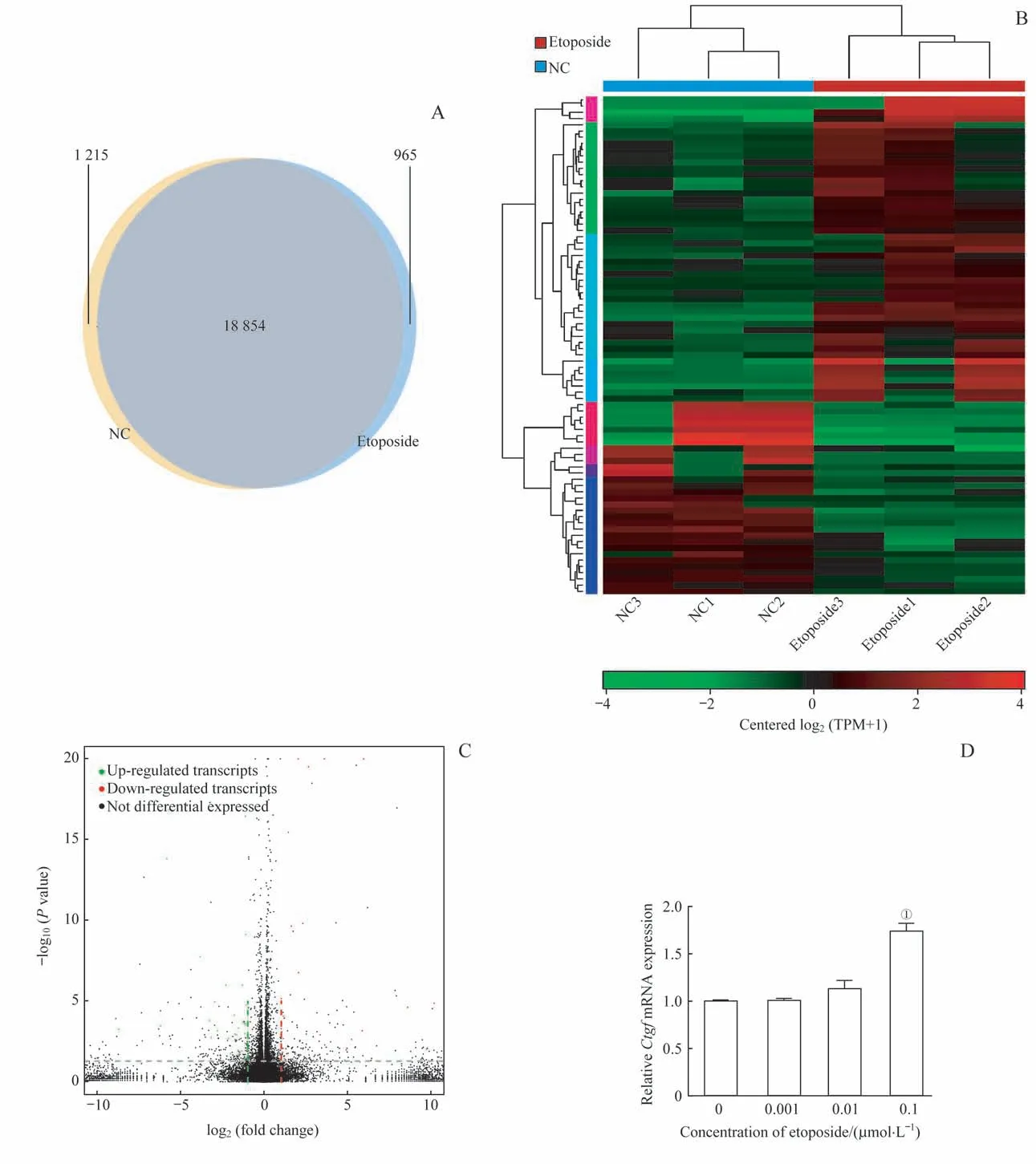
图5 RNA测序和PCR检测依托泊苷对UMR-106细胞mRNA表达的影响Fig 5 Effect of etoposideon theexpression of mRNAs in the UMR-106 cells by RNA sequencing and PCR
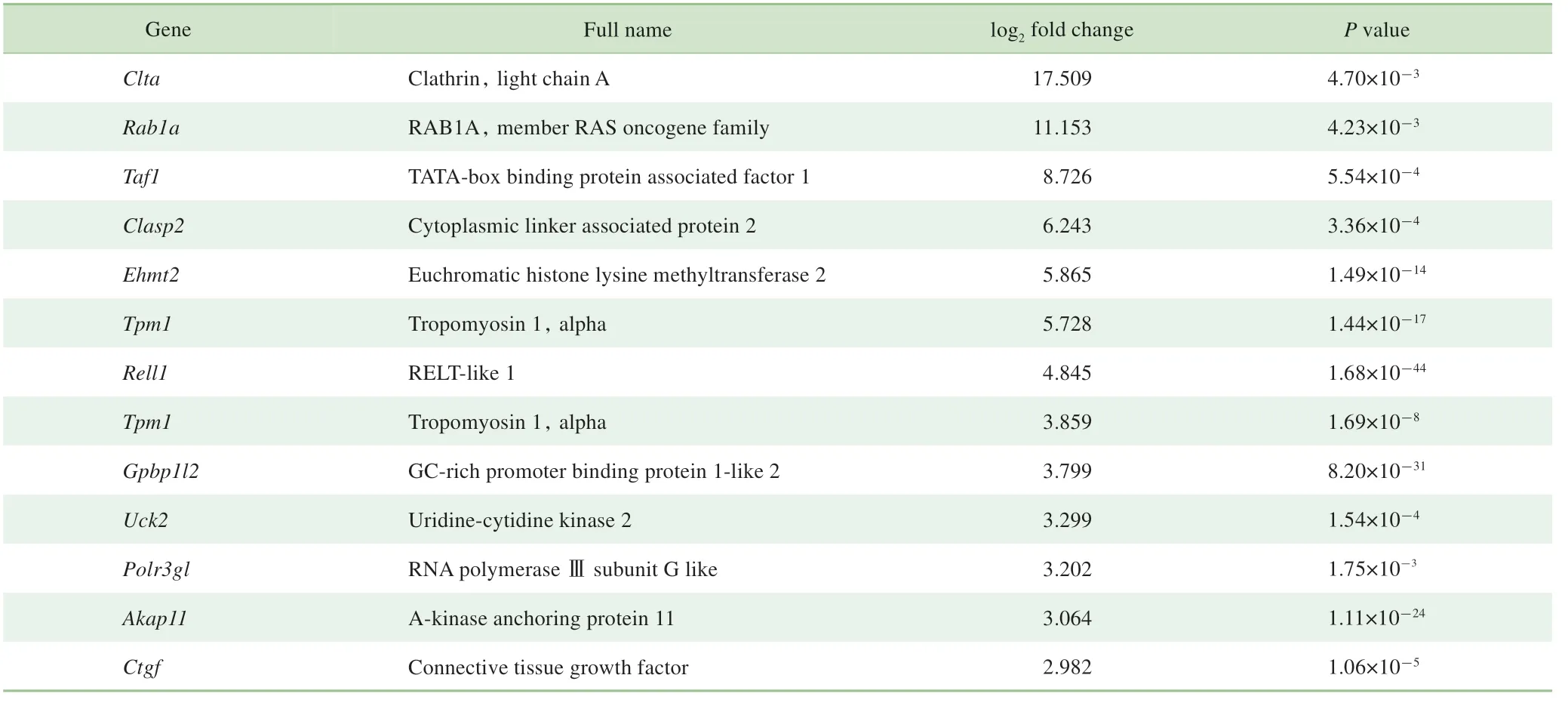
表1 依托泊苷促进UMR-106细胞表达上调倍数最高的前13个基因Tab 1 Top up-regulated 13 genespromoted by etoposide in the UMR-106 cellsdetected by RNA sequencing
2.6 依托泊苷作用于小鼠MSC后RUNX2、OSX、ID1的蛋白表达变化
Western blotting结果显示,与未加药诱导组相比,0.001、0.01μmol/L依托泊苷组小鼠MSC成骨相关蛋白RUNX2、OSX及ID1表达水平均显著增高(均P<0.05,图6)。
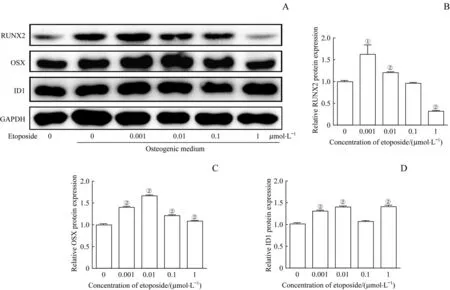
图6 Western blotting检测依托泊苷对小鼠MSC成骨相关蛋白表达的影响Fig 6 Effect of etoposideon the expression of osteogenic related proteins in mouse MSCby Western blotting
3 讨论
骨肿瘤术后造成的骨缺损或骨重建不良是目前骨科临床面临的一大挑战。干细胞由于其优越的再生潜能成为器官和组织再生领域的研究热点[11-14]。有别于一般骨缺损的骨再生,骨肿瘤术后骨再生的理想状态为在抑制肿瘤细胞的同时促进干细胞骨修复。本研究在目前临床抗肿瘤药物中筛选到了具有此双重作用的依托泊苷,发现依托泊苷具有促进干细胞向成骨细胞分化的功能。ALP是干细胞向成骨细胞分化的早期标志性酶,成骨细胞形成的钙结节是干细胞晚期成骨分化的标志物。本研究中,MSC经不同浓度的依托泊苷处理后发现,其早期及晚期的成骨分化标志物均显著增加,同时又在mRNA和蛋白质水平进一步证明依托泊苷能促进MSC成骨分化相关标志物的表达。
转录组测序可在RNA水平研究基因表达差异[15],目前已应用于多种疾病诊疗的分子机制研究。为研究依托泊苷促进干细胞成骨分化的机制,本研究利用Illumina Xten高通量RNA测序技术对依托泊苷处理后的成骨性骨肉瘤细胞UMR-106样品进行转录组测序,发现依托泊苷可显著上调Ctgf的表达。CTGF属于基质细胞蛋白(CYR61-CTGF-NOV,CCN)家族,已被证明可调节多种细胞功能,并参与更复杂的生物学过程,如软骨生成和成骨[16-17]。研究[18]还表明,在骨骼组织的修复或再生过程中,CTGF的表达显著增加,而重组形式的CTGF处理可以刺激成骨细胞或细胞系的增殖和分化。
已有研究[19]表明ID1是CTGF的下游信号通路分子,且沉默ID1的表达能下调成骨标志物骨桥蛋白(osteopontin,OPN)的表达。ID1在机体生命过程中发挥重要作用,包括细胞发育、衰老、分化、血管生成和迁移[20-21]。有研究[22-23]表明,ID1是成骨信号的重要激活分子,也是骨形态发生蛋白(bone morphogenetic protein,BMP)信号通路信号的靶基因。
为了进一步验证转录组测序结果,我们在蛋白质水平检测了依托泊苷作用下MSC成骨分化过程中ID1及其下游成骨关键转录因子RUNX2和OSX的表达,发现依托泊苷能够显著增加MSC成骨分化过程中ID1、RUNX2和OSX的表达,从而促进干细胞成骨分化。
依托泊苷在抗肿瘤方面也起着重要的作用。研究[24]表明,依托泊苷对骨肉瘤细胞有杀伤作用,与其促细胞凋亡有关。我们的数据显示依托泊苷在促进成骨的有效浓度范围内能促进骨肉瘤细胞凋亡。近年来的观点认为骨肉瘤可能是一种分化缺陷疾病,骨肉瘤细胞成骨分化被认为是治疗骨肉瘤的一种全新方法[25]。本研究发现依托泊苷的另一个重要功能,即促进成骨性骨肉瘤细胞UMR-106向成骨分化;其机制可能是依托泊苷通过促进Ctgf基因的表达激活其靶基因Id1,进而激活其下游成骨关键转录因子RUNX2和OSX。我们的研究对未来研究依托泊苷的药物靶点及功能等提供了新的思路,为临床骨肿瘤切除术后的骨缺损、保肢重建治疗的临床难题提供了新的策略及理论依据。
参·考·文·献
[1] Gianferante DM,Mirabello L,Savage SA.Germline and somatic genetics of osteosarcoma-connecting aetiology,biology and therapy[J].Nat Rev Endocrinol,2017,13(8):480-491.
[2] Reed DR,Hayashi M,Wagner L,et al.Treatment pathway of bone sarcoma in children,adolescents,and young adults[J].Cancer,2017,123(12):2206-2218.
[3] Sarkar N,Bose S.Controlled delivery of curcumin and vitamin K2 from hydroxyapatite-coated titanium implant for enhancedinvitrochemoprevention,osteogenesis,andin vivoosseointegration[J].ACSAppl Mater Interfaces,2020,12(12):13644-13656.
[4] Pan SS,Yin JH,Yu LD,et al.2D MXene-integrated 3D-printing scaffolds for augmented osteosarcoma phototherapy and accelerated tissue reconstruction[J].Adv Sci(Weinh),2020,7(2):1901511.
[5] Takeuchi A,Yamamoto N,Hayashi K,et al.Joint-preservation surgery for pediatric osteosarcoma of the knee joint[J].Cancer Metastasis Rev,2019,38(4):709-722.
[6] Whelan JS,Davis LE.Osteosarcoma,chondrosarcoma,and chordoma[J].JClin Oncol,2018,36(2):188-193.
[7] Dang WT,Li T,Li B,et al.A bifunctional scaffold with CuFeSe2nanocrystals for tumor therapy and bone reconstruction[J].Biomaterials,2018,160:92-106.
[8] Marina NM,Smeland S,Bielack SS,et al.Comparison of MAPIEversusMAP in patients with a poor response to preoperative chemotherapy for newly diagnosed high-grade osteosarcoma(EURAMOS-1):an open-label,international,randomised controlled trial[J].Lancet Oncol,2016,17(10):1396-1408.
[9] Goorin AM,Schwartzentruber DJ,Devidas M,et al. Presurgical chemotherapy compared with immediate surgery and adjuvant chemotherapy for nonmetastatic osteosarcoma:Pediatric Oncology Group Study POG-8651[J].JClin Oncol,2003,21(8):1574-1580.
[10] Gorthi A,Romero JC,Loranc E,et al.EWS-FLI1 increases transcription to cause R-loops and block BRCA1 repair in Ewing sarcoma[J].Nature,2018,555(7696):387-391.
[11] Xu R,Yallowitz A,Qin A,et al.Targeting skeletal endothelium to ameliorateboneloss[J].Nat Med,2018,24(6):823-833.
[12] Debnath S,Yallowitz AR,McCormick J,et al.Discovery of a periosteal stem cell mediating intramembranous bone formation[J].Nature,2018,562(7725):133-139.
[13] Liu Q,Yu YX,Reisdorf RL,et al.Engineered tendon-fibrocartilage-bone composite and bone marrow-derived mesenchymal stem cell sheet augmentation promotes rotator cuff healing in a non-weight-bearing canine model[J].Biomaterials,2019,192:189-198.
[14] Sui BD,Hu CH,Liu AQ,et al.Stem cell-based bone regeneration in diseased microenvironments:challenges and solutions[J].Biomaterials,2019,196:18-30.
[15] Wang Z,Gerstein M,Snyder M.RNA-Seq:a revolutionary tool for transcriptomics[J].Nat Rev Genet,2009,10(1):57-63.
[16] Ivkovic S,Yoon BS,Popoff SN,et al.Connective tissue growth factor coordinates chondrogenesis and angiogenesis during skeletal development[J].Development,2003,130(12):2779-2791.
[17] Lambi AG,Pankratz TL,Mundy C,et al.The skeletal site-specific role of connective tissue growth factor in prenatal osteogenesis[J].Dev Dyn,2012,241(12):1944-1959.
[18] Arnott JA,Lambi AG,Mundy C,et al.The role of connective tissue growth factor(CTGF/CCN2)in skeletogenesis[J].Crit Rev Eukaryot Gene Expr,2011,21(1):43-69.
[19] Liao X,Bu Y,Jiang SS,et al. CCN2-MAPK-Id-1 loop feedback amplification is involved in maintaining stemness in oxaliplatin-resistant hepatocellular carcinoma[J].Hepatol Int,2019,13(4):440-453.
[20] Bhattacharya A,Baker NE.A network of broadly expressedHLHgenes regulates tissue-specific cell fates[J].Cell,2011,147(4):881-892.
[21] Anido J,Sáez-Borderías A,Gonzàlez-JuncàA,et al.TGF-βreceptor inhibitors target the CD44high/Id1highglioma-initiating cell population in human glioblastoma[J].Cancer Cell,2010,18(6):655-668.
[22] Jeong JW,Kim M,Lee J,et al.ID1-mediated BMP signaling pathway potentiates glucagon-like peptide-1 secretion in response to nutrient replenishment[J].Int JMol Sci,2020,21(11):E3824.
[23] Chen WC,Chung CH,Lu YC,et al.BMP-2 induces angiogenesis by provoking integrinα6 expression in human endothelial progenitor cells[J].Biochem Pharmacol,2018,150:256-266.
[24] 梁承伟,朱炯,沈海敏,等.依托泊苷诱导骨肉瘤细胞凋亡的实验研究[J].中国新药与临床杂志,2006,25(9):718-721.
[25] 熊齐胜,韩迎祥,汪学松,等.骨肉瘤的分化疗法与研究进展[J].中国现代医学杂志,2020,30(11):48-51.

