6-OHDA诱导的帕金森病小鼠表现出以p16Ink4a上调和星形胶质细胞衰老为特征的衰老表型
袁 笑,田野野,薛 峥
华中科技大学同济医学院附属同济医院神经内科,武汉 430030
帕金森病(Parkinson disease,PD)是一种神经退行性疾病,在人群中的发病率随着人口老龄化加剧而升高,是一种年龄相关性疾病,也是一种致残性疾病。当今可用的治疗方法不能显著改变疾病的进展,造成了很大的社会经济负担[1]。PD的临床症状主要包括以运动迟缓、肢体抖动、肌肉僵硬为主要表现的运动障碍,以及以睡眠-唤醒周期调节障碍、认知障碍、情绪和情感障碍、自主神经功能障碍和疼痛为主要表现的非运动障碍。这两方面都会随着疾病的发展而加重,严重影响患者的生活质量[2]。
衰老是癌症、糖尿病、动脉粥样硬化、骨质疏松、纤维化和神经退行性疾病的独立危险因素[3-4]。近年来,衰老与神经退行性疾病的关系越来越受到重视[3,5]。人们试图从靶向去除衰老细胞的角度寻找治疗神经退行性疾病的方法[6]。动物模型在认识PD的发病机制和寻找潜在治疗靶点的过程中发挥重要作用[7]。在小鼠纹状体内注射6-羟基多巴胺(6-hydroxydopamine,6-OHDA)可建立一种较为理想的PD模型,能很好地模拟多巴胺能神经元的进行性损伤,能够诱发PD中出现的主要行为缺陷和非运动症状[7-8],具有生产稳定、造模效果易于判断的特点,适用于多种神经保护策略的研究。然而,这种动物模型是否具有与PD患者类似的衰老表现,是否能用于PD与衰老方向的基础研究,尚未可知。本研究建立6-OHDA诱导的PD小鼠模型,探讨此模型的衰老表型及衰老的胶质细胞表现。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组 选取雄性C57BL/6J小鼠,9~10月龄,体质量28~35 g,由华中科技大学同济医学院附属同济医院实验动物中心提供,动物生产许可证号为SCXK(豫)2020-0005。动物饲养于该医院实验动物中心SPF级动物实验室,动物使用许可证号为SYXK(鄂)2019-0106。高压灭菌饮用水和饲料,动物自由摄取。所有动物实验均经华中科技大学同济医学院动物实验伦理委员会批准(审批号2020-S108)。将动物随机分为假手术组(Sham组)和6-OHDA组,每组15只小鼠。
1.1.2 药物与试剂 6-OHDA、阿扑吗啡、L-抗坏血酸(Sigma-Aldrich,美国),兔抗酪氨酸羟化酶(tyrosine hydroxylase,TH)抗 体(16825-1-AP,Proteintech,中国),兔抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(25859-1-AP,Proteintech,中国),兔抗离子钙接头蛋白分子1(ionized calcium bindingadaptor molecule-1,Iba-1)单克隆抗体(016-26721,Wako,日本),兔抗少突胶质细胞系转录因子2(oligodendrocyte transcription factor 2,Olig2)单 克 隆 抗 体(ab109186,Abcam,美国),小鼠抗p16抗体(sc-1661,Santa Cruz,美国),小鼠抗p21抗体(sc-6246,Santa Cruz,美国),488标记的驴抗兔IgG抗体(711-545-152,Jackson ImmunoResearch,美国),594标记的驴抗小鼠IgG抗体(715-585-150,Jackson ImmunoResearch,美国),DAPI(MBD0015,Sigma-Aldrich,美国)。
1.2 实验方法
1.2.1 6-OHDA纹状体立体定位注射建立PD模型 将小鼠置于吸入式麻醉诱导盒中,将异戊烷浓度升至2%行诱导麻醉。待小鼠充分麻醉后,将小鼠头部连接麻醉面罩,调整异戊烷浓度至1%维持麻醉。将动物固定在立体定位仪(RWD,中国)上,沿头部矢状线做1.3 cm长的切口,用3%H2O2消化颅骨表面的软组织,暴露前囟。以中线旁-2 mm、前囟前+0.5 mm为进针点,用颅骨钻(RWD,中国)在颅骨表面打直径约为1 mm的小孔。微量进样器(上海高鸽,10μL)缓慢下行,在颅骨下3.5 mm注入药物(6-OHDA组注入含有1%抗坏血酸的6-OHDA溶解液1.2μL,Sham组注入含有1%抗坏血酸的生理盐水),速度0.5μL/min,每次注射完成后需留针5 min。缓慢退出进样器,处理创面。
1.2.2 行为学实验
(1)阿扑吗啡诱导的旋转实验 在造模后第21日,腹腔注射0.125 g/L的阿扑吗啡(0.5μg/g)观察小鼠旋转情况。将小鼠放置在5 000 mL的烧杯里,杯底附新鲜干燥垫料,等待5 min后,连续计数10 min内小鼠向未造模侧的旋转圈数,每旋转360°记为1圈。
(2)转棒实验 注射6-OHDA前1周,将小鼠置于转棒仪上(IITC Life Science,美国)进行预训练,分别以恒速16 r/min进行练习,连续训练5 d,去除未达到均一水平的小鼠。在造模后的第21日,以16 r/min匀速进行实验,记录小鼠在转棒上停留的时间,取3次平均值,每次检测间隔2 h。
与陆上车用柴油排放相比,船舶和港作机械所用的燃料污染危害更大,船舶污染已成为继机动车尾气污染、工业企业排放之后第三大大气污染来源。多项研究表明,国际航运业70%的硫排放在距离海岸线400千米以内的主要贸易路线上,在海陆风的作用下,航运排放污染可以侵入内陆数百千米。
1.2.3 脑组织制备 末次行为学实验后,将小鼠用异氟醚麻醉,用PBS经心脏灌注处死小鼠。用于蛋白质印迹实验(Western blotting)和实时荧光定量PCR(RTqPCR)分析的脑组织,放入预冷的异戊烷中快速冷冻,储存在-80℃的冰箱中。用于免疫荧光染色的脑组织,在PBS灌流后使用4%多聚甲醛灌注,并在4%多聚甲醛中固定24 h,在30%蔗糖溶液脱水3 d。小鼠大脑的冠状切片厚20μm,贴在抗脱落的载玻片上,将载玻片储存在-80℃冰箱中,待后续染色。分别采集造模侧和健侧的纹状 体[caudate putamen(striatum),CPu]及 黑 质(substantia nigra,SN)区域的组织,用于Western blotting和RT-9PCR实验。在CPu和SN区域中分别收集60~70个切片,用于免疫荧光染色。
1.2.4 Western blotting检测脑组织中TH蛋白含量 将小鼠CPu、SN区域脑组织加入蛋白裂解液和研磨珠,在组织研磨仪(赛维尔生物,中国)中打碎,提取蛋白质。蛋白质与5×上样缓冲液混匀后进行SDS-PAGE电泳,常规转膜封闭后加入一抗TH(1∶2 000),同时以GAPDH为内参,4℃孵育过夜,TBST缓冲盐溶液洗涤。根据一抗种属加入相应二抗,室温孵育1 h,ECL显色。用Biorad曝光机拍照,使用ImageJ软件进行灰度分析。
1.2.5 免疫荧光染色观察细胞衰老 将脑组织切片经封闭和破膜后加入一抗,包括兔抗GFAP抗体(1∶200)、兔抗Iba-1单克隆抗体(1∶200)、兔抗Olig2单克隆抗体(1∶200)、小鼠抗p16抗体(1∶100)、小鼠抗p21(1∶100),置于湿盒中,4℃静置过夜。次日用0.01 mol/L PBS洗片3次,每次5 min;滴加对应二抗和DAPI,置于湿盒中,室温避光静置1 h;再用0.01 mol/L PBS洗片3次,每次5 min;擦干玻片,50%甘油封片。所有切片均在激光扫描共聚焦显微镜FV500(Olympus,日本)下盲法观察。每只小鼠取CPu和SN区各3个脑片,在40倍物镜视野下随机采集各脑片相应区域的照片5张,使用ImageJ软件的Cell Counter插件分别统计与p16、p21、p16+GFAP、p16+Iba-1、p16+Olig2染色阳性细胞数量,取15张照片的平均值以减少误差。统计数据来自每组5只小鼠。
1.2.6 RT-qPCR检测细胞周期蛋白依赖性激酶抑制剂(cyclin-dependent kinase inhibitor,CDKi)及衰老相关分泌 表 型 (senescence-associated secretory phenotype,SASP) 在造模后的第21日,在冰上收集小鼠造模侧及健侧CPu及SN区脑组织。用RNAiso PLUS(Takara,中国)提取总RNA,按照PrimeScriptRT试剂盒(Takara,中国)说明书,将RNA反转录成cDNA。使用荧光染料ChamQ Universal SYBR qPCR Master Mix(Vazyme,中国)在RT-qPCR仪(stepone PLUS,Thermofisher,美国)进行CDKi(p15Ink4b、p16Ink4a、p19Ink4d、p21和p27Kip1)和SASP[Cxcl10、Ccl2、肿瘤坏死因子α(tumor necrosis factor-α,Tnf-α)、白介素1α(interleukin-1α,Il-1α)、Il-1β、Il-6、基质金属蛋白酶3(matrix metalloproteinase 3,Mmp3)]的定量检测。CT值归一化为同一样本的β-肌动蛋白。引物序列见表1。
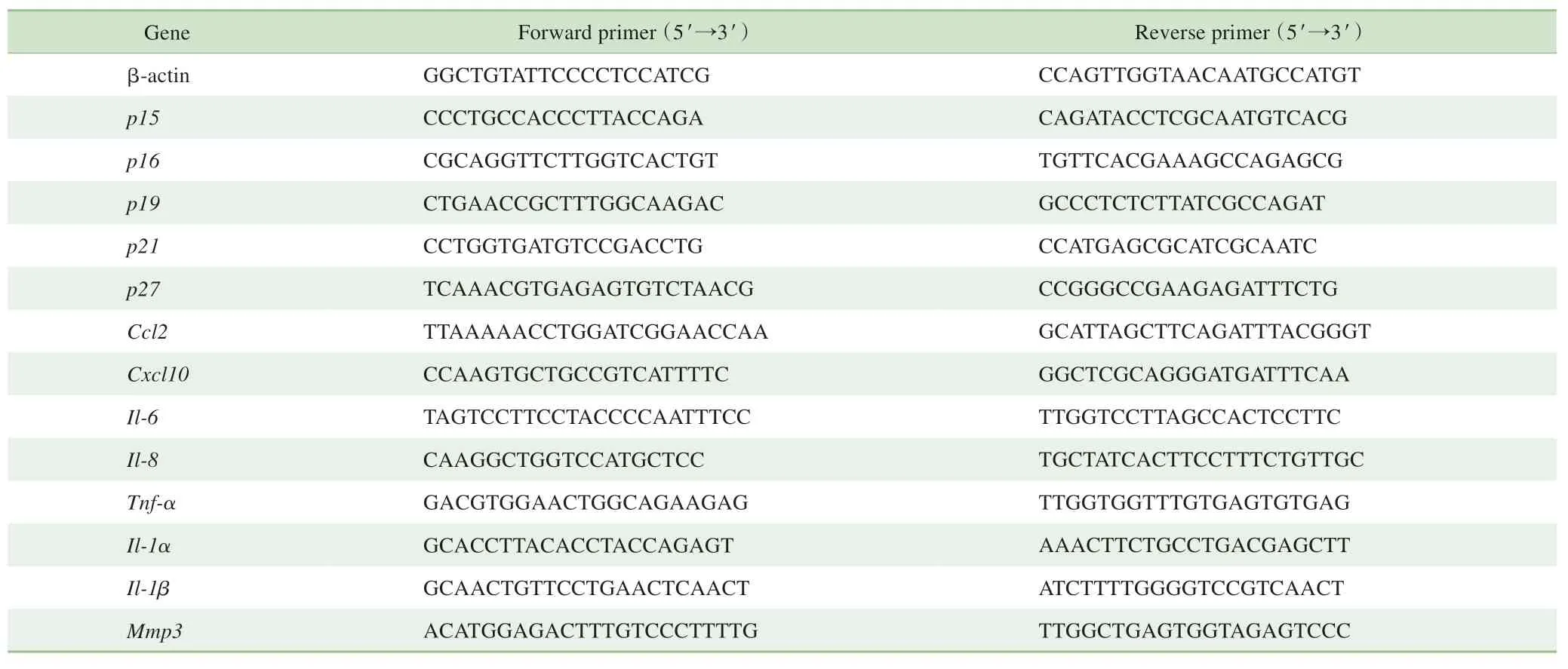
表1 RT-qPCR引物Tab 1 Primersfor RT-qPCR
1.3 统计学分析
使用GraphPad Prism 8软件进行统计学分析。数据以x±s形式表示。多组间比较采用单因素方差分析和Tukey事后检验;2组间差异采用独立样本均数t检验进行分析。P<0.05表示差异有统计学意义。
2 结果
2.1 PD模型构建
造模后,6-OHDA组小鼠的毛色变灰,持续到术后第21日;小鼠体质量逐渐下降,从第14日开始恢复。转棒实验结果显示:与Sham组相比,6-OHDA组小鼠在转棒上的停留时间较短(P=0.000)(图1A)。阿朴吗啡诱导的旋转实验结果显示:与Sham组相比,6-OHDA组小鼠总旋转次数较多(P=0.000)(图1B)。Western blotting结果显示:6-OHDA组的CPu和SN区域TH蛋白表达量均显著低于Sham组,差异均有统计学意义(均P=0.000)(图1C、D)。以上结果表明造模成功。
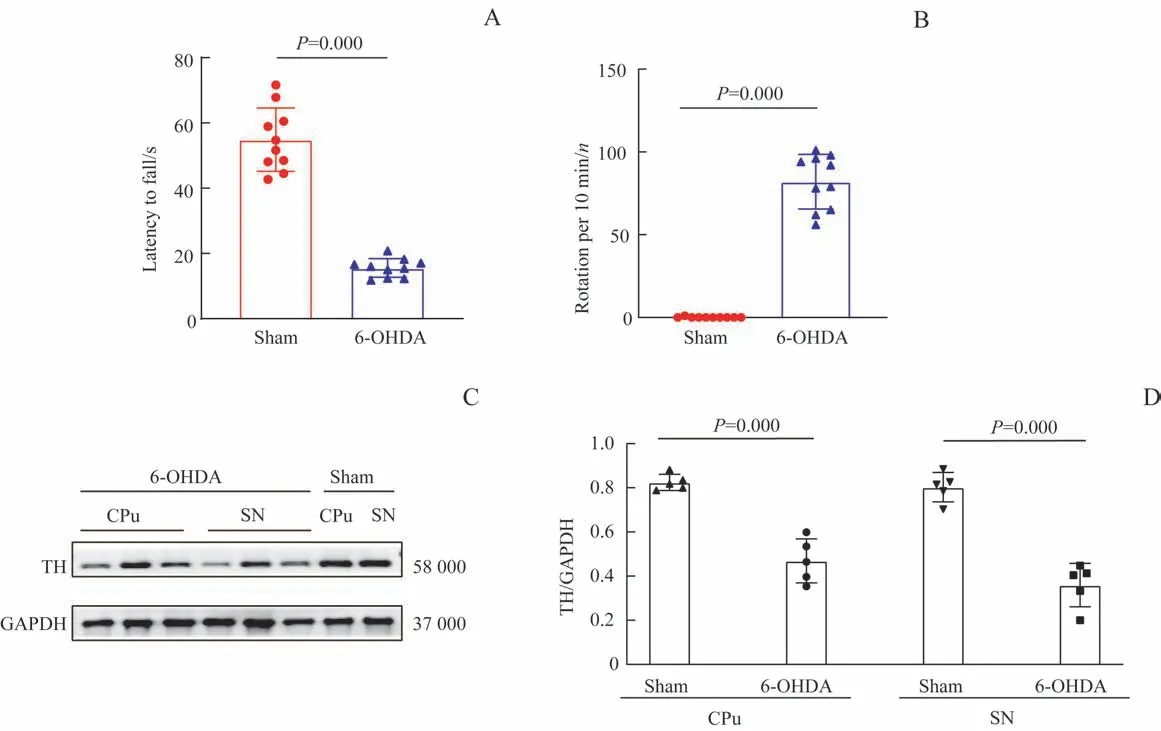
图1 6-OHDA诱导的小鼠PD模型评估Fig 1 Evaluation of 6-OHDA-induced PD model
2.2 细胞衰老的观察
2.2.1 以p16Ink4a上调为特征的细胞衰老 术后第21日,免疫荧光染色结果(图2)显示:与Sham组比较,6-OHDA组中CPu和SN区域p16Ink4a阳性细胞明显增多,Sham组无p16表达;2组CPu区和SN区均未发现明显的p21阳性细胞;CPu和SN区域p16Ink4a阳性细胞与p21阳性细胞数量比较,差异均有统计学意义(均P=0.000)。RT-qPCR检测Sham组和6-OHDA组造模侧CPu和SN区域CDKi,结果显示,与Sham组相比:6-OHDA组造模侧CPu和SN区域p16Ink4a、p15Ink4b和p19Ink4d的表达上调,差异均有统计学意义(均P<0.05);p21轻微上调,但差异无统计学意义(P>0.05);p27Kip1轻微上调,但仅在SN区域的差异有统计学意义(P=0.016)。
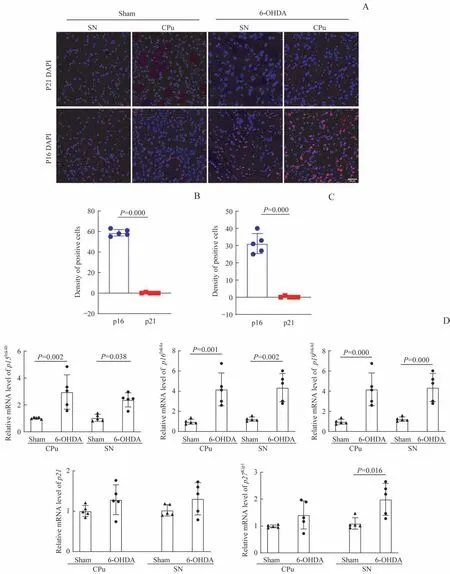
图2 细胞衰老标志物的检测(n=5)Fig 2 Detection of cell senescence markers(n=5)
2.2.2 SASP的变化 RT-qPCR分析了8个最常见的SASP基因,结果显示:与Sham组相比,6-OHDA组造模侧CPu区域的Cxcl10、Ccl2、Tnf-α、Il-1α和Il-6显著上调,Il-1β显著下调(均P<0.05),SN区域的Ccl2、Tnf-α、Il-1α和Il-6显著上调(均P<0.05),Mmp3和Il-1β均显著下调(均P<0.05)(图3)。
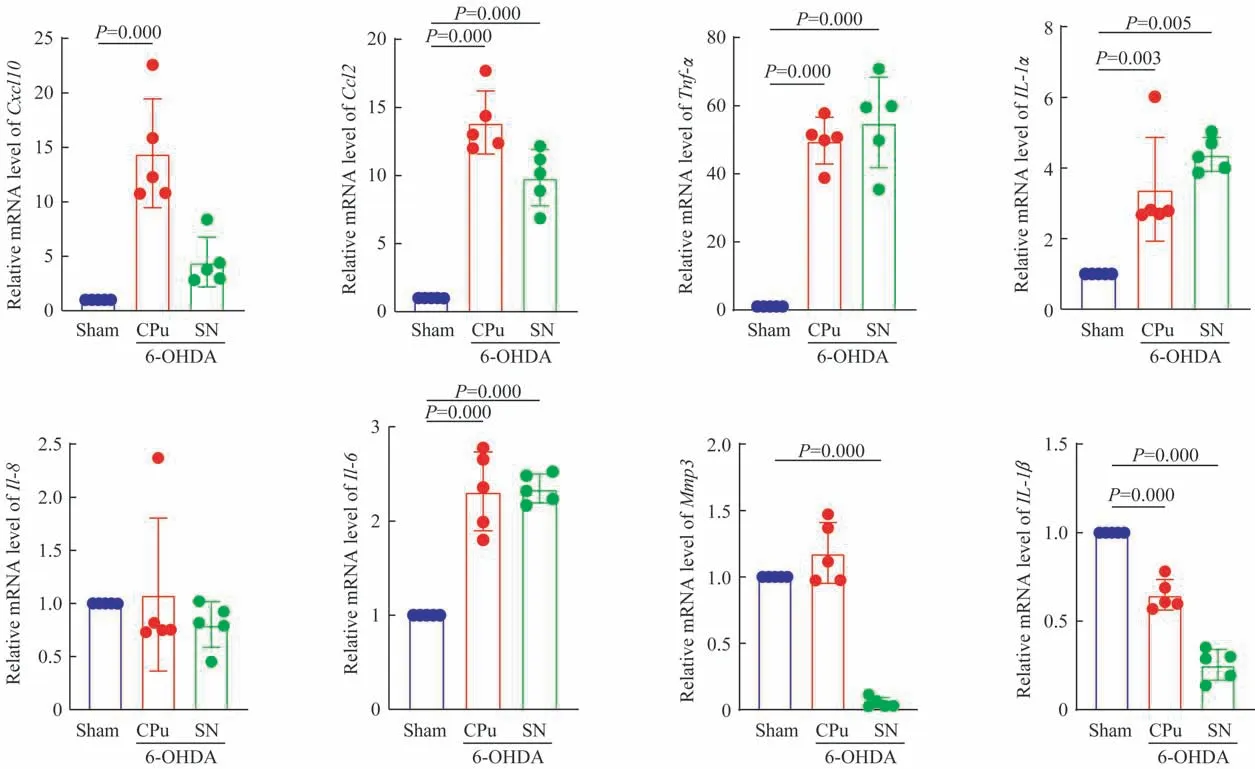
图3 造模后第21日SASP表达水平的变化Fig 3 SASPlevels on day 21 post modelling
2.3 6-OHDA诱导的小鼠PD模型中胶质细胞衰老变化
6-OHDA组造模侧CPu区域含有多个与GFAP和p16Ink4a抗体均呈阳性免疫反应的星型胶质细胞,很少有共表达p16Ink4a和Olig2的少突胶质细胞,基本不存在共表达p16Ink4a和Iba-1的小胶质细胞;且星形胶质细胞数量大于少突胶质细胞和小胶质细胞(均P<0.05)。健侧与造模侧相比,3种衰老的胶质细胞数量具有相似的趋势,即星形胶质细胞数量最多,小胶质细胞数量最少;但健侧胶质细胞的数量较造模侧少,两侧差异具有统计学意义(均P=0.000)。健侧和造模侧的SN区域也观察到GFAP和p16Ink4a阳性的星形胶质细胞(图4)。
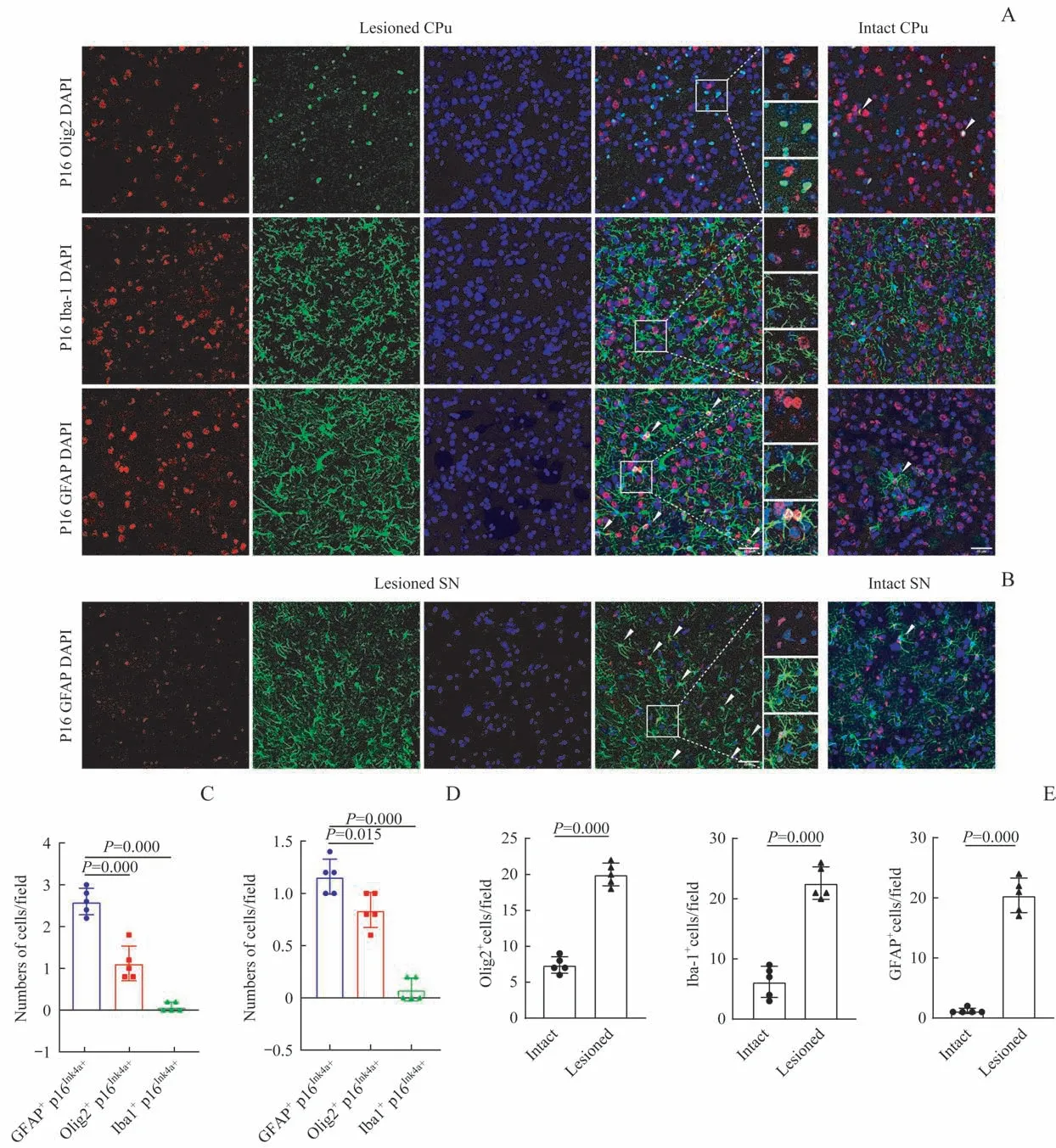
图4 CPu和SN区胶质细胞的衰老表型(n=5)Fig 4 Senescent phenotypeof glial cells in CPu and SN regions(n=5)
3 讨论
细胞衰老会产生SASP[12]。SASP包含促炎症细胞因子、趋化因子、生长调节剂、血管生成因子和基质金属蛋白酶(matrix metalloproteinase,MMP)等[13]。SASP的组成和表达强度因衰老的持续时间、促衰老刺激的来源和细胞类型而有很大不同[14]。目前,PD动物模型有多种,常见的包括1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)、6-OHDA、百草枯、鱼藤酮等毒性模型及PD致病基因的单基因转基因小鼠模型[8]。这些模型中是否都有衰老表型,衰老产生的SASP谱与PD患者有哪些差异,都值得进一步研究。
有文献报道,在PD患者的黑质中,核苷酸结合寡聚化 结 构 域 样 受 体 蛋 白 3(nucleotide-binding oligomerization domain,leucine rich repeat and pyrin domain containing 3,NLRP3)上调几乎仅定位到小胶质细胞[15],NLRP3炎症小体可以促进IL-1β、IL-18的成熟和分泌[16],而IL-1β可以进一步诱导促炎症细胞因子的表达,包括MMP。本研究中,可能是由于造模后第21日的小胶质细胞呈静息状态,相应的NLRP3小体水平较低,因此6-OHDA组SASP中的Mmp3和Il-1β呈下调趋势。在以后的研究中可以扩大SASP的检测谱以探索相关分子机制。
神经退行性疾病中,已经被测定有衰老标志物的细胞包括星型胶质细胞、小胶质细胞[17]。星形胶质细胞的反应性也是啮齿动物、非人类和人类灵长类动物生理衰老的标志[18]。阿尔茨海默病(Alzheimer′sdisease,AD)相关的研究中,也确定了AD模型小鼠中少突胶质祖细胞的衰老表型[4]。考虑到PD与AD在病理改变方面有很多相似之处[19],我们认为在PD模型小鼠中也应研究胶质细胞的衰老情况。本研究结果显示,6-OHDA纹状体注射PD模型小鼠中,衰老表现最明显的是星形胶质细胞。这也与文献报道中,PD患者衰老标志物阳性的星形胶质细胞水平较高的结论相一致[20]。目前研究[21]表明,通过靶向去除衰老细胞的抗衰老药物在治疗神经退行性疾病中很有潜力。因此,星形胶质细胞可以作为抗衰老药物在PD治疗应用中的靶点。
综上所述,本研究结果显示,纹状体注射6-OHDA造成的PD模型小鼠具有以p16Ink4a高表达和星形胶质细胞衰老为特征的衰老表型,其产生机制及意义需要进一步研究。
参·考·文·献
[1] van Bulck M,Sierra-Magro A,Alarcon-Gil J,et al.Novel Approaches for the treatment of Alzheimer′s and Parkinson′s disease[J].Int J Mol Sci,2019,20(3):719.
[2] Chaudhuri KR,Schapira AH.Non-motor symptoms of Parkinson′s disease:dopaminergic pathophysiology and treatment[J].Lancet Neurol,2009,8(5):464-474.
[3] Saez-Atienzar S,Masliah E.Cellular senescence and Alzheimer disease:the egg and the chicken scenario[J].Nat Rev Neurosci,2020,21(8):433-444.
[4] Zhang P,Kishimoto Y,Grammatikakis I,et al.Senolytic therapy alleviates Aβ-associated oligodendrocyte progenitor cell senescence and cognitive deficits in an Alzheimer′s disease model[J].Nat Neurosci,2019,22(5):719-728.
[5] Riessland M,Kolisnyk B,Kim TW,et al.Loss of SATB1 induces p21-dependent cellular senescence in post-mitotic dopaminergic neurons[J].Cell Stem Cell,2019,25(4):514-530.e8.
[6] Kirkland JL,Tchkonia T.Senolytic drugs:from discovery to translation[J].JIntern Med,2020,288(5):518-536.
[7] Tieu K.A guide to neurotoxic animal models of Parkinson′s disease[J].Cold Spring Harb Perspect Med,2011,1(1):a009316.
[8] Gubellini P,Kachidian P.Animal models of Parkinson′s disease:an updated overview[J].Rev Neurol(Paris),2015,171(11):750-761.
[9] Hernandez-Segura A,Nehme J,Demaria M. Hallmarks of cellular senescence[J].Trends Cell Biol,2018,28(6):436-453.
[10] Lozano-Torres B,Estepa-Fernández A,Rovira M,et al.The chemistry of senescence[J].Nat Rev Chem,2019,3(7):426-441.
[11] Sacco A,Belloni L,Latella L.From development to aging:the path to cellular senescence[J].Antioxid Redox Signal,2021,34(4):294-307.
[12] von Kobbe C. Targeting senescent cells:approaches,opportunities,challenges[J].Aging,2019,11(24):12844-12861.
[13] CoppéJP,Desprez PY,Krtolica A,et al.The senescence-associated secretory phenotype:the dark side of tumor suppression[J].Annu Rev Pathol,2010,5:99-118.
[14] Schaum N,Lehallier B,Hahn O,et al.Ageing hallmarks exhibit organspecific temporal signatures[J].Nature,2020,583(7817):596-602.
[15] Gordon R,Albornoz EA,Christie DC,et al.Inflammasome inhibition prevents alpha-synuclein pathology and dopaminergic neurodegeneration in mice[J].Sci Transl Med,2018,10(465):eaah4066.
[16] Mangan MSJ,Olhava EJ,Roush WR,et al.Targeting the NLRP3 inflammasome in inflammatory diseases[J].Nat Rev Drug Discov,2018,17(8):588-606.
[17] Heneka MT.Microglia take centre stage in neurodegenerative disease[J].Nat Rev Immunol,2019,19(2):79-80.
[18] Pan J,Ma N,Yu B,et al.Transcriptomic profiling of microglia and astrocytesthroughout aging[J].JNeuroinflammation,2020,17(1):97.
[19] Hammond TR, Marsh SE, Stevens B. Immune signaling in neurodegeneration[J].Immunity,2019,50(4):955-974.
[20] Martínez-CuéC,Rueda N.Cellular senescence in neurodegenerative diseases[J].Front Cell Neurosci,2020,14:16.
[21] Thoppil H,Riabowol K.Senolytics:a translational bridge between cellular senescence and organismal aging[J].Front Cell Dev Biol,2019,7:367.

