异土木香内酯诱导慢性粒细胞白血病细胞BCR-ABL融合蛋白降解
陈 晨,高丰厚
上海交通大学医学院附属第九人民医院肿瘤科,上海 201999
慢性粒细胞白血病(chronic myeloid leukemia,CML)是一种骨髓增生性肿瘤,BCR-ABL基因的异常表达是其显著特征;研究显示,该基因是由9号染色体上的C-ABL与22号染色体上的BCR相互易位形成的融合基因[1-2]。该融合基因编码的BCR-ABL融合蛋白具有较强的酪氨酸蛋白激酶活性,可通过激活多个信号转导途径使细胞发生恶性转化[3]。酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)——伊马替尼是美国食品药品监督管理局批准的首个用于临床的选择性TKI,可极大地改善CML患者的生存率[4-5]。然而,随着该药物的长期使用,临床上逐渐出现了伊马替尼耐受的情况[6]。尽管沿着既有的思路开发了第2代TKI如Nilotinib、Dasatinib,同样地也出现了耐药性报道[7]。因此,寻求靶向BCR-ABL蛋白的新策略与新药物仍然是目前克服BCR-ABL阳性肿瘤细胞耐药的主要研究方向。异土木香内酯(isoalantolactone,Iso)是从桉树属植物的根中分离出的内酯化合物[8]。研究[9]表明,其对多种肿瘤细胞具有细胞毒性效应,而对正常细胞则无明显毒性。基于此,本研究观察了Iso对伊马替尼敏感和耐药的CML细胞的效应,探讨其下调伊马替尼敏感和耐药CML细胞中BCR-ABL融合蛋白的分子机制,以期为CML耐药的相关研究提供新思路。
1 材料与方法
1.1 实验细胞及主要试剂
K562细胞(对伊马替尼敏感)和K562R细胞(对伊马替尼耐药)由上海交通大学基础医学院病理生理学系吴英理教授赠送。293T细胞购自中国科学院典型培养物保藏委员会细胞库。
Iso由吴英理教授赠送。主要试剂:蛋白酶体抑制剂MG132、自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)、溶酶体抑制剂氯喹(chloroquine,CQ)和半胱天冬酶抑制剂Z-VAD-FMK(Selleck,美国),RPMI-1640培养基、DMEM培养基(HyClone,美国),胎牛血清(Gibco,美国),CCK-8细胞增殖和毒性检测试剂盒(Dojindo,日本),FITCAnnexin-V细胞凋亡检测试剂盒(BD Pharmingen,美国),SYBR Green荧光定量PCR试剂盒(上海翊圣生物科技有限公司),Lipo 3000转染试剂(Invitrogen,美国);剪切型多聚腺苷二磷酸核糖聚合酶(cleaved poly ADP-ribose polymerase,cleaved PARP)抗体、剪切型半胱天冬酶3(cleaved caspase 3,cleaved CASP3)抗体、C-ABL抗体、半胱天冬酶7(caspase 7,CASP7)抗体、β-肌动蛋白(β-actin)抗体(CST,美国),CASP3抗体(Abcam,美国),辣根过氧化物酶结合兔抗鼠二抗、辣根过氧化物酶结合羊抗兔二抗(Jackson ImmunoResearch,美国)。
1.2 研究方法
1.2.1 细胞培养 用含10%胎牛血清的RPMI-1640培养基分别培养K562和K562R细胞,在培养K562R细胞时需加入10µmol/L伊马替尼以维持其耐药性。同时,用含10%胎牛血清的DMEM培养基培养293T细胞。培养条件为37℃、5%CO2。
1.2.2 CCK-8法检测细胞增殖能力 将处于对数生长期的K562和K562R细胞分别用完全培养液重悬,按照5×103个/孔接种至96孔板中。向其中分别加入2.5、5、10、20、40、80µmol/L Iso作为处理组,加入等体积的二甲基亚砜(dimethyl sulfoxide,DMSO)作为对照组,于37℃、5%CO2条件下培养。采用CCK-8法分别于接种后0、24、36、48 h检测细胞活性,并用酶标仪检测各孔在450 nm处的吸光度。细胞增殖抑制率(%)=[1-处理组D(450 nm)/对照组D(450 nm)]×100%。
1.2.3 流式细胞术检测细胞凋亡 分别将K562和K562R细胞按照1×104个/孔接种至6孔板中,加入Iso使其终浓度为10µmol/L(即为Iso组),同时加入等体积的DMSO作为对照组。培养24 h后,收集细胞并按照试剂盒说明书进行细胞重悬,加入5µLAnnexin V-FITC和5µL PI染液,室温下避光孵育15 min,于流式细胞仪进行检测。
1.2.4 蛋白质印迹法检测细胞内蛋白表达 ①分别用不同浓度的Iso(2.5、5、7.5、10、20µmol/L,即为处理组)处理K562和K562R细胞24 h,对照组用等体积的DMSO;同时,用10µmol/L Iso处理K562和K562R细胞0、6、12、24 h。②分别用2µmol/L MG132、5µmol/L 3-MA、20µmol/L CQ预处理K562细胞1 h后,再加入10µmol/L Iso处理6 h;用50µmol/L Z-VAD-FMK预处理K562和K562R细胞1 h后,再加入10µmol/L Iso处理12 h。分别收集①、②实验的细胞,加入适当体积的1×SDS裂解液于100℃金属浴中裂解10 min,而后行SDSPAGE电泳。经转膜后用5%脱脂奶粉封闭,加入对应的一抗,包括剪切型PARP抗体(1∶1 000)、剪切型CASP3抗体(1∶1 000)、C-ABL抗体(1∶1 000)、CASP7抗体(1∶1 000)、β-actin抗体(1∶1 000)及CASP3抗体(1∶2 000),4℃孵育过夜,TBST洗膜后加入二抗(1∶5 000)。室温孵育2 h,再经TBST洗膜后加入化学发光显影液进行曝光。
1.2.5 反转录和实时荧光定量PCR检测 采用10µmol/L Iso分别处理K562或K562R细胞0、6、12、24 h后,用TRIzol试剂抽提该2种细胞的总RNA,并按照反转录说明书将其反转录为cDNA。依据SYBR Green荧光定量PCR试剂盒的步骤行实时荧光定量PCR(quantitative real-time PCR,qPCR)检测,以β-actin为内参,BCR-ABL基因表达差异以相对表达量2-ΔΔCT展示。qPCR引物序列见表1。

表1 qPCR引物序列Tab 1 Primer sequence for qPCR
1.2.6 构建CASP3和CASP7敲减的稳转细胞株 为敲减K562R细胞中CASP3和CASP7基因,首先需构建pLL3.7-shCASP3和pLL3.7-shCASP7质粒,敲减序列见表2。将293T细胞接种于6孔板中,并置于37℃、5%CO2培养箱中培养24 h。按照Lipo 3000转染试剂说明书,将能表达病毒外壳的质粒psPAX.2和病毒膜蛋白质粒pMD2.G与上述构建的pLL3.7质粒同时转染293T细胞,培养48 h后收集带有病毒颗粒的培养基上清液,用其感染K562R细胞,筛选CASP3和CASP7敲减的稳转细胞株。随后,分别向CASP3、CASP7敲减细胞中加入10µmol/L Iso处理12 h,采用蛋白质印迹法(Western blotting)检测BCR-ABL蛋白的表达,方法同“1.2.4”。
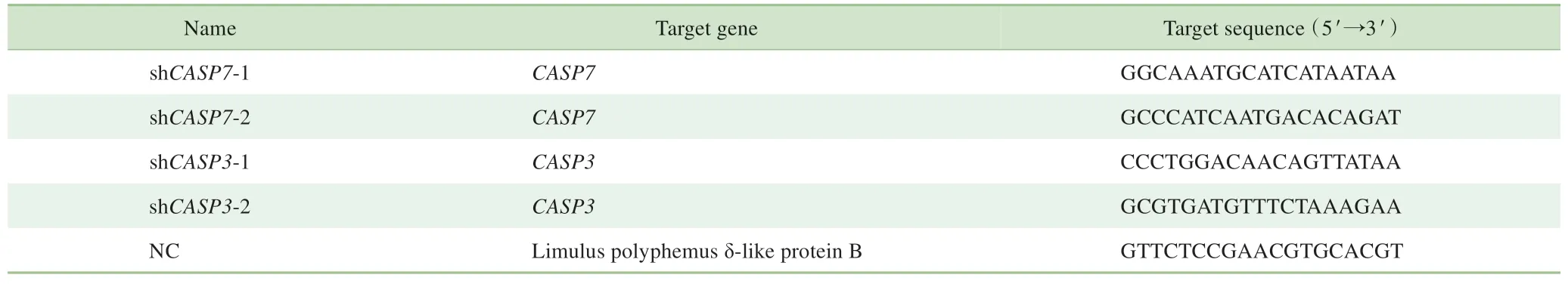
表2 靶向敲减序列Tab 2 Target sequence of knockdown
1.3 统计学方法
采用Graphpad Prism 8软件对研究数据进行统计分析。定量资料以±s表示。组间差异采用Studentt检验或方差分析进行比较。P<0.05表示差异具有统计学意义。
2 结果
2.1 Iso对K562和K 562R细胞的增殖抑制效应分析
采用CCK-8法检测不同浓度的Iso于不同时间下对K562和K562R细胞的增殖抑制效应,结果(表3)显示,与对照组相比,Iso可抑制上述细胞的增殖,且呈剂量和时间依赖性。
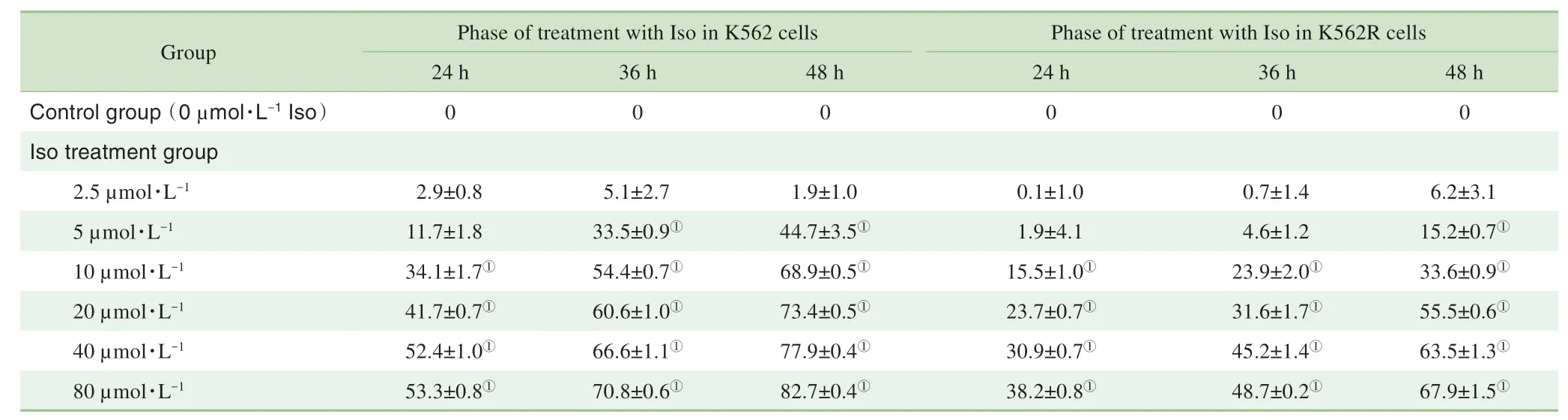
表3 Iso对K562/K562R细胞的增殖抑制率分析(%)Tab 3 Analysisof proliferation inhibition rateof K562/K562Rcellsby Iso(%)
2.2 Iso诱导K562和K562R细胞凋亡效应的检测
采用流式细胞术检测Iso(10µmol/L)诱导K562和K562R细胞24 h的凋亡效应,结果(图1)显示,与对照组相比,Iso处理K562和K562R细胞后,发生凋亡的细胞比例明显增多(P=0.034,P=0.000)。
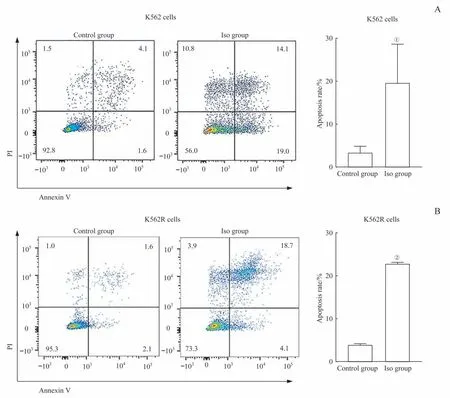
图1 流式细胞术检测Iso对K562和K562R细胞的凋亡诱导效应Fig 1 Apoptosisinducing effects of Iso on K562 and K562R cells by flow cytometry
2.3 Iso对K562和K562R细胞中BCR-ABL融合蛋白及凋亡相关蛋白水平的影响
用一系列浓度(0、2.5、5、7.5、10、20µmol/L)的Iso处理K562和K562R细胞24 h后,经Western blotting检测(图2A、B)显示,凋亡相关蛋白(包括剪切型CASP3和剪切型PARP)水平均显著增加,BCR-ABL融合蛋白水平呈剂量依赖性下降。同时,随着Iso(10µmol/L)作用CML细胞的时间延长,Western blotting结果(图2C、D)显示凋亡相关蛋白水平显著增加、BCR-ABL蛋白水平显著降低。
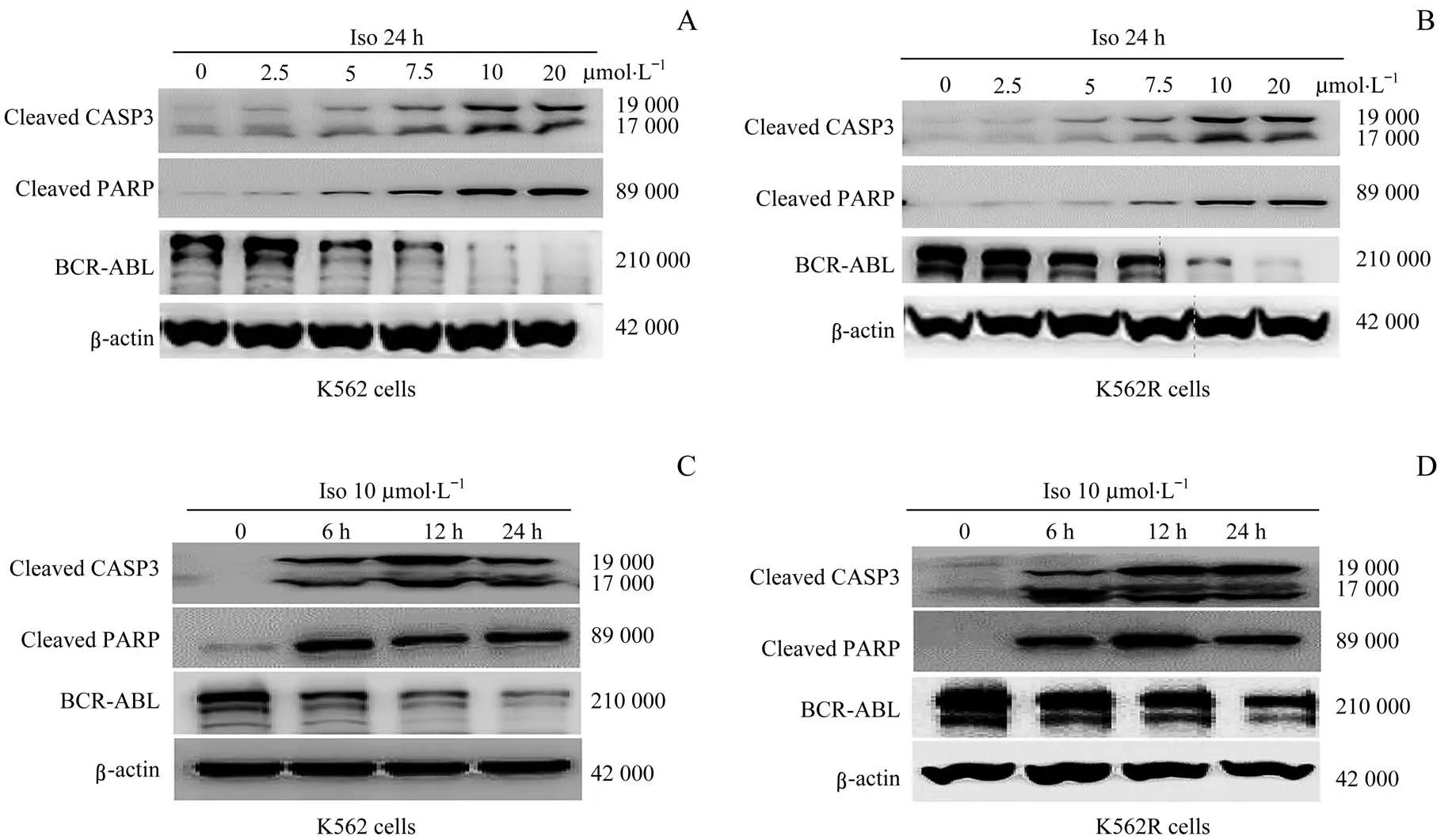
图2 不同浓度及作用时间下Iso对K562和K 562R细胞中凋亡相关蛋白和BCR-ABL融合蛋白水平的影响Fig 2 Effects of Iso on the levels of apoptosis-related protein and BCR-ABL fusion protein in K562 and K562Rcells at different concentrations and time
2.4 Iso对BCR-ABL mRNA水平的影响
为了探索Iso下调BCR-ABL融合蛋白表达的机制,采用反转录及qPCR检测BCR-ABLmRNA的表达水平。结果(图3)显示Iso处理K562和K562R细胞后,BCRABLmRNA的表达水平无明显变化。
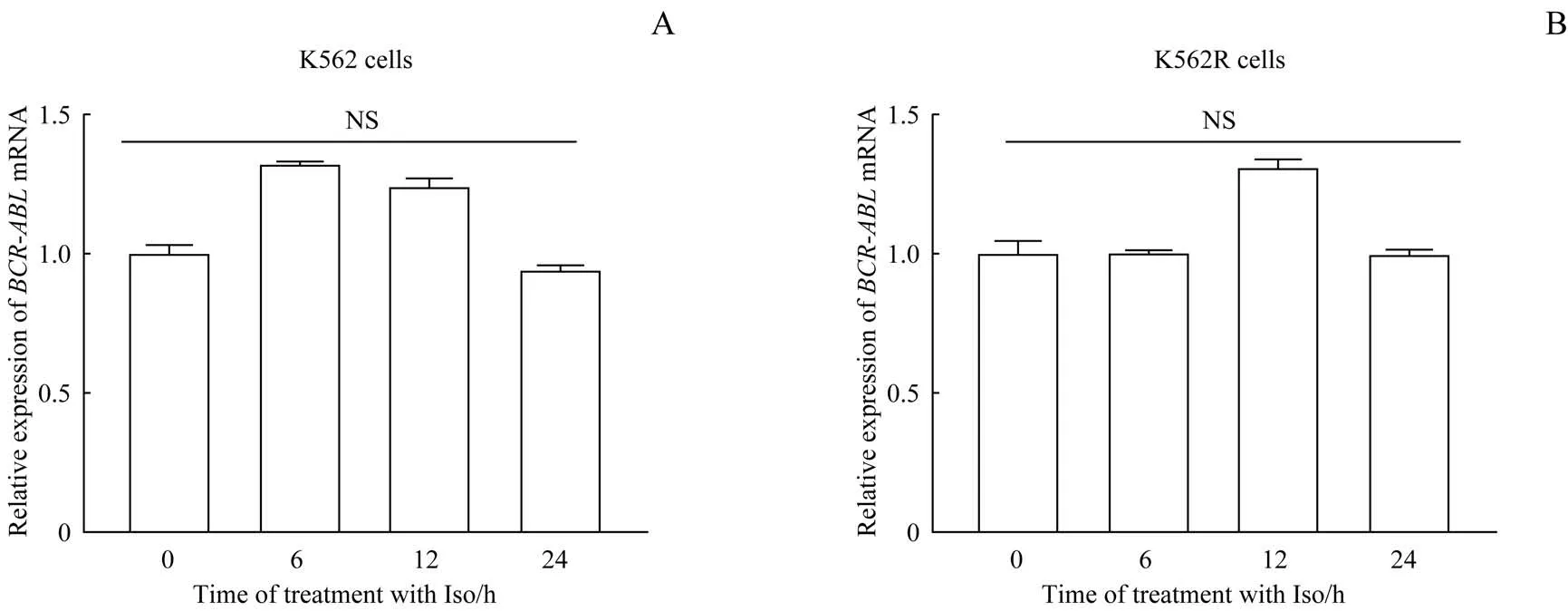
图3 Iso对K 562细胞(A)和K562R细胞(B)中BCR-ABL mRNA水平的影响Fig 3 Effects of Iso on the level of BCR-ABL mRNA in K562 cells(A)and K562Rcells(B)
2.5 蛋白酶体抑制剂、自噬抑制剂和溶酶体抑制剂对Iso诱导K562细胞中BCR-ABL融合蛋白下调的影响
为进一步探究Iso诱导CML细胞中BCR-ABL蛋白的降解途径,采用蛋白酶体抑制剂MG132、自噬抑制剂3-MA、溶酶体抑制剂CQ分别联合Iso处理K562细胞,结果(图4)显示上述3种抑制剂均不能阻断由Iso诱导的K562细胞中BCR-ABL蛋白的降解。
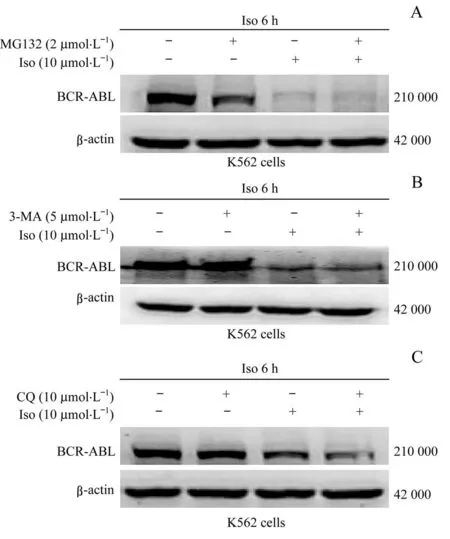
图4 蛋白酶体抑制剂MG132(A)、自噬抑制剂3-MA(B)和溶酶体抑制剂CQ(C)对Iso诱导BCR-ABL融合蛋白下调的影响Fig 4 Effects of proteasome inhibitor MG132(A),autophagy inhibitor 3-MA(B)and lysosomal inhibitor CQ(C)on the down-regulation of BCR-ABL fusion protein induced by Iso
2.6 半胱天冬酶抑制剂对Iso诱导K 562和K 562R细胞中BCR-ABL融合蛋白下调的影响
为探究半胱天冬酶活性是否参与Iso诱导的CML细胞中BCR-ABL融合蛋白的降解,采用半胱天冬酶抑制剂Z-VAD-FMK联合Iso处理K562和K562R细胞。结果(图5)显示Z-VAD-FMK作用后,CASP3活性形式(剪切型CASP3)及下游剪切型PARP均有所减少,表明ZVAD-FMK抑制了半胱天冬酶的活性。结果表明,Z-VADFMK能够部分逆转由Iso诱导的CML细胞中BCR-ABL蛋白的降解。
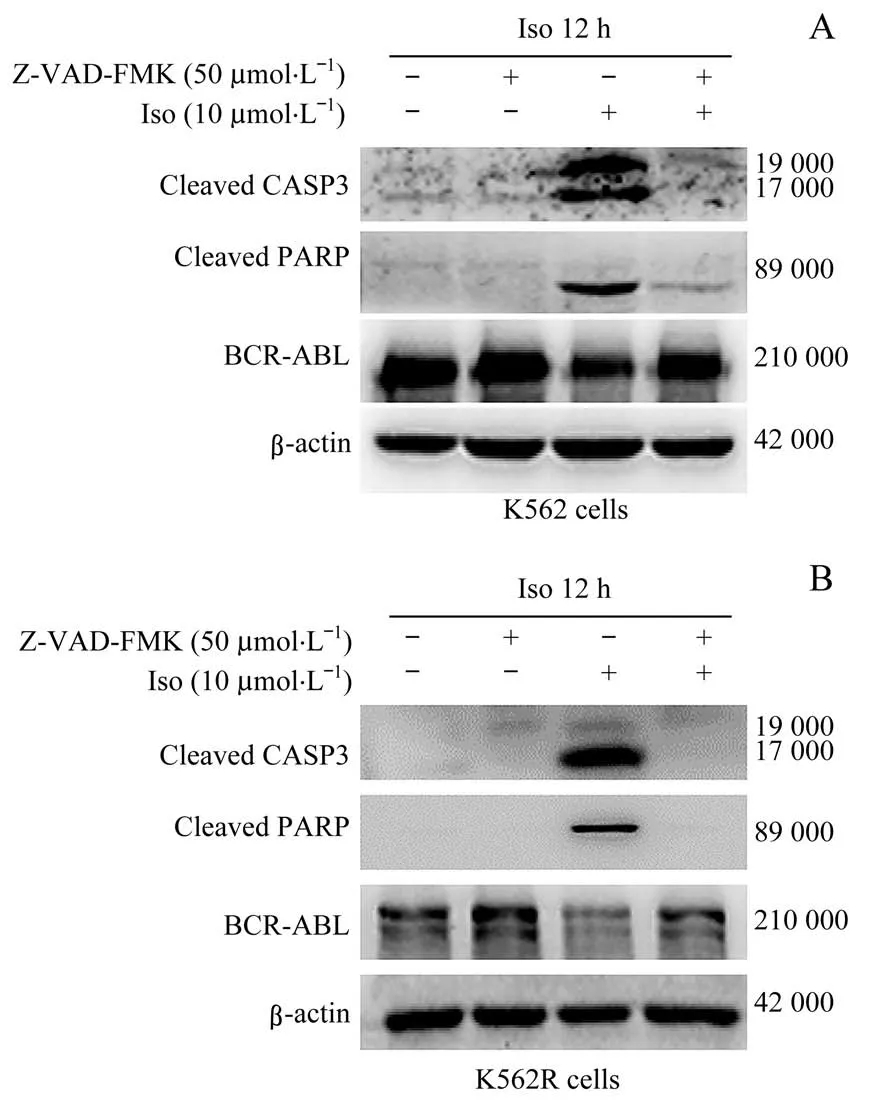
图5 半胱天冬酶抑制剂Z-VAD-FMK对Iso诱导BCR-ABL融合蛋白下调的影响Fig 5 Effects of caspase inhibition Z-VAD-FMK on the down-regulation of BCRABL fusion protein induced by Iso
2.7 CASP3和CASP7在Iso诱导K562R细胞内BCRABL蛋白下调作用中的比较
为了进一步证实半胱天冬酶的激活有助于Iso诱导BCR-ABL融合蛋白的降解,本研究通过构建CASP3和CASP7敲减的稳转细胞株,用Iso分别处理上述细胞。结果(图6)显示与NC组相比,敲减CASP7的细胞中CASP7表达量减少,但却不能逆转BCR-ABL融合蛋白的降解;而在敲减CASP3的细胞中,敲减CASP3则可部分逆转该融合蛋白的降解。
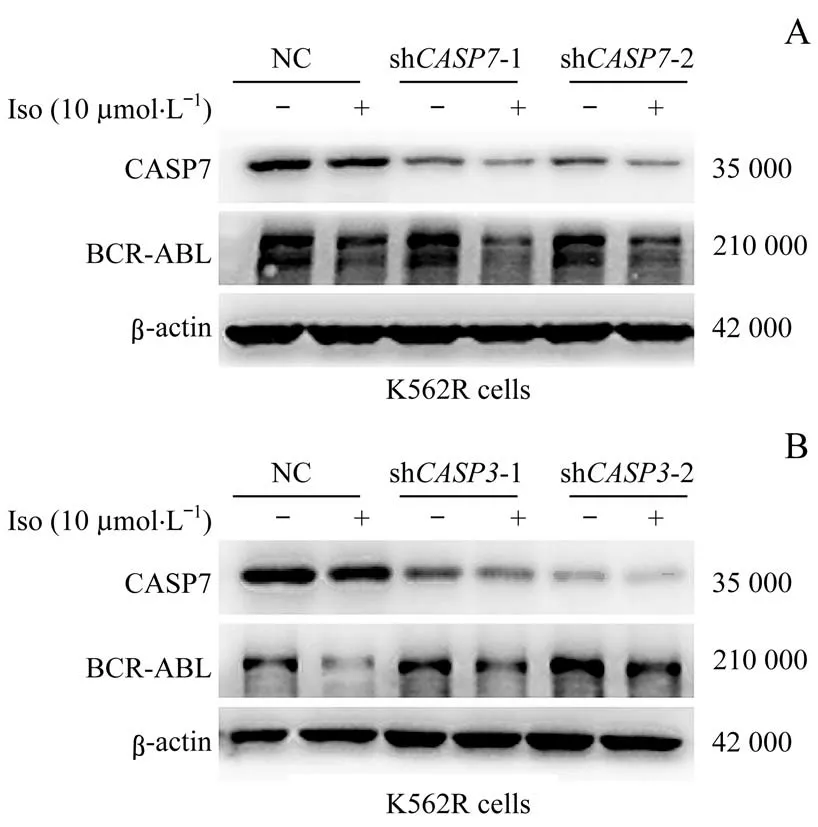
图6 CASP7(A)与CASP3(B)敲减对Iso诱导BCR-ABL融合蛋白下调的影响Fig 6 Effects of CASP7(A)and CASP3(B)knockdown on the down-regulation of BCR-ABL fusion protein induced by Iso
3 讨论
BCR-ABL融合蛋白可通过激活多种信号通路[如磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB)、核因子活化B细胞κ轻链增强子(nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)、JAK激 酶(Janus kinase,JAK)/信号转导及转录活化因子(signal transducer and activator of transcription,STAT)等通路]促进细胞的存活和增殖,因此靶向BCR-ABL或将是治疗CML的有效方法[1-2,10]。越来越多的证据[7,11]表明,通过小分子化合物诱导BCR-ABL的降解可能是克服TKI耐药的有效策略。本研究发现,Iso可抑制CML细胞增殖且呈时间、剂量依赖性。值得说明的是,当使用2.5µmol/L Iso处理K562细胞时,其抑制率较低,且随着时间的增加组内存在一定的偏差,使得该组在不同时间点下的差异无统计学意义;但随着Iso浓度的增加,其抑制效果更为明显。此外,Iso可诱导CML细胞中BCR-ABL融合蛋白的下调,而不影响BCR-ABLmRNA水平;同时,蛋白酶体和自噬溶酶体途径均不参与Iso诱导BCR-ABL融合蛋白的降解过程。
近来的研究发现,caspase途径参与了BCR-ABL融合蛋白的降解。如藤黄酸可通过激活caspase系统下调BCRABL蛋白的表达[12],抗氧化剂黄腐酚通过激活caspase而非自噬或泛素蛋白酶体系统(ubiquitin proteasome system,UPS)诱导BCR-ABL蛋白的降解[13],而巯氧吡啶硫铂通过caspase激活来抑制BCR-ABL的表达[14]。本研究的数据显示半胱天冬酶抑制剂可阻断Iso对BCRABL的降解,这也提示Iso可通过半胱天冬酶的激活来诱导BCR-ABL蛋白降解。
在半胱天冬酶家族中,CASP3和CASP7参与了多个蛋白质的降解过程[15-16]。激活CASP3可促进法尼酰基转移 酶(farnesyltransferase,FTase)/牻 牛 儿 基 转 移 酶(geranylgeranyltransferase,GGTase)α亚基的裂解[17],CASP7能够裂解肿瘤坏死因子受体1(tumor necrosis factor receptor 1,TNFR1)[18],CASP3和CASP7也负责P53诱导的BCR-ABL降解[19]。本研究发现在CASP3敲减的K562R细胞中可部分逆转由Iso诱导的BCR-ABL降解,而CASP7的敲减对该降解无影响。这一结果提示,CASP3活化可能参与了Iso诱导的BCR-ABL融合蛋白的降解过程。然而,Iso如何活化CASP3、活化的CASP3如何参与BCR-ABL融合蛋白的降解,或可通过观察Iso如何作用于CASP3上游分子及活化的CASP3如何剪切BCR-ABL蛋白中氨基酸来阐明。
综上,本研究证实Iso可通过激活CASP3来诱导CML细胞中BCR-ABL融合蛋白的降解。该结果为探究Iso靶向降解BCR-ABL融合蛋白提供了实验基础,同时也为克服CML治疗中的耐药问题提供了新的线索。
参·考·文·献
[1] Apperley JF.Chronic myeloid leukaemia[J].Lancet,2015,385(9976):1447-1459.
[2] Chereda B,Melo JV.Natural course and biology of CML[J].Ann Hematol,2015,94(Suppl 2):S107-S121.
[3] Quintás-Cardama A,Cortes J.Molecular biology ofbcr-abl1-positive chronic myeloid leukemia[J].Blood,2009,113(8):1619-1630.
[4] Jabbour E,Kantarjian H.Chronic myeloid leukemia:2018 update on diagnosis,therapy and monitoring[J].Am JHematol,2018,93(3):442-459.
[5] Waller CF.Imatinib mesylate[J].Recent Results Cancer Res,2018,212:1-27.
[6] Soverini S,Mancini M,Bavaro L,et al.Chronic myeloid leukemia:the paradigm of targeting oncogenic tyrosine kinase signaling and counteracting resistancefor successful cancer therapy[J].Mol Cancer,2018,17(1):49.
[7] Singh VK,Coumar MS.Chronic myeloid leukemia:existing therapeutic options and strategies to overcome drug resistance[J].Mini Rev Med Chem,2019,19(4):333-345.
[8] Wang Q,Gao S,Wu GZ,et al.Total sesquiterpene lactones isolated from Inula helenium L.attenuates 2,4-dinitrochlorobenzene-induced atopic dermatitis-like skin lesions in mice[J].Phytomedicine,2018,46:78-84.
[9] Li ZL,Qin BY,Qi XG,et al.Isoalantolactone induces apoptosis in human breast cancer cellsviaROS-mediated mitochondrial pathway and downregulation of SIRT1[J].Arch Pharm Res,2016,39(10):1441-1453.
[10] Huang R,Kang Q,Liu HM,et al.New insights into the molecular resistance mechanisms of chronic myeloid leukemia[J].Curr Cancer Drug Targets,2016,16(4):323-345.
[11] Yin B,Fang DM,Zhou XL,et al.Natural products as important tyrosine kinaseinhibitors[J].Eur JMed Chem,2019,182:111664.
[12] Shi XP,Chen X,Li XF,et al.Gambogic acid induces apoptosis in imatinibresistant chronic myeloid leukemia cellsviainducing proteasome inhibition and caspase-dependent Bcr-Abl downregulation[J].Clin Cancer Res,2014,20(1):151-163.
[13] Lu XX,Geng JJ,Zhang JM,et al.Xanthohumol,a prenylated flavonoid from hops,induces caspase-dependent degradation of oncoprotein BCRABL in K562 cells[J].Antioxidants(Basel),2019,8(9):E402.
[14] Lan XY,Zhao C,Chen X,et al.Platinum pyrithione induces apoptosis in chronic myeloid leukemia cells resistant to imatinibviaDUB inhibitiondependent caspase activation and Bcr-Abl downregulation[J].Cell Death Dis,2017,8(7):e2913.
[15] Van Opdenbosch N,Lamkanfi M.Caspases in cell death,inflammation,and disease[J].Immunity,2019,50(6):1352-1364.
[16] D′Arcy MS.Cell death:a review of the major forms of apoptosis,necrosis and autophagy[J].Cell Biol Int,2019,43(6):582-592.
[17] Veluthakal R,Arora DK,Goalstone ML,et al.Metabolic stress induces caspase-3 mediated degradation and inactivation of farnesyl and geranylgeranyl transferase activities in pancreaticβ-cells[J].Cell Physiol Biochem,2016,39(6):2110-2120.
[18] Ethell DW,Bossy-Wetzel E,Bredesen DE.Caspase 7 can cleave tumor necrosis factor receptor-I(p60)at a non-consensus motif,in vitro[J].Biochim Biophys Acta,2001,1541(3):231-238.
[19] di Bacco AM,Cotter TG.p53 expression in K562 cells is associated with caspase-mediated cleavage of c-ABL and BCR-ABL protein kinases[J].Br J Haematol,2002,117(3):588-597.

