MLL基因重排阳性的儿童急性白血病患者的临床特点及预后分析
刘 青,张 娜,邵静波,李 红,陈 凯,杜成坎,王 真,蒋 慧
1.上海交通大学附属儿童医院/上海市儿童医院血液肿瘤科,上海 200040;2.上海交通大学附属儿童医院/上海市儿童医院检验科,上海200040
混合谱系白血病(mixed linage leukemia,MLL)基因位于11号染色体长臂2区3带(11q23),其重排导致与“伙伴”基因的融合,从而转录出融合基因转录本,并编码相应的蛋白,可引起造血祖细胞的异常自我更新和表观遗传调控紊乱,从而诱发白血病的发生,是恶性血液病常出现的基因之一。可见于15%~20%儿童急性髓细胞性白血病(acute myeloid leukemia,AML)和2.5%~5%的儿童急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL),在婴幼儿急性白血病(acute leukemia,AL)中占75%[1]。
MLL基因重排(MLLrearrangement,MLL-r)是AL预后不良的独立因素,这类患者具有发病年龄较小、高白细胞、多器官浸润、常规化学治疗(化疗)难以缓解、缓解后极易复发、生存期短等特点。但针对不同年龄阶段及不同“伙伴”融合基因患者的预后仍存在争议。目前的联合化疗和异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)使这类患者的生存率有所提高,但总体治疗效果仍不理想,新的靶向药物和细胞免疫治疗有望改善MLL-r阳性白血病患儿的预后[2]。本研究拟通过分析MLL-r阳性的AL患儿的临床、实验室资料及生存情况,探讨该类患者的临床特点及预后。
1 对象与方法
1.1 研究对象
回顾性分析2009年1月1日至2019年12月31日上海交通大学附属儿童医院收治的初发儿童AL患者633例,依据世界卫生组织(Word Health Organization,WHO)(2008)诊断分型标准确诊为ALL患者498例和AML患者135例,并经荧光原位杂交(fluorescencein situhybridization,FISH)检测和/或实时荧光定量聚合酶链反应(real-time polymerase chain reaction,RT-PCR),明确45例MLL-r的患儿为研究对象。
1.2 临床诊断
临床诊断通过细胞形态学、免疫学、细胞遗传学及分子生物学检查。形态学检查采用骨髓细胞学及免疫组化。免疫分型采用直接免疫荧光标记法,流式细胞仪canto2(Biosciences,美国)进行标准化检测。MLL-r采用FISH和RT-PCR检测,RT-PCR法采用上海源奇生物科技公司的试剂盒,可检测MLL-AF9、MLL-AF6、MLLAF4、MLL-AF10、MLL-ELL、MLL-ENL、MLL-AF1q、MLL-AF17等11种MLL相关融合基因。染色体核型分析采用G显带技术,核型描述按《人类细胞遗传学国际命名体制(ISCN2009)》[3]。2015年后收治的患者采用一代测序法检测ALL及AML常见基因突变,包括:tumor protein 53 gene(TP53)、paired-box domain gene 5(PAX5)、janus kinase 1 gene(JAK1)、janus kinase 2 gene(JAK2)、plant homeodomain finger gene 6(PHF6)、cytokine receptor-like factor 2(CRLF2)、notch 1 gene(NOTCH1)、fms-related tyrosine kinase 3 gene(FLT3)、nucleophosmin 1 gene(NPM1)、receptor tyrosine kinase gene(c-Kit)、CCAAT enhancer binding protein α gene(CEBPA)、isocitrate dehydrogenase 1(IDH1)、DNA methyltransferase 3A gene(DNMT3A)、additional sex combs-like 1 gene(ASXL1)、neuroblastoma RASviral oncogene homolog gene(NRAS)、tet methylcytosine dioxygenase 2(TET2)、histone-modifying CREB-binding protein gene(CREBBP)和Casitas B-lineage lymphoma proto-oncogene(CBL)等,筛查出阳性者采用二代测序法进行定量。
1.3 治疗方案
1.3.1 AML治疗方案 所有入组AML对象均采用上海交通大学附属儿童医院AML治疗方案(SCH-AML方案)[4],临床应用通过医院伦理委员会批准(批准文号:2010R030-F01),患儿监护人均签署知情同意书。
1.3.2 ALL治疗方案 所有入组ALL对象按收治时间分别采用CCCG-ALL2005方案[5](2009年1月—2014年12月)和CCCG-ALL2015方案[6](2015年1月—2020年10月)进行治疗,临床应用通过医院伦理委员会批准(批准文号:2015R037-F01)。
1.3.3 allo-HSCT ALL高危组患儿若有合适配型供者,建议在缓解后3个月左右行allo-HSCT;AML高危组患儿若有合适配型供者,建议在完成诱导Ⅱ或巩固疗程Ⅰ后行allo-HSCT;所有复发患者均建议行allo-HSCT。
1.4 疗效评估
疗效评估标准参照《血液病诊断及疗效标准》第3版[7]。无事件生存(event-free survival,EFS)定义为从诊断到第一次事件发生或末次随访时间,事件包括复发、死亡与未缓解。总生存期(overall survival,OS)定义为从诊断起至死亡或末次随访时间。本研究随访终点为2020年10月31日,中位随访时间26个月(2~138个月)。
1.5 统计学分析
所有数据使用SPSS 23.0软件进行分析。定量资料以x±s表示;定性资料用频数(百分率)表示,2组样本率的比较采用四格表的χ2检验。采用Kaplan-Meier法进行生存率的分析并绘制生存曲线,组间生存率的比较采用Log-rank检验,单因素分析P<0.05的因素归入COX回归模型进行多因素分析,以确定独立预后因素。P<0.05认为差异具有统计学意义。
2 结果
2.1 一般资料
45例MLL-r阳性患者占收治AL患者总数的7.1%(45/633)。男23例,女22例,诊断时中位年龄29个月(3~136个月)。ALL 27例,AML 18例,占同期患儿的比例分别为5.4%(27/498)和13.3%(18/135),2组患儿MLL-r检出率的差异有统计学意义(χ2=10.067,P=0.002)。MLL-r阳性的ALL组和AML组患儿中年龄≤1岁的分别有11例(40.7%)和2例(11.1%),初发时的白细胞(white blood cell,WBC)数≥50×109/L的患儿分别有17例(62.9%)和5例(27.8%),2组比较差异均有统计学差异(χ2=4.615,P=0.032;χ2=5.351,P=0.021),2组患儿性别分布差异无统计学意义(χ2=0.534,P=0.465)。
2.2 形态学和免疫分型
ALL患者中B-ALL患者24例,T-ALL患者3例,其中早期前体B-ALL患者19例(79.2%),普通B-ALL患者5例(20.8%)。AML患者中M5型患者14例(77.8%),M4型患者3例(16.7%),M2型患者1例(5.5%),M4和M5型患者共占94.4%(17/18)。
2.3 细胞遗传学和分子生物学特征
45例MLL-r阳性患儿通过染色体核型分析检出异常核型30例(66.7%),正常核型10例(22.2%),5例(11.1%)因培养细胞生长不良无法分析(表1)。异常核型中包括11号染色体易位26例,检出率为4.1%(26/633),FISH对MLL-r的检出率为7.1%(45/633),2种方法检出率比较差异有统计学意义(χ2=5.387,P=0.020)。RT-PCR方法检测MLL的伙伴基因(表1),ALL患儿中检出MLL/AF4的16例(59.2%),其中年龄小于1岁的患儿11例(68.7%),非MLL/AF4组年龄小于1岁的患儿3例(27.3%),二者差异有统计学意义(χ2=4.492,P=0.034)。AML患儿中检出MLL/AF9的6例(33.3%)。
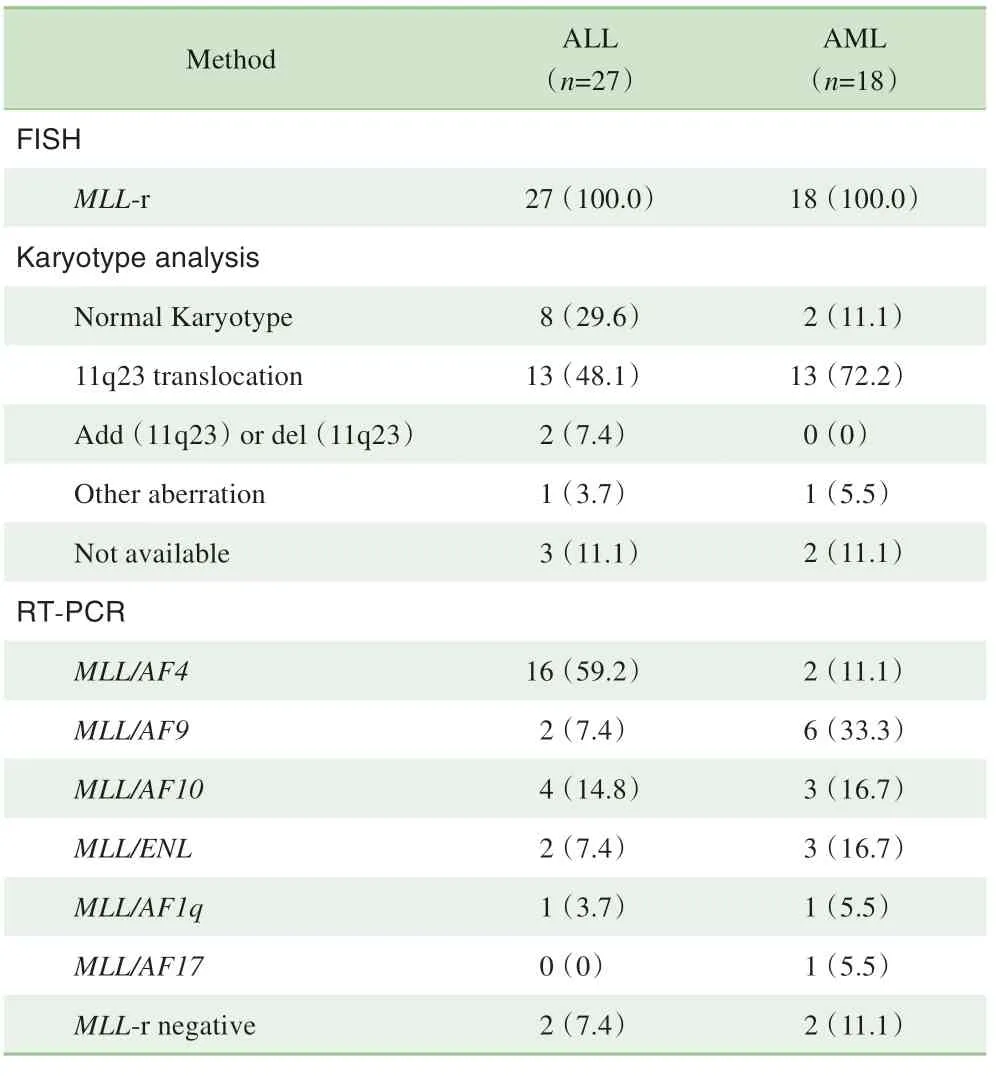
表1 45例MLL-r儿童AL患者的细胞遗传学和分子生物学特征[n(%)]Tab 1 Cytogenetic and molecular characteristics of 45 AL children with MLL-r[n(%)]
2.4 基因突变分析
共27例MLL-r患儿采用基因测序方法检测了常见的突变基因,8例(占29.6%)患儿检出基因突变。其中16例ALL患儿中有5例(占31.2%)突变基因阳性,包括CREBBP突变1例、NRAS突变1例、NOTCH1突变1例、CRLF2突变1例、TP53突变1例。11例AML患儿中有3例(占27.3%)突变基因阳性,包括NRAS突变1例,NRAS并FLT3突变1例,TET2并CBL突变1例。
2.5 预后分析
2.5.1 疗效分析 45例患儿中,3例ALL确诊后放弃治疗,其余42例均完成诱导化疗。仅1例婴儿ALL患儿诱导治疗未缓解后放弃,余41例患儿均经诱导治疗缓解,完全缓解(complete response,CR)率97.6%。中位随访时间26个月(2~138个月),中位EFS和OS时间分别为21个月和24.5个月,3年EFS和OS率分别为(41.8±9.4)%和(60.9±9.3)%。24例ALL患儿的中位EFS和OS时间分别为21.5个月和28个月,3年EFS和OS率分别为(44.3±11.7)%和(58.2±12.1)%(图1),其中2例分别在诊断后2个月和14个月时因早期感染死亡,1例诱导化疗未缓解后死亡。18例AML患儿中位EFS和OS时间分别为16个月和23个月,2年EFS和OS率分别为(36.5±15.8)%和(64.7±14.5)%(图2)。2组患儿EFS及OS比较差异均无统计学意义(χ2=0.182,χ2=0.081;P=0.670,P=0.776)。
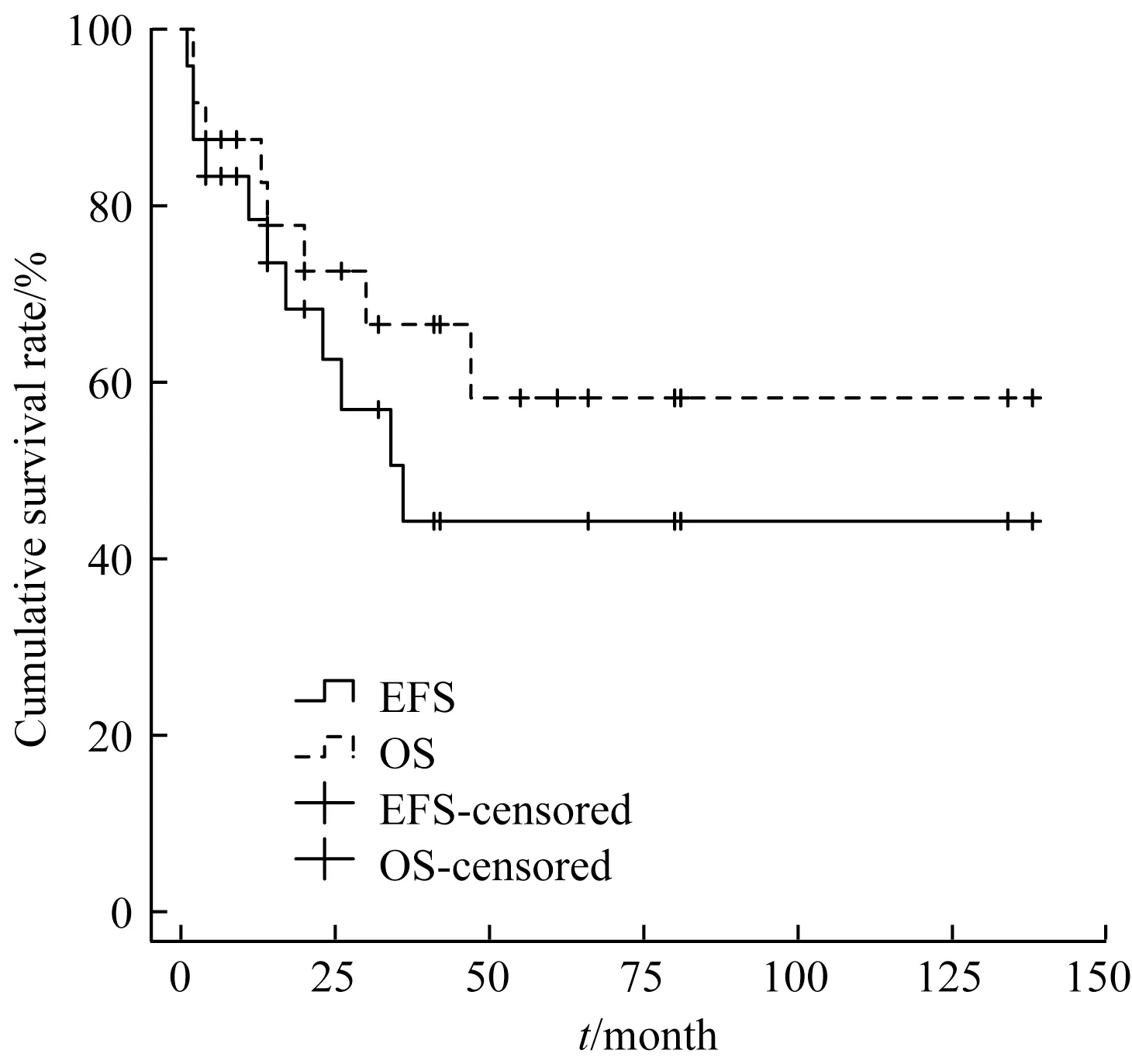
图1 MLL-r ALL患儿的EFS和OSFig 1 EFSand OSof MLL-r ALL patients
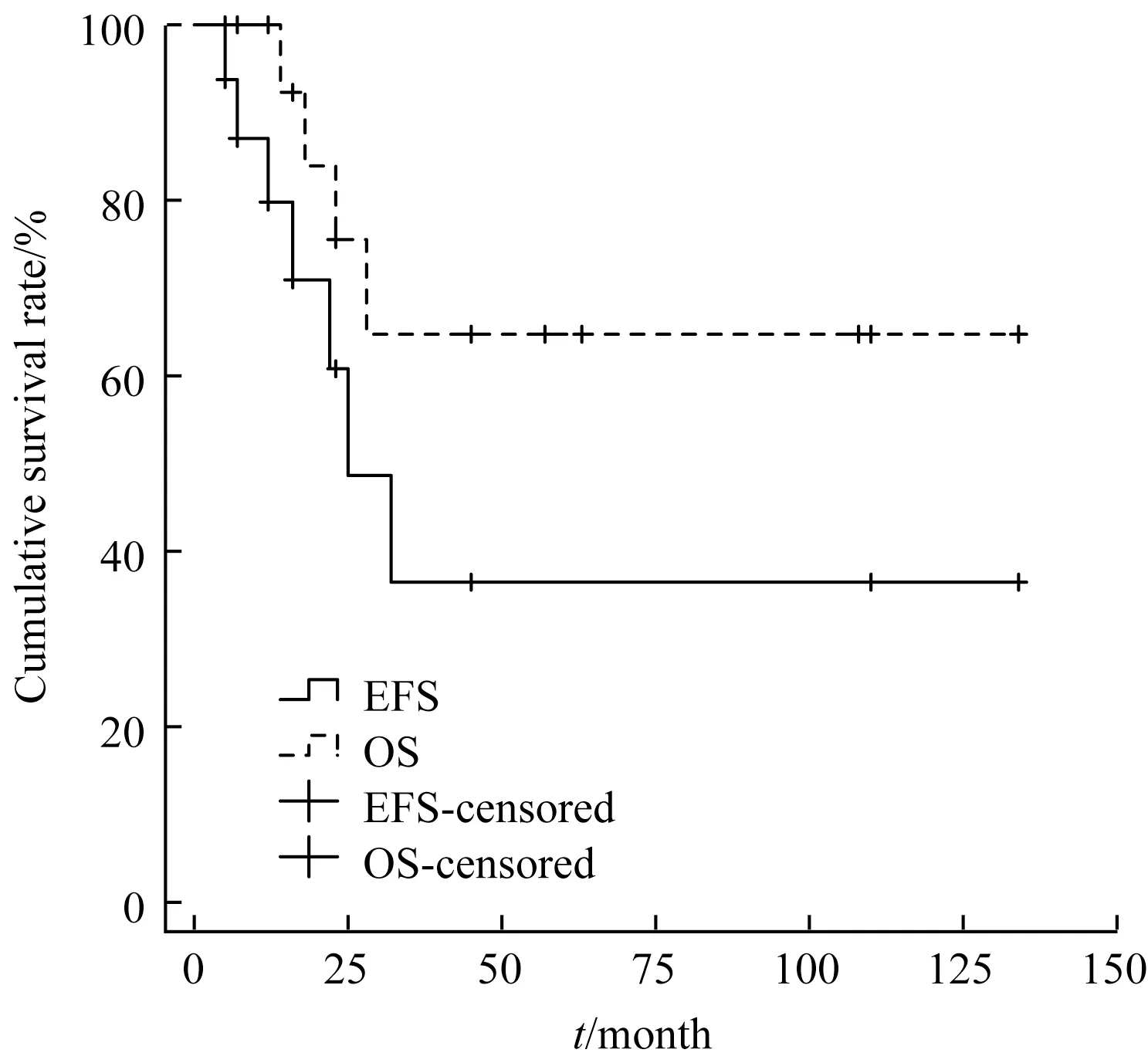
图2 MLL-r AML患儿的EFS和OSFig 2 EFSand OSof MLL-r AML patients
2.5.2 复发情况分析 本组42例长期随访患儿,复发15例,中位复发时间为17个月(2~38个月),累积复发率为54%(图3)。ALL患儿复发8例,其中骨髓复发7例,睾丸复发1例,中位复发时间为20个月(2~36个月),3年累积复发率为48.4%。AML患儿复发7例,均为骨髓复发,其中1例骨髓并中枢复发,中位复发时间为16个月(5~38个月),2年累积复发率为63.9%。ALL组与AML组累积复发率比较差异无统计学意义(χ2=0.716,P=0.398)。
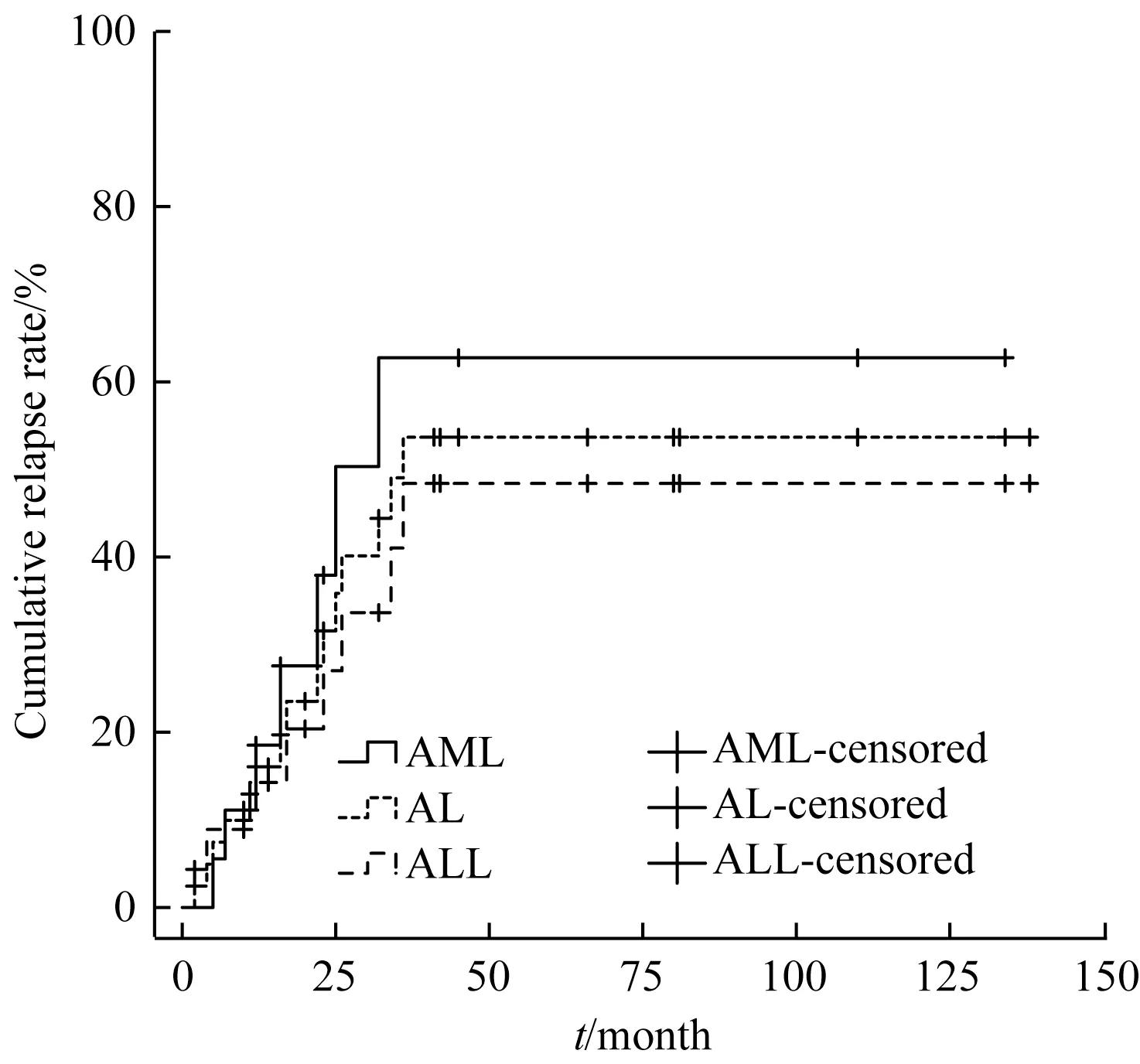
图3 MLL-r白血病患儿的累积复发率Fig 3 Cumulative relapse rate in patientswith MLL-r abnormalities
2.5.3 alb-HSCT 共有8例患儿行allo-HSCT,其中6例为复发后移植,另2例高危AML患儿CR1后移植。ALL患儿4例均于复发后行HSCT,1例死于移植后急性移植物抗宿主病,1例目前持续缓解18个月,2例二次复发。2例二次复发患者均行嵌合抗原受体T细胞治疗(chimeric antigen receptor engineered T cell,CAR-T)后达CR3,其中1例于CAR-T细胞治疗后7个月第3次复发,另1例目前持续缓解3个月计划近期二次移植。AML患儿中2例复发后和2例CR1行造血干细胞移植,目前无病均存活。
2.5.4MLL-r阳性患儿EFS的影响因素单因素分析 通过Kaplan-Meier法分析影响42例MLL-r阳性AL患儿EFS的因素,结果提示:发病时的年龄≤1岁、白细胞数≥50×109/L、血小板数≤30×109/L是影响MLL-r阳性ALL患儿EFS的预后因素。将P<0.05的因素纳入COX回归模型进行多因素分析,发现起病时的白细胞数(RR=6.113,95%CI0.017~1.050,P=0.013)为影响MLL-r阳性ALL患儿EFS的独立预后因素。但单因素分析影响MLL-r阳性AML患儿EFS的预后因素差异均无统计学意义(表2)。另外对18例AML患者进行治疗后MLL-r转阴时间分析,>2个疗程转阴与≤2个疗程转阴对患儿EFS无影响(χ2=0.000,P=0.983)。
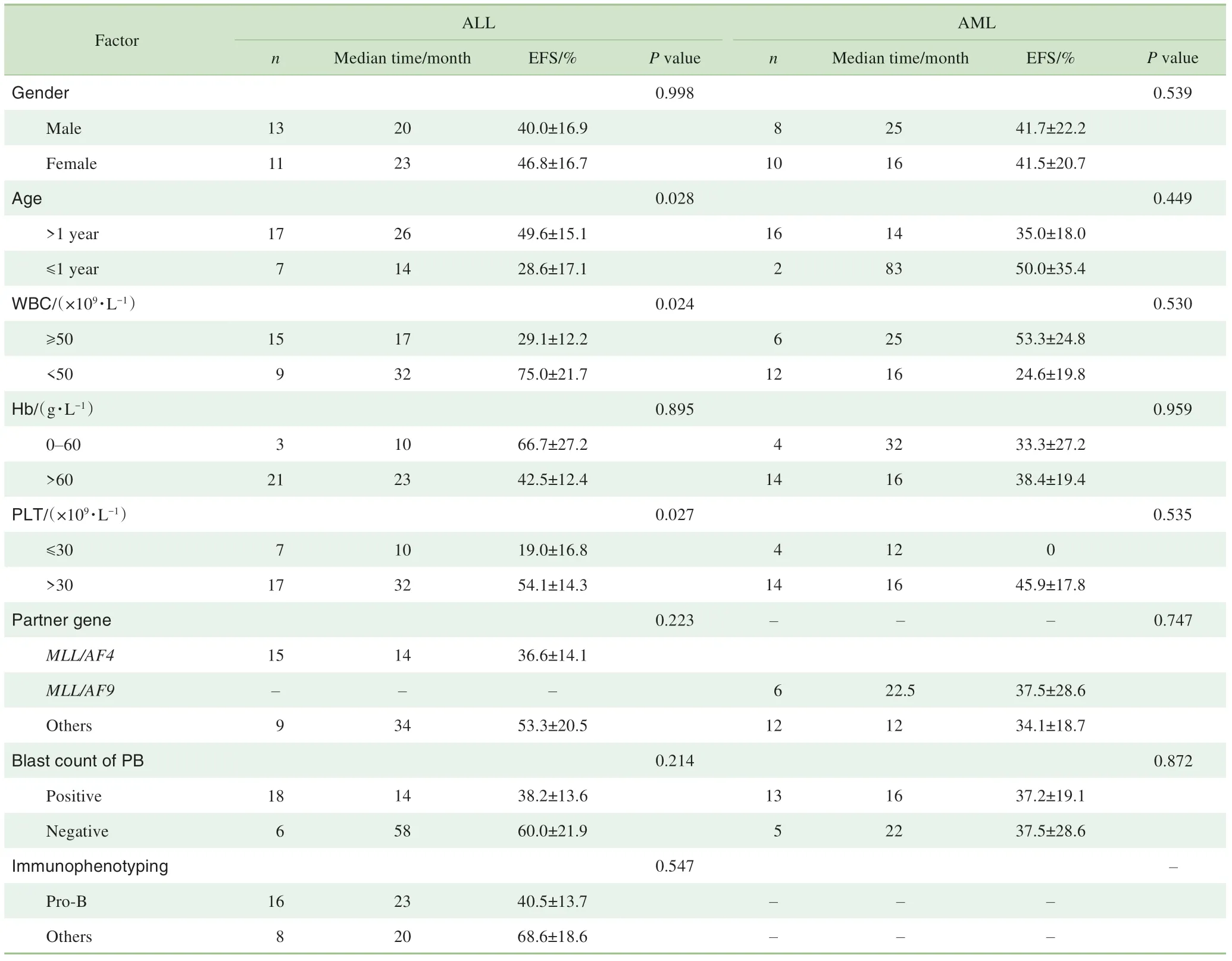
表2 单因素分析影响MLL-r AL患儿的EFS的预后因素Tab 2 Effectsof different prognostic factorson the survival ratesof MLL-r AL patients
3 讨论
MLL-r是造血系统恶性肿瘤常见的遗传学改变,其易位形成的MLL融合蛋白引起转录调控异常及诱导下游目的基因如HOX、EPHA7、MEIS、PBX等异常表达,从而影响造血分化,导致白血病的发生[8]。这类白血病通常表现为白细胞计数高、常规化疗不敏感、缓解后易复发、平均生存期短等,已成为AL中的一个特殊亚型。WHO已将其列为11q23/MLL白血病[9],对其进行检测对这类白血病的诊断及预后判断有重要意义。MLL-r见于5%~10%的儿童AL患儿,婴幼儿是一个高发群体[10]。本研究MLL-r的检出率为7.1%,中位年龄为29个月(3~136个月),发病年龄以婴幼儿为主。在ALL和AML患儿的检出率分别为5.4%和13.3%,二者差异有统计学意义(P=0.002),与文献[10]报道的发生率大致相符。MLL-r在AML患儿中的发生率高于ALL,这也可能是AML患儿预后比ALL差的一个原因。与MLL-r AML患儿相比,本研究MLL-r ALL患儿发病时年龄较小,高白细胞数发生率高,与北欧的一项对1 425名0~14.9岁的儿童白血病的研究[11]数据一致。
作为AL的一个亚组,MLL-r可能与某些表型特征相关。文献[12]报道在MLL-r B-ALL患儿中,免疫表型多为pro-B ALL,是MLL-r ALL的不良预后因素。本研究MLL-r ALL患儿中pro-B ALL占79.2%,3年的EFS率为(40.5±13.7)%,非pro-B ALL患儿3年的EFS率为(68.6±18.6)%,但二者差异无统计学意义(P=0.547),可能与本组患儿随访时间较短有关。在AML中11号染色体长臂的异常在单核细胞系祖细胞的分化和成熟过程中起着重要的调控作用,所以MLL-r AML患者的FAB分型与M4/M5具有高度相关性[13]。本研究18例AML患儿中M4/M5有17例,占94.4%。提示有必要对所有新发的M4/M5患儿进行MLL基因异常的筛查。
本研究比较FISH与染色体核型分析方法对MLL-r的检出率,二者差异有统计学意义(P=0.020)。染色体核型分析能明确伙伴染色体,但易受细胞培养条件和实验室环境影响,因此存在漏检的可能性。FISH技术几乎能够检出所有的MLL-r患者,周期短、敏感性强,但由于受探针的限制,无法检测出MLL的伙伴基因。结合RTPCR方法,本中心可检测MLL/AF9、MLL/AF6、MLL/AF4、MLL/AF10、MLL/ELL、MLL/ENL、MLL/AF1q、MLL/AF17等11种MLL相关融合基因,弥补了FISH方法的不足。ALL患儿MLL的伙伴基因以AF4为主,占59.2%,并且AF4组年龄小于1岁的患儿占68.7%,与非AF4组小于1岁的患儿数相比差异有统计学意义(P=0.034)。AML患儿MLL的伙伴基因以AF9为主,占33.3%。有临床研究[14]表明MLL的伙伴基因是最终白血病表型的主要决定因素,MLL/AF4主要与淋巴系恶性肿瘤有关,而MLL/AF9更多地导致髓系恶性肿瘤,本研究结果与其一致。
研究[15]报道,超过45%的MLL-r阳性的白血病患儿同时合并基因突变,最常见的突变涉及RAS通路,如NRAS、KRAS、PTPN11等。这些突变对MLL-r阳性白血病的预后影响存在争议,但将来有可能成为治疗的新靶点[16]。本研究对27例ALL患者进行突变基因检测,8例阳性(占29.6%)。低于文献报道的原因,可能与检测方法的敏感度有关。其预后意义有待于累积病例及延长随访时间来进一步研究。
MLL-r阳性白血病患者对化疗不敏感,且缓解后易复发,平均生存期短。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)将除MLL/AF9以外的其他MLL-r归为AML的预后不良因素,复发率为47%~100%,生存率为0~45%[17]。对于MLL-r ALL也被归为高危组,生存率为50%~60%[18]。这类患儿单用化疗,由于复发率高,长期生存率很差。本组MLL-r ALL和MLL-r AML患儿EFS和OS率均低于本中心前期研究中ALL和AML患儿5年的EFS率(74.8%和56.5%)和OS率(82.6%和69.6%)[4-5],同时本组MLL-r AML患儿2年EFS率也低于本中心前期研究中M4/M5患儿3年EFS率(51.9%)[19],提示M4/M5伴有MLL-r可能是儿童AML预后更差的因素。
目前已被证明发病时的年龄、白细胞数、CD10是否表达、对泼尼松的治疗反应是影响MLL-r ALL预后的因素[20]。80%~90%的MLL-r患者经诱导化疗会进入缓解状态,但复发率高(50%~60%);最常见的复发部位是骨髓,加强化疗可降低复发率,但同时也会增加治疗相关的并发症和死亡率[21]。文献报道,大于1岁的MLL-r ALL患儿的预后比婴儿好(5年EFS 60%vs42.3%),但仍比MLL-r阴性的儿童差(5年EFS为92%)[22],而MLLr阳性的婴儿AML并没有比MLL-r阴性者有更差的预后[23]。本组患儿的诱导缓解率为97.6%,与国内文献报道相仿[24];复发率为35.7%,略低于文献[14];ALL组年龄≤1岁的患儿预后比>1岁患儿差(P=0.028),3年EFS率 分 别 为(28.6±17.1)%。和(49.6±15.1)%,而 在AML组并没有显示出这种差异。本研究白细胞数≥50×109/L和<50×109/L的ALL患儿3年的EFS率分别为(29.1±12.2)%和(75±21.7)%,差异有统计学意义(P=0.024),而AML组差异则无统计学意义。
MLL的伙伴基因有80多个,可以导致130多种不同的重排[14]。既往研究显示,ALL中MLL/AF4融合与较差的生存相关[25],AML中MLL/AF9有中间到良好的预后[26]。但也有临床研究并未发现MLL-r AL患者的复发或存活与任何特定融合伙伴有显著的关联。来自15个国家的11个研究组的756名MLL-r AML患者融合伙伴与结果之间关系的meta分析表明,OS差异很大,这项研究没有证实以前报道的MLL-AF9易位的可能的“良好风险”特征[26]。这可能与MLL-r白血病通常不采用统一的治疗方案有关。尽管有很多的融合伙伴存在,目前MLL-r白血病主要根据表型(AML与ALL)和年龄(婴儿白血病)进行管理,大多数的临床危险度分层没有考虑融合伙伴。本研究ALL患儿中AF4与非AF4组3年的EFS率分别为(36.6±14.1)%和(53.3±20.5)%,但差异无统计学意义。AML中AF9与非AF9组2年EFS率分别为(37.5±28.6)%和(34.1±18.7)%,与上述文献报道相仿。
传统的化疗已被证明不足以改善MLL-r白血病患者的预后,而造血干细胞移植可将复发率降低到30%~40%,生存率提高到50%~60%[27]。日本的一项研究对132例具有MLL-r的婴儿ALL患者的allo-HSCT进行分析,显示移植后5年OS率为(67.4±4.5)%[28]。但也有报道对于初诊的MLL-r ALL患者,allo-HSCT后5年EFS率仅为48.8%,并没有让MLL-r初诊患者获益[29],所以allo-HSCT可能是复发患者有效的治疗手段。CAR-T可使复发ALL患者达到再次缓解,但缓解状态持续时间有限,需要进一步桥接造血干细胞移植[30]。本组4例ALL患儿复发后行allo-HSCT,其中2例二次复发,均于再复发后行CAR-T治疗缓解,其中1例于CAR-T治疗后7个月第3次复发,另1例目前CAR-T治疗后3个月仍为缓解状态,计划行二次移植。Chen[31]等报道的CR1中的allo-HSCT对改善MLL-r AML患者的OS(39%vs13%,P<0.001)和无复发生存率(40%vs10%,P<0.001)有显著的好处。本组4例MLL-r AML行allo-HSCT,2例高危患者CR1,2例复发患者CR2,目前均处于缓解状态;其中1例随访超过5年目前仍存活,另3例随访时间较短,还需要延长随访时间来进一步观察预后。
MLL-r阳性的儿童急性白血病(ALL和AML)缓解率尚可,但复发率高,总体生存率低。MLL-r ALL患儿发病时的白细数≥50×109/L是预后不良的独立因素。allo-HSCT和CAR-T有望改善这部分患儿的预后,但还需要大样本、多中心的临床研究来证实。
参·考·文·献
[1] Yang L,Ding L,Liang J,et al.Relatively favorable prognosis forMLLrearranged childhood acute leukemia with reciprocal translocations[J].Pediatr Blood Cancer,2018,65(10):e27266.
[2] Gole B,Wiesmüller L.Leukemogenic rearrangements at the mixed lineage leukemia gene(MLL)-multiple rather than a single mechanism[J].Front Cell Dev Biol,2015,3:41.
[3] Shaffer LG,Slovak ML,(eds)Campbell LJ.ISCN 2009:an international system for human cytogenetic nomenclature(2009):recommendations of the International Standing Committee on Human Cytogenetic Nomenclature[M].Basel:Karger,2009.
[4] 朱嘉莳,蒋慧,陆正华,等.儿童急性髓系白血病的疗效及预后相关因素分析[J].中国小儿血液与肿瘤杂志,2016,21(4):211-215.
[5] 李红,蒋慧,朱嘉莳,等.CCCG-ALL 2005方案单中心10年随访研究[J].中国小儿血液与肿瘤杂志,2020,25(2):60-64.
[6] 林嘉乐,刘亢亢,储金华,等.急性淋巴细胞白血病儿童营养状况与医院感染相关性研究[J].中国实验血液学杂志,2020,28(3):767-774.
[7] 张之南,沈悌.血液病诊断及疗效标准(第三版)[M].北京:科学出版社,2008:116-121.
[8] Slany RK.The molecular mechanics of mixed lineage leukemia[J].Oncogene,2016,35(40):5215-5223.
[9] Cox MC,Panetta P,Venditti A,et al.Fluorescencein situhybridization and conventional cytogenetics for the diagnosis of 11q23+/MLL+translocation in leukaemia[J].Br JHaematol,2003,121(6):953-955.
[10] Dafflon C,Tiedt R,Schwaller J.Targeting multiple nodes ofMLLcomplexes to improve leukemia therapy[J].Oncotarget,2017,8(53):90614-90615.
[11] Forestier E,Schmiegelow K,Nordic Society of Paediatric Haematology and Oncology NOPHO.The incidence peaks of the childhood acute leukemias reflect specific cytogenetic aberrations[J].J Pediatr Hematol Oncol,2006,28(8):486-95.
[12] 弓晓媛,王迎,刘兵城,等.CD10阴性的前B急性淋巴细胞白血病的临床特征以及预后分析[J].中华血液学杂志,2017,38(1):17-21.
[13] 王彤,赵燕,张青青,等.成人AML伴MLL重排患者临床特征及预后影响因素探讨[J].中国实验血液学杂志,2020,28(3):775-780.
[14] Meyer C,Burmeister T,Gröger D,et al.TheMLLrecombinome of acute leukemias in 2017[J].Leukemia,2018,32(2):273-284.
[15] Mansur MB,Ford AM,Emerenciano M.The roleofRASmutations inMLLrearranged leukaemia:a path to intervention?[J].Biochim Biophys Acta Rev Cancer,2017,1868(2):521-526.
[16] Matsuo H,Yoshida K,Nakatani K,et al.Fusion partner-specific mutation profiles andKRASmutations as adverse prognostic factors inMLLrearranged AML[J].Blood Adv,2020,4(19):4623-4631.
[17] Tomizawa D,Tanaka S,Hasegawa D,et al.Evaluation of high-dose cytarabine in induction therapy for children withde novoacute myeloid leukemia:a study protocol of the japan children's cancer group multi-center seamless phaseⅡ-Ⅲrandomized trial(JPLSG AML-12)[J].Jpn J Clin Oncol,2018,48(6):587-593.
[18] Sun YN,Hu YX,Gao L,et al.The therapeutic efficacy of pediatric ALL patients withMLLgene rearrangement treated with CCLG-ALL2008 protocol[J].Eur Rev Med Pharmacol Sci,2018,22(18):6020-6029.
[19] 陈凯,蒋慧,陆正华,等.儿童急性髓系白血病(M4/M5亚型)临床疗效及预后因素分析[J].中华实用儿科临床杂志,2018,33(3):186-190.
[20] Cui L,Li ZG,Chai YH,et al.Outcome of children with newly diagnosed acutelymphoblastic leukemiatreated with CCLG-ALL 2008:thefirst nationwide prospective multicenter study in china[J].Am JHematol,2018,93(7):913-920.
[21] Dreyer ZE,Hilden JM,Jones TL,et al.Intensified chemotherapy without SCT in infant ALL:results from COG P9407(cohort 3)[J].Pediatr Blood Cancer,2015,62(3):419-426.
[22] Hunger SP,Mullighan CG.Acute lymphoblastic leukemiain children[J].N Engl JMed,2015,373(16):1541-52.
[23] Bolouri H,Farrar JE,Triche T,et al.The molecular landscape of pediatric acute myeloid leukemia reveals recurrent structural alterations and agespecific mutational interactions[J].Nat Med,2018,24(1):103-112.
[24] 王书春,陈晓娟,刘晓明,等.28例MLL阳性急性淋巴细胞白血病患儿的治疗转归[J].中国实验血液学杂志,2020,28(2):359-364.
[25] Britten O,Ragusa D,Tosi S,et al.MLL-rearranged acute leukemia with t(4;11)(q21;q23)-current treatment options.Is there a role for CAR-T cell therapy?[J].Cells,2019,8(11):1341.
[26] Balgobind BV,Raimondi SC,Harbott J,et al.Novel prognostic subgroups in childhood 11q23/MLL-rearranged acute myeloid leukemia:results of an international retrospective study[J].Blood,2009,114(12):2489-2496.
[27] Bai L,Cheng YF,Lu AD,et al.Prognosisof haploidentical hematopoietic stem cell transplantation in non-infant children with t(v;11q23)/MLL-rearranged B-cell acute lymphoblastic leukemia[J].Leuk Res,2020,91:106333.
[28] Kato M,Hasegawa D,Koh K,et al.Allogeneic haematopoietic stem cell transplantation for infant acute lymphoblastic leukaemia withKMT2A(MLL)rearrangements:a retrospective study from the paediatric acute lymphoblastic leukaemia working group of the japan society for haematopoietic cell transplantation[J].Br JHaematol,2015,168(4):564-570.
[29] Fagioli F,Quarello P,Zecca M,et al. Hematopoietic stem cell transplantation for children with high-risk acute lymphoblastic leukemia in first complete remission: a report from the AIEOP registry[J].Haematologica,2013,98(8):1273-1281.
[30] Terwilliger T,Abdul-Hay M.Acute lymphoblastic leukemia:a comprehensive review and 2017 update[J].Blood Cancer J,2017,7(6):e577.
[31] Chen Y,Kantarjian H,Pierce S,et al.Prognostic significance of 11q23 aberrations in adult acute myeloid leukemia and the role of allogeneic stem cell transplantation[J].Leukemia,2013,27(4):836-842.

