听神经瘤自然生长规律与症状演变的初步分析:56例患者回顾
姚俊吉,陈见清,谭皓月,汪照炎,2,张治华,2,吴 皓,2,贾 欢,2
1.上海交通大学医学院附属第九人民医院耳鼻咽喉头颈外科,上海 200011;2.上海交通大学医学院耳科学研究所,上海市耳鼻疾病转化医学重点实验室,上海 200125
听神经瘤,是起源于前庭神经鞘膜的良性肿瘤,占所有颅内肿瘤的6%,桥小脑角区肿瘤的85%[1]。听神经瘤的年发病率为10/100万~20/100万[2],且随着影像学技术的进步,发病率(检出率)呈逐年上升态势。听神经瘤的症状包括听力减退、耳鸣、眩晕、面部感觉减退、行走不稳等,严重者可危及生命。进入21世纪,听神经瘤治疗逐渐向面神经功能保留、听觉功能保留和听觉重建的方向发展。由于越来越多的小型听神经瘤(桥小脑角最大径<1.5 cm)被早期诊断,同时考虑到手术创伤对患者生活质量的影响,治疗策略和理念也在逐步从过去的单纯手术切除转变为现在的个体化治疗,如影像学随访、放射治疗(放疗)等[3]。而肿瘤的生长模式是个体化治疗的关键。根据国外大样本的研究[4-7]发现,并非所有的听神经瘤都持续生长,30%~60%的肿瘤会停止生长,约5%的肿瘤甚至会缩小。但国外这些研究大多基于小型听神经瘤,缺少大型听神经瘤的观察研究。近年来,国内小型听神经瘤的影像学随访、放疗等非手术治疗已占大多数[8],而部分大型听神经瘤(如年龄较大、唯一听力耳)也需要非手术治疗[9-10]。但因目前国内尚无听神经瘤生长模式的观察研究,不利于治疗方式的合理选择和及时调整。此外,听神经瘤的放疗效果也应该与肿瘤自然生长规律相比较。本研究旨在通过回顾性研究观察各型听神经瘤生长速度及临床表现,分析国内患者听神经瘤的自然生长规律,以期为听神经瘤的个体化治疗方案的合理选择提供更多的依据。
1 对象与方法
1.1 研究对象
收集2016年3月至2019年11月在上海交通大学医学院附属第九人民医院耳鼻咽喉头颈外科就诊及随访复诊的散发性听神经瘤的患者。纳入标准:有2次或2次以上的术前增强磁共振(MRI)检查结果,影像DICOM文件可收集,并且首末2次MRI检查间隔时间大于60 d。排除标准:神经纤维瘤病2型患者。本研究已得到所在单位伦理委员会批准(2018-69-T60)。
1.2 临床资料收集
回顾性收集患者就诊过程中的影像DICOM资料(增强MRI)、听力学资料(纯音听阈及言语识别率)、临床表现(听力下降、耳鸣、眩晕、面部疼痛或麻木)资料等。在不干预患者治疗策略的情况下,进行随访记录(即肿瘤较小或听力较好者主动采取观察随访策略,其他患者因个人原因被动进行定期影像学检查),随访期间不进行任何治疗。听力分级采用美国耳鼻咽喉头颈外科协会(American Academy of Otolaryngology-Head and Neck Surgery,AAO-HNS)分级标准:A级,纯音听阈≤30 dB,且言语识别率≥70%;B级,纯音听阈>30 dB且≤50 dB,且言语识别率≥50%;C级,纯音听阈>50 dB,且言语识别率≥50%;D级,言语识别率<50%。其中纯音听阈测定采取0.5、1、2、4 Hz骨导听阈的平均值,言语识别率采用普通话言语测听材料进行测试。
1.3 影像学评估
将患者影像学数字资料载入HorosTM软件(V3.3.6,https://horosproject.org),首先评估是否存在囊性变。随后,通过测量增强MRI水平位上内听道外桥小脑角最大径作为肿瘤大小指标,若该长度小于内听道内肿瘤长度或肿瘤仅限于内听道内,则以内听道内肿瘤长度作为肿瘤大小指标(同一患者2次影像学测量采用相同的方法)。肿瘤最大径均由高年资耳神经外科医师进行数字建模测量。本研究参考House分期及Samii分期[11-12],将患者分为4组,即内听道内型、小型听神经瘤(桥小脑角最大径≤10 mm)、中型听神经瘤(10 mm<桥小脑角最大径<20 mm)、中大型及大型听神经瘤(桥小脑角最大径≥20 mm)。肿瘤生长速度以单位时间内肿瘤最大径的变化表示:肿瘤年生长速度=(末次随访时肿瘤最大径-初始肿瘤最大径)/2次随访间隔天数×365,用mm/年(mm/a)表示。生长速度>2 mm/a判定为肿瘤生长,<-2 mm/a判定为缩小,介于两者之间判定为稳定[5]。
1.4 统计学分析
采用SPSS 20.0软件进行统计学分析,定量资料采用x±s表示,定性资料采用频数(百分比)表示。采用非参数检验(Kruskal-Wallis检验及Mann-Whitney检验)比较各年龄分组、肿瘤分级、初诊时各听力分级,不同性别组、不同患侧组、囊性变组与非囊性变组、有突聋组与无突聋组、耳鸣组与非耳鸣组、眩晕组与非眩晕组之间的差异。用Pearson相关性分析检验纯音听阈及言语识别率与肿瘤生长速度之间的关系。以P<0.05认为差异有统计学意义。
2 结果
2.1 患者一般情况
本研究共纳入56例患者,其中男性28例,女性28例;患侧位于左侧31例、右侧25例。初诊时平均年龄为(48.8±12.0)岁,最小23岁,最大71岁。初诊时肿瘤最大径为(15.9±9.6)mm,末次随访时肿瘤最大径为(18.7±10.4)mm,首末2次MRI的间隔时间为(266.3±313.5)d,平均生长速度为(4.4±4.7)mm/a。本研究中,8例为囊性变听神经瘤,其平均生长速度为(9.4±3.8)mm/a,显著高于其他48例非囊性变肿瘤[(3.6±4.4)mm/a,P=0.003]。随访期间,35例(62.5%)肿瘤生长,20例(35.7%)肿瘤稳定,1例(1.8%)肿瘤缩小。40例初诊时有可测听力(AAO-HNS听力分级A、B、C级)的患者中,16例(40.0%)维持原听力分级,5例(12.5%)听力分级好转,19例(47.5%)出现听力分级下降。患者随访过程中临床表现、听力结果及影像学变化如表1总结。

表1 听神经瘤患者临床表现及影像学的自然演变(平均间隔266.3 d,n=56)Tab 1 Natural evolution of clinical manifestations and imaging in the patientswith vestibular schwannoma(averageinterval of 266.3 d,n=56)
2.2 主动观察随访者与被动随访者的肿瘤及听力情况演变
本研究中17例患者因初诊时肿瘤较小或听力较好[13],主动采取观察随访策略(wait and scan),平均随访时间(248.1±149.3)d。初诊时肿瘤最大径为(8.8±3.8)mm;听力A级者3例、B级4例、C级4例、D级6例。肿瘤生长速度为(2.4±3.6)mm/a,其中7例(41.2%)肿瘤生长,10例(58.8%)肿瘤稳定。在有可测听力的11例患者中,6例(54.5%)维持原听力分级,3例(27.3%)出现听力分级好转(2例B到A,1例C到B),2例(18.2%)出现听力分级下降(1例A到B,1例C到D)。
其余39例患者初诊时肿瘤最大径为(19.1±9.7)mm,听力A级者4例、B级15例、C级10例、D级10例,因个人原因致手术等待时间为(274.2±364.3)d。肿瘤生长速度为(5.3±5.0)mm/a,其中28例(71.8%)肿瘤生长,10例(25.6%)肿瘤稳定,1例(2.6%)肿瘤缩小(为60岁女性)。在有可测听力的29例患者中,10例(34.5%)维持原听力分级,2例(6.9%)出现听力分级好转,17例(58.6%)出现听力分级下降。
2.3 肿瘤大小、临床症状与非囊性变肿瘤生长的关系
在48例非囊性变听神经瘤中,如图1所示为各型肿瘤的生长情况,其中22例内听道内型和小型肿瘤(≤10 mm)的生长速度较26例中型及以上肿瘤(>10 mm)显著缓慢[(2.1±3.6)mm/avs(4.8±4.7)mm/a,P=0.031]。各年龄段患者肿瘤的生长速度如图2所示,其中60岁及以上患者的肿瘤生长速度显著低于60岁以下的患者[(1.7±3.1)mm/avs(4.2±4.6)mm/a,P=0.040]。

图1 不同大小的非囊性变听神经瘤的生长速度Fig 1 Growth ratesof non-cystic acoustic neuromawith different sizes
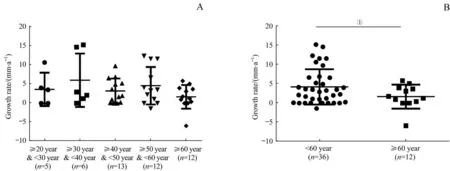
图2 不同年龄非囊性变听神经瘤患者的肿瘤生长速度Fig 2 Tumor growth ratesin the patientswith non-cystic acoustic neuroma of different ages
本组非囊性变肿瘤患者中,有突聋病史者与无突聋病史者间、有耳鸣病史者与无耳鸣者间、有眩晕病史者与无眩晕者间,初诊时不同听力分级患者间的肿瘤生长速度差异均无统计学意义(均P>0.05)。肿瘤生长速度与初诊时纯音听力测试结果(r=-0.121,P=0.235)及言语识别率(r=0.161,P=0.141)无相关性。其他临床因素如不同患侧、不同性别间的肿瘤生长速度差异也无统计学意义(均P>0.05,表2)。
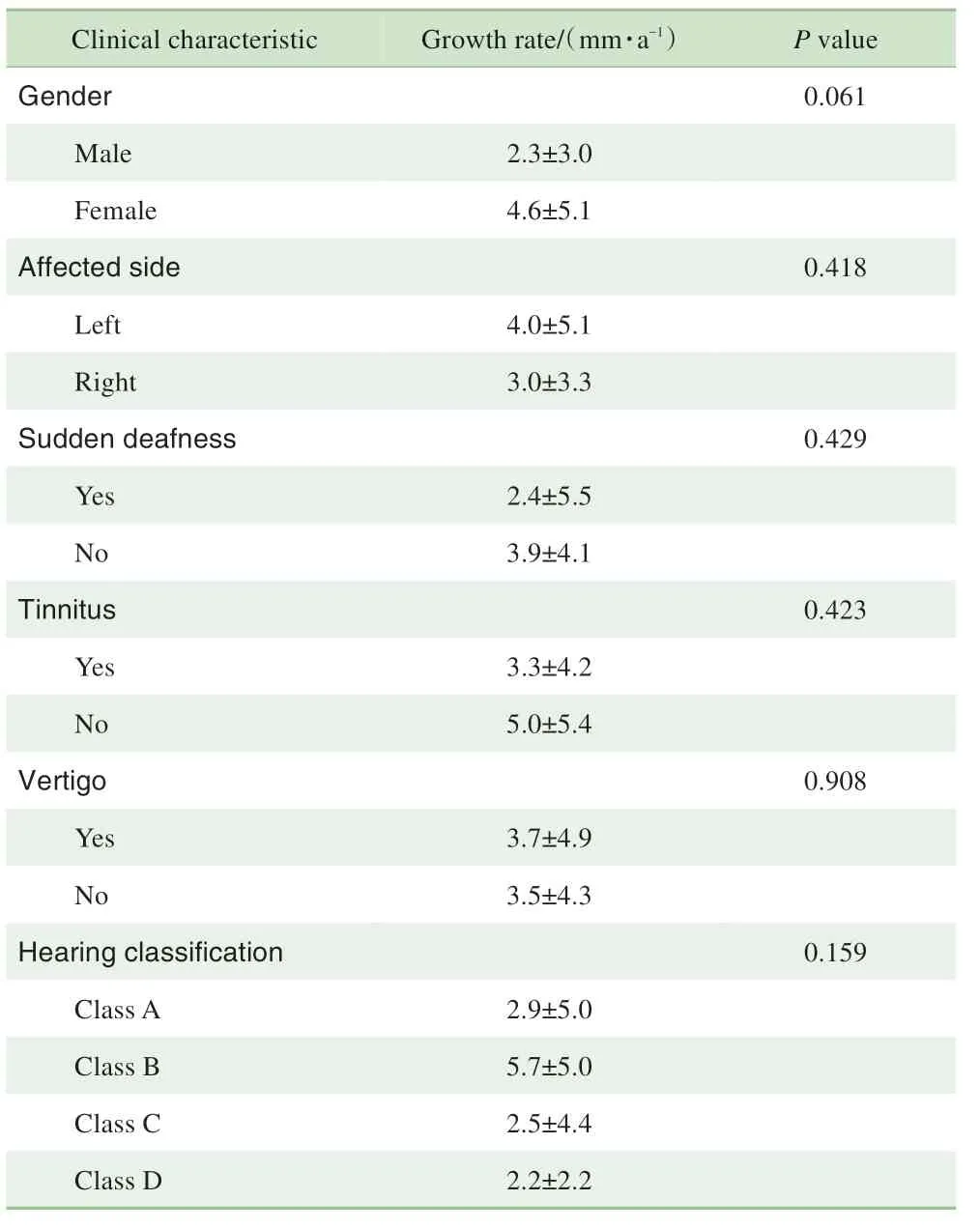
表2 不同临床特征非囊性变听神经瘤患者肿瘤生长速度的比较Tab 2 Comparison of tumor growth rates in the non-cystic acoustic neuroma patients with different clinical features
3 讨论
国内听神经瘤的治疗方式已与国际接轨,主要采用手术治疗、影像学随访观察、立体定向放疗等。虽然国外已有大量听神经瘤生长的观察性研究,但涉及大型听神经瘤及国内患者听神经瘤生长规律的数据资料仍然缺乏。考虑到散发性听神经瘤的自然生长规律对非手术治疗期间的决策改变有重要意义,且能有助于分析立体定向放疗的效果,本课题组开展了此次回顾性研究。
听神经瘤的囊性变意味着肿瘤有快速生长倾向[14]。国外文献[2,7,15]报道囊性变听神经瘤生长速度为(6.1±3.1)mm/a,而非囊性变肿瘤生长速度为2~3 mm/a。本研究病例中囊性变听神经瘤的生长速度亦显著高于非囊性变组,与国外人群的结果一致。本组病例的非囊性变肿瘤生长速度为(3.6±4.4)mm/a,略高于国外报道,可能因为部分初诊内听道内型及小型肿瘤患者确诊后失随访,导致无症状或轻症(多数生长慢)患者缺失,引起结果偏倚。若单纯考虑初诊后主动采取观察随访策略的患者,其肿瘤生长速度为(2.4±3.5)mm/a,与国外报道相近。而本研究的非囊性变肿瘤中,内听道内型及小型听神经瘤生长速度的确相对较慢,直径≥20 mm的听神经瘤生长速度快,与Fucci等[5]报道相符。
年龄与肿瘤生长速度的关系目前尚无定论。Sanna M团队的研究发现>40岁患者肿瘤生长速度要显著高于≤40岁的患者[7],而本研究发现≥60岁组的患者肿瘤生长相对较慢,但也有研究发现年龄与肿瘤生长速度无关[16]。因此这两者之间的关系需要结合肿瘤生物学特性进一步验证。
本研究中,是否有突聋、耳鸣、眩晕病史患者的肿瘤生长速度间无显著差异;初始听力情况与肿瘤生长速度无显著相关,这与Rosenberg等[17]和Jethanamest等[18]报道的结果相符,可能与听神经瘤生长模式多变有关,因此初诊时无法通过临床表现来预测听神经瘤的生长速度。
对于本研究中有可测听力的内听道内型及小型肿瘤患者,在平均8个月左右的随访期后近82%未出现听力下降,与国外文献报道[19]接近;而在有可测听力的中型及以上肿瘤患者中,仅41.4%患者能在相近时间段内未出现听力下降。其他研究[20-21]报道听神经瘤术后总体听力保留率在31%~35%,其中听力为AAO-HNSA级的小型听神经瘤患者,术后2~5年听力保留率相对较好(中等水平,>50%~75%),但10年后听力保留率有所下降(较低水平,>25%~50%);对于采取观察随访的听神经瘤患者,2年后听力保留率较高(较高水平,>75%~100%),但呈明显逐年下降的趋势,5年后听力保留率呈中等水平,10年后呈较低水平。本中心前期研究[22]表明,有可测听力的内听道内型及小型听神经瘤患者的术后听力保留率为60%,而本组同类患者的同期听力保留率近82%,因此对于该类患者可建议先观察随访,对其短期内维持原有生活质量有一定帮助。
金寨县红色旅游主要营销的重点放在新中国成立前该县红色旅游方面,例如各种红军旧址与名人故居,却不知还有一处六安红军邮局。六安红军邮局位于金寨县汤家汇镇老街上徐氏宗祠——赤城县邮政局遗址。在炮火硝烟中诞生的中华苏维埃赤色邮政六安红军邮局,印证着红军的足迹,是目前中国仅存两处的红军邮局之一,在中国邮政史上,是不可替代的宝贵文物。此处不仅安徽人知道的不多,即使在六安本地也鲜为人知,六安红军邮局可以与当地的文化产品结合,并在原有基础上加以创新,开发出具有特色的旅游产品。
本研究初步对国内听神经瘤患者的生长模式进行分析,研究例数和随访时间有一定局限性,进一步的长时间随访和大样本量研究能更好地完善上述结果。
综上所述,囊性听神经瘤生长较快,建议尽早进行手术切除。内听道内型及桥小脑角最大径≤10 mm或年龄60岁及以上的患者肿瘤一般生长较慢,可酌情采用影像学随访观察等方式,且短期听力下降的风险较小。本研究初步观察了中国人群听神经瘤短期自然生长规律,可为听神经瘤的个性化治疗、与立体定向放疗的结果作对比提供一定依据。
参·考·文·献
[1] Nikolopoulos TP,Fortnum H,O'Donoghue G,et al.Acoustic neuroma growth[J].Otol Neurotol,2010,31(3):478-485.
[2] Stangerup SE,Caye-Thomasen P,Tos M,et al.The natural history of vestibular schwannoma[J].Otol Neurotol,2006,27(4):547-552.
[3] Flickinger JC,Kondziolka D,Niranjan A,et al.Results of acoustic neuroma radiosurgery:an analysis of 5 years′experience using current methods[J].JNeurosurg,2001,94(1):1-6.
[4] Raut VV,Walsh RM,Bath AP,et al.Conservative management of vestibular schwannomas:second review of a prospective longitudinal study[J].Clin Otolaryngol Allied Sci,2004,29(5):505-514.
[5] Fucci MJ,Buchman CA,Brackmann DE,et al.Acoustic tumor growth:implicationsfor treatment choices[J].Am JOtol,1999,20(4):495-499.
[6] Bozorg Grayeli A,Kalamarides M,Ferrary E,et al. Conservative managementversussurgery for small vestibular schwannomas[J].Acta Otolaryngol,2005,125(10):1063-1068.
[7] Patnaik U,Prasad SC,Tutar H,et al.The long-term outcomes of wait-andscan and the role of radiotherapy in the management of vestibular schwannomas[J].Otol Neurotol,2015,36(4):638-646.
[8] 孙时斌,刘阿力,罗斌,等.伽玛刀治疗听神经鞘瘤的MRI随访及临床分析[J].中华放射学杂志,2004,38(10):1042-1046.
[9] 火子榕,张治华,黄琦,等.唯一听力耳听神经瘤患者人工耳蜗植入疗效分析[J].中华耳鼻咽喉头颈外科杂志,2016,51(6):408-413.
[10] Lassaletta L,Aristegui M,Medina M,et al.Ipsilateral cochlear implantation in patients with sporadic vestibular schwannoma in the only or best hearing ear and in patients with NF2[J].Eur Arch Otorhinolaryngol,2016,273(1):27-35.
[11] Hitselberger WE,House WF. Classification of acoustic neuromas:supplement to the monograph on transtemporal bone microsurgical removal of acoustic neuromas[J].Arch Otolaryngol,1966,84(3):245-246.
[12] Samii M,Matthies C.Management of 1 000 vestibular schwannomas(acoustic neuromas):surgical management and results with an emphasis on complications and how to avoid them[J].Neurosurgery,1997,40(1):11-21,discussion 21-23.
[13] 中华耳鼻咽喉头颈外科杂志编辑委员会,中华医学会耳鼻咽喉头颈外科学分会.听神经瘤诊断和治疗建议[J].中华耳鼻咽喉头颈外科杂志,2014,49(3):181-186.
[14] Huo ZR,Zhang ZH,Huang Q,et al.Clinical comparison of two subtypes of cystic vestibular schwannoma:surgical considerations and outcomes[J].Eur Arch Otorhinolaryngol,2016,273(12):4215-4223.
[15] Koos WT,Day JD,Matula C,et al.Neurotopographic considerations in the microsurgical treatment of small acoustic neurinomas[J].JNeurosurg,1998,88(3):506-512.
[16] Paldor I,Chen AS,Kaye AH.Growth rate of vestibular schwannoma[J].JClin Neurosci,2016,32:1-8.
[17] Rosenberg SI.Natural history of acoustic neuromas[J].Laryngoscope,2000,110(4):497-508.
[18] Jethanamest D,Rivera AM,Ji H,et al.Conservative management of vestibular schwannoma:predictors of growth and hearing[J].Laryngoscope,2015,125(9):2163-2168.
[19]Stangerup SE,Caye-Thomasen P.Epidemiology and natural history of vestibular schwannomas[J].Otolaryngol Clin North Am,2012,45(2):257-268,vii.
[20] Carlson ML,Vivas EX,McCracken DJ,et al.Congress of neurological surgeons systematic review and evidence-based guidelines on hearing preservation outcomes in patients with sporadic vestibular schwannomas[J].Neurosurgery,2018,82(2):E35-E39.
[21] Preet K,Ong V,Sheppard JP,et al.Postoperative hearing preservation in patients undergoing retrosigmoid craniotomy for resection of vestibular schwannomas:a systematic review of 2 034 patients[J].Neurosurgery,2020,86(3):332-342.
[22] Zhu WD,Chen HS,Jia H,et al.Long-term hearing preservation outcomes for small vestibular schwannomas:retrosigmoid removalversusobservation[J].Otol Neurotol,2018,39(2):e158-e165.

