细胞膜包被纳米颗粒的制备及其在抗菌中的应用
石亭旺,陈云丰
上海交通大学附属第六人民医院骨科,上海 200233
致病菌是一类高度复杂的微生物,携带着编码数百种蛋白质的复杂基因,其侵入人体可引起包括心内膜炎、脓肿甚至败血症在内的多种感染性疾病。几十年来,抗生素的广泛应用虽然极大地改善了感染的预后,但其通过多种途径导致了细菌耐药性的发展[1-2]。当前,多药耐药(multidrug resistance,MDR)菌已被证明与临床日益增多的致死性感染如脓毒症、细菌性脑膜炎等息息相关[1,3]。除了细菌本身的因素外,某些感染微环境复杂的病理生理特点也使得传统的治疗手段难以奏效。例如,慢性骨髓炎由于生物膜形成、血供破坏及清创术后死腔形成,抗菌药物对于感染部位的渗透有限[4-5];而中枢神经系统感染由于血脑屏障的存在,所有的大分子药物及98%的小分子药物不能到达靶部位[3]。因此,寻找一种全新并且安全有效的抗菌策略很有必要。
近年来,纳米颗粒(nanoparticle,NP)在感染性疾病的精确诊断和有效治疗中的潜力受到广泛关注[6-7]。然而,NP尤其是合成纳米颗粒一旦在体内应用,将不可避免地被免疫系统识别并清除,使其难以达到理想的治疗效果[8]。近年来,生物启发的“隐身”策略,即通过在NP表面涂覆一层细胞膜,提供了一种功能化纳米颗粒的方法。相关研究[8-10]表明,通过细胞膜包被技术,源细胞膜的相关功能如免疫逃避、主动靶向、炎症归巢等可被赋予纳米颗粒。细胞膜包被的 纳 米 颗 粒 (cell membrane-coated nanoparticle,CMCNP)具有良好的仿生特性及整合潜能,为解决抗生素耐药及复杂感染提供了思路。为了对相关研究提供依据,现将CMCNP的制备、表征及其在抗感染治疗中的研究进展作一综述。
1 CMCNP的制备
CMCNP是由细胞膜囊泡和纳米核心组成的“壳-核”结构(图1),其制备主要包括膜提取、核心纳米颗粒的制备及细胞膜的包被[11]。
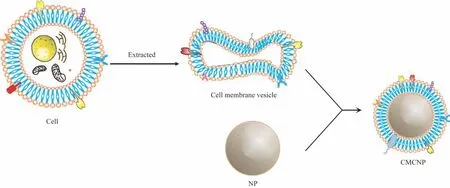
图1 CMCNP的结构示意Fig 1 Structural representation of CMCNP
1.1 细胞膜的提取
提取细胞膜的方法通常包括细胞裂解和膜纯化,其具体步骤依据细胞类型的不同而有差异[12]。
1.1.1 原核细胞膜的提取 对于无核细胞如红细胞和血小板,首先分别从全血和富血小板血浆(platelet rich plasma,PRP)中分离足量的红细胞和血小板,然后利用低渗处理或反复冻融法裂解细胞,最后通过离心去除细胞内的可溶性蛋白而获得细胞膜片段[13-14]。
与红细胞和血小板相比,细菌除了外围的细胞膜外,还被一层刚性的肽聚糖包裹,这对细菌膜的提取带来了困难。但是,某些革兰阴性菌在生理状态下能向外分泌细菌膜囊泡(outer membrane vesicle,OMV),而这些OMV可不经过细胞裂解而直接从细菌培养基滤液中收集[15]。除此之外,Wang等[16]报道了一种利用氮气空化获取革兰阴性细菌膜的方法,氮气空化可在细胞内形成急剧变化的机械力;该机械力可使细胞破裂,内容物(如蛋白质和遗传分子)释放,通过逐步离心去除蛋白质和核酸而最终收集到细菌双层膜(细菌膜-肽聚糖-外膜)囊泡(double-layered membrane vesicle,DMV)。Wang等[16]认为,氮气空化可使细菌受力快速而均匀,且在该过程中,细菌膜蛋白没有受到热或化学损伤,因此该方法可同时获得大量品质均一的OMV。
1.1.2 真核细胞膜的提取 真核生物如巨噬细胞和中性粒细胞,由于具有靶向细菌和感染微环境的能力,是功能化CMCNP外膜的重要来源。从真核细胞中提取细胞膜比原核细胞更加复杂[17-18]。首先源细胞可能不足以在体内分离后直接使用,因此需要进行富集和纯化。其次细胞裂解阶段除需要低渗处理外,还需要进行机械裂解,如超声、挤压、均质化处理,在膜的纯化阶段需用差速离心法去除细胞内成分[8]。
值得注意的是,不管是以何种方法提取细胞膜,都应该在尽量温和的环境中进行,以减少位于细胞膜上的蛋白质的变性。
1.2 核心NP的特性
纳米材料的极小粒径,往往使其具有某些独特的物理化学特性,如高表面积体积比、光/磁致产热(纳米粒子在激光/磁场作用下发生能级跃迁,释放热量)、光动力效应(在光的激发下产生活性氧)[19]。迄今为止,已有不同大小、形状、材质的NP被用于构建CMCNP,总体上可被分为有机NP和无机NP。有机NP主要包括聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]、大分子纳米明胶(supramolecular gelatin nanoparticle,SGNP)、脂质体、壳聚糖等,其可作为抗生素载体以延长药物的半衰期、改善药物的溶解度、减小不良反应以及实现靶向运输和控制性释放[6,8]。此外,由于许多无机NP如纳米金(AuNP)、纳米银(AgNP)、金银纳米笼(gold-silver nanocage,GSNC)本身具有抗菌效果或磁学、电学、光学特性,可作为体外磁调控以及光动力治疗、光热治疗的介质[5,7]。纳米材料在抗菌领域的应用,避免了大剂量使用抗生素而导致的细菌耐药和全身毒性,为抗感染治疗带来了新的曙光。
1.3 细胞膜包被技术
最常用的2种细胞膜包被技术是机械挤出和超声处理。前者通过外力将细胞膜和NP的混合物依次通过不同大小的孔径挤出,使得细胞膜囊泡围绕着纳米颗粒核心重建;虽然该法有效且稳定,但通过该法进行CMCNP的大规模制备依然具有挑战性[11-12]。在超声处理中,组成CMCNP的2种成分受到超声能量的影响,自发地组装成“壳-核”结构;该法制备的CMCNP不仅与物理挤压法制备的纳米粒子一致,通过对超声参数的调控,还可以提高涂覆效率,减少膜的用量[14]。此外,电穿孔法可通过电脉冲在细胞膜上产生多个瞬态空隙,使NP进入细胞膜,完成膜的涂覆[20]。
上述方法都是在预先合成纳米颗粒的基础上,将纳米核心作为模板进行细胞膜的涂覆。与此不同,Zhang等[21]提出了一种在囊泡内通过原位聚合形成NP内核继而完成细胞膜包被的策略。该策略确保了纳米核心被细胞膜完整地覆盖,同时细胞囊泡可作为控制聚合物核心最终尺寸的模板,使得合成的CMCNP具有均一性。
2 CMCNP在抗菌中的应用
自2011年Hu等[22]利用红细胞膜包被PLGA NP以增强其免疫相容性以来,许多细胞膜如巨噬细胞膜[5,23-24]、血 小 板 膜[9,25]、中 性 粒 细 胞 膜[6]、细 菌膜[15-16,26]甚至基因工程细胞膜[27]均被用于NP的功能化,以达到靶向感染、黏附毒素和细菌、增强宿主免疫等目的(图2)。
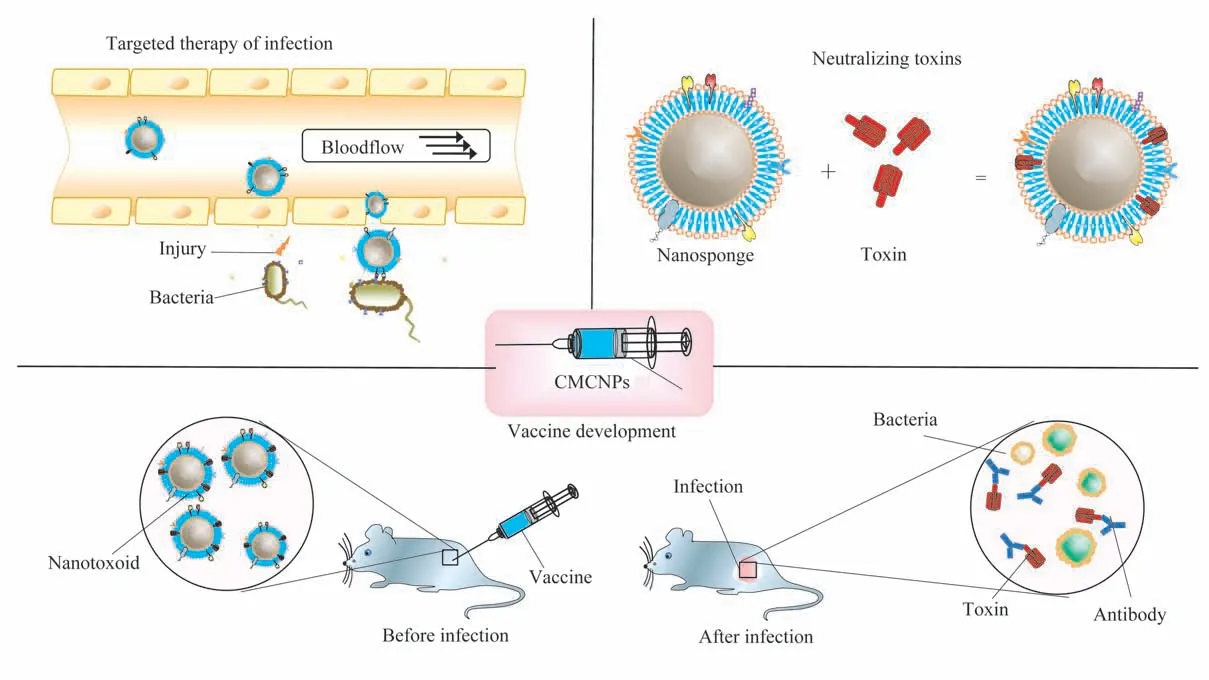
图2 CMCNP在抗感染中的应用Fig 2 Application of CMCNPto antimicrobial
2.1 靶向感染
2.1.1 靶向细菌 尽管致病机制不尽相同,但细菌与宿主细胞膜之间的特异性识别和交流是其侵入宿主、引起感染的必要条件[28-29]。因此CMCNP通过模拟源细胞膜的特性,不仅延长了NP在血液循环中的半衰期,还具备了与相关细菌特异性识别和结合的能力[12]。
作为循环系统哨兵和抗感染的第一道防线,巨噬细胞可通过细胞膜上的一系列受体如toll样受体与致病菌的病原体相关分子模式(pathogen-associated molecular pattern,PAMP)特异性识别并结合[30]。Wang等[5]利用金黄色葡萄球菌(金葡菌)预处理的巨噬细胞膜包被载抗生素GSNC,实现了对病原菌的特异性识别和精确杀灭;机会性细菌,包括几种葡萄球菌和链球菌,通过直接和间接黏附于血小板上进行组织定位和免疫逃逸。因此将天然血小板膜涂覆在NP的表面作为细菌诱饵可能是一种有前景的靶向策略[31]。Hu等[13]的研究表明,在相同的条件下,血小板包被的NP对于金葡菌的黏附能力是裸NP的12倍。此外,Li等[9]将血小板膜涂覆在螺旋形纳米马达的表面,借助纳米马达在低雷诺数环境中的强大推动力,血小板膜对于病原菌和毒素的靶向吸附得到显著增强。
当细菌进入机体并被宿主吞噬细胞(主要是中性粒细胞和巨噬细胞)吞噬,其中大多数能被这些免疫细胞杀灭,但是仍有部分细菌能在细胞内(尤其是巨噬细胞)长期存活[32-33]。这种细胞内寄生机制不仅可以保护细菌免受宿主防御和抗生素的影响,还使致病菌能通过劫持感染细胞作为“特洛伊木马”,造成慢性复发性感染[34-35]。因此,设计出一种能被巨噬细胞特异性吞噬的载药NP以达到细胞内靶向给药的目的可能是解决这一问题的关键。Gao等[26]将金葡菌菌膜囊泡包被在载抗生素的PLGA NP表面,使其获得免疫原性;当该颗粒被应用于机体时,极易被具有“免疫记忆”的感染巨噬细胞识别并吞噬,从而促使了抗生素的靶向传递。
2.1.2 靶向感染微环境 宿主细胞与病原菌之间的相互作用造就了特殊的感染微环境。在感染微环境中血管内皮通透性增大、pH降低、各种炎症因子及细菌酶广泛存在[36-37]。因此,设计NP使其能够特异性靶向或响应感染微环境,对于感染的治疗具有深刻的指导意义。
在感染环境中促炎因子(如TNF-α、IL-1β和IL-6)的作用下,中性粒细胞被活化并穿过血管内皮细胞到达感染部位,故活化的中性粒细胞可被设计为靶向药物载体,用于治疗与感染相关的疾病[38-39]。Wang等[6]基于细胞膜包被技术,设计了一种能够模拟活化的中性粒细胞并在感染微环境中积累的NP,实验证明:中性粒细胞膜仿生NP能够穿透气血屏障,有效治疗小鼠细菌性肺炎;除此之外,中性粒细胞膜能够显著延长治疗性NP的半衰期,降低抗生素对周围正常组织的毒性,显示出理想的抗菌效果。
在长期的抗肿瘤研究中,有学者发现生物大分子倾向于优先积聚在血管通透性增强的部位(如实体肿瘤组织),这一特性被称为高通透长滞留(enhanced permeability and retention,EPR)效应。有研究表明,EPR效应并不仅仅存在于实体肿瘤中,在感染、炎症等局部血管通透性增加时同样明显。Li等[40]报道了一种基于细胞膜修饰的明胶NP,该NP可通过EPR效应在感染部位聚集并释放万古霉素;实验表明,这种仿生颗粒具有极佳的抗菌效果,且能最小化抗菌药物的用量。
2.2 中和毒素
致病菌常常会导致危及生命的感染。革兰阳性细菌合成和释放成孔毒素(pore-forming toxin,PFT),革兰阴性细菌释放内毒素是其重要的致病机制。成孔毒素能够与细胞膜自发融合,形成一个七聚体结构,导致细胞内容物渗出、细胞裂解;而内毒素血症会导致脓毒症、休克、弥散性血管内凝血甚至死亡[24,41]。已有研究证明抑制细菌毒素能极大缓解感染相关的中毒症状、改善预后,但是传统的解毒策略依赖于抗原抗体特异性结合,一种抗体仅针对某种单一抗原,且需要对毒素结构和致病菌种类进行鉴定,给临床应用带来诸多不便。
2.2.1 PFT的中和 目前,已有超过80个家族的PFT被鉴定,尽管分子结构和抗原表位不尽相同,但其共同的致病机制(靶向细胞膜、使细胞裂解)却为设计广泛适用的解毒平台提供了线索。Rao等[29]采用共挤出法制备了以PLGA为核心、红细胞膜为外壳的“纳米海绵”。体内外实验证明,这种独特的壳-核结构作为毒素诱饵能够高效地吸附PFT,使其偏离预定目。Thamphiwatana等[42]的研究证实用相同策略合成的“纳米海绵”可有效中和链球菌衍生的毒素,消除对靶细胞的毒性作用。Pang等[27]利用基因工程获得了针对α-溶血素的单克隆抗体质粒,然后将其转染到细胞中,以使细胞表面表达相关抗体,利用基因工程细胞膜制备的NP能够有效地中和α-毒素。以上结果说明纳米海绵是一种通用、高效且容易整合的解毒平台。
2.2.2 内毒素的中和 内毒素血症是由于宿主对细菌内毒素(也称为脂多糖、LPS)反应失调而引起的一种严重疾病。哺乳动物免疫系统过度激活会导致全身性炎症反应综合征(systemic inflammatory response syndrome,SIRS),包括脓毒症、休克、弥漫性血管内凝血(disseminated intravascular coagulation,DIC)和多器官功能衰竭(multipleorgan failure,MOF)[24],而有效的内毒素清除是内毒素血症治疗的关键。虽然所有的内毒素都有共同的分子骨架,但对于不同种属的细菌其结构单元有很大的差异[42],因此“纳米海绵”的通用性对开发用于中和内毒素的仿生NP具有重要的借鉴意义。由于存在CD14、TLR-4受体,巨噬细胞膜对LPS具有高亲和力,巨噬细胞膜源性NP能够作为诱饵对LPS进行捕获从而阻断免疫应答。Shen等[24]利用带正电的氧化铁核心和巨噬细胞膜合成了可用于捕获内毒素的NP;氧化铁不仅稳定了巨噬细胞膜外壳,还增强了NP对带负电LPS的吸附作用;在内毒素小鼠模型中,该纳米诱饵显著降低了LPS的毒性,降低了死亡率。Thamphiwatana等[42]认为,巨噬细胞膜除了作为纳米诱饵与LPS结合,还可吸附多种炎性细胞因子,从而抑制病理性“细胞因子风暴”的形成。
2.3 疫苗开发
在应对抗生素耐药性的替代策略中,抗菌疫苗的开发一直备受关注。因为疫苗接种本质上是通过免疫训练使机体及早发现并解除细菌感染的特定机制,而并不对细菌施加直接的选择压力,所以一般不会导致耐药的发生[43]。出于安全原因,抗毒力疫苗一般来源于类毒素或通过化学方法及热处理的病原体,但是这种灭活方法会破坏蛋白质的三级结构,导致抗原表位的改变和免疫原性降低[11,29]。为了均衡安全性和有效性,亟待开发一种能够安全高效地呈递细菌毒素抗原表位的疫苗平台。如前所述,仿生NP的细胞膜涂层能够高效紧密地吸附细菌毒素。相关研究[43]也已证明,由此形成的纳米类毒素能够安全地以其自然形式传递细菌抗原表位,而不需要经过变性和亚基形式的改造。
2.3.1 单价疫苗 通过将目标毒素与“纳米海绵”混合孵育,毒素能紧密锚定于红细胞膜上,由此即可获得用于免疫目标细菌的纳米类毒素制剂。进一步研究[44]显示,纳米类毒素的NP形态能促进其自身被巨噬细胞内吞,随后经过一系列反应,类毒素上的抗原表位被呈递并被用于激活宿主免疫反应。Wang等[43]在利用纳米类毒素免疫耐甲氧西林金黄色葡萄球菌(methicillinresistantStaphylococcus aureus,MRSA)的研究中发现,纳米类毒素能有效地促进动物生发中心的形成,且能在无佐剂的环境中激发强大的体液免疫,显著减弱了MRSA对于宿主的定植和侵入能力。
2.3.2 多价疫苗 细菌通常分泌大量毒素,因此对单一毒力因子的免疫不足以防止细菌感染的发生[11]。为了制备具有多重免疫功能的“多价疫苗”,通过将红细胞“纳米海绵”与细菌培养上清液中提取的粗蛋白片段孵育,可使NP能够捕获任何原位存在的膜攻击毒素,由此形成的多价类毒素疫苗,可在机体产生针对多种毒力因子的抗体,显著降低致病菌的存活机会和致病能力[45]。另外,细菌膜具有强大的免疫原性,在细菌入侵过程中,机体通过免疫细胞上的受体识别细菌膜抗原而激活免疫系统,这一现象激发了基于细菌膜的多价疫苗的开发[11]。Wang等[16]利用铜绿假单胞菌膜制备的疫苗免疫小鼠,先天性和适应性免疫反应显著增强,其存活率也大大提升。
3 结语
由于CMCNP忠实地保留了细胞膜的复杂特性,其表现出源细胞所具有的广泛功能。CMCNP的功能多样性显著促进了靶向感染、中和毒素和疫苗开发等抗菌策略的发展。总的来说,细胞膜涂层技术的成功主要归功于2个方面。首先,直接利用整个细胞膜作为涂层极大地简化了纳米粒子功能化的方法。第二,与传统的化学修饰相比,细胞膜包被技术大大提高了NP在体液中的稳定性及其与生物环境交流、作用的能力。尽管这一策略取得了一定的成功,但仍有一些问题需要解决。首先,实验室研究和临床应用之间存在着巨大的差距,需要对CMCNP的生物学特性进行全面的研究,并进行进一步的临床试验以验证其安全性和有效性。第二,许多细胞的来源不足、细胞膜包被技术效率不高,大规模生产面临挑战。第三,某些NP由于复杂的表面特性,可能难以与细胞膜兼容,其功能化仍然面临挑战。
除抗菌外,CMCNP被更多地应用于抗肿瘤治疗。研究表明,细菌感染与肿瘤具有某些相似的病理生理特性,而这些特性可能是CMCNP发挥作用的基础。例如:感染局部血管内皮通透性增大,其与肿瘤组织呈现出相同的的EPR效应,有利于CMCNP的富集;细菌与肿瘤细胞均与免疫系统尤其是免疫细胞存在复杂而广泛的相互作用,这为CMCNP的靶向治疗提供了理论依据。但是,当机体面临复杂感染,如中枢神经系统感染、生物膜感染,CMCNP可能无法通过体液循环完成类似于在肿瘤组织中的积聚。因此,结合不同感染的病理生理特点,比较并运用不同的抗感染策略(表1),筛选具有更好生物相容性、更高特异性和更广泛应用前景的细胞膜包被NP,将有助于其在抗菌领域的进一步应用。

表1 不同的抗感染策略中CMCNP特性的比较Tab 1 Comparison of characteristicsof CMCNPin different anti-infection strategies
参·考·文·献
[1] Mi G,Shi D,Wang M,et al.Reducing bacterial infections and biofilm formation using nanoparticles and nanostructured antibacterial surfaces[J].Adv Healthc Mater,2018,7(13):e1800103.
[2] Hemeg HA.Nanomaterials for alternative antibacterial therapy[J].Int J Nanomedicine,2017,12:8211-8225.
[3] Rizvi SMD,Hussain T,Ahmed ABF,et al.Gold nanoparticles:a plausible tool to combat neurological bacterial infections in humans[J].Biomed Pharmacother,2018,107:7-18.
[4] Ford CA,Cassat JE.Advances in the local and targeted delivery of antiinfective agents for management of osteomyelitis[J].Expert Rev Anti Infect Ther,2017,15(9):851-860.
[5] Wang C,Wang YL,Zhang LL,et al.Pretreated macrophage-membranecoated gold nanocages for precise drug delivery for treatment of bacterial infections[J].Adv Mater,2018,30(46):e1804023.
[6] Wang KY,Lei YT,Xia DL,et al.Neutrophil membranes coated,antibiotic agent loaded nanoparticles targeting to the lung inflammation[J].Colloids Surfaces B:Biointerfaces,2020,188:110755.
[7] Fulaz S,Vitale S,Quinn L,et al.Nanoparticle-biofilm interactions:the role of the EPSmatrix[J].Trends Microbiol,2019,27(11):915-926.
[8] Zou SJ,Wang BL,Wang C,et al.Cell membrane-coated nanoparticles:research advances[J].Nanomedicine(Lond),2020,15(6):625-641.
[9] Li JX,Angsantikul P,Liu WJ,et al.Biomimetic platelet-camouflaged nanorobots for binding and isolation of biological threats[J].Adv Mater,2018,30(2).DOI:10.1002/adma.201704800.
[10] Esteban-Fernández deÁvila B,Angsantikul P,Ramírez-Herrera DE,et al.Hybrid biomembrane-functionalized nanorobots for concurrent removal of pathogenic bacteriaand toxins[J].Sci Robot,2018,3(18):eaat0485.
[11] Qin M,Du GS,Sun X.Biomimetic cell-derived nanocarriers for modulating immuneresponses[J].Biomater Sci,2020,8(2):530-543.
[12] Choi B,Park W,Park SB,et al.Recent trends in cell membrane-cloaked nanoparticles for therapeutic applications[J].Methods,2020,177:2-14.
[13] Hu CM,Fang RH,Wang KC,et al.Nanoparticle biointerfacing by platelet membrane cloaking[J].Nature,2015,526(7571):118-121.
[14] Copp JA,Fang RH,Luk BT,et al.Clearance of pathological antibodies using biomimetic nanoparticles[J].PNAS,2014,111(37):13481-13486.
[15] Gao W,Fang RH,Thamphiwatana S,et al.Modulating antibacterial immunityviabacterial membrane-coated nanoparticles[J].Nano Lett,2015,15(2):1403-1409.
[16] Wang S,Gao J,Li M,et al.A facile approach for development of a vaccine made of bacterial double-layered membrane vesicles (DMVs)[J].Biomaterials,2018,187:28-38.
[17] Cao HQ,Dan ZL,He XY,et al. Liposomes coated with isolated macrophage membrane can target lung metastasis of breast cancer[J].ACS Nano,2016,10(8):7738-7748.
[18] Gao C,Lin Z,Jurado-Sánchez B,et al.Stem cell membrane-coated nanogels for highly efficientin vivotumor targeted drug delivery[J].Small,2016,12(30):4056-4062.
[19] Ai X,Hu M,Wang Z,et al.Recent advances of membrane-cloaked nanoplatforms for biomedical applications[J].Bioconjug Chem,2018,29(4):838-851.
[20] Rao L,Cai B,Bu LL,et al.Microfluidic electroporation-facilitated synthesis of erythrocytemembrane-coated magnetic nanoparticles for enhanced imagingguided cancer therapy[J].ACSNano,2017,11(4):3496-3505.
[21] Zhang J,Gao W,Fang RH,et al.Synthesis of nanogels via cell membranetemplated polymerization[J].Small,2015,11(34):4309-4313.
[22] Hu CM,Zhang L,Aryal S,et al.Erythrocyte membrane-camouflaged polymeric nanoparticles as a biomimetic delivery platform[J].PNAS,2011,108(27):10980-10985.
[23] Wei XL,Ran DN,Campeau A,et al.Multiantigenic nanotoxoids for antivirulence vaccination against antibiotic-resistant gram-negative bacteria[J].Nano Lett,2019,19(7):4760-4769.
[24] Shen S,Han F,Yuan AR,et al.Engineered nanoparticles disguised as macrophages for trapping lipopolysaccharide and preventing endotoxemia[J].Biomaterials,2019,189:60-68.
[25] Dehaini D,Wei XL,Fang RH,et al.Erythrocyte-platelet hybrid membrane coating for enhanced nanoparticle functionalization[J].Adv Mater,2017,29(16):1606209.
[26] Gao F,Xu LL,Yang BQ,et al.Kill the real with the fake:eliminate intracellularStaphylococcus aureususing nanoparticle coated with its extracellular vesicle membrane as active-targeting drug carrier[J].ACS Infect Dis,2019,5(2):218-227.
[27] Pang X,Liu X,Cheng Y,et al.Sono-immunotherapeutic nanocapturer to combat multidrug-resistant bacterial infections[J].Adv Mater,2019,31(35):e1902530.
[28] Lin LC,Chattopadhyay S,Lin JC,et al.Advances and opportunities in nanoparticle-and nanomaterial-based vaccines against bacterial infections[J].Adv Healthc Mater,2018,7(13):e1701395.
[29] Rao L,Tian R,Chen XY.Cell-membrane-mimicking nanodecoys against infectious diseases[J].ACSNano,2020,14(3):2569-2574.
[30] Kawai T,Akira S.Toll-like receptors and their crosstalk with other innate receptors in infection and immunity[J].Immunity,2011,34(5):637-650.
[31] Fitzgerald JR,Foster TJ,Cox D.The interaction of bacterial pathogens with platelets[J].Nat Rev Microbiol,2006,4(6):445-457.
[32] Spaan AN,Surewaard BG,Nijland R,et al.Neutrophilsversus Staphylococcus aureus:abiological tug of war[J].Annu Rev Microbiol,2013,67:629-650.
[33] Garzoni C,Kelley WL.Return of the Trojan horse:intracellular phenotype switching and immune evasion byStaphylococcus aureus[J].EMBO Mol Med,2011,3(3):115-117.
[34] Lehar SM,Pillow T,Xu M,et al.Novel antibody-antibiotic conjugate eliminates intracellular S.aureus[J].Nature,2015,527(7578):323-328.
[35] Thwaites GE,Gant V.Are bloodstream leukocytes Trojan Horses for the metastasis ofStaphylococcusaureus?[J].Nat Rev Microbiol,2011,9(3):215-222.
[36] Dong XY,Zhang CY,Gao J,et al.Targeting of nanotherapeutics to infection sites for antimicrobial therapy[J].Adv Ther,2019,2(11):1900095.
[37]Azzopardi EA,Ferguson EL,Thomas DW.The enhanced permeability retention effect:a new paradigm for drug targeting in infection[J].J Antimicrob Chemother,2013,68(2):257-274.
[38] Zhang CY,Gao J,Wang ZJ.Bioresponsive nanoparticles targeted to infectious microenvironments for sepsis management[J].Adv Mater,2018,30(43):e1803618.
[39] Chu D,Dong X,Shi X,et al.Neutrophil-based drug delivery systems[J].Adv Mater,2018,30(22):e1706245.
[40] Li LL,Xu JH,Qi GB,et al.Core-shell supramolecular gelatin nanoparticles for adaptive and“on-demand”antibiotic delivery[J].ACSNano,2014,8(5):4975-4983.
[41] Yan HZ,Shao D,Lao YH,et al.Engineering cell membrane-based nanotherapeutics to target inflammation[J].Adv Sci(Weinh),2019,6(15):1900605.
[42] Thamphiwatana S,Angsantikul P,Escajadillo T,et al.Macrophage-like nanoparticles concurrently absorbing endotoxins and proinflammatory cytokines for sepsis management[J].Proc Natl Acad Sci USA,2017,114(43):11488-11493.
[43] Wang F,Fang RH,Luk BT,et al.Nanoparticle-based antivirulence vaccine for the management of methicillin-resistantStaphylococcus aureusskin infection[J].Adv Funct Mater,2016,26(10):1628-1635.
[44] Hu CM,Fang RH,Luk BT,et al.Nanoparticle-detained toxins for safe and effectivevaccination[J].Nat Nanotechnol,2013,8(12):933-938.
[45] Wei XL,Gao J,Wang F,et al.In situcapture of bacterial toxins for antivirulence vaccination[J].Adv Mater,2017,29(33):1701644.

