miR-877-3p对骨质疏松症小鼠骨髓间充质干细胞增殖能力的影响
童 徐,舒林径
1.重庆医科大学附属口腔医院修复科,重庆 401147;2.口腔疾病与生物医学重庆市重点实验室,重庆 401147;3.重庆市高校市级口腔生物医学工程重点实验室,重庆 401147;4.重庆医科大学附属口腔医院种植科,重庆 401147
骨质疏松症是以骨质丧失及骨破坏为特点的一类全身性疾病,严重影响人们的生活质量。该疾病与雌激素缺乏相关,尤其以绝经后女性高发[1]。骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)是存在骨髓中的多潜能干细胞,其能够分化为成骨细胞、成软骨细胞、成脂细胞等[2-4]。因此,BMSCs在维持骨平衡稳态、维护骨健康中发挥重要作用[5]。BMSCs生物学特性的改变会打破骨平衡稳态,从而导致骨质疏松症的发生[6]。然而,其具体机制仍不明确。微小RNA(microRNA,miRNA)能够调控多种细胞的增殖、分化、凋亡,受到研究人员的关注[7-9]。细胞内miRNA表达的变化会导致细胞生物学特性的改变,从而导致疾病的发生。研究[10]发现,miR-877-3p能够促进细胞的分化;但尚无研究指出miR-877-3p能够调控BMSCs的增殖能力。本实验旨在研究绝经后骨质疏松症发生、发展过程中,雌激素的减少是否影响miR-877-3p的变化,并调控BMSCs的增殖能力。
1 材料与方法
1.1 材料
1.1.1 动物 8周健康雌性WT C57BL/6J小鼠,购于重庆医科大学实验动物中心。动物生产许可证号为SCXK(渝)2018-0003,使用许可证号为SYXK(渝)2018-0003。将小鼠在SPF级动物房饲养,自由饮水及采食。所有动物实验经重庆医科大学附属口腔医院伦理委员会批准[2020年伦审(067)号]。
1.1.2 主要试剂及设备 胎牛血清(fetal bovine serum,FBS)(天杭生物,中国);α-MEM培养基(Gibco,美国);实时荧光PCR(real-time PCR)试剂盒、RNA提取试剂盒(TaKaRa,日本);茜素红、胰蛋白酶(Sigma,美国);CKK-8试剂盒(Invitrogen,美国);成脂诱导试剂、成骨诱导试剂(百恩维,中国);siPORTTM转染剂(Ambion,美国);miR-877-3p冻干粉(锐博,中国);micro-CT检测仪(西门子,德国)。
1.2 实验方法
1.2.1 骨质疏松模型及假手术模型建立 手术在10 g/L戊巴比妥钠麻醉下进行。将40只小鼠随机分为卵巢摘除术后骨质疏松症组(OVX组,n=20)和假手术组(Sham组,n=20)。OVX组小鼠切除双侧卵巢,Sham组切除卵巢附近部分脂肪,分层缝合肌肉和皮肤层。
1.2.2 血清雌激素水平及骨参数检测 术后8周,小鼠头部及眶周消毒后眼球取血,离心取血清,用酶联免疫试剂盒测定血清雌激素水平。术后2个月,脱颈处死2组小鼠,多聚甲醛固定小鼠股骨48 h;micro-CT扫描检测2组小鼠骨参数,包括骨体积分数(bone volume fraction,BVF)、骨小梁数量(trabecular number,Tb.N)及骨密度(bone mineral density,BMD)。
1.2.3 BMSCs培养及表型鉴定 取Sham组及OVX组小鼠股骨,在超净台内冰袋上去尽肌肉与筋膜,剪刀剪去股骨两端。注射器插入髓腔,将骨髓冲出,剪碎吹均成单细胞悬液,加入含FBS的α-MEM培养液,于37℃培养箱中常规培养。取状态较好的P3代BMSCs消化,用含3%FBS的PBS清洗后重悬,分别加入Sca-1、CD90、CD45、CD34抗体,4℃避光1 h,离心,弃上清液,用含3%FBS的磷酸盐缓冲液(phosphate buffer solution,PBS)清洗,重悬,流式细胞仪检测细胞表面抗原表达率。
1.2.4 BMSCs成骨诱导及观察
(1)茜素红染色观察 取P3代细胞,按照2×105个/孔密度接种于6孔板中,随后加入成骨诱导液培养,每3 d换液。培养21 d后,PBS清洗,多聚甲醛固定,PBS轻轻冲洗,去除多聚甲醛。茜素红染液染色,显微镜下拍照观察,利用分光光度仪检测吸光度[D(520 nm)]。
(2)碱 性 磷 酸 酶(alkaline phosphatase,ALP)染色 取P3代细胞,按照2×105个/孔密度接种于6孔板中,随后加入成骨诱导液培养,每3 d换液,培养7 d。PBS清洗,多聚甲醛固定,依照ALP检测试剂盒说明进行ALP染色,拍照观察,检测吸光度[D(520 nm)]。
1.2.5 BMSCs成脂诱导及观察 取P3代细胞,按照2×105个/孔的密度接种于6孔板中,加入成脂诱导液培养,每3 d换液。培养14 d后,PBS清洗,多聚甲醛固定,再用PBS轻轻冲洗,去除多聚甲醛。油红O染色,显微镜下拍照观察,利用分光光度仪检测吸光度[D(520 nm)]。
1.2.6PPARγ2和Runx2基因检测 将OVX组和Sham组P3代BMSCs进行成脂基因PPARγ2与成骨基因Runx2检测。提取2组细胞RNA,按照试剂盒说明进行反转录及合成cDNA,real-time PCR检测。PPARγ2上游引物为5′-GGGTCAGCTCTTGTGAATGG-3′,下游引物为5′-CTGATGCACTGCCTATGAGC-3′;Runx2上游引物为5′-TTCTCCAACCCACGAATGCAC-3′,下游引物为5′-CAGGTACGTGTGGTAGTGAGT-3′;Gapdh上游引物为5′-GACTTCAACAGCAACTCCCAC-3′,下游引物为5′-TCCACCACCCTGTTGCTGTA-3′。
1.2.7 BMSCs增殖能力检测
(1)CCK-8法 将P3代BMSCs按照4×103个/孔的密度接种于96孔板,连续7 d每日定时检测细胞增殖能力。每孔滴入10μL CCK-8液,置于37℃培养箱中2 h,取出后用酶联免疫检测机测量吸光度[D(490 nm)]。
(2)细胞计数法 将P3代BMSCs按照4×103个/孔的密度接种于96孔板,连续7 d每日定时对细胞进行计数。
1.2.8 miR-877-3p表达检测 收集OVX组和Sham组P3代BMSCs,PBS清洗,参照试剂盒说明书提取总RNA及反转录合成cDNA。miR-877-3p上游引物为5′-UGUCCUCUUCUCCCUCCUCCCA-3′,下游引物为5′-UGGGAGGAGGGAGAAGAGGACA-3′;内参U6上游引物为5′-CTCGCTTCGGCAGCACATATACT-3′,下游引物为5′-ACGCTTCACGAATTTGCGTGTC-3′。具体反应条件及体系参照产品说明。
1.2.9 miR-877-3p转染及BMSCs增殖能力检测 取P3代BMSCs,以4×103个/孔的密度接种于96孔板,待BMSCs贴壁,按照miRNA转染试剂盒说明书将miR-877-3p mimics(miR-877-3p过表达组)、miR-877-3p inhibitor(miR-877-3p抑制组)、空白对照试剂control(对照组)进行BMSCs转染。步骤如下:用50μL不含血清的培养基稀释1μL转染试剂siPORTTM,轻轻混匀并室温孵育5 min;用50μL不含血清培养基分别稀释0.5μL(20µmol) 的miR-877-3p mimics、miR-877-3p inhibitor、control存储液,轻轻混匀,室温孵育5 min;将稀释后的转染试剂siPORTTM与稀释后的miR-877-3p mimics、inhibitor、control轻轻混匀,静置后分别加入含有BMSCs的96孔板,置于37℃的5%CO2培养箱中培养。分别采用CCK-8法和细胞计数法检测BMSCs的增殖能力。
1.3 统计学分析
采用SPSS12.0软件进行统计学分析。定量资料用x±s表示,2组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 BMSCs鉴定
细胞表面抗原流式检测结果显示,间充质来源干细胞表面标志物Sca-1和CD90表达率分别为88.4%和90.3%,而非间充质来源干细胞表面标志物CD45和CD34的表达率分别为4.9%和0.3%(图1)。

图1 BMSCs流式细胞鉴定Fig 1 Flow cytometry analysis of BMSCs
2.2 血清雌激素水平的比较
术后8周,Sham组血清雌激素水平为(32.49±3.17)pg/mL,显著高于OVX组的(8.89±1.13)pg/mL,差异具有统计学意义(P=0.002)。
2.3 骨参数的比较
术后2个月,micro-CT骨参数检测结果(图2)显示,Sham组BVF、Tb.N、BMD均明显高于OVX组,差异均有统计学意义(均P<0.05)。

图2 2组小鼠股骨micro-CT影像学表现及骨参数比较Fig 2 Comparison of micro-CT imaging features of femurs and boneparameters between thetwo groups
2.4 BMSCs成骨分化及成脂分化鉴定
BMSCs经过成骨诱导液培养7 d后,ALP染色(图3A)及定量检测(图3B)结果显示,OVX组ALP活性低于Sham组(P=0.004)。BMSCs经过成骨诱导液培养21 d后,经茜素红染色,显微镜下可见橘红色钙盐沉淀,Sham组橘红色钙化结节多于OVX组(图3C);定量检测结果(图3D)显示Sham组吸光度明显高于OVX组(P=0.005)。
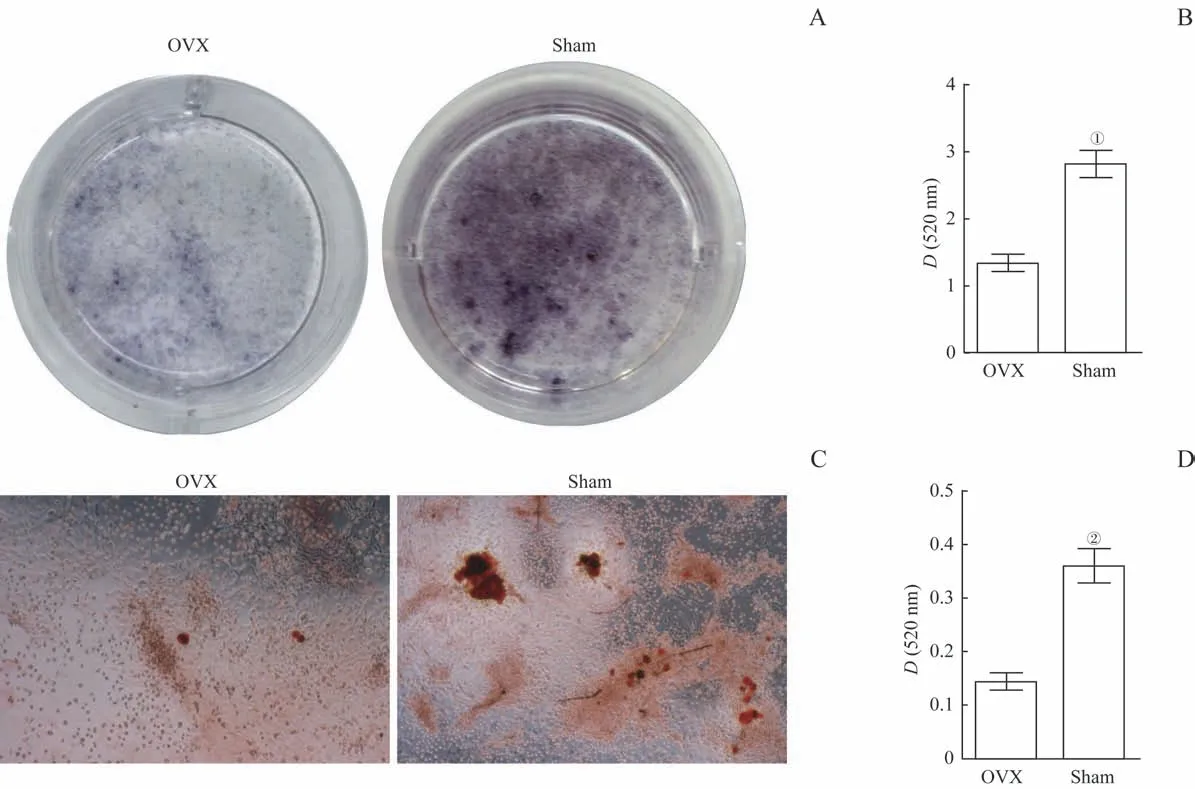
图3 2组BMSCs成骨能力比较Fig 3 Comparison of osteogenic ability of BMSCs between thetwo groups
BMSCs成脂诱导14 d后,经油红O染色,显微镜下可见成串脂滴(图4A)。定量检测结果(图4B)显示,OVX组吸光度明显高于Sham组(P=0.042)。
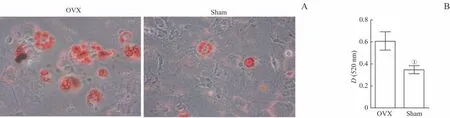
图4 2组BMSCs成脂能力比较Fig 4 Comparison of adipogenic ability of BMSCsbetween the two groups
Real-time PCR检测结果(图5)显示,OVX组BMSCs成骨基因Runx2的相对表达量低于Sham组,OVX组BMSCs成脂基因PPARγ2的相对表达量高于Sham组,差异均有统计学意义(均P<0.05)。
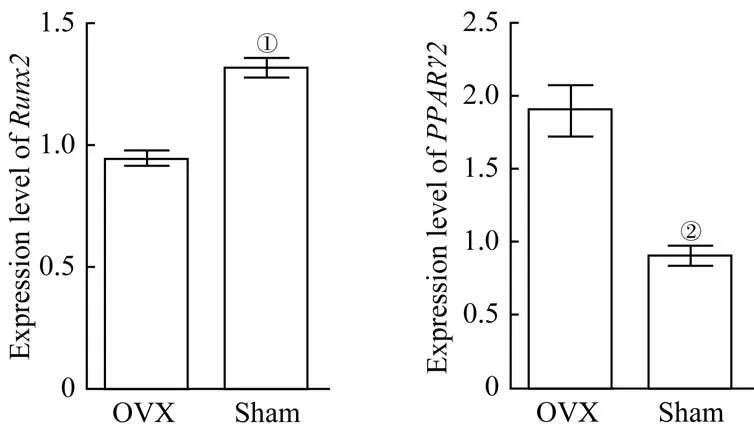
图5 2组小鼠BMSCs Runx2 and PPARγ2表达量比较Fig 5 Comparison of expression levels of Runx2 and PPARγ2 in BMSCs between thetwo groups
2.5 2组BMSCs增殖能力比较
连续7 d采用CCK-8法检测2组BMSCs的增殖能力,结果(图6A)显示,Sham组BMSCs与OVX组BMSCs增殖能力从第4日开始逐步显现差异,Sham组BMSCs的增殖能力显著高于OVX组(均P<0.05)。同样,连续7 d细胞计数结果(图6B)显示,Sham组BMSCs的增殖能力也是从第4日开始,显著高于OVX组(均P<0.05)。

图6 2组BMSCs增殖能力比较Fig 6 Comparison of proliferation ability of BMSCsbetween thetwo groups
2.6 2组miR-877-3p表达量的比较
Real-time PCR检测OVX组和Sham组BMSCs miR-877-3p的表达水平,结果显示OVX组BMSCsmiR-877-3p相对表达量(0.23±0.04)明显高于Sham组(0.06±0.02),差异具有统计学意义(P=0.018)。
2.7 转染效率检测
将BMSCs转染miR-877-3p mimics后,miR-877-3p的相对表达量显著上升;转染miR-877-3p inhibitor后,miR-877-3p的表达显著下降。该结果证实转染有效(图7)。

图7 转染后BMSCs中miR-877-3p的相对表达量Fig 7 Expression of miR-877-3p in BMSCsafter transfection
2.8 转染miR-877-3p后BMSCs增殖能力变化
转染miR-877-3p后通过CCK-8法(图8A)和细胞计数(图8B)检测各组BMSCs的增殖能力,均发现各组BMSCs增殖能力从第4日开始逐步显现差异。miR-877-3p过表达组BMSCs增殖能力显著低于对照组,而miR-877-3p抑制组BMSCs的增殖能力显著高于对照组,差异均有统计学意义(均P<0.05)。
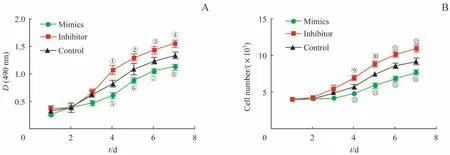
图8 转染miR-877-3p后各组BMSCs增殖能力比较Fig 8 Comparison of proliferation ability of BMSCs in thegroupsafter transfection of miR-877-3p
3 讨论
雌激素缺乏在骨质疏松症的发生及发展中起着重要作用。绝经后骨质疏松症是女性最常见的疾病之一。伴随年龄增加,女性体内雌激素水平降低,骨质破坏逐渐增加。绝经期后女性的BVF、Tb.N、BMD等骨参数指标较绝经前明显降低。研究[11]发现,雌激素影响体内成骨细胞的形成与破骨细胞的破坏,进而调控骨的破坏与重建。BMSCs具有增殖和多向分化的潜能,在一定条件下能够分化为成骨细胞、成软骨细胞等,从而对体内骨平衡稳态有着重要的调控作用[12]。近年来,研究人员[13]发现,miRNA因其特有的转录后调控作用,在绝经后骨质疏松症的发生及发展过程中产生了较大影响。本研究构建小鼠雌激素缺乏所致的骨质疏松症模型,比较来源于骨质疏松症小鼠的BMSCs与假手术组的BMSCs中miR-877-3p的表达情况;并通过上调(下调)BMSCs中miR-877-3p的表达,观察miR-877-3p是否能够调控BMSCs的增殖,进而影响雌激素缺乏导致的骨质疏松症。
本实验发现,OVX组小鼠行卵巢摘除术8周后,雌激素水平较假手术组明显降低,BVF、Tb.N、BMD均下降,与Shuai等[14]研究结果一致。BMSCs作为成骨细胞的前体细胞,在骨质疏松症的发病过程中有重要作用。骨质疏松症与BMSCs相互影响的研究大多集中在骨质疏松症环境下BMSCs多向分化能力的生物学特性改变;而关于来源于骨质疏松症机体BMSCs增殖能力改变的分子机制,研究较少。Tan等[15]发现,TAZ能够通过PI3K/Akt通路促进BMSCs的成骨分化。Qi等[16]发现,来源于骨质疏松症病理环境下的BMSCs成骨能力较弱,骨再生与改建能力降低;但自噬能够保护BMSCs的成骨能力,进而减少骨质疏松症的发生。Wang等[17]发现,核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain,leucine rich repeat and pyrin domain containing 3,NLRP3)炎症小体的激活能够抑制BMSCs的成骨能力,而BMSCs的成脂能力却明显提升,进而导致骨质疏松症的发生。本实验发现,来源于卵巢摘除术所致的骨质疏松症小鼠模型的BMSCs经成骨诱导后,成骨能力低于假手术组,而成脂能力却高于假手术组,与上述相关研究结果一致。来源于骨质疏松症小鼠的BMSCs增殖能力较假手术组弱,说明在骨质疏松症的发病过程中,可能存在某些分子影响BMSCs的增殖能力。miRNA是多种生理和病理过程的重要调节因子,并可能通过影响成骨细胞分化,在维持骨稳态中发挥关键作用[18]。Wang等[10]研究发现,miR-877-3p能够靶向调控Smad7的表达,进而调控肌纤维细胞的分化。有研究[19]指出,在转化生长因子β1诱导的成骨细胞分化过程中,miR-877-3p参与了成骨细胞前体细胞系MC3T3-E1成骨分化的过程。本研究发现,OVX组BMSCs中miR-877-3p表达水平高于假手术组,说明雌激素缺乏可能导致BMSCs中miR-877-3p表达升高,进而对BMSCs的增殖能力产生影响,导致骨质疏松症的发生。Li等[20]在膀胱癌的肿瘤抑制基因p16的启动子位点上发现了miR-877-3p的结合位点,通过高表达miR-877-3p,能够增加p16的表达,抑制膀胱癌细胞的增殖,提示miR-877-3p可能参与细胞增殖能力调控。Xu等[21]发现,miR-887-3p负调控STARD13,进而调控胰腺癌细胞的增殖能力,影响胰腺癌的进展。本研究得到相似结果:OVX组BMSCs中miR-877-3p表达升高,BMSCs增殖能力降低;体外下调miR-877-3p后,BMSCs的增殖能力有一定程度的升高。
综上,本研究发现,在雌激素缺乏导致的骨质疏松症病理环境下,BMSC中miR-877-3p表达升高,抑制了BMSC的增殖,但其涉及的相关靶基因调控机制有待进一步探索。
参·考·文·献
[1] Pavel OR,Popescu M,Novac L,et al.Postmenopausal osteoporosis:clinical,biological and histopathological aspects[J].Romanian J Morphol Embryol,2016,57(1):121-130.
[2] Moskaleva EY,Semochkina YP,Shuvatova VG,et al.Mesenchymal stem cells from mouse adipose tissue stimulate tumor growth[J].Bull Exp Biol Med,2019,167(1):145-149.
[3] Shuai Y,Yang R,Mu R,et al.MiR-199a-3p mediates the adipogenic differentiation of bone marrow-derived mesenchymal stem cells by regulating KDM6A/WNT signaling[J].Life Sci,2019,220:84-91.
[4] Mortada I,Mortada R.Epigenetic changes in mesenchymal stem cells differentiation[J].Eur JMed Genet,2018,61(2):114-118.
[5] Zheng XD,Yu Y,Shao BY,et al.Osthole improves therapy for osteoporosis through increasing autophagy of mesenchymal stem cells[J].Exp Anim,2019,68(4):453-463.
[6] Shao BY,Liao L,Yu Y,et al.Estrogen preserves Fas ligand levelsby inhibiting microRNA-181ain bone marrow-derived mesenchymal stem cells to maintain bone remodeling balance[J].FASEB J,2015,29(9):3935-3944.
[7] Yu Y,Liao L,Shao BY,et al.Knockdown of microRNA Let-7a improves the functionality of bone marrow-derived mesenchymal stem cells in immunotherapy[J].Mol Ther,2017,25(2):480-493.
[8] Kozomara A,Birgaoanu M,Griffiths-Jones S.miRBase:from microRNA sequences to function[J].Nucleic Acids Res,2019,47(d1):D155-D162.
[9] Ritchie W.microRNA target prediction[J].Methods Mol Biol Clifton N J,2017,1513:193-200.
[10] Wang C,Gu S,Cao H,et al.miR-877-3p targets Smad7 and is associated with myofibroblast differentiation and bleomycin-induced lung fibrosis[J].Sci Rep,2016,6:30122.
[11] Zablotni A,Dakischew O,Trinkaus K,et al.Regulation of acetylcholine receptors during differentiation of bone mesenchymal stem cells harvested from human reaming debris[J]. Int Immunopharmacol,2015,29(1):119-126.
[12] Li Y,Feng C,Gao M,et al.MicroRNA-92b-5p modulates melatoninmediated osteogenic differentiation of bone marrow mesenchymal stem cells by targeting ICAM-1[J].JCell Mol Med,2019,23(9):6140-6153.
[13] Chen R,Qiu H,Tong Y,et al.MiRNA-19a-3p alleviates the progression of osteoporosis by targeting HDAC4 to promote the osteogenic differentiation of hMSCs[J].Biochem Biophys Res Commun,2019,516(3):666-672.
[14] Shuai Y,Liao L,Su X,et al.Melatonin treatment improves mesenchymal stem cells therapy by preserving stemness during long-termin vitroexpansion[J].Theranostics,2016,6(11):1899-1917.
[15] Tan FZ,Dai HL. TAZ accelerates osteogenesis differentiation of mesenchymal stem cellsviatargeting PI3K/Akt[J].Eur Rev Med Pharmacol Sci,2019,23(3 Suppl):81-88.
[16] Qi M,Zhang L,Ma Y,et al.Autophagy maintains the function of bone marrow mesenchymal stem cells to prevent estrogen deficiency-induced osteoporosis[J].Theranostics,2017,7(18):4498-4516.
[17] Wang L,Chen K,Wan X,et al.NLRP3 inflammasome activation in mesenchymal stem cells inhibits osteogenic differentiation and enhances adipogenic differentiation[J].Biochem Biophys Res Commun,2017,484(4):871-877.
[18] Xie Y,Chen Y,Zhang L,et al.The roles of bone-derived exosomes and exosomal microRNAs in regulating bone remodelling[J].J Cell Mol Med,2017,21(5):1033-1041.
[19] He G,Chen J,Huang D.miR-877-3p promotes TGF-β1-induced osteoblast differentiation of MC3T3-E1 cells by targeting Smad7[J].Exp Ther Med,2019,18(1):312-319.
[20] Li S,Zhu Y,Liang Z,et al.Up-regulation of p16 by miR-877-3p inhibits proliferation of bladder cancer[J].Oncotarget,2016,7(32):51773-51783.
[21] Xu X,Zheng S.MiR-887-3p negatively regulates STARD13 and promotes pancreatic cancer progression[J].Cancer Manag Res,2020,12:6137-6147.

