两种棘球绦虫丝氨酸蛋白酶抑制剂结构及功能的比较与分析
郭刚,田梦潇,焦红杰,李军,张文宝
1.新疆医科大学第一附属医院临床医学研究院中亚高发病成因与防治国家重点实验室,新疆 乌鲁木齐 830054;2.新疆医科大学基础医学院,新疆 乌鲁木齐 830054;3.新疆医科大学儿科学院,新疆 乌鲁木齐 830054
棘球蚴病又称包虫病,是人感染棘球绦虫幼虫(棘球蚴)所致寄生虫病,该病是一种严重的人畜共患疾病,呈全球性分布,严重威胁公共卫生安全。家犬食入细粒棘球蚴感染病畜内脏及狐狸等野生动物食入泡球蚴感染小型野生啮齿类中间宿主动物,排出虫卵成为传染源,会分别导致人感染囊型包虫病(cystic echinococcosis,CE)和泡型包虫病(alveolar echinococcosis,AE),病原分别为细粒棘球绦虫(Echinococcus granulosus,Eg)和多房棘球绦虫(Echinococcus multilocularis,Em)[1]。目前棘球蚴病在预防、诊断、治疗方面均存在一定难度。在预防方面,通过研制终末宿主疫苗阻断传播循环链尚处于探索阶段,如何确定特异蛋白阻止幼虫入侵宿主肠道和虫体发育是研究的一个思路[2-3];在诊断方面,尚缺乏敏感度和特异度均较高的稳定诊断抗原[4];在治疗方面,尤其是泡球蚴感染中晚期病灶呈癌性生长,为手术根治带来较大难度,借助免疫学手段通过抑制炎症实现病灶向良性囊型转变,再结合手术是未来一段时间内的治疗方向[1]。上述问题的解决,均可通过筛选特异抗原,利用基因重组技术制备蛋白来寻找突破口。
丝氨酸蛋白酶抑制剂(serine protease inhibitor,简称Serpin)是一类结构保守的酶活性调节剂,属于丝氨酸蛋白酶抑制剂超家族。经典的Serpin蛋白相对分子质量为40 000~100 000,广泛存在于多种生物体内,是参与免疫调节和其他生物学通路的重要因子[5]。Serpin蛋白在寄生性蠕虫中也广泛存在,由于Serpin发挥的重要作用,近年来对有关寄生性蠕虫Serpin的研究日益受到重视。其主要作用如下:通过抑制宿主丝氨酸蛋白酶活性,抵抗宿主蛋白水解酶对虫体的降解作用,在寄生虫入侵和寄生宿主过程中发挥关键作用;寄生虫分泌Serpin通过调节宿主免疫应答和炎性反应,对宿主机体产生致病损伤作用[6-7]。
我们在前期研究中分别对Eg和Em各自两种Serpin基因完成了扩增和测序,将有突变的序列上传GenBank,分别命名为:Eg-SerpinA(基因注册号:MT547781,与已上传的XM_024492374.1[8]同源性为99.73%)、Eg-SerpinB(基因注册号与已上传的KY438963.1[9]一致)、Em-SerpinA(基因注册号与已上传的AJ420237.1[10]一致)、Em-SerpinB(基因注册号:MT601850)。利用免疫组化和Western blot技术发现SerpinA在两种棘球绦虫原头蚴和成虫发育阶段均高表达,而SerpinB则仅在包囊阶段的生发层高表达(待发表)。本研究利用生物信息学技术对来自两种棘球绦虫的SerpinA和SerpinB基因编码区及编码蛋白进行系统和全面的比较,分析其理化性质、结构域、信号肽等生物学信息,对进一步确定其生物学功能、研究其对宿主的致病作用及是否可成为棘球绦虫感染诊断和预防疫苗靶蛋白等均具有重要意义。
1 材料与方法
1.1 基因信息分析 应用NCBI-BLAST分析Eg和Em两种Serpin的核苷酸和氨基酸同源性。
1.2 蛋白结构及功能预测 用ExPasy-PortParam和ExPasy-ProtScale K-D法分别分析SerpinA和SerpinB蛋白基本理化性质和亲-疏水性;TMHMM 2.0 Server预测蛋白可溶性和跨膜区;Signal 5.0 Server预测蛋白信号肽;PROSITE在线搜索蛋白motif位点;Coils Server、SMART、ExPasy-SOMPA(PSIPRED Server,http://bioinf.cs.ucl.ac.uk/psipred/)及SWISS-MODEL分别预测蛋白卷曲螺旋结构、功能域、二级结构和三级结构;ElliPro[11](http://tools.iedb.org/ellipro/)预测蛋白抗原表位。
2 结果
2.1 基因信息 Eg-SerpinA基因编码区由1 104个碱基组成,编码367个氨基酸,Em-SerpinA基因编码区由1 065个碱基组成,编码354个氨基酸,其核苷酸和氨基酸序列同源性分别为94.02%和92.92%;Eg-SerpinB和Em-SerpinB基因编码区均由228个碱基组成,编码75个氨基酸,核苷酸和氨基酸序列同源性均为100%。其中Em-SerpinA和Em-SerpinB与Sanger网站公布的预测核酸序列进行比对,分别与注册编号为EmuJ_001193100.1和EmuJ_00053-4800.1的序列一致。
2.2 蛋白质结构及功能预测
2.2.1 基本理化性质和亲疏水性 ExPasy-PortParam和ExPasy-ProtScale K-D法分析显示,不同来源Serpin的基本性质存在不同,其中Eg-SerpinA和Em-SerpinA为亲水性蛋白,Eg(Em)-SerpinB为疏水性蛋白,见表1。
表1 两种棘球绦虫来源Serpin基本理化性质Tab.1 Basic physical and chemical properties of serine proteases from two strains of Echinococcus
2.2.2 跨膜区预测析 TMHMM 2.0 Server预测结果显示,Eg-SerpinA、Em-SerpinA、Eg-SerpinB、Em-SerpinB所有氨基酸序列均无跨膜结构,且均位于胞外,见图1。

图1 两种棘球绦虫来源Serpin跨膜区预测结果Fig.1 Prediction of transmembrane regions of Serpin from two strains of Echinococcus
2.2.3 信号肽预测 Signal 5.0 Server预测结果显示,信号肽可能性均大于0.5,Eg-SerpinA和Em-SerpinA均为分泌蛋白,存在信号肽序列,最可能的剪切位点均位于19和20位氨基酸之间;Eg-SerpinB和Em-SerpinB也均为分泌蛋白,存在信号肽序列,最可能的剪切位点均位于18和19位氨基酸之间。见图2。
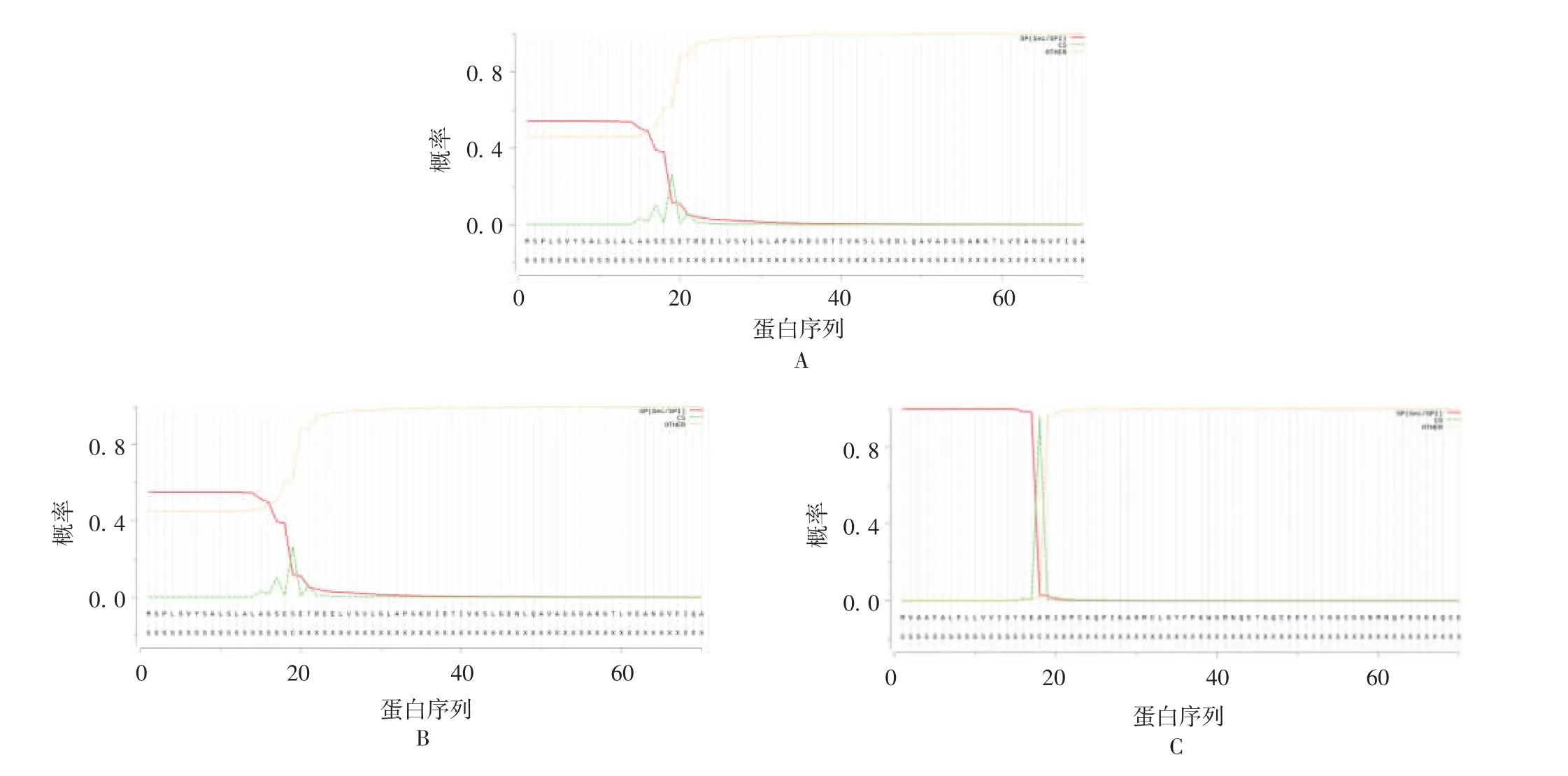
图2 两种棘球绦虫来源Serpin信号肽预测结果Fig.2 Prediction of signal peptides of Serpin from two strains of Echinococcus
2.2.4 蛋白motif位置 PROSITE搜索结果显示,Eg-SerpinA的第338~348位氨基酸序列与Em-SerpinA第325~335位氨基酸序列(FIVDHPFIFFI)相同,为丝氨酸蛋白酶抑制剂超家族标记。Eg(Em)-SerpinB在51~69位氨基酸(FIYGGCG GNMNQFDSKEQC)为Kunitz型胰蛋白酶抑制剂家族标记。
2.2.5 蛋白卷曲螺旋结构 Coils Server预测结果显示,在3种窗口宽度下检测到Eg-SerpinA和Em-SerpinA各自均含有1个卷曲螺旋结构,参与蛋白质寡聚化功能。而Eg(Em)-SerpinB则不含有卷曲螺旋结构。见图3。

图3 两种棘球绦虫来源Serpin卷曲螺旋结构预测结果Fig.3 Prediction of coil structures of Serpin from two strains of Echinococcus
2.2.6 功能域分析 SMART预测结果显示,Eg-SerpinA第2~364位氨基酸之间和Em-SerpinA第2~351氨基酸之间为高保守的丝氨酸蛋白酶抑制剂家族结构域;Eg(Em)-SerpinB第21~74氨基酸之间为高保守的Kunitz型胰蛋白酶抑制剂家族结构域。见图4。

图4 两种棘球绦虫来源Serpin结构域分析结果Fig.4 Analysis of protein domains of Serpin from two strains of Echinococcus
2.2.7 蛋白二级结构预测 ExPasy-SOMPA和PSIPRED Server两种预测方法得到的二级结构预测结果存在一定差异,见表2和图5。

图5 ExPasy-SOMPA和PSIPRED Server预测两种棘球绦虫来源Serpin结构域二级结构Fig.5 Prediction of secondary structures of serine proteases from two strains of Echinococcus with ExPasy-SOMPA and PSIPRED Server
表2 两种棘球绦虫来源Serpin二级结构预测(%)T ab.2 Prediction of secondary structures of serine proteases from two strains of Echinococcus(%)
2.2.8 蛋白三级结构预测 SWISS-MODEL同源建模预测结果显示,Eg和Em SerpinA三级预测结构较接近,而与Eg(Em)-SerpinB存在较大不同,见图6。
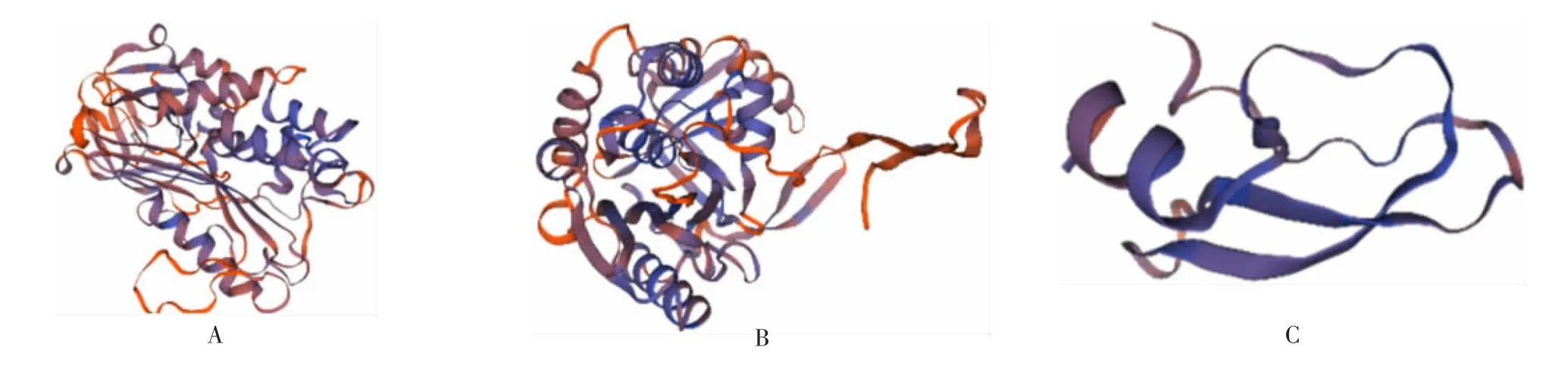
图6 SWISS-MODEL法预测两种棘球绦虫来源Serpin蛋白三级结构Fig.6 Prediction of tertiary structures of Serpin from two strains of Echinococcus by SWISS-MODEL
2.2.9 抗原表位预测
2.2.9.1 B细胞抗原表位 ElliPro B淋巴细胞抗原表位预测结果显示,Eg-SerpinA和Em-SerpinA均含9个线性表位和8个构象表位,共有的最佳线性表位候选区域为RCMPAPPVDFFVDHPFIFFIVTKTG IPVFMGHVVHP(316~351);共有的最佳构象表位为F334、I335、V336、T337、K338、T339、G340、I341、P342和V343。Eg(Em)-SerpinB含4个线性表位和3个构象表位,最佳线性表位候选区域为NQETGQ(42~47);最佳构象表位为N42、E44、T45、G46和Q47。见图7。

图7 两种棘球绦虫来源Serpin蛋白最佳线性表位和构象表位3D结构Fig.7 3D structures of optimal linear epitope and conformational epitope of Serpin from two strains of Echinococcus
2.2.9.2 T细胞抗原表位 IEDB ElliPro分析显示,Eg-SerpinA的T细胞最佳HLAⅠ类分子抗原表位为氨基酸SPLSVYSAL(2~10),Em-SerpinA的最佳HLAⅡ类分子抗原表位为氨基酸MPAPPVDFF(318~326);Eg(Em)-SerpinB的最佳HLAⅠ类分子抗原表位为氨基酸VVISYSEAR(11~19)。
3 讨论
目前根据活性位点氨基酸种类的不同将自然界蛋白酶抑制剂分为4大类:丝氨酸蛋白酶抑制剂[7]、天冬氨酸蛋白酶抑制剂[12]、巯基(半胱氨酸)蛋白酶抑制剂[13]和金属蛋白酶抑制剂[14]。4类天然蛋白酶抑制剂寄生虫均可表达且发挥生物学作用,其中尤以丝氨酸蛋白酶抑制剂在生物体内一些重要生理活动中发挥重要调控作用,从而受到人们关注。丝氨酸蛋白酶抑制剂超家族现有数百种Serpin,迄今超过80种具有不同构象结构,依其序列、拓扑结构及功能相似性至少可分为18个非同源家族,但典型Serpin均具有3个β片层,8~9个α螺旋,且还有1个反应活性环(reactive central loop,RCL),可与目的蛋白互补互相作用[5]。
寄生性蠕虫分泌的Serpin在虫体和宿主之间的相互作用中发挥重要调节作用。有研究发现,曼氏血吸虫分泌丝氨酸蛋白酶抑制剂SMKI-1完全阻断了中性粒细胞弹性蛋白酶的活动位点,具有明显抑制中性粒细胞杀死血吸虫的能力[15]。国内研究发现,伪旋毛虫丝氨酸蛋白酶抑制剂rTp-Serpin对小鼠肥大细胞糜蛋白酶、人中性粒细胞弹性蛋白酶和猪胰脏弹性蛋白酶均有明显抑制作用,因此推测伪旋毛虫通过自身Serpin来抵抗源自宿主肠道消化酶对其的损伤[16]。有研究还发现旋毛虫3种有活性的Serpin[17]。在棘球绦虫研究领域,国外有报道从Eg中分离出相对分子质量仅为12 000的丝氨酸蛋白酶抑制剂[18],该序列与α1-抗胰蛋白酶和已知多种Serpin序列存在同源性,能够表现出对弹性蛋白酶活力的抑制能力,也能够对中性粒细胞发挥一定的调控作用。有研究表达了与Eg有关的EgK-I和EgKI-2两种Serpin,前者高表达于六钩蚴和卵,后者高表达于成虫,推测两种Serpin通过抑制酶降解和促进免疫逃避作用,可能促进了Eg的寄生[18]。另外值得一提的是,新近开展的动物体内外试验发现,原核表达EgK-I蛋白可通过干扰癌细胞周期和诱导癌细胞凋亡来发挥抗癌作用[19]。还有研究发现,通过原核表达获得的Em-Serpin具有抑制剂活性,并对哺乳动物肠道内包括胰蛋白酶和胰弹性蛋白酶等多种蛋白水解酶活性发挥抑制作用[20]。
本研究主要从生物信息学角度出发,分析了两种棘球绦虫蛋白结构及功能,结合前期试验结果推测,SerpinA可能与虫体肠道入侵及定居并进一步发育有关,而SerpinB可能与虫体寄生中间宿主脏器致病灶形成有关。同时我们预测了Serpin的抗原表位,对进一步研究棘球绦虫Serpin的生物学功能具有重要意义。目前CE和AE的诊断、药物治疗及阻断循环链疫苗研制等领域是人们关注的热点和难点。从构建Eg和Em虫体不同发育时期特有表达的Serpin重组蛋白作为候选靶分子出发,进一步筛选抗原并探寻其生物学功能及应用价值,将是未来防治棘球绦虫感染疾病的一个重要方向。

