SARS-CoV-2亚单位疫苗研究现状与挑战
杨柏峰,张家友,李启明
1.武汉生物制品研究所有限责任公司,湖北 武汉 430207;2.国家联合疫苗工程技术研究中心,湖北 武汉 430207;3.国药中生生物技术研究院有限公司,北京 101111
20世纪60年代第1次发现了人类冠状病毒,因其形似皇冠而得名[1]。由重症急性呼吸综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引起的2019冠状病毒病(Coronavirus Disease 2019,COVID-19)大流行给全球社区、医疗系统和经济带来前所未有的压力[2],SARSCoV-2成为第7种可感染人的冠状病毒[3]。截至2021年6月7日,WHO公布数据显示,全球223个国家和地区累计确诊病例达173 005 553例,其中死亡病例3 727 605例[4]。COVID-19疫苗是预防和控制SARS-CoV-2感染最有效和经济的干预性手段,因此,加速开发安全有效的COVID-19疫苗已成为全球研发的重点。目前正在研发的COVID-19候选疫苗根据技术路线大致分为病毒类疫苗、蛋白类疫苗、核酸类疫苗和载体类疫苗,各类疫苗均有其优缺点[5]。已有101种候选疫苗进入临床实验,其中亚单位疫苗有37种。世界各国已获得紧急使用的疫苗有15种,包括2种基因工程重组亚单位疫苗:ZF2001(安徽智飞龙科马生物制药有限公司)、Epi VacCorona(俄罗斯“矢量”国家病毒学与生物技术研究中心)。
本文重点对临床试验的亚单位疫苗、构建平台技术和最新进展作一综述。
1 SARS-CoV-2蛋白特征
SARS-CoV-2是单股正链RNA包膜病毒,基因组长度约30 000 bp,与SARS-CoV-1的基因同源性高达79.6%[6]。以SARS-CoV-2参考序列(NC_045512.2)为例,包含11个基因,分别对应11个开放阅读框(open reading frames,ORFs):1个编码多聚蛋白ORFs(ORF1ab)、4个编码结构蛋白ORFs(ORF2、ORF4、ORF5和ORF9)(表1)、6个编码辅助蛋白ORFs(ORF3a、ORF6、ORF7a、ORF7b、ORF8和ORF10)[7]。
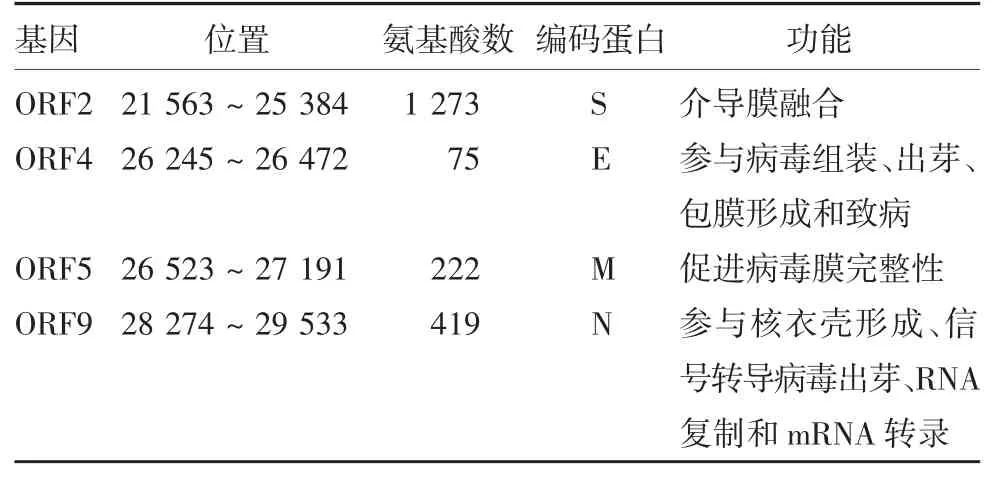
表1 SARS-CoV-2(NC_045512.2)结构蛋白Tab.1 Structural proteins of SARS-CoV-2(NC_045512.2)
1.1 S蛋白 SARS-CoV-2S蛋白是病毒表面的一种高糖基化的Ⅰ型膜蛋白,呈三聚体结构,很大程度上决定了细胞的趋性和宿主范围[8]。S蛋白相对分子质量约140 000,由S1和S2亚基两部分组成。S1亚基包括N-端结构域(N-terminal domain,NTD)和C-端结构域(C-terminal domain,CTD)[8]。从COVID-19康复者体内可筛选出多个靶向NTD的中和抗体,均有很强的中和活性[9]。CTD中有一个关键蛋白,即受体结合域(receptor-binding domain,RBD),约含193个氨基酸,相对分子质量大小约为52 900,含8个半胱氨酸,形成4个二硫键,3个位于RBD核心,1个位于受体结合基序内,RBD与人上皮细胞表面的血管紧张素转换酶2(human angiotensin-converting enzyme 2,hACE2)结合,介导病毒对宿主细胞的黏附[8]。电镜发现[9],RBD含有多种构象表位,是研发新冠候选疫苗最具潜力的抗原之一,但RBD单体诱导的免疫原性低。目前可通过增加抗原大小、多聚体形式或使单体富集在颗粒表面等方法提高单体RBD的免疫原性。S2亚基含有1个furin切割位点,由138个氨基酸组成,介导病毒膜与宿主细胞膜的融合,是病毒侵袭宿主细胞的一个关键步骤。S2亚基含有诱导中和抗体的表位或不同免疫优势的T细胞表位,由内部膜融合肽、2个七肽重复序列(heptad repeat region,HR1/2)、近膜端外部区域(membrane proximal external region,MPER)和转膜基序组成,是当前候选疫苗开发的最主要靶点。
1.2 M蛋白 M蛋白是位于病毒表面的一种转膜糖蛋白,有N-端胞外结构域、三次跨膜结构域和内部C-端结构域,相对分子质量大小约为25 000,促进病毒膜的完整性[10]。N-端和C-端分别各有1个免疫优势表位,在三次跨膜结构域中有1个T细胞表位簇,能诱导较强的T细胞免疫反应[10]。在动物模型中证明[11],毕赤酵母表达的M蛋白可诱导具有保护性的体液免疫反应,可作为疫苗的候选抗原之一。
1.3 N蛋白 N蛋白相对分子质量大小约为50 000,有分子伴侣活性,与RNA结合促进核衣壳的形成,参与信号转导的病毒出芽、RNA复制和mRNA转录等[12]。研究发现[13],在N蛋白的C-端有不同的免疫优势表位。在COVID-19患者中,89%可检测到针对N蛋白的抗体,是疫苗中诱导T细胞反应的代表性抗原,诱导SARS-CoV-2特异性T细胞的浸入和细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL),可作为疫苗研发的候选抗原之一。
1.4 E蛋白 当前对于SARS-CoV-2 E蛋白的结构和作用机制了解较少。E蛋白是冠状病毒的小分子完整膜蛋白,助力于病毒生命周期的各方面,如病毒组装、出芽、包膜形成以及致病[14]。E蛋白具有离子通道的活性,单独E蛋白免疫原性较弱,是其不能作为疫苗候选抗原的一个重要原因。研究发现[15],SARS-CoV-1 E蛋白可诱导IL-1、TNF和IL-6等炎性因子的产生,因此,E蛋白或许是该病毒的一种重要毒力因子。
2 亚单位疫苗
亚单位疫苗是利用微生物的某种表面结构成分(抗原)制成不含有核酸、能诱发机体产生抗体的疫苗,抗原成分明确,安全性好,但需添加佐剂来增强疫苗效果。亚单位疫苗的成功制备,需要高效的体外表达系统生产抗原,常用表达系统有原核表达系统(prokaryotic expression system)、酵母表达系统(yeast expression system)、杆状病毒/昆虫表达系统(baculovirus/insect cell expression system)和哺乳动物细胞表达系统(mammalian expression system)。当前进入临床阶段的新冠亚单位疫苗有蛋白和病毒样颗粒(virus-like particles,VLP)两类,分别有32和5种,大多数是基于S蛋白或S蛋白的一些特殊结构蛋白设计的候选疫苗,也有多组分亚单位候选疫苗(表2)。下面以不同表达系统为例介绍新冠亚单位疫苗的研究进展。
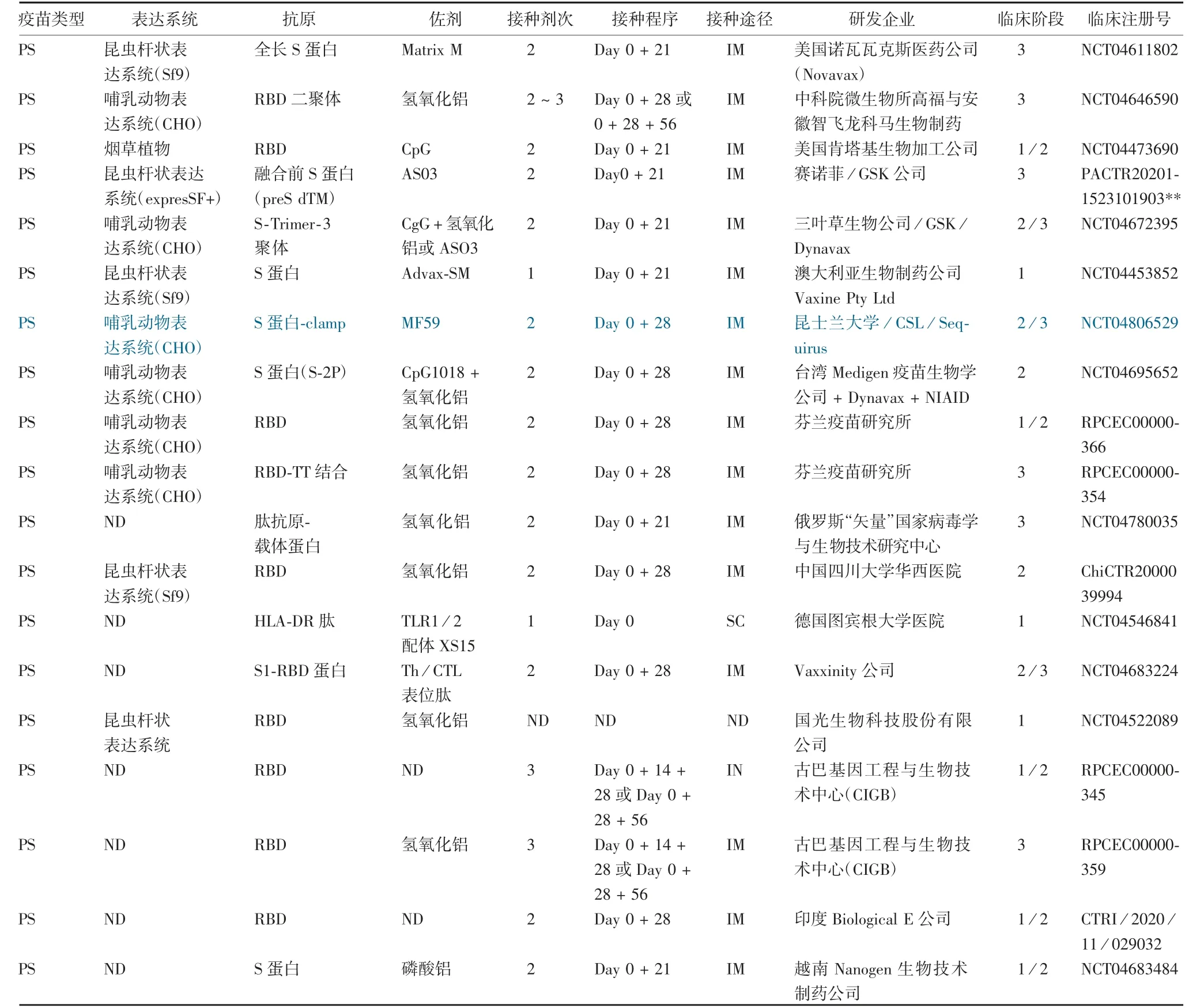
表2 正在进行临床试验的新冠亚单位疫苗Tab.2 SARS-CoV-2 subunit vaccines candidates in clinic
2.1 哺乳动物细胞表达系统 哺乳动物细胞表达系统的优势在于能够指导蛋白质的正确折叠,提供准确的糖基化等多种翻译后加工修饰,是最具潜力的表达系统之一。常用表达细胞有中国仓鼠卵巢细胞(CHO)、人胚肾细胞(HEK293)和COS细胞等,其中CHO细胞易培养、成本低且安全性好,已成为最常用的表达细胞系之一[16]。应用实例如下。
中国科学院微生物研究所与安徽智飞龙科马生物制药有限公司合作,体外构建含MERS-CoV SP序列→RBD_1(R319-K537)-RBD_2(R319-K537)的cDNA序列载体,利用CHO细胞表达生产由二硫键相连的RBD串联重复序列(RBD二聚体),与氢氧化铝佐剂配伍制成亚单位疫苗(ZF2001)[17]。该RBD二聚体充分暴露了与中和抗体(NAb)结合的双受体结合基序,与hACE2的亲和力和RBD单体一样好。Ⅰ/Ⅱ期临床数据显示,该疫苗具有良好的安全性和免疫原性,在中国和乌兹别克斯坦已批准紧急使用。
SCB-2019是三叶草生物制药公司利用其独有的专利技术Trimer-Tag©(蛋白质三聚体化)开发的新冠重组亚单位疫苗[18]。利用基因工程方法构建“S-Trimer”重组蛋白基因表达载体,转染CHO细胞表达目的蛋白。因Protein A树脂与人IgG1 Fc段具有高亲和力,将Endo180-Fc融合蛋白负载到Protein A树脂上,制成“特制”层析柱,再利用Trimer-Tag与Endo180(Endocytic 180)之间的高亲和力纯化出与冠状病毒S蛋白构象高度相似的共价三聚体融合蛋白重组抗原“S-Trimer”。Ⅰ期临床结果显示[19],含AS03或CpG/氢氧化铝佐剂的SCB-2019疫苗均诱导了较强的体液免疫和CD4+Th1型细胞免疫,具有较好的病毒中和活性,且耐受性好。目前正在开展Ⅱ/Ⅲ期(NCT04672395)临床实验。
SARS-CoV-2 Sclamp是澳洲昆士兰大学利用新型分子钳“molecular clamp”疫苗平台技术开发的一种新冠亚单位疫苗[20]。该平台技术通过了2018年由流行病防范创新联盟(The Coalition for Epidemic Preparedness Innovations,CEPI)发起的针对不同病原体引起的疾病的快速反应评审会。其优势是无需增加其他位点特异性突变即可使目标抗原稳定在融合前构象,诱导的高水平中和抗体具有广谱性,可针对病毒粒子表面的一些构象表位。该“分子钳”三聚域来自人类免疫缺陷病毒1型(human immunodeficiency virus type 1,HIV-1)糖蛋白41(gp41)的七肽重复区1和2(HR1/2,氨基酸540-576和619-656),可组装成一个极其稳定的六螺旋束。通过基因工程手段用甘氨酸linker(GSG)取代680-SPRRARSVASQ-690中的RS,之后,用“分子钳”三聚域序列替换S蛋白的TM基序,构建目的基因+“分子钳”三聚域的表达载体,瞬时转染CHO细胞后,表达具有融合前构象的Sclamp三聚体蛋白。研究证实,该三聚体蛋白构象在4℃下可保持3个月,甚至长时间暴露在热应激下也能很好地维持其构象,与MF59佐剂配伍制成新冠亚单位候选疫苗。Ⅰ期临床研究结果表明[21],该疫苗具有良好的耐受性,诱导的中和抗体水平与轻度至中度COVID-19康复者血清抗体水平类似。但“分子钳”中HIV-1 gp41诱导的抗体干扰了HIV阳性的筛查,因此停止了Sclamp疫苗的进一步临床研究。该研究小组已用新的三聚域代替gp41,正在重新开展Ⅰ期临床研究。
芬兰疫苗研究所开发的RBD-TT新冠亚单位候选疫苗也是利用CHO细胞来表达RBD抗原[22]。该重组RBD是从319-541增加了1个Cys538,该Cys通常与S蛋白中C590相连,还增加了2个N-糖基化位点(Asn331和Asn343)和2个O-糖基化位点(Thr323和Ser325)。由于发酵过程中Cys538与培养基中存在的Cys通过1个S-SCys自然加成反应被保护起来,不会与其他8个Cys残基竞争性结合。ESI-MS结果显示,该重组RBD含有4个二硫键,表明多余的Cys538不影响RBD的正确折叠。使用三(2-羧乙基)膦(TCEP)可将半胱氨酰化的Cys538还原为硫醇,之后与用交联剂3-马来酰亚胺丙酸N-羟基琥珀酰亚胺酯(SMP)处理过的含多个马来酰亚胺基的TT相连,得到RBDn-TT结合物,利用该技术可获得表面呈现多价RBD的大分子结构,更好地暴露受体结合基序,利于免疫系统识别。TT作为载体蛋白已成功应用于Hib和肺炎等多糖蛋白结合疫苗中,这是首次用于冠状病毒蛋白疫苗中。与单独RBD相比,高免疫原性的载体蛋白携带的多个T和B细胞表位可潜在激活细胞免疫反应。临床前研究发现[22],过继转移RBD6-TT疫苗诱导的小鼠脾细胞后,用3μg RBD/Alum加强免疫,诱导的RBD特异性IgG水平更高,在转移RBD/Alum的淋巴细胞的小鼠组未观察到此现象。该疫苗还诱导了高水平的IFNγ(Th1),未检测到IL-4和IL-17A,通过流式细胞术检测到分泌IFNγ、TNF-α和颗粒酶(细胞毒淋巴细胞和自然杀伤细胞释放的细胞浆颗粒)的CD8+CD44high记忆T细胞。该疫苗已完成Ⅰ期、Ⅱ期临床实验,正在开展Ⅲ期临床研究,至今未公布Ⅰ/Ⅱ期临床实验结果。
美国沃尔特·里德陆军研究所(Walter Reed Army Institute of Research,WRAIR)基于幽门螺旋杆菌铁蛋白(Helicobacter pylori ferritin)的多聚化平台技术,利用人HEK293细胞系表达研发了新冠重组亚单位纳米颗粒疫苗(SpFN_1B-06-PL)[23]。该平台技术已应用于流感病毒[24]、HIV[25]和EB病毒[26]等其他病毒的抗原。H.pylori铁蛋白自组装成具有8个三重对称轴的24亚基颗粒,将病毒糖蛋白的单个原聚体融合到H.pylori铁蛋白亚基的N-末端区域有助于组装蛋白质纳米颗粒,该蛋白质纳米颗粒在3倍轴的表面上可显示8个三聚体抗原拷贝[27]。与单独抗原相比,该蛋白质纳米颗粒诱导了更强的中和抗体反应[23]。已有两种基于H.pylori铁蛋白的流感疫苗[28]在临床试验中证明了其安全性和免疫原性(NCT03186781,NCT03814720)。通过基因手段构建的表达载体包括:删除了C-末端70个残基的截短S蛋白(SΔC)、一个突变的fulin裂解位点:精氨酸-精氨酸-丙氨酸-精氨酸突变为一个丙氨酸、在986和987位置增加了2个脯氨酸,稳定S蛋白处于融合前的构象,用人HEK293细胞系表达SΔC-Fer,与QS-21佐剂配伍制成新冠亚单位疫苗。该疫苗正在进行Ⅰ期临床研究。
2.2 杆状病毒/昆虫表达系统 昆虫细胞具有内质网和高尔基体等细胞器,可对杆状病毒表达的目的蛋白进行加工修饰,因此,杆状病毒/昆虫表达系统已发展为一个生产功能性或免疫原性重组蛋白的常用真核表达系统[29]。该系统还可容载大片段基因,使多个基因共表达,是表达VLP多价疫苗的最佳表达系统。第一个利用该表达系统(粉蚊夜娥细胞系,High Five)生产的人用疫苗是GSK研发的用于预防子宫癌的Cervarix®[30]。应用实例如下。
美国Novavax公司利用该系统(草地贪夜蛾细胞,Spodoptera frugiperda cellline9,Sf9细胞)开发了一款基于全长S蛋白的重组纳米颗粒疫苗(VNXCoV2373)[31]。该S蛋白序列进行了2处改造,一处是在S1/S2裂解位点将682-RRAR-685突变为682-QQAQ-685,使重组蛋白具有蛋白酶抗性;另一处是在S2亚基的七肽重复序列1/中心螺旋(HR1/CH)顶端处将986-KV-987突变为986-PP-987,使S蛋白稳定在融合前构象,不仅与hACE2具有高亲和力,还显示出耐热稳定性。与基于皂甙的佐剂(Matrix-M1)配伍制成纳米颗粒疫苗。1/2期临床结果显示,NVX-CoV2373疫苗接种后35 d,表现出安全性良好,诱导的免疫反应超过COVID-19患者康复期血清水平,含Matrix-M1佐剂组疫苗诱导了偏向Th1型的CD4+T细胞免疫。
赛诺菲公司对S蛋白序列进行改造,在S2亚基C-端序列引入2个脯氨酸突变,该修饰使S蛋白稳定在融合前构象,增加了蛋白的稳定性和三聚化,利用expresSF+昆虫细胞表达重组preSdTM抗原,与GSK公司的AS03佐剂配伍制成亚单位疫苗(VAT-00002)[32]。Ⅰ/Ⅱ期临床结果显示,该疫苗在老年组诱导的免疫反应低于预期,加强免疫后副反应较高。分析发现,用于定量S蛋白抗原的试剂(一种单克隆抗体)与配方中存在的糖基化的宿主蛋白(杆状病毒蛋白)发生交叉反应,使得抗原定量浓度低估4~6倍,导致制品中预期抗原含量低。但该临床实验得出的积极结论是在preS dTM中需要添加佐剂,且AS03效果优于AF03佐剂,需进一步优化生产工艺及对含AS03佐剂的疫苗进行配方和剂量研究。目前正在19~44岁、45~64岁、65~80岁和80岁以上人群中开展Ⅲ期(PACTR202011523101903)临床实验。
2.3 原核表达系统和酵母表达系统 原核表达系统具有遗传背景清晰、操作简单、表达量高、成本低和周期短等特点,是生物制品生产的首选表达系统,缺点是原核细胞缺少真核细胞翻译后修饰(糖基化、磷酸化等)所需的细胞器和酶,对病毒类复杂性蛋白的表达较困难。成功的标志性事件是2012年全球首个戊型肝炎疫苗(VLP)在中国上市[33-34]。酵母表达系统也具有遗传背景清晰、基因表达调控机制清楚、不产内毒素等优势,被美国FDA认定为安全的基因工程表达系统,缺点是具有超糖基化能力,表达的外源蛋白易被酵母蛋白酶系统降解影响产量,已成功应用于乙肝等疫苗的生产[35]。SARS-CoV-2的S蛋白是高糖基化的膜蛋白,为了不影响S蛋白的生物活性,目前临床的亚单位疫苗均未采用这两种表达系统。
2.4 VLP疫苗 VLP由病毒主要结构蛋白在表达宿主中自组装或在体外装配而成,形态学和结构上与病毒相似,不携带遗传物质,无感染性,不能自我复制。VLP可将靶抗原递送到免疫系统,诱导体液和细胞(CD4+T细胞)免疫,已成功应用于HBV[36]和HPV[37]疫苗。目前已上市的HBV和HPV疫苗是基于哺乳动物、昆虫细胞和酵母表达系统。Medicago公司利用植物(烟草烟叶)生产新冠VLP疫苗(Co-VLP)[38],主要过程是将构建的含目的基因的质粒导入到农杆菌(Agrobacterium tumefaciens)载体中,转染烟草后生产出VLP。Medicago公司利用烟草开发的四价流感VLP疫苗[39]已完成了Ⅲ期(NCT0330-1051,NCT03739112)临床研究,结果显示耐受性良好,可提供实质性保护。CoVLP候选疫苗的S蛋白也经过多处修饰,一处是在S1/S2裂解位点进行了3个氨基酸的替换以提高蛋白稳定性,R667G、R6-68S和R670S;一处发生在K971P和V972P,提高蛋白的融合前构象;用苜蓿的蛋白质二硫键异构酶代替信号肽,用流感毒株(H5 A/Indonesia/5/2005)的TM/CT(转膜基序/胞质尾)代替S蛋白的TM/CT,该替换提高了VLP的组装和出芽;使用双35S启动子和专有的5′和3′非翻译区来驱动S蛋白的表达,以最大限度地提高mRNA的稳定性和蛋白质的翻译;添加番茄丛矮病毒(TBSV)P19基因沉默抑制物,以最大化S蛋白的瞬时表达。目前已在18~55岁人群中完成了CoVLP候选疫苗的Ⅰ期(NCT0-4450004)临床试验[40],结果显示,CoVLP候选疫苗安全性良好,血清中和抗体水平无剂量递增效应(3.75、7.5和15μg),CoVLP+AS03组加强免疫后诱导的中和抗体水平是COVID-19康复者血清的10倍,并诱导了S蛋白特异性的IFNγ和IL-4细胞免疫。目前正在18岁以上人群中开展CoVLP候选疫苗安全性、有效性和免疫原性的Ⅱ/Ⅲ期(NCT0463-6697)临床研究。
其他几款VLP疫苗,如印度血清研究所开发的基于乙型肝炎表面抗原组成的新冠亚单位VLP(RBD)正在进行Ⅰ期(ACTRN12620000817943)临床试验;VBI疫苗公司利用包膜类病毒颗粒(eVLP)疫苗技术开发的VBI-2902a疫苗正在进行Ⅰ/Ⅱ期(NCT04773665)临床试验;土耳其科学技术研究委员会(Scientific and Technological Research Council of Turkey,TBITAK)开发的SARS-CoV-2 VLP疫苗正在进行Ⅰ期(NCT04818281)临床试验;拉德堡大学开发的ABNCoV2(VLP)正在进行Ⅰ期(NCT04839146)临床试验。

续表2正在进行临床试验的新冠亚单位疫苗Tab.2(Continued)SARS-CoV-2 subunit vaccines candidates in clinic
3 我国新冠亚单位疫苗临床现状
截止目前,我国已进入临床试验的候选亚单位疫苗有6款,其中进入Ⅲ期的有2款(ZF2001、SCB-2019)。国药中生生物技术研究院利用CHO细胞表达的针对RBD天然结构的亚单位疫苗正在开展Ⅰ/Ⅱ期(NCT04869592)临床试验,未见临床前研究报道。中国四川大学华西医院利用Sf细胞表达的针对RBD的亚单位疫苗[41],在猴子等动物中未见明显副作用,可较好地预防SARS-CoV-2感染,已完成Ⅰ期(ChiCTR2000037518)临床试验,正在进行Ⅱ期(ChiCTR2000039994)临床研究。中科院生物物理所与丽珠单抗生物技术有限公司合作开发的V-01疫苗[42],是将通用型DR辅助T细胞表位(pan-DR helper Tcell epitopes,PADRE)插入IFNα和RBD蛋白序列之间,表达形成I-P-R-F融合蛋白(IFNα-PADRERBD-Fc),进一步加强疫苗的T/B细胞应答,与人群常见HLA-DR分子结合,较少受MHC限制性;V-01免疫恒河猴诱导产生了高水平病毒中和抗体,免疫256 d后,血清RBD结合抗体仍维持高水平。江苏省疾病预防控制中心基于基因工程疫苗概念设计开发了针对S蛋白RBD+NTD双组分亚单位新冠疫苗[43],临床前研究结果表明,有较好的保护作用;与江苏瑞科生物科技有限公司合作,已进入Ⅰ期(NCT04818801)临床研究。
4 挑战与展望
4.1 病毒变异株 截止2021年5月26日,国家生物信息中心共收录1 741 494条新冠病毒序列,发现35 016个变异,主要为单核苷酸多态性(single nucleotide polymorphism,SNP)变异(28 558),变异主要位于ORF1ab区(核苷酸20334个,氨基酸14987个),其次在S蛋白共有3 692个核苷酸位点发生突变,引起氨基酸变化的突变共2 717个,位于RBD的氨基酸407个,其中在已报道蛋白互作中关键的17个氨基酸中发生非同义突变的氨基酸41个(https://bigd.big.ac.cn/ncov/variation/spike)。自2020年1月发现D614G突变株后[44],其已成为全球主要流行株。目前主要的流行突变株有4种:英国株(B.1.1.7)[45],具有高传染、高致病的特点;南非株(B.1.351)[46]和印度株(B.1.617)[47],传染性强,还可能削弱疫苗效果;巴西株(P.1)[48],具有很强的二次感染性。发生在S蛋白RBD和NTD上的突变可引起免疫逃逸,对基于S蛋白的亚单位疫苗提出了挑战。因此,根据抗原变异特征,通过靶抗原的选择设计,利用现有平台技术研发具有广谱保护性的疫苗是有效预防COVID-19的最具潜力的疫苗。
4.2 S蛋白糖基化 蛋白质糖基化是生物体内最重要的翻译后修饰之一,可改变多肽的构象和增加蛋白质的稳定性,从而使不同的蛋白质具有不同构象,主要以N-糖基化和O-糖基化形式呈现。当前SARSCoV-2疫苗的候选抗原主要集中在S蛋白,而S蛋白是一种高度糖基化的蛋白质,糖基化作为关键属性决定着蛋白的空间构象和化学性质,甚至作为突变的潜在靶点[49]。
ANDERSEN等[50]预测,每个单体S蛋白有22个潜在N-链接糖基化位点,3个潜在O-链接糖基化位点,O-糖基化位点是接近furin裂解位点(S1/S2)的位点。WATANABE等[51]用质谱方法鉴定出293F细胞表达的S蛋白有22个N-糖基化位点,其中18个具有保守性,糖基化修饰包括高甘露糖型、杂合型和复合型3种,其中复合型糖链占比较高,不同糖基化位点的多糖种类和丰度具有较大差别。WALLS等[52]通过Cryo-electron microscopy(Cryo-EM)技术证明,22个糖基化位点中有14~16个发生了N-糖基化,并证明这种N-糖基化在蛋白的正确折叠中起重要作用,有利于病毒逃避宿主的先天性和适应性免疫应答。SHAJAHAN等[53]在HEK293细胞表达的S蛋白中观察到22个潜在N-糖基化位点中有17个发生了N-糖基化修饰,并在S1亚基RBD中首次确认存在2个O-糖基化(O323/O325)。ZHANG等[54]对昆虫细胞表达的S蛋白和293细胞表达的S1亚基的糖基化进行特征分析,在昆虫细胞表达的S蛋白中鉴定出22个N-糖基化位点,糖链修饰主要是高甘露糖型,含38种多糖;而293细胞表达的S1蛋白其糖链修饰主要是复合型糖链,多糖多达140种。这些研究表明,不同表达系统表达的蛋白糖链修饰类型和多糖组成差异很大。值得注意的是,同样是用293细胞表达体系,表达的S蛋白其糖基化水平和糖链种类也有较大差别,表明重组S蛋白的糖基化修饰具有多样性和异质性。因此,根据设计需要选择合适的表达系统对于亚单位疫苗抗原的生产至关重要。
4.3 安全性和保护持久性 安全性和持久性与靶抗原选择、非天然序列/片段的引入、抗原稳定性以及佐剂选择均具有相关性。2019年,LIU等[55]通过灵长类动物实验发现了SARS-CoV-1病毒疫苗的“抗体依赖增强效应”(antibody-dependent enhancement,ADE)。最近,日本学者YAFEI等[56]在感染SARSCoV-2的患者中发现,一系列S蛋白的NTD表位抗体(如8D2)可诱导RBD呈现开放型构象,增强SARS-CoV-2的感染性,虽然增强机制与Fc介导的ADE不同,但存在潜在ADE效应。至今虽未出现疫苗接种会诱导这种类型抗体的证据,但鉴于SARSCoV-2与SARS-CoV-1病毒S蛋白的结构和感染机制有较高的相似性,应对SARS-CoV-2疫苗的安全性持续关注和跟踪[57-58]。
亚单位疫苗由于抗原成分明确、纯度高、免疫原性弱,需加入佐剂来增强免疫效果。目前批准用于人用疫苗的佐剂有铝盐佐剂、AS系列佐剂、MF59和CpG等佐剂[59]。当前进入临床试验的新冠亚单位疫苗除氢氧化铝和磷酸铝佐剂外,还有新型佐剂,如Matrix-M、MF59、CpG、Advax-SM、TLR1/2配 体(XS15)和QS-21佐剂。虽然新型佐剂可显著提高疫苗诱导的体液或(和)细胞免疫,但也伴随着不良反应事件的增加,因此佐剂的选择需谨慎考虑疫苗安全性和有效性之间的平衡。
4.4 展望 一种高效和安全的COVID-19疫苗不仅需要诱导机体所需的体液和细胞免疫,同时应尽量减少如细胞因子风暴等不良副作用,还可快速开发和部署针对病毒突变的疫苗,因此,需对抗原、剂型、接种途径和接种时机进行多方面综合考虑。疫苗研发过程中遇到困难,或对疫苗设计、接种方案重新评估并不罕见,重要的是要从失败的试验中确定疫苗成分或生产中需要优化的方面,从而使产品研发得以恢复。成功预防COVID-19大流行的疫苗应具有以下优势:提供长期保护性,可接受的安全性和有效性,易于快速大规模生产,可利用现有冷链设施进行广泛分发等。疫苗种类多样性将减少因疫苗原材料有限而产生的疫苗供应不足等负面影响。虽然目前灭活疫苗、亚单位疫苗、腺病毒载体和mRNA疫苗已广泛使用,但临床实验数据征集时间短,是否存在长期不良反应等仍不明确,需进一步跟踪和评价,加之全球流行加速了病毒的变异,因此不排除特别是在免疫反应协调性差和向炎症状态发展的老年人群中进行加强免疫,而重组亚单位疫苗能有效增强已有的免疫反应。因此,重组亚单位疫苗是最具潜力的候选疫苗之一,相信该类疫苗在有效预防和控制SARS-CoV-2感染中能发挥重要作用。
志谢衷心感谢中国生物武汉生物制品研究所有限责任公司黄仕和研究员指导

