甲型肝炎病毒L-A-1株在人胚肺二倍体细胞2B S株上的遗传稳定性
徐艳玲,李昊堃,王艺博,夏青娟,岳立广,刘令九
长春生物制品研究所有限责任公司,吉林长春130012
甲型肝炎是由甲型肝炎病毒(hepatitis A virus,HAV)引起的一种急性自限性疾病,主要经粪-口途径传播,严重者可导致死亡[1],其发病率与社会经济生活水平和环境卫生情况密切相关[2-3]。目前,甲型肝炎在全球部分地区仍有暴发[4-5],接种甲型肝炎疫苗是预防和控制该病的有效措施[6]。近年,随着疫苗接种率的提高,我国甲型肝炎发病率呈逐年递减趋势,流行特征呈地区性分布[7],但局部暴发时有发生。
HAV基因组是一条长约7 500 bp的单链线性正股RNA,分为5′端非编码区、开放性读码框(open reading frame,ORF)和含有Poly(A)尾的3′端UTR。HAV ORF较长,可编码1个2 227个氨基酸残基的多聚蛋白,该多聚蛋白可分为P1、P2和P3区。其中P1区编码结构蛋白,包括VP4(1A)、VP2(1B)、VP3(1C)、VP1(1D);P2和P3区编码非结构蛋白,包括2A、2B、2C、3A、3B、3C、3D。HAV的衣壳蛋白由VP1~VP4组成,其中VP1、VP2、VP3是构成病毒衣壳蛋白的主要部分。研究表明,HAV的抗原性与病毒蛋白的立体结构有关,VP3和VP1在衣壳上的天然构象形成单个抗原表位,可诱发中和抗体反应[8-9]。目前,国内冻干甲型肝炎减毒活疫苗使用的毒株为L-A-1和H2减毒株,这两种病毒株生产的疫苗均具有良好的安全性和免疫原性[10]。疫苗生产过程中,毒株传代的稳定性与疫苗质量密切相关,因此,本研究对甲型肝炎病毒L-A-1株在人胚肺二倍体细胞2BS株(简称2BS细胞)上连续传代的遗传稳定性进行评价,为疫苗的质量控制及灭活疫苗的研发提供实验依据。
1 材料与方法
1.1 细胞及病毒株 2BS细胞和HAVL-A-1株(23代)由长春生物制品研究所有限责任公司疫苗二室提供。
1.2 主要试剂 MEM培养基购自日本日水制药株式会社;新生牛血清购自兰州民海生物工程有限公司;胰蛋白酶购自美国Gibco公司;定性甲肝抗原(hepatitis A antigen,HAAg)诊断试剂盒和HAV抗体诊断试剂盒购自北京万泰生物药业有限公司;病毒基因组RNA提取试剂盒购自天根生化科技(北京)有限公司;DNA marker DL2000和One Step RNA PCR kit(AMV)购自宝生物工程(大连)有限公司。
1.3 实验动物 SPF级ICR小鼠,雌雄各半,体重14~16 g,购自北京华阜康生物科技有限公司,实验动物生产许可证号为:SCXK(京)2014-0004。
1.4 细胞培养 从液氮罐中取出2BS细胞,37℃水浴中复苏,用10 mL含10%新生牛血清的MEM培养液按1∶2的比例传代,37℃培养至细胞长成单层后,用0.25%胰蛋白酶消化,按1∶4的比例传代培养至31代。
1.5 病毒培养及传代 将第23代HAV L-A-1株采用混悬感染的方式,按MOI=0.2接种至31代2BS细胞,35℃培养7 d;更换含2%新生牛血清的MEM培养液,于接种后21 d收获病毒液,-60℃以下冻存。按该方法连续传10代,取第23、24、26、28和32代病毒(分别命名为L-A-1-23、L-A-1-24、L-A-1-26、L-A-1-28、L-A-1-32),采用HAAg诊断试剂盒检测病毒抗原含量,Reed-Muench法[11]计算病毒滴度。
1.6 引物设计及合成 根据GenBank中登录的HAV减毒株基因序列(AF314208),应用Primer 5.0软件设计7对引物,各扩增片段大小约1 000 bp,片段间约有200 bp重叠,并用Oligo 7.0软件验证引物。引物序列见表1,由吉林省库美生物科技有限公司合成。

表1 HAV L-A-1株基因组扩增的引物序列Tab.1 Primer sequences for amplification of genome of L-A-1 strain
1.7 基因序列分析 用病毒基因组RNA提取试剂盒提取5代病毒基因组RNA,逆转录为cDNA,以其为模板,HAV1~HAV7为引物,进行RT-PCR扩增。PCR扩增条件为:94℃预变性2 min;94℃30 s,45~60℃退火30 s,72℃延伸1.5 min,共30个循环;72℃再延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳鉴定后,送吉林省库美生物科技有限公司测序。采用DNAMAN软件对病毒基因序列片段进行拼接,得到全基因组核苷酸序列,并对不同代次病毒的核苷酸和氨基酸序列进行多序列对比分析;将L-A-1-32代次病毒与GenBank中登录的国内外其他主要HAV毒株核苷酸和氨基酸序列进行比对及同源性分析,并比较分析L-A-1-32代次病毒与国内外主要HAV毒株的VP1和VP3蛋白的氨基酸序列,国内外主要HAV毒株的相关信息见表2。
表2 国内外主要HAV毒株的相关信息Tab.2 Data on major HAV strains at home and abroad
1.8 HA V L-A-1株免疫原性的检测 取L-A-1-23、L-A-1-24、L-A-1-26、L-A-1-28、L-A-1-32代 次 病 毒收获液,4 058×g离心15 min,弃上清,用5 mLHank′s液收集沉淀,混匀,加入5 mL三氯甲烷,振荡30 min;4 058×g离心30 min,取上清。重复操作1次,将两次的上清液混合,即为病毒纯化液。将ICR小鼠随机分为L-A-1-23组、L-A-1-24组、L-A-1-26组、L-A-1-28组、L-A-1-32组、阴性对照组和空白对照组,每组10只。试验组分别经小鼠腹腔免疫各代次病毒纯化液,阴性对照组免疫生理盐水,均0.5 mL/只;空白对照组小鼠不免疫。免疫后28 d经心脏采血,分离血清,采用HAV抗体诊断试剂盒检测血清抗体效价。
1.9 统计学分析 应用SPSSStatistics 17.0统计学软件进行统计学分析,免疫原性检测结果采用均值±标准差()表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 HA V L-A-1株病毒抗原含量及病毒滴度 各代次HAV L-A-1株病毒在2BS细胞上连续传代培养,抗原含量在10 240~20 480 EU/mL之间,病毒滴度为7.00~7.50 lgCCID50/mL,见表3。表明HAV L-A-1株在2BS细胞上传代稳定性较好。

表3 各代次HAV L-A-1株病毒抗原含量及病毒滴度Tab.3 Antigen contents and virus titers of HAV L-A-1 strain of various passages
2.2 HA V L-A-1株基因扩增产物的鉴定 各代次HAV L-A-1株病毒基因PCR产物经1%琼脂糖凝胶电泳鉴定,均可见约1 000 bp的HAV1~HAV7目的基因片段,大小均与预期相符,L-A-1-23代次病毒结果见图1(其他代次结果略)。
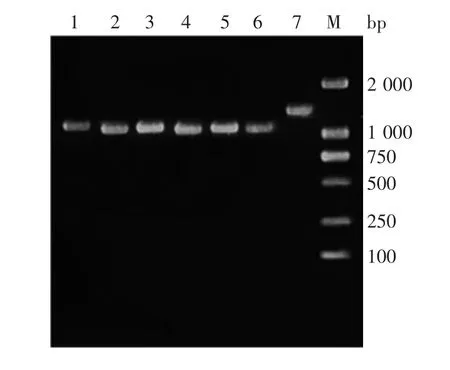
图1 HAV L-A-1-23代次病毒各基因片段PCR产物电泳图Fig.1 Electrophoretic profile of PCR products of HAV L-A-1 strain of passage 23
2.3 各代次HA V L-A-1株基因组核苷酸及氨基酸序列的同源性 各代次HAV L-A-1株基因组序列全长均为7 420 bp,5′UTR的核苷酸为1~736 bp,ORF以737 nt处的ATG为起始密码子,编码2 225个氨基酸,包括862个疏水性氨基酸、790个亲水性氨基酸、278个碱性氨基酸、248个酸性氨基酸及较短的3′UTR区。各代次HAV L-A-1株间核苷酸和氨基酸序列同源性均为100%。
2.4 HA V L-A-1株与国内外主要HA V毒株核苷酸及氨基酸序列的同源性 国内外主要HAV毒株核苷酸和氨基酸序列同源性分别达91%和98%以上。L-A-1-32代次毒株与国内外其他主要HAV毒株核苷酸序列同源性为91.40%~99.70%,氨基酸序列同源性为98.20%~99.69%;与L-A-1参考株(AF314208)比较,核苷酸和氨基酸序列同源性最高,分别为99.70%和99.69%;与MBB、LV8和H2K25株核苷酸序列同源性分别为98.84%、94.74%和98.13%,与H2W株核苷酸序列同源性最低,为91.40%;与H2K25株氨基酸序列同源性最高,为99.69%,与GBM和H2W株氨基酸序列同源性最低,为98.20%。见表4和表5。
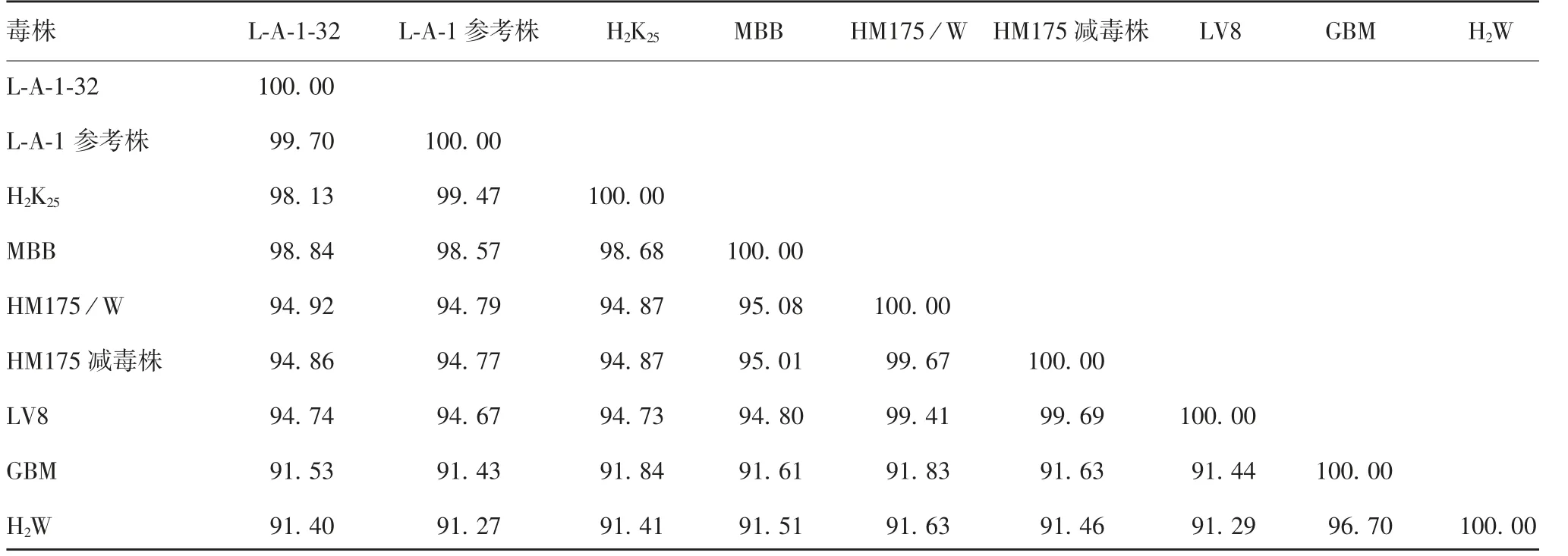
表4 L-A-1-32代次病毒与国内外主要HAV毒株核苷酸序列的同源性(%)Tab.4 Homologies of nucleotide sequences of L-A-1 strain of passage 32 to those of major virus strains at home and abroad(%)
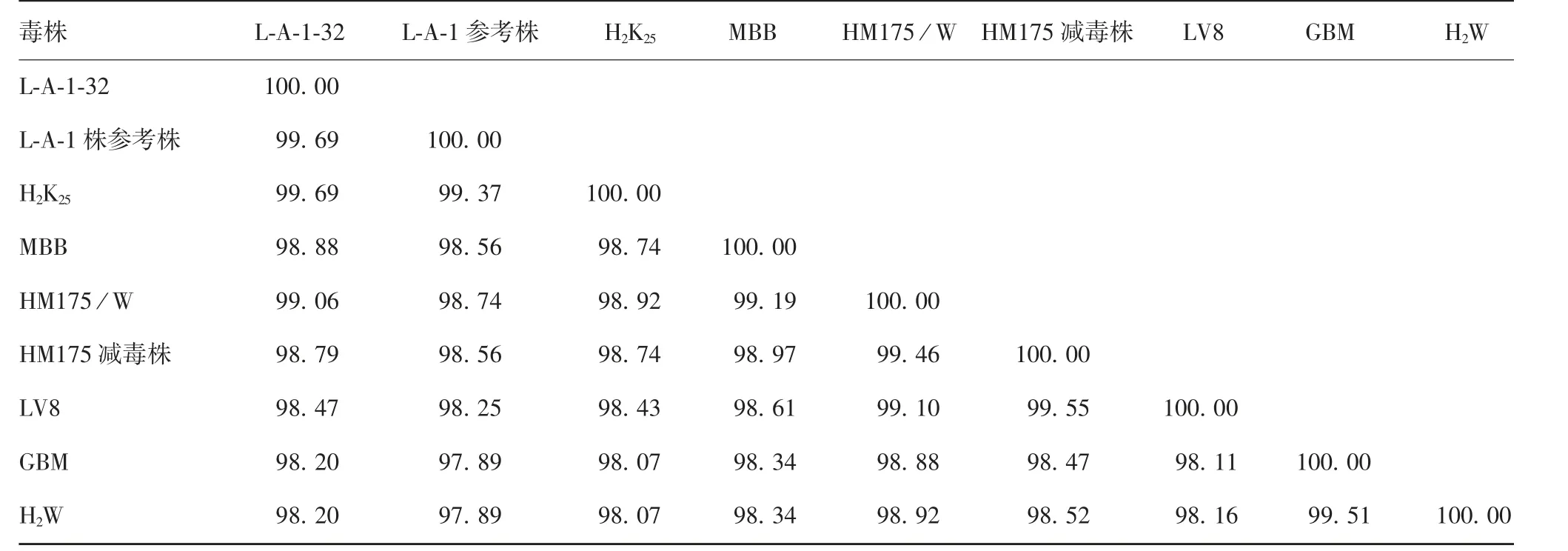
表5 L-A-1-32代次病毒与国内外主要病毒株氨基酸的同源性(%)Tab.5 Homologies of amino acids of L-A-1 strain of passage 32 to those of major virus strains at home and abroad(%)
2.5 HA V L-A-1株与国内外主要HA V病毒株VP1区氨基酸序列比对 各毒株间有5处氨基酸序列不一致。其中,有2处发生在GBM株及H2W株VP1的第28及296位氨基酸,均由K变为R;LV8株VP1的第17位氨基酸由V变为D;MBB株VP1的第147位氨基酸由T变为I;HM175减毒株和LV8株VP1的第272位氨基酸由E变为V。L-A-1-32代次病毒与参考株(AF314208)和H2K25减毒株VP1区氨基酸序列完全一致,表明HAV L-A-1株VP1蛋白具有良好的遗传稳定性,见图2。

图2 HAV L-A-1株与国内外主要HAV毒株VP1区的氨基酸序列Fig.2 Comparison of VP1 amino acid sequences in VP1 region of L-A-1 with those of major virus strains at home and abroad
2.6 HA V L-A-1株与国内外主要HA V毒株VP3区氨基酸序列比对 各毒株VP3间有2处氨基酸序列不一致,H2W株VP3的第32位氨基酸由Q变为P;H2W株和GBM株的第144位氨基酸由S变为T;L-A-1-32代次病毒与参考株(AF314208)和H2K25减毒株VP3区氨基酸序列完全一致,见图3。表明HAV L-A-1株VP3蛋白具有良好的遗传稳定性。

图3 HAV L-A-1株与国内外主要HAV毒株VP3区的氨基酸序列Fig.3 Comparison of VP1 amino acid sequences in VP3 region of L-A-1 with those of major virus strains at home and abroad
2.7 HA V L-A-1株的免疫原性 L-A-1-23组、L-A-1-24组、L-A-1-26组、L-A-1-28组、L-A-1-32组免疫后小鼠血清抗体效价分别为(684.69±5.95)、(750.93±14.47)、(997.84±2.60)、(854.16±15.60)、(850.11±6.20)m IU/mL,组间差异无统计学意义(F=1.491,P>0.05),阳转率均为100%,阴性对照组和空白对照组小鼠血清抗体检测均为阴性。
3 讨论
HAV L-A-1株的传代稳定性在疫苗质量控制中具有重要意义。本研究将HAV L-A-1株在2BS细胞上连续传代至32代,采用RT-PCR法对不同代次病毒全基因组序列进行了测定,结果显示,HAV L-A-1株23、24、26、28和32代次病毒间核苷酸和氨基酸序列同源性均为100%;病毒滴度均在7.00 lgCCID50/mL以上,符合《中国药典》三部(2015版)[12]相关要求,且抗原含量相对比较稳定。表明HAV L-A-1株在传代过程中保持了良好的抗原性和感染性,且具有良好的遗传稳定性。
将L-A-1-32代次病毒与GenBank中登录的目前国内外主要HAV毒株进行基因序列比对,结果表明,国内外主要的HAV毒株氨基酸序列同源性达98%以上,L-A-1-32代次病毒与L-A-1株参考株(AF314208)核苷酸和氨基酸序列同源性分别为99.70%和99.69,与MBB和H2K25核苷酸序列同源性分别为98.84%和98.13%,与H2W株核苷酸序列同源性最低,为91.40%;L-A-1-32代次病毒与H2K25株氨基酸序列同源性最高,为99.69%,与GBM和H2W株氨基酸序列同源性最低,为98.20%。表明国内外主要的HAV株间氨基酸序列同源性较高。
HAV只有一个血清型,其基因组VP1和VP3区是主要的抗原区域,本研究进一步对HAV L-A-1株与国内外主要HAV株基因组VP1和VP3蛋白区域的氨基酸序列进行分析比较,结果表明,在VP1区HAV L-A-1株与各病毒株之间有5处氨基酸序列不一致,其中2处发生在GBM和H2W株,LV8株、MBB株和HM175减毒株和LV8株各1处;在VP3区各病毒株间有2处氨基酸序列不一致,L-A-1-32代次病毒与参考株(AF314208)和H2K25株VP1和VP3区氨基酸序列完全一致。表明国内使用的甲型肝炎减毒活疫苗株的主要抗原位点氨基酸序列保守,该结果与文献报道[9,13-15]一致,且VP1和VP3区基因结构的稳定性极少由于细胞株更改而发生变异。
为进一步评价HAV L-A-1株不同代次的免疫原性,用L-A-1株23、24、26、28和32代次病毒液的纯化产物免疫小鼠,结果表明,均可诱导小鼠产生抗体,阳转率为100%,表明不同代次L-A-1株病毒具有良好的免疫原性。综上所述,HAV L-A-1株在2BS细胞连续传代后,具有良好的遗传稳定性。本研究为疫苗的质量控制及灭活疫苗的研发提供了实验依据。

