盐酸西那卡塞纳米结晶的制备及体外溶出度研究
张庆明,徐云燕,夏 超
0 引 言
盐酸西那卡塞(cinacalcet hydrochloride,CINA)是美国药品食品监督管理局(FDA)批准的第一个钙敏感受体激动剂,成为治疗继发性甲状旁腺功能亢进的主要药物[1]。它能有效地抑制甲状旁腺组织的增殖,减少甲状旁腺激素的分泌,保护骨骼等靶器官[2]。现有的CINA剂型是Amgen公司的一种商品名为Sensipar®的片剂。然而,Sensipar®片的CINA溶出率缓慢导致其在体内的生物利用度较低[3]。此外,其受食物种类的影响较大,需要与食物一起服用增强吸收,这导致该药餐前餐后的生物利用度相差较大,因此CINA的临床应用中患者依从性差[4]。许多学者对此进行了研究:Yang等[5]制备固体分散片来提高CINA的溶解效率;Cao等[6]开发了一种无食物效应的CINA自微乳化给药系统。有文献表明纳米结晶是一种很有前景的制剂手段,它可以提高药物的安全性、溶出度、口服生物利用度,以及消除空饱腹状态之间的差异[7-10]。本研究利用纳米结晶制备盐酸西那卡塞纳米结晶(CINA-NCs)来提高CINA的溶解度和体外溶出度,以期提高其生物利用度,从而提高药效。
1 材料与方法
1.1 仪器与试药高效液相色谱仪(LA-20A,日本岛津),冷冻干燥机(中国新芝生物科技有限公司),旋转蒸发仪(RE-200A,中国上海亚荣生化仪器厂),马尔文粒度仪Zetasizer(Nano ZS90,Malven Instruments,英国),超声仪(中国宁波善思生物科技有限公司),差示扫描量热仪(STA449C,NerzschCo.Ltd,德国),扫描电镜(S-4800, Hitachi Ltd,Tokyo, 日本)。X-射线粉末衍射仪(GNR APD2000,意大利),涡旋混合器(WH-2,中国上海湖西分析仪器厂),恒温振荡培养箱(THz-98B,中国上海益恒科学仪器有限公司)。CINA(纯度99%以上)购自江苏恒瑞药业有限公司,批号20170603(中国江苏)。无水乙醇购自无锡亚盛化工有限公司(江苏)。聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(Soluplus)是从德国巴斯夫公司采购的。滑石粉来自上海阿拉丁生物化学科技有限公司(中国上海)。微晶纤维素(MCC)购自武汉胜天宇生物有限公司(中国湖北)。交联羧甲基纤维素钠(CCNa)来源于上海华威药业科技有限公司(中国上海)。实验室自制双蒸水。实验中使用的其余材料都是分析级的。
1.2方法
1.2.1 纳米结晶的制备采用沉淀-超声法制备CINA-NCs。将100 mg的CINA分散在1 mL的无水乙醇中作为有机相,将100 mg的Soluplus溶解在50 mL的双蒸水中作为水相。有机相在冰浴中快速注入到水相中。然后用超声波处理混合物。超声状态参数设定为3 s,间隔2 s,400 W,30 min。通过蒸馏脱除乙醇,最终得到CINA-NCs。在制备过程中,考察有机相中CINA浓度、稳定剂浓度、水相与有机相体积比、超声功率输入、超声时间等因素对纳米颗粒的质量的影响。通过单因素实验,选择Soluplus作为稳定剂,并通过肉眼观察CINA-NCs的形态,然后测定粒度和多分散指数(polydispersity index,PDI)为评价指标。
1.2.2响应面法(Box-Behnken)设计采用Box-Behnken设计进一步优化处方[11]。设计中考虑了三个因素和三个水平,见表1。这三个因素分别是A:有机相中的CINA浓度、B:稳定剂浓度、C:水相与有机相体积比。实验由软件Design-Expert8.0.6 (StatEase Inc.,USA)设计,每个实验执行3次。
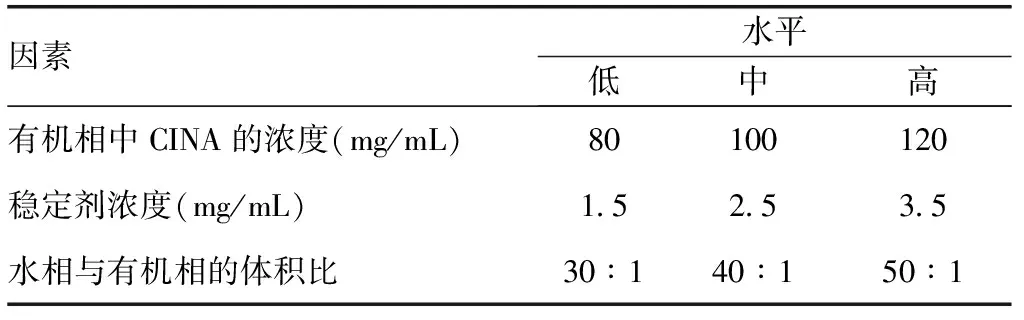
表 1 盐酸西那卡塞纳米结晶制备优化处方的响应面法Box-Behnken设计
1.2.3冷冻干燥采用冷冻干燥机对优化后的CINA-NCs进行冷冻干燥制得冻干粉。将三批冻干样品放入小瓶中,在低于-60 ℃的冷阱中预冻12 h,然后将样品在0.01 kPa真空、-50 ℃下冷冻干燥48 h,得到冷冻干燥的CINA-NCs。考察冻干粉在双蒸水中的再分散性。另外,对冻干前后的颗粒大小和PDI进行评价,以考察冻干前后的差异。
1.2.4冻干CINA-NCs的表征①颗粒大小、PDI和Zeta电位测定。取出适量冻干的CINA-NCs,分散在双蒸水中。然后将溶液稀释到合适的浓度。用马尔文粒度仪测定其粒径、PDI和Zeta电位,每个实验进行3次。②差示扫描量热[12]。采用差示扫描量热仪(DSC),以铝坩埚为参照物,对适量的CINA原料药、Soluplus、物理混合物(处方比例的CINA、Soluplus)以及冻干CINA-NCs进行分析。加热范围为30~250 ℃,速度为每分钟10 ℃。③X射线粉末衍射测试。分别取CINA原料药、Soluplus、物理混合物(处方比例的CINA、Soluplus)和冻干CINA-NCs适量,进行X射线粉末衍射仪(XRPD)分析,具体的测试条件为:铜靶,加速电压:40 kV;加速电流:40 mA;衍射角(2θ) 4°/min,扫描范围:5~50°[13]。④原料药、样品观察。5 kV加速电压下,用扫描电镜(SEM)观察CINA原料药和CINA-NCs的形貌[14]。用金-钯溅射后,对样品进行观察。⑤饱和溶解度分析。将过量的CINA原料药、CINA和Soluplus的混合物和冻干CINA-NCs分别加入5 mL双蒸水中,涡旋混合。然后将混合物置于恒温振荡培养箱中,在25 ℃,300 r/min下孵育48 h,平衡后,将样品以5000 r/min的速度离心10 min,然后将样品放入恒温振荡培养箱,转速为300 r/min,孵化48 h,平衡后,将样品以5000 r/min的转速离心10 min。上清液过滤(0.45 μm),适当稀释后用高效液相色谱法分析饱和溶解度。
1.2.5稳定性研究对冻干CINA-NCs进行室温下0~6个月的稳定性研究。考察冻干CINA-NCs在室温下6个月的稳定性。即将冻干的CINA-NCs保存在密闭的小瓶中,定期取出适量的CINA-NCs,在0、1、2、3、6个月的预定时间点进行复溶分析。以粒径和PDI为评价指标。每个样品都进行3次分析,以减少误差。
1.2.6CINA-NCs胶囊的制备及体外溶出度研究以MCC为填充剂,CCNa为崩解剂,滑石粉为润滑剂,将30 mg冻干CINA-NCs制成胶囊。采用正交试验设计对胶囊剂的处方进行研究,以不同处方制备的胶囊剂在pH 6.8磷酸盐缓冲液(PBS)中30 min的累积溶出度进行评价,见表2。以体外溶出度为指标考察胶囊剂的最佳溶出度。以《中国药典》2015年版方法为基础,采用浆法测定胶囊、市售片(Sensipar®)和原料药的体外溶出度。溶出介质分别为pH 1.2盐酸缓冲液、pH 4.5醋酸缓冲液、pH 6.8磷酸盐缓冲液和水。将样品放入900 mL的培养基中,搅拌速度为75 r/min,37 ℃,然后在5、10、15、20、30、45、60和90 min取出样品5 mL,加入等量的缓冲液以保持缓冲液体积恒定。样品经0.45 μm滤膜过滤后,用高效液相色谱法测定CINA的含量。
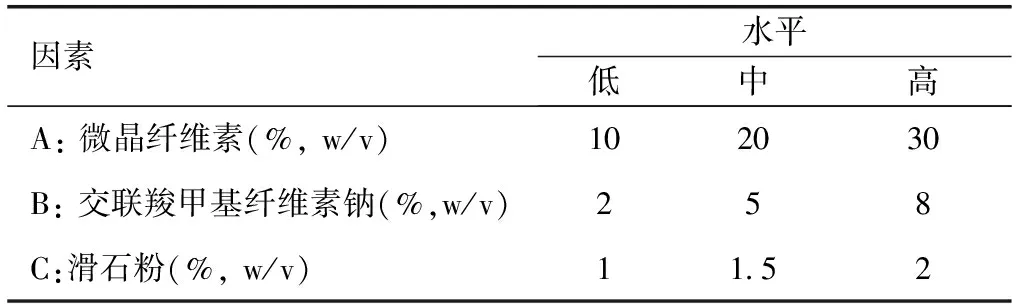
表2 盐酸西那卡塞纳米结晶胶囊剂三因素三水平正交试验设计
2 结 果
2.1 因素考察
2.1.1 有机相中CINA的浓度当浓度从80 mg/mL增加到120 mg/mL时,粒径和PDI变化不大,但当浓度大于120 mg/mL时,粒径和PDI明显增加。初步测定有机相中CINA的浓度范围为80~100 mg/mL。见图1a。
2.1.2稳定剂浓度当CINA浓度为100 mg/mL时,由于弱立体效应,当其他因素保持不变时,随着稳定剂浓度的增加,粒径先减小后增大。当稳定剂浓度大于3.5 mg/mL时,由于颗粒的聚集,促进了奥斯瓦尔德熟化。因此,初步确定了Soluplus的浓度范围为1.5~3.5 mg/mL。见图1b。
2.1.3水相与有机相的体积比当体积比在30∶1到60∶1时,粒径变化不大。较大的颗粒尺寸使超声难以进行,这可能是由于粘性悬浮液在比例为20∶1时造成的,因此最佳的体积比为30∶1~50∶1。见图1c。
2.1.4超声波因素随着超声时间的延长,粒径和PDI先减小后增大,见图1d。最佳超声时间为30 min,当超声时间超过30 min时,颗粒尺寸和PDI开始增大。超声波功率输入越强,颗粒越小,见图1e。但是,当功率输入大于400 W时,由于纳米结晶的不稳定性,颗粒尺寸和PDI变大。因此,当功率为400 W时,可以获得最佳的纳米结晶。
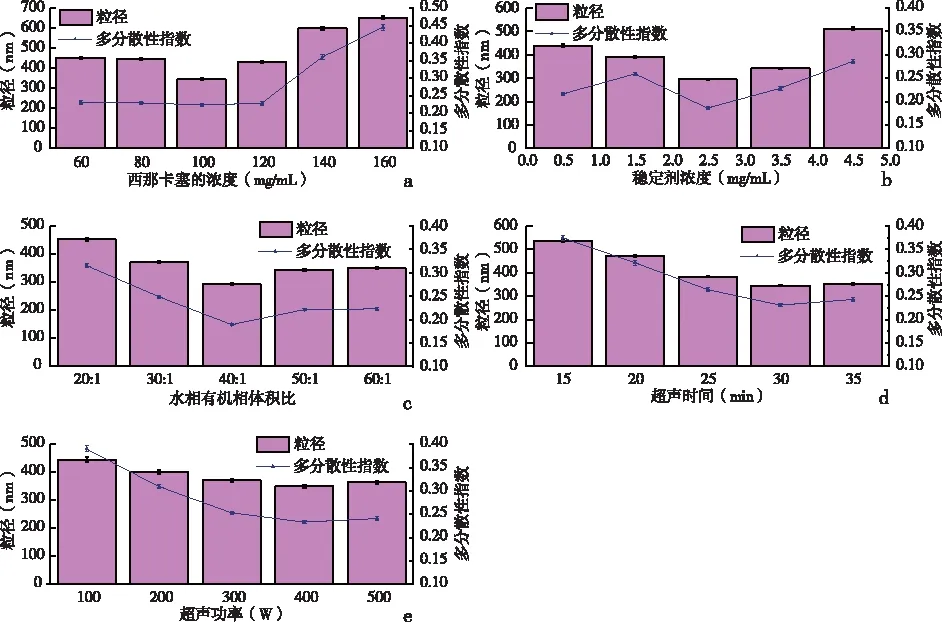
a: 有机相中不同CINA浓度;b: 不同稳定剂浓度;c: 不同水相与有机相体积比; d: 超声时间; e: 超声功率
2.2配方优化粒径和PDI随稳定剂浓度和CINA浓度的增加先减小后增大。在一定范围内,体积比的增加导致颗粒尺寸和PDI的减小。随着体积比和稳定剂浓度的增加,粒径和PDI先减小后增大。见图2。总的来说,模型揭示了粒径和PDI在一定范围内有最小值。A(有机相中的CINA浓度)、B(稳定剂浓度)、C(水相与有机相的体积比)的多项式回归方程如下:
R1(粒径)=248.35-53.12A-31.42B-19.82C-27.34AB-17.44AC+ 7.71BC+137.60A2+22.72B2+118.92C2
(R2=0.9941,P<0.0001)
R2(PDI)=0.17-0.034A-0.021B-0.014C-0.017AB-0.011AC+0.005235BC+0.088A2+0.03B2+0.076C2
(R2=0.9934,P<0.0001)
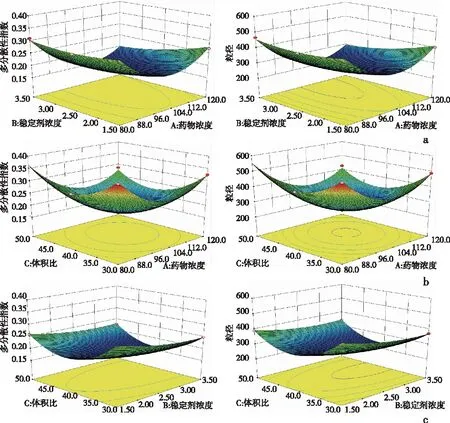
a:有机相中的CINA浓度; b:稳定剂浓度; c: 水相与有机相的体积比
从回归方程和响应面结果来看,CINA在有机相中浓度为108 mg/mL、Soluplus浓度为2.7 mg/mL、水相与有机相的比例为40∶1时获得最佳配方。同时,将超声功率输入和持续时间设定为400 W,30 min。根据最佳配方,考察颗粒大小为(244±2)nm,PDI为0.168±0.001。
2.3冻干及稳定性研究冻干粉的再分散性研究中发现,制备得到的纳米结晶冻干粉的分散率较好,且颗粒大小和PDI变化不大,见表3。
2.4性状
2.4.1 粒径、PDI和Zeta电位优化后的冻干CINA-NCs的粒径为(257.3±13.740)nm,PDI为0.185±0.002,Zeta电位为(-31.7±0.012)mV。
2.4.2差示扫描量热通过差示扫描量热法显示CINA原料药、Soluplus、物理混合物和冻干CINA-NCs的温度曲线,见图3。CINA原料药在180 ℃时有明显的吸热尖峰,而在171 ℃时由于晶体形态的不同也有微弱的吸热峰。物理混合物的热像图与原料药的相似。此外,在180 ℃时,CINA-NCs的热像图中有一个弱吸热峰。上述现象可以证明CINA-NCs中CINA的结晶状态在制备和冻干过程中没有本质上的变化,但是由于晶体更小,所以峰强度变弱。
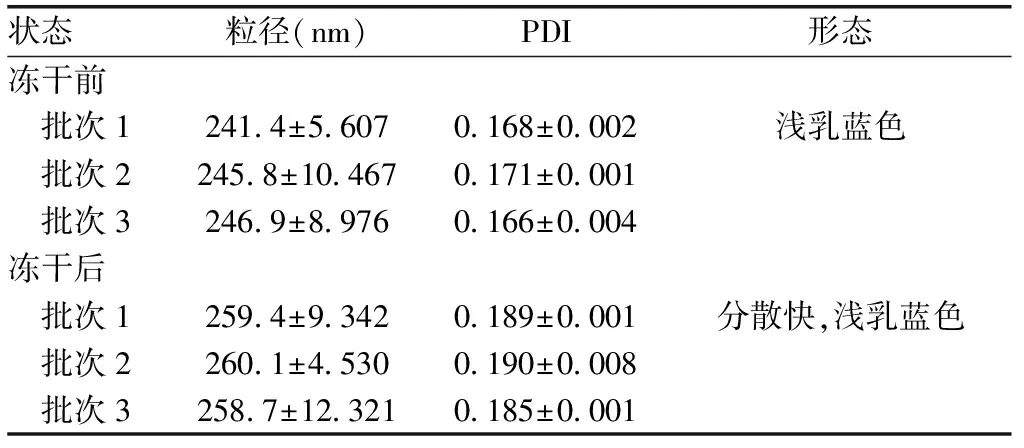
表3 三批冻干CINA-NCs样品的再分散性试验结果
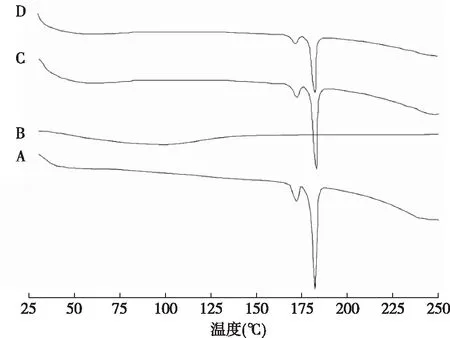
a: CINA原料药; b: Soluplus;c: CINA原料药和Soluplus物理混合物; d: CINA纳米结晶
2.4.3X-射线粉末衍射XRPD进一步证实了CINA的结晶状态,见图4。CINA原料药在4°、11°、14°、18°和26°处呈现明显的峰型。由于其无定型结构,Soluplus呈现出驼峰。冻干后的CINA-NCs呈现出CINA的特征峰。但冻干粉末的峰值强度比物理混合物弱。峰值强度的降低可能是由于制备过程中CINA-NCs的粒径减小所致。
2.4.4扫描电镜结果CINA原料药呈棒状,粒径分布较宽。而Soluplus具有巨大的球形性。物理混合物清楚地呈现出棒状CINA原料药和球形Soluplus的简单混合物。相比之下,Soluplus显示为大量的薄片。冻干CINA-NCs的形貌呈宽粒径范围的纳米球,从图上方框的放大图中可以看出,很明显镶嵌在Soluplus片状中。见图5。
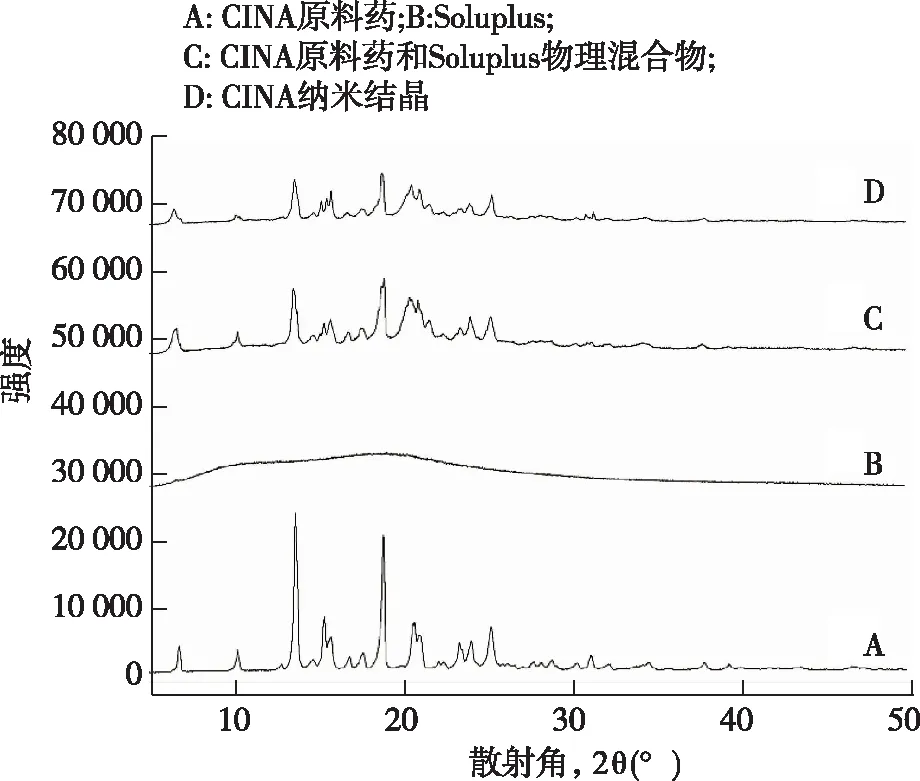
图4 粉末X射线衍射图

a: CINA原料药;b:Soluplus;c: CINA原料药和Soluplus物理混合物;d: CINA纳米结晶[D(2)为图中小红框的局部放大图]
2.4.5饱和溶解度25 ℃时,CINA原料药、物理混合物和冻干CINA-NCs在双蒸水中的饱和溶解度分别为35.20 μg/mL、178.53 μg/mL、2.67 mg/mL。冻干粉的溶解度明显大于原料药和物理混合物,进一步表明纳米结晶能显著提高CINA的溶解度。
2.5稳定性研究根据长期稳定性研究结果,粒径和PDI差异不明显,见表4。结果表明,冷冻干燥的CINA-NCs在室温下0~6个月物理性质稳定,符合要求。

表4 CINA-NC冻干粉的稳定性试验结果
2.6胶囊的最佳处方及体外溶出度研究胶囊的最佳配方由30 mg冻干CINA-NCs、30%(w/v)MCC、8%(w/v)CCNa和2%(w/v)滑石粉组成,见表5。制备的CINA-NCs胶囊在四种不同介质中的累积溶出度值均大于95%,溶出速率明显大于市售片剂和原料药。此外,通过数据可以证实胶囊的溶解不受pH值的影响。见图6。
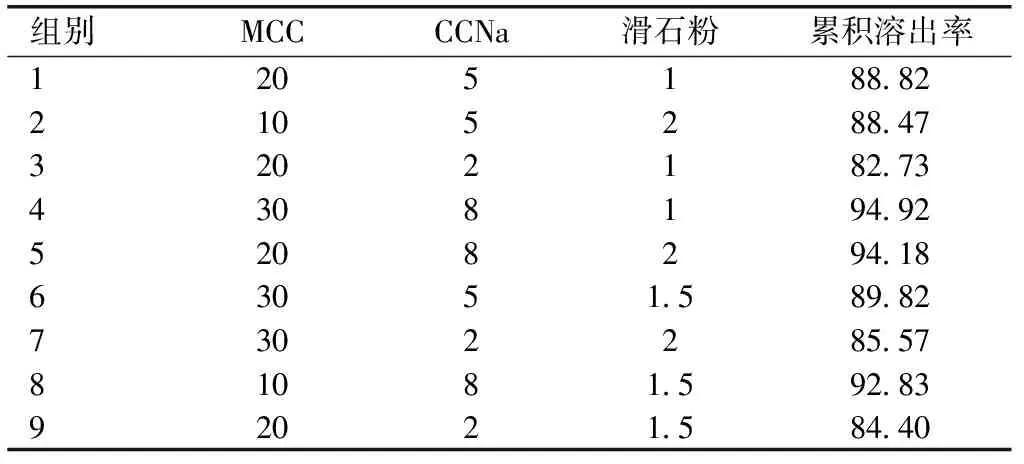
表5 胶囊处方筛选的正交试验设计及结果(%,w/v)
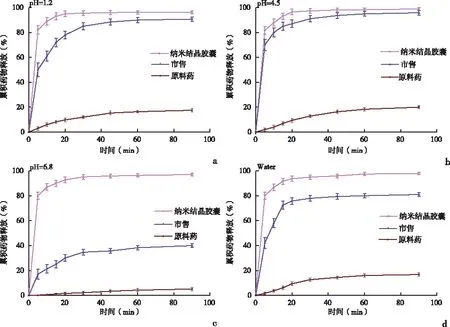
a:pH 1.2 盐酸缓冲液; b:pH 4.5 醋酸缓冲液; c:pH 6.8 PBS;d:水
3 讨 论
本研究采用沉淀-超声法制备CINA-NCs。采用单因素法进行初步优化,并采用Box-Behnken设计法成功筛选出最优处方。采用冷冻干燥法对CINA-NCs进行干燥,并用DSC和XRPD对其进行了表征,表明其结晶状态没有本质的变化,DSC峰值强度的降低可能是由于制备过程中CINA-NCs的粒径减小所致。根据Noyes-Whitney方程,具有大表面积的小颗粒尺寸可以增加溶解速率[15-16],所以制备的CINA-NCs溶出度较高。溶出度研究进一步证实了该纳米结晶具有促进溶出的作用。利用扫描电镜对冻干后的CINA-NCs进行了形态观察,进一步证明了在制备过程和冻干过程中,CINA-NCs的结晶状态变化不大。
因为市售Sensipar®在pH 4.5的醋酸缓冲液中的累积溶出度最高,在pH 1.2的盐酸缓冲液中以80.5%位居第二。然而,在pH 6.8 PBS中的累积溶解率仅为40.01%,这证实了Sensipar®的溶解度取决于pH值。实验中发现CINA原料药在pH 1.2盐酸缓冲液、pH 4.5醋酸缓冲液、pH 6.8 PBS和水中的累积溶出度分别为17.45%、19.98%、5.12%和16.79%,溶出率极低,且受pH值的影响较大。然而,本实验制备CINA-NCs胶囊在四种不同介质中的累积溶出度值均大于95%,溶出速率明显大于市售片剂和原料药。此外,实验数据表明本实验制备的胶囊溶解性能不受pH值的影响。
综上所述,纳米结晶是一种很有前途的技术,CINA-NCs可以改善难溶性药物CINA的溶解度,提高口服生物利用度,从而提高药效。

