长链非编码RNA ReCAL作为肾透明细胞癌预后标志物和靶向治疗反应预测因子的研究
钟 科,唐富豪,潘 鑫,张征宇
0 引 言
肾细胞癌(renal cell carcinoma,RCC)是最常见的肾癌,2017年在美国确诊近63 990例,其中死亡人数高达14 400[1]。肾细胞癌70%以上为肾透明细胞癌(clear cell RCC,ccRCC),大部分病例为散发性[2]。虽然大多数局限性肾癌患者肿瘤生长缓慢,呈非致死性,但是大约四分之一的患者在部分或根治性肾切除术后发生了疾病进展和转移[3-4]。为了区分惰性肿瘤和侵袭性肿瘤,目前临床指南主要以肿瘤的大小、分期和分级作为依据,这些都不包含任何分子生物标记物[5-6]。然而,即使是根据这些临床指南所定义的低风险的患者也可能会发生疾病进展和肿瘤复发[7]。一些研究报告了某些特定分子有助于ccRCC的风险分层,如ClearCode34和复发评分[8-9],但其临床应用可能太昂贵和复杂。因此,有必要寻找一种可以准确有效地对ccRCC患者预后进行分层的新的预后生物标记物。
长链非编码RNA(long noncoding RNAs,lncRNAs)已被证实在肿瘤发展中具有重要作用[10-12]。我们以前对lncRNAs的功能进行了广泛的研究,特别是在ccRCC进展和靶向治疗抵抗方面[13-15]。近年来,随着RNA测序的进展,已经发现了大量lncRNAs可以作为一类新的预后生物标记物[16-17]。基于ccRCC的这些临床需要和lncRNAs作为肿瘤生物标记物的潜在优势[18],本研究对来自3个独立ccRCC队列的转录组数据进行分析,以确定与患者预后相关的lncRNAs,随后在多个独立的ccRCC队列中进行验证。
1 材料与方法
1.1 研究设计本研究遵循肿瘤标志物预后研究(REMARK)标准[19]的报告建议,并得到了所有机构审查委员会的批准。肿瘤样本和临床数据是在长海医院、长征医院、东部战区总医院伦理委员会批准和患者知情同意下获得[13-15,20-22]。本研究在3个有可用RNA测序数据和临床注释的ccRCC患者队列中进行:①来自TCGA(癌症基因组图谱)数据库(美国队列)的530个原发肿瘤和72个匹配的相邻正常组织[22],②来自EGA(欧洲基因组表型档案)数据库(日本队列)的100个原发肿瘤[21],③来自ICGC(国际癌症基因组联盟)数据库(欧洲队列)的91个原发肿瘤和45个匹配的邻近正常组织[20],具体流程见图1。验证研究在多中心队列中进行,包括来自长海医院的1326例ccRCC患者、来自长征医院的353例ccRCC患者和来自东部战区总医院的229例ccRCC患者。在验证队列中连续采集了从2004年到2012年的组织样本。这些队列包括有临床病理特征和随访资料的患者,中位随访时间为96个月。
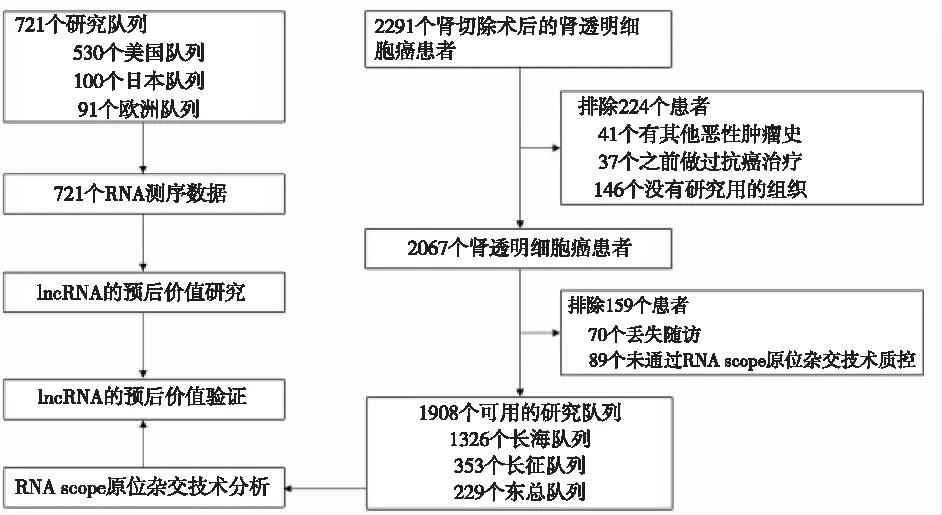
图1 肾透明细胞癌患者队列的研究流程图
1.2 方法开发一种综合数据挖掘策略来识别3个筛选队列中的预测候选lncRNA:为了确定ccRCC中高度可靠的预后lncRNA,对3个研究队列[①来自TCGA数据库(美国队列,中位随访40个月),②来自EGA数据库(EGAS0001000509,日本队列,中位随访50.5个月),③来自ICGC数据库(欧洲队列,中位随访58.9个月)] 进行研究,获得准确的lncRNA注释集,筛选出基因组定位中与蛋白质编码基因重叠的lncRNAs(GENCODE版本19注释),并对7070个lncRNAs进行分析。然后,考虑在每个队列中至少80%的样本中表达值大于零的lncRNAs用于下游分析。对所选lncRNA的预后价值进行验证:为了验证ReCAL评估患者预后的能力,使用RNA原位杂交技术(RNA scope)检测长海队列(n=1326)、长征队列(n=353)和东总队列(n=229)三家独立医院1908例ccRCC患者ReCAL的表达。进一步评估在用Mayo Clinic SSIGN评分分层的患者中ReCAL的评估预后能力。对98例接受舒尼替尼或索拉非尼治疗的患者进行lncRNA表达与临床预后的关系分析。主要临床终点是总生存期(overall survival,OS)。采用单变量和多变量Cox回归、Kaplan-Meier曲线评估lncRNA表达与临床终点的相关性。
1.3 统计学分析采用SPSS 16.0软件(SPSS Inc., USA)进行统计分析。以频率和百分比描述患者的临床病理特征。用χ2检验或Fisher精确检验估计ReCAL表达水平与临床变量的相关性。t检验用于检验两组间的ReCAL表达差异。用Kaplan-Meier方法估计事件发生的时间,用log-rank检验评估患者特征之间的比较。应用多变量Cox比例风险模型来评估有意义和无意义的预测协变量对总生存期(overall survival,OS)的影响,并在Cox模型中报告风险比(hazard ratios,HR)[23-26]。使用Kaplan-Meier生存曲线来评估Cox回归模型中风险的占比。所有统计检验均为双侧,以P≤0.05为差异有统计学意义。
2 结 果
2.1 多数据集分析证实长链非编码RNA ReCAL是ccRCC的预后生物标志物每个数据集中得到大约1695个lncRNAs。在研究队列中,单变量Cox回归分析显示,29个lncRNA的表达与3个队列的生存率显著相关(P<0.05)。接下来,分别以29个lncRNA的表达中值作为界值将患者分为高表达组和低表达组,并评估2组总体生存期差异。确定了一个独特的lncRNA,该基因在RefSeq参考序列数据库中被注释为LINC01410(集成基因注释ENSG0000238113),它显示了3个队列和集合队列中高表达组和低表达组之间最显著的差异生存率,见图2a-2d。根据其与ccRCC预后的关系,将该基因命名为“与肾癌相关的LincRNA”(renal cancer associated LincRNA,ReCAL)。多变量Cox回归分析表明,高表达ReCAL是ccRCC患者预后不良的独立预测因素(美国队列:HR:1.420,95%CI:1.040~1.939,P=0.027;日本队列:HR:3.658,95%CI:1.457~9.181;P=0.006;欧洲队列:HR:1.630,95%CI:0.732~3.630;P=0.232),见表1。此外,探讨连续的ReCAL表达与OS的关系发现,在所有3个队列中,随着ReCAL表达的增加,低OS的风险呈线性增长(美国队列:HR:1.736;95%CI:1.416~2.129;P=1.141E-7;日本队列:HR:1.711;95%CI:1.161~2.522;P=0.007;欧洲队列:HR:2.257;95%CI:1.105~4.609;P=0.025),见表1。
2.2 通过多队列研究验证了ReCAL评估患者预后的能力ccRCC肿瘤中ReCAL的代表性染色见图3a,通过RNA scope和实时荧光定量PCR(qRT-PCR)结果的比较,证实了ReCAL探针的特异性,见图3b。以中位数为界将ReCAL的表达分为高表达组和低表达组。在所有3个验证队列和集合队列中,与低表达组的患者相比,ReCAL高表达组的患者预后较差,见图2e-2h。多变量Cox回归分析显示,在这些队列中高ReCAL表达与较短OS独立相关(长海队列:HR:2.180,95%CI:1.775~2.678,P=1.111E-13;长征队列:HR:2.735,95%CI:1.747~4.280,P=1.076E-5;东总队列:HR:2.113,95%CI:1.270~3.514,P=0.004),见表1。此外,当建模为连续变量时,发现随着ReCAL表达增加,低OS风险呈线性增长(长海队列:HR:3.391,95%CI:2.741~4.386,P=1.344E-14;长征队列:HR:2.473,95%CI:1.062~3.251,P=0.044;东总队列:HR:2.409,95%CI:1.097~3.210,P=0.037),见表1。
2.3 ReCAL在低危Mayo Clinic SSIGN评分肾透明细胞癌患者中尤其具有预后价值ReCAL评估预后的能力在低风险患者(SSIGN评分0~3)中最为明显,在中等风险患者(SSIGN评分4~7)中则较小,而在高风险患者(SSIGN评分>8)中最小,见图4。长海、长征和东总队列中高ReCAL表达的低风险患者发生ccRCC特异性死亡的可能性分别为低ReCAL表达组的5.854倍、8.15倍和3.091倍(95%CI:3.799~9.020,P=1.142E-15;95%CI:2.420~27.450,P=0.001;95%CI:1.458~6.555,P=0.003),见表2。中等风险患者中,长海队列ReCAL高表达的患者发生ccRCC特异性死亡的可能性是低ReCAL表达组的1.408倍(95%CI:1.055~1.879,P=0.02),而在其他两个队列中无显著相关性。在高风险患者中ReCAL的表达与ccRCC特异性死亡无显著相关性。
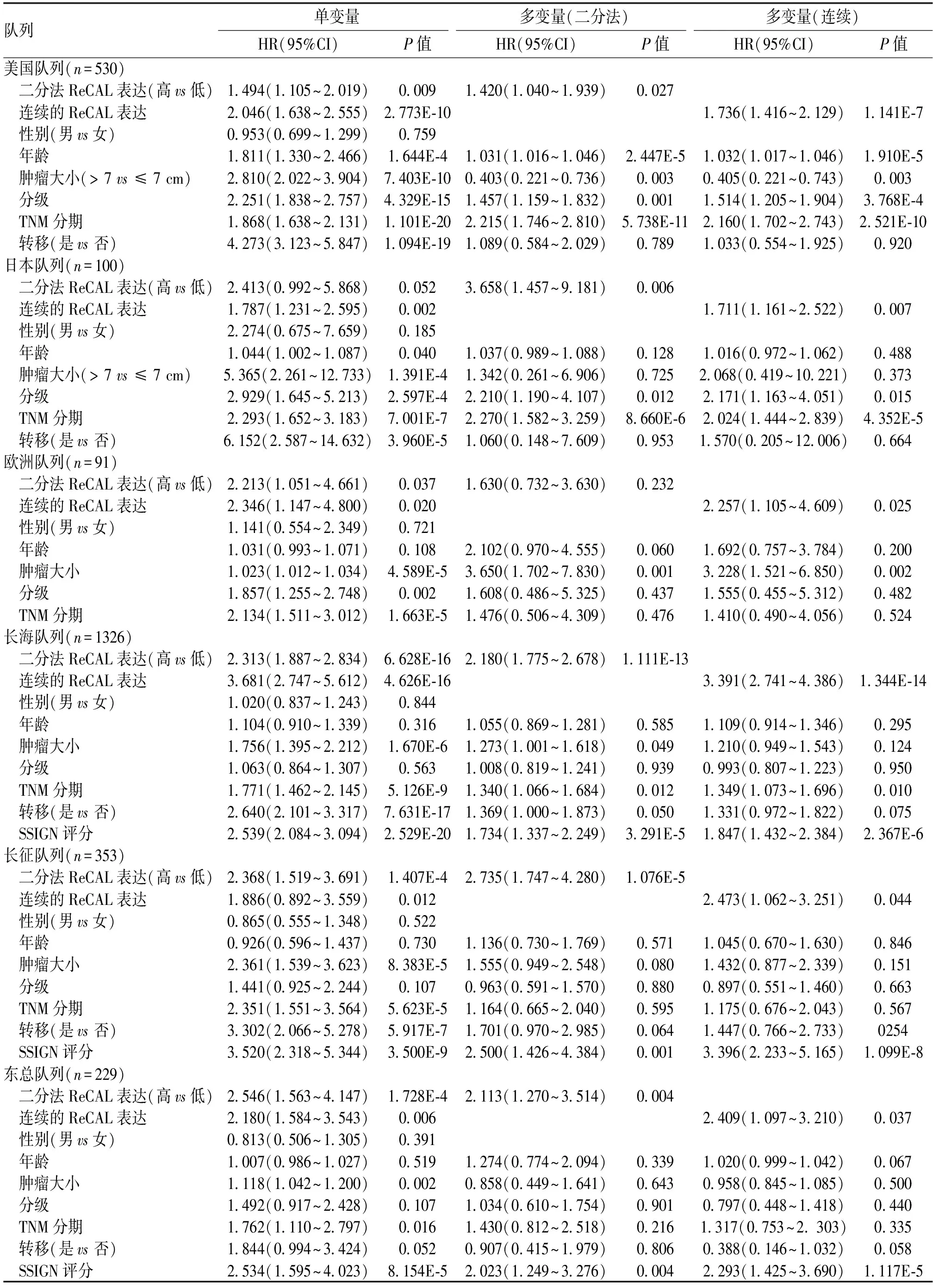
表1 研究队列和验证队列中肾透明细胞癌患者总体生存率相关因素的单变量和多变量分析
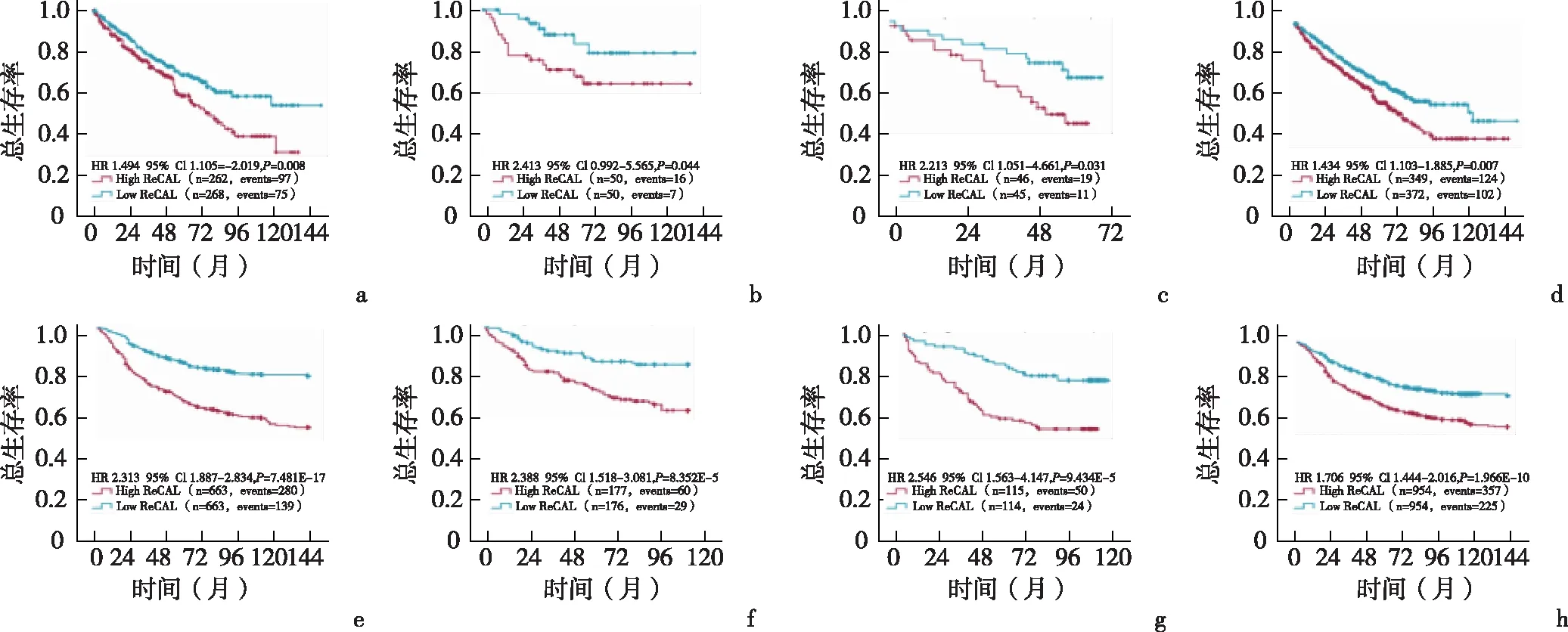
a:美国队列;b:日本队列;c:欧洲队列;d:联合研究队列;e:长海队列;f:长征队列;g:东总队列;h:联合验证队列图2 长链非编码RNAReCAL在肾透明细胞癌中的表达对3个研究队列和3个验证队列总生存率的生存曲线
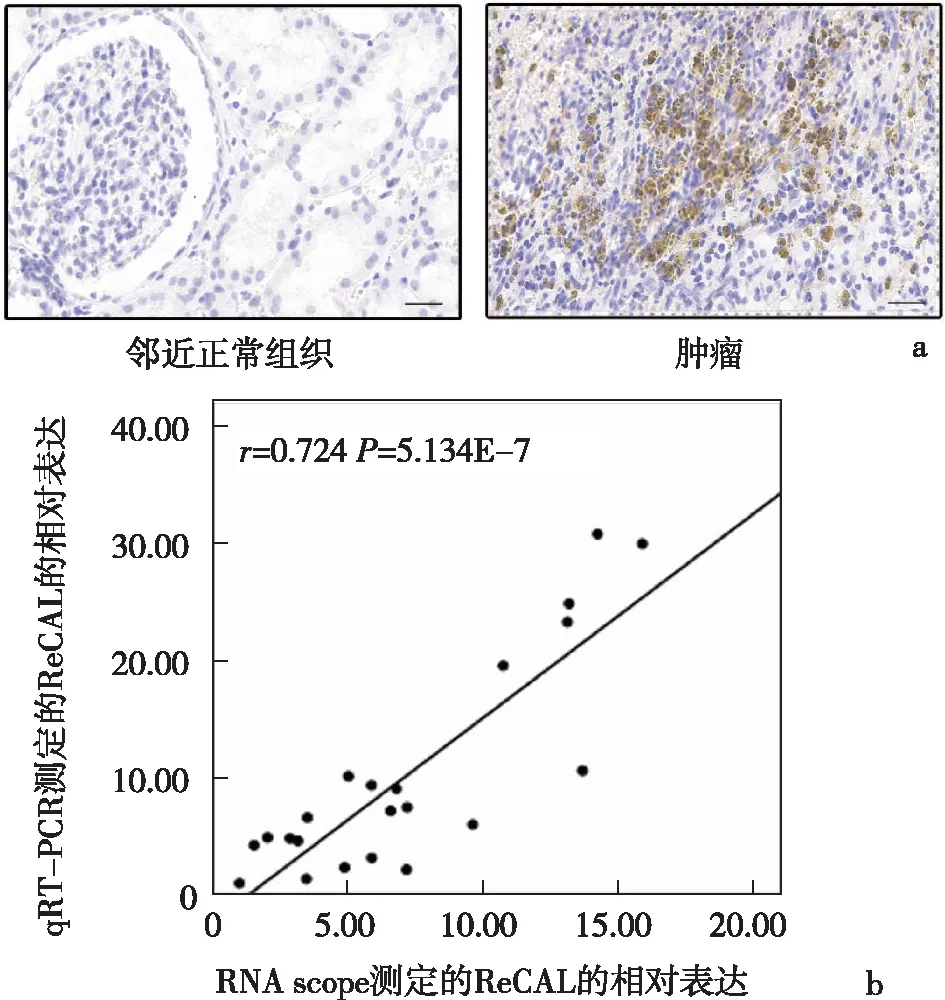
a:长链非编码RNA ReCAL的代表性染色;b:RNA scope和qRT-PCR结果图3 肾透明细胞癌患者肿瘤中长链非编码RNA ReCAL的表达
2.4 长链非编码RNA ReCAL表达与靶向治疗反应呈负相关与匹配的邻近正常组织相比,ReCAL在肿瘤中的表达显著上调,见图5。此外,与原发肿瘤相比,ReCAL在复发转移肿瘤中的表达较高(P=0.048),见图6a。探讨ReCAL是否可以作为评估靶向治疗反应的生物标记物时发现,与对新辅助舒尼替尼治疗有良好反应的患者相比,ReCAL在舒尼替尼治疗后复发的肾癌组织中富集(P=0.034),见图6b。为了确定接受靶向治疗的ccRCC患者的ReCAL表达与患者预后的关系,对先前报道的两组患者[13-15]进行评估发现,舒尼替尼或索拉非尼治疗对所有ccRCC患者无进展生存期的改善能力有限,而与对照组相比,低ReCAL表达的患者在接受靶向治疗后预后较好,高ReCAL表达的患者对靶向治疗反应不佳,见图7。这些结果提示ReCAL可以作为ccRCC患者评估靶向治疗反应的生物标志物。
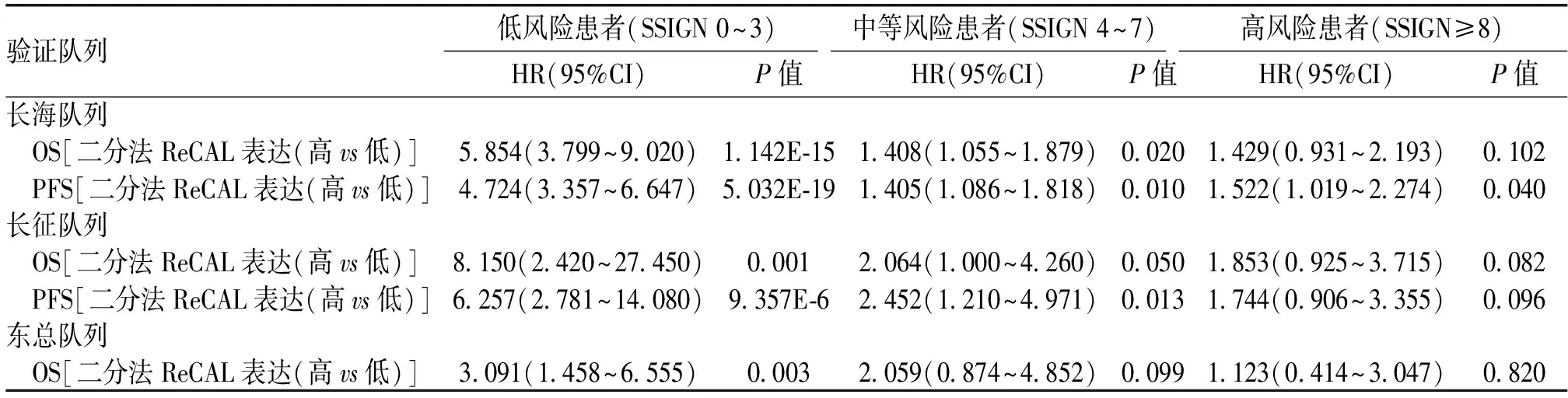
表2 不同Mayo Clinic SSIGN 评分患者的ReCAL表达对总生存期(OS)和无进展生存期(PFS)的分析

a、b、c:长海队列;d、e、f:长征队列;g、h、i:东总队列图4 3个验证队列不同Mayo Clinic SSIGN(分期、大小、分级和坏死)评分患者的ReCAL表达对总体生存率的生存曲线
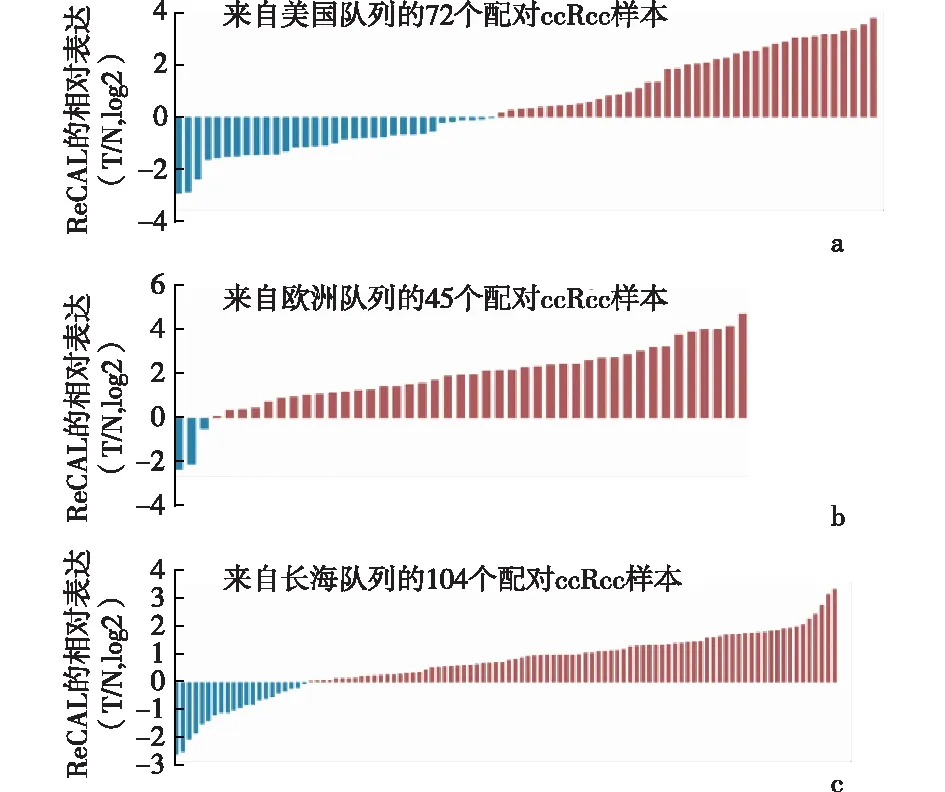
a: 美国队列;b:欧洲队列;c:长海队列图5 ReCAL表达在肿瘤中与匹配的邻近正常组织比较
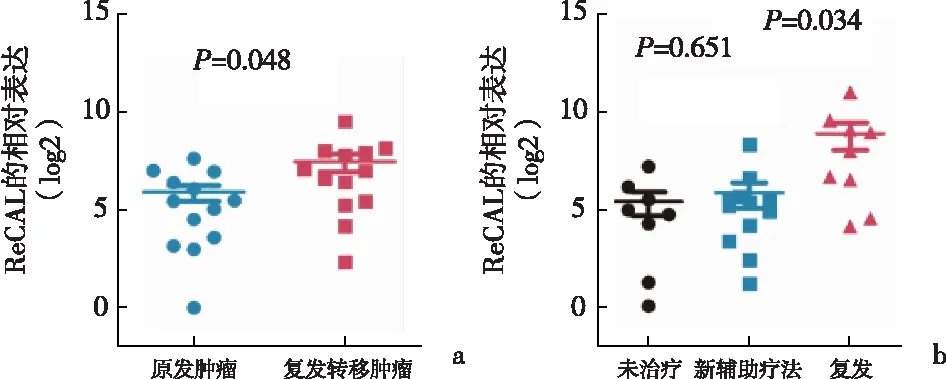
a:复发转移肿瘤中与原发肿瘤比较;b:舒尼替尼治疗后复发的患者肾癌组织中与对新辅助舒尼替尼治疗有良好反应的患者肾癌组织比较图6 在不同分组的组织中长链非编码RNA ReCAL的表达
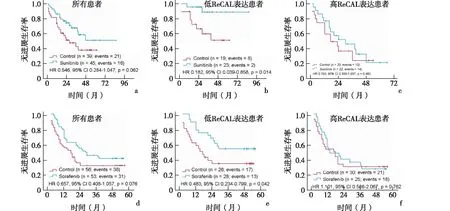
a、b、c:有或无舒尼替尼治疗的ccRCC患者无进展生存期的生存曲线;d、e、f:有或无索拉非尼治疗的ccRCC患者无进展生存期的生存曲线图7 肾透明细胞癌患者中长链非编码RNA ReCAL表达与靶向治疗反应的关系
3 讨 论
本研究证实了一种之前未报道的lncRNA,命名为ReCAL,其高表达与ccRCC患者的不良预后相关。值得注意的是,ReCAL评估预后的能力在低风险患者(SSIGN评分0~3)中最为明显。此外,本研究还发现ReCAL可以作为靶向治疗反应的独立预测因子。虽然以往的研究已经推荐了几种用于ccRCC风险分层的分子生物标记物,以及传统的临床病理参数,但是这些作为检测预后的可靠生物标记物的能力不足,并且这些研究大多集中于晚期ccRCC[27]。本研究确定并验证了lncRNAReCAL,它在6个独立的ccRCC患者队列中显示出显著的预后价值,表明了ReCAL在临床应用中的重要作用。
对于ccRCC患者的分层,ReCAL比经典的肿瘤分期和分级指标更能反映ccRCC复发风险。患者常常对术后可能发生转移性疾病感到不安,即使术后发生转移的风险很低。然而,大多数患者由于缺乏任何可以有效降低复发风险并最终保持健康的指导方针而恶化,例如早期发现复发性疾病的生物标志物和有效的治疗方案。在本研究分层分析中,ReCAL主要在根据标准临床病理指标SSIGN评分被归类为低风险的患者中表现出对评估预后的高效率。
三分之一被诊断为区域性或远处转移的ccRCC患者需要强化治疗,如靶向治疗[28]。血管内皮生长因子(VEGF)抑制剂或雷帕霉素靶蛋白(mTOR)信号通路是晚期ccRCC患者的标准治疗方案[29]。然而,10%~20%的晚期ccRCC患者天生对靶向治疗不敏感,其余大多数患者在治疗6~15个月后出现耐药性和肿瘤进展,导致靶向治疗未能有效延长ccRCC患者的生存期[30-31]。由于在选择治疗反应性患者时缺乏生物标记物,靶向治疗可能对一部分ccRCC患者有未实现的临床益处[32]。本研究发现,治疗前ccRCC肿瘤中ReCAL的高表达与舒尼替尼和索拉非尼治疗反应不良显著相关,而治疗后ReCAL低表达的患者预后显著改善。因此,在决定一个疗程之前,最好评估ccRCC肿瘤中ReCAL的表达,以确定可能受益于靶向治疗的患者类型。
总的来说,本研究提供了可靠的证据,证明ccRCC组织中ReCAL高表达与恶化临床结局的风险增加相关,并且独立于多个独立队列中其他已知的病理预测因子。此外,这种联系在低风险ccRCC患者中更为明显。本研究的发现揭示了ReCAL可以作为ccRCC评估预后的生物标记物,可能有助于个体化治疗方案的有效制订,改善患者的治疗和预后。

