幽门螺旋杆菌感染与胃间质瘤相关危险因素的相关性研究
吴湛彬,周荣佳,林树洪,陈浩军
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)作为消化道肿瘤的其中一种,来源于胃肠道肌间神经丛附近的间叶组织,其发病率占所有消化道肿瘤的5%[1],GIST可发生于食管、胃、十二指肠、空肠、回肠、结肠、直肠等,其中GSTs发生率最高。在目前需病理学检查确定形态,再通过免疫组化方法检查酪氨酸CD117和骨髓干细胞抗原CD34来鉴别于其他间质起源的肿瘤(如平滑肌瘤、神经内分泌瘤等)[2]。虽然GSTs大多数为良性肿瘤,并不能单靠良恶性来区分GSTs,将间质瘤进行危险程度分级已作为一种指导临床治疗的手段[3],目前更多辅助检查例如超声内镜、CT、MR等检查对胃肠道间质瘤的发现、诊断、危险分级、治疗方式起指导性作用[4-10]。
幽门螺杆菌(Helicobacterpylori,H.pylori)感染成为目前上消化道疾病等头等因素,例如H.pylori感染大大的增加了上消化道溃疡、胃癌、慢性萎缩性的概率[11]。本文研究幽门螺旋杆菌感染是否与GSTs的恶性程度及瘤体大小、出血存在一定关系。为临床的治疗及复查跟踪提供参考意见。
1 资料与方法
1.1 一般资料
收集2020年1月8至2021年4月2日广州市番禺区中心医院就诊的40例GSTs患者,年龄为32岁~77岁,平均年龄(58.78±14.41岁),其中<60岁有22例,≥60岁有18例,男性、女性患者各20例,收集患者的资料包括:性别、年龄、住院时间,观察指标:肿瘤部位、瘤体内坏死、起源部位、细胞的异型程度、肿瘤的危险程度、瘤体破裂出血、瘤体的大小纳入标准:①经胃镜和病理学、免疫组化检查确诊为GSTs;②患者签署知情同意书。排除标准:①严重肝肾脾等脏器器质性病变者;②曾有进行过化疗、放疗的患者;③精神疾病等严重影响本研究者;④不能通过病理或免疫组化等方法确诊的;⑤不能进行危险度分级;⑥缺乏相应的临床资料;⑦标本组织较少。本研究经我院医学伦理委员会批准。
1.2 实验方法
1.2.1 石蜡切片 采用10%的福尔马林固定活检标本,使用不同浓度的乙醇进行脱水,然后进行石蜡包埋,切成4 μm厚度的切片。
1.2.2 病理学检查 其中GSTs的危险程度是根据NIH 2008改良版原发GIST术后危险程度来进行判定见表1。
1.2.3 免疫组化 采用免疫组化SP法,测定Desmin、OG-1、SMA、S-100、Ki-67、CD34、CD117、CgA、SDHB等蛋白标志物在GSTs组织中的表达情况。标本石蜡块切片4 μm厚,在75 ℃恒温箱中放置4 h,取出后自然冷却。将切片脱蜡、水合,放置于高压水浴锅内的枸橼酸钠缓冲液中进行热修复,滴加内源性过氧化物酶阻断剂, 37 ℃静置30 min后,PBS缓冲液洗片3次,一次5 min,随后滴加山羊血清封闭液,37 ℃静置40 min后,滴加Desmin、DOG-1、SMA、S-100、Ki-67、CD34、CD117、CgA、SDHB抗体(1∶200)切片在4 ℃过夜。复温、PBS缓冲液洗片后滴加生物素标记的第二抗体,37 ℃静置30 min,PBS缓冲液洗片3次,一次5 min,随后滴加链霉菌抗生素蛋白-过氧化物酶,37 ℃静置30 min后,PBS缓冲液洗片后滴加DAB显色液,自来水冲洗终止显色,苏木素复染,脱水,最后用中性树胶封片。图1A为CD34阳性表达,图1B位CD117阳性表达,图1C为ki67阳性表达,图1D为肿瘤细胞核分裂相。
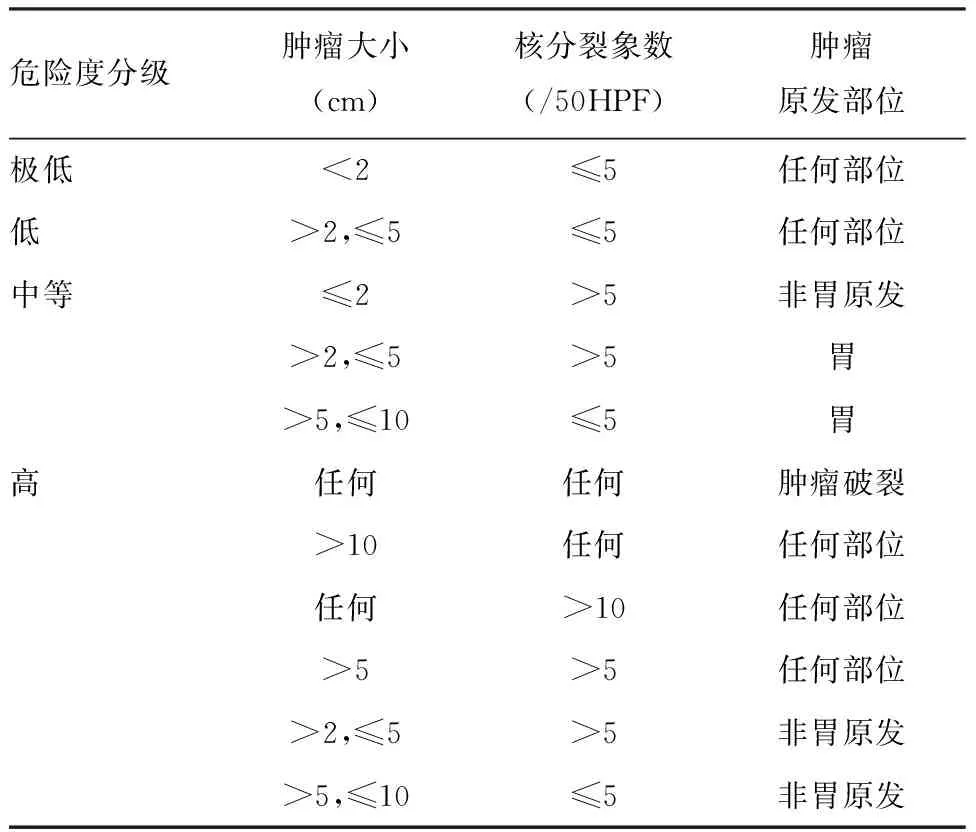
表1 原发GIST术后危险程度分级(NIH 2008改良版)
1.2.4H.pylori检查 采用改良Giemsa染色法和13C呼气试验对H.pylori进行检测,改良Giemsa染色法:将石蜡切片常规脱蜡复水后,采用2%的Giemsa染色剂进行30 min的染色,采用自然水洗后置入纯酒精内进行脱水,应用二甲苯进行透明,树胶进行封固,在油镜下观察,染色结果H.pylori呈蓝色,形状为短杆状、点状或略呈“S”型,以胃小凹最多见。13C呼气试验:让患者空腹6 g以上后再收集100 mL呼气,口服13C标记的尿素再收集100 mL呼气,连接13C标记的红外线能谱仪的检测孔进行检测,DOB>2.5则为阳性。结果判定标:改良Giemsa染色法和13C呼气试验均为阳性则为阳性,否则为阴性。
1.3 统计学分析

2 结果
2.1 H.pylori感染与间质瘤各项特性的相关性
根据本实验所收集的标本中有19例提示阳性(H.pylori+),21例提示阴性(H.pylori-),其中性别、肿瘤部位、瘤体内坏死、起源部位、细胞的异型程度与H.pylori感染均无明显统计学意义;而肿瘤的危险程度、瘤体破裂出血、瘤体大小、年龄与H.pylori感染表现出相关性,差异均有统计学意义(P<0.05)。见表2。
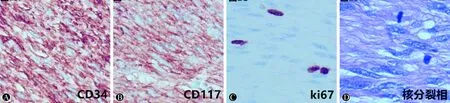
图1 CD34、CD117、ki-67的阳性表达及核分裂相(A:CD34; B:CD117;C:ki-67;D:核分裂相)
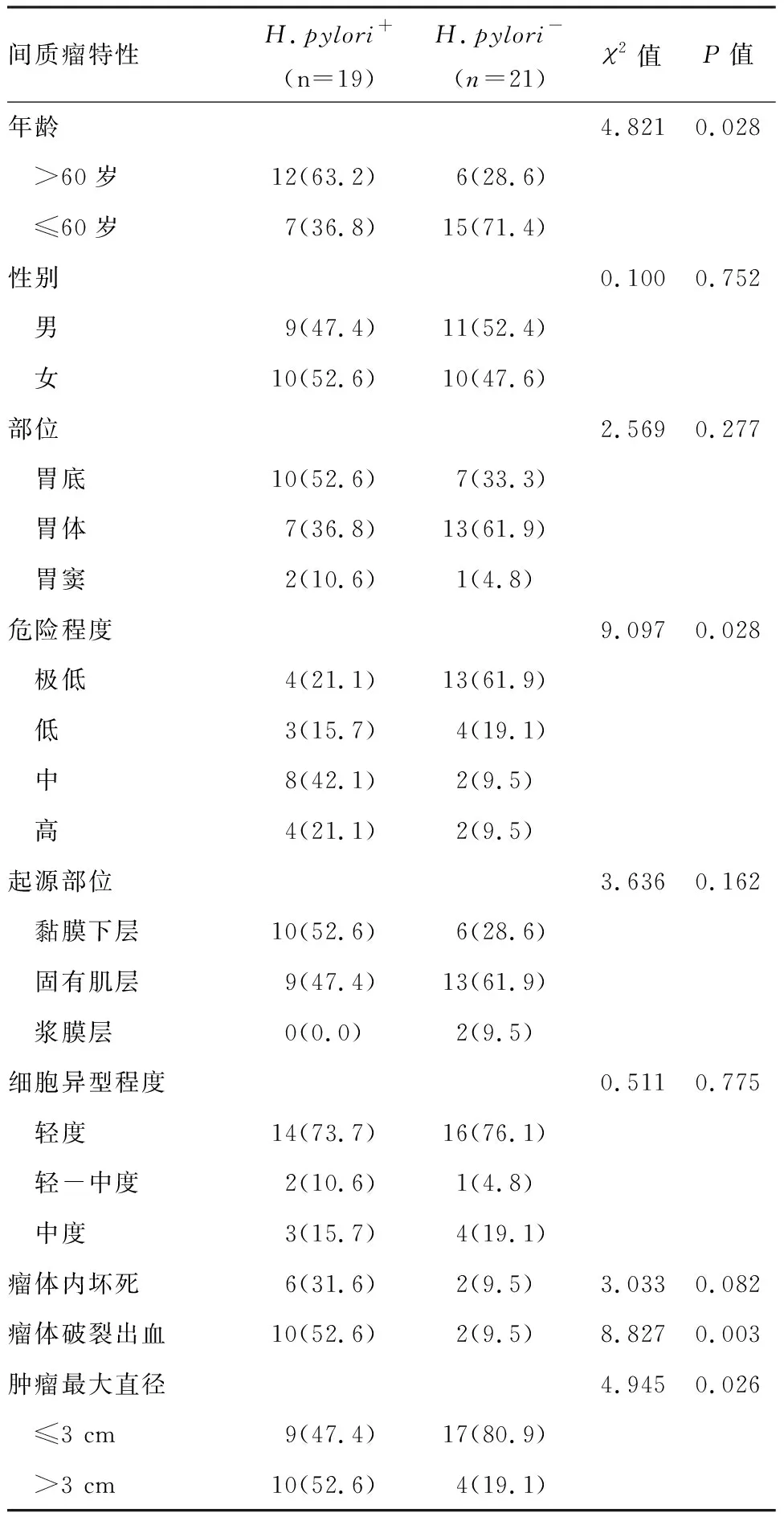
表2 不同间质瘤特性的H.pylori感染比较 [n(%)]
2.2 H.pylori感染对黏膜下层间质瘤的影响分析
黏膜下层GSTs中有10例提示阳性(H.pylori+),6例提示阴性(H.pylori-),在H.pylori感染下明显增加了瘤体破裂出血的风险,瘤体内细胞坏死及细胞异型程度与H.pylori感染无明显相关性。见表3。
3 讨论
GIST作为消化道系统的常见肿瘤之一,其起源的最常见原因是受体酪氨酸激酶的突变[12],大约有10%~30%的GSTs存在恶性的倾向,例如周围器官的侵袭及转移[13]。GSTs临床症状有腹痛、腹部肿块,可伴恶心、呕吐或胃肠道出血,当出现这类临床症状时往往肿瘤体积都比较大,造成胃肠道堵塞、肿瘤的破溃,对周围器官的侵犯[14]。近年来随着胃肠镜及超声内镜检查的普及,能够及早发现GSTs,同时内镜下的切除操作更是早期GSTs的首要治疗方案。但目前GSTs的发生机制仍未明确,亦没有相关研究中提及H.pylori感染与GSTs的关系。

表3 H.pylori对黏膜下层GSTs的影响分析 [n(%)]
H.pylori能够在胃酸这种极端环境中生存,能够通过鞭毛及表面分子定植于胃黏膜,但机体的免疫系统无法将其清除,从而造成胃黏膜的慢性炎症[15],经过时间越长,对黏膜组织的损伤越大,最终导致胃黏膜细胞萎缩、化生和异常增生,增加胃癌风险,同时胃黏膜抵抗酸的能力下降导致消化道溃疡、出血的风险增加[16]。 相关研究提示H.pylori感染后可促进组织中相关分子的表达,如肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)、 白细胞 介素 (interleukin,IL)、MIF、P27、环氧化酶Ⅱ (COX 2)、TRAP1、CagA等, 这类细胞因子能够增加细胞变异的风险,从而导致肿瘤发生,以及促进肿瘤细胞的生长、侵袭、转移[17-25]。
虽然本研究中未能证明幽门螺旋杆菌感染与GSTs细胞的生长存在一定关系,可能样本例数较少,但是GSTs发生于黏膜层及黏膜下层时,是否H.pylori更为容易的影响到GIST细胞的突变,同时诱导一系列的炎症细胞因子释放改变肿瘤细胞的微环境,从而增加肿瘤细胞的侵袭、形变、转移等能力,我们可以在后续实验中增加样本例数,以及检测H.pylori感染中GSTs瘤体内相关蛋白及基因的变化,从而加强证明H.pylori在GSTs的形成及发展有一定的作用。在本研究中我们发现H.pylori感染可能增加了GSTs的出血风险,可能性有:①在H.pylori感染基础下胃腺体细胞的萎缩,造成黏膜变薄,局部瘤体更容易突破黏膜,在胃酸腐蚀下造成出血;②H.pylori感染可能通过改变GSTs细胞的微环境,促进肿瘤细胞的生长,增加瘤体破裂出血风险。所以H.pylori感染可能作为GSTs的发生、发展的一种危险因素。虽然目前仍未证明H.pylori的感染与GSTs的产生存在一定关系,希望能在更多样本例数中得到结论,同时进一步研究H.pylori感染诱导GSTs产生的条件及机制,如何通过改变肿瘤细胞的微环境进一步促进肿瘤细胞的生长、变异、侵袭及转移。

