高剂量二联疗法与经典四联疗法根除幽门螺杆菌的疗效对比
袁培杰, 李夏平, 李乐谦, 刘伟, 黄梅芳, 熊婧
目前,幽门螺杆菌(Helicobacterpylori,H.pylori)感染率逐年上升。全球人口H.pylori的感染率高达50%[1]。两项大型研究显示我国的H.pylori感染率高达48.4%~52.3%[2-3],而且不同的经济与卫生条件下H.pylori感染率也不相同[3]。H.pylori的感染及长期定植与慢性胃炎[4-5]、消化性溃疡[6]、胃癌[7-10]、胃黏膜相关淋巴组织(mucosa-associated lymphoid tissue, MALT)淋巴瘤[11-14]的发生进展密切相关。因此根除H.pylori对上述疾病的防治具有极其重要的意义。目前临床上常用的H.pylori根除方案主要为基于克拉霉素的三联疗法(clarithromycin triple therapy,CTT)和经典的铋剂四联疗法(bismuth-containing quadruple therapy,BQT)[15-16]。研究显示[16],随着H.pylori耐药菌株的增加,CTT和BQT疗法均面临根除率下降的问题。HDDT疗法是一种高剂量的阿莫西林联合质子泵抑制剂(PPI)的二联疗法,本研究拟研究HDDT疗法在当地对H.pylori的根除率及其在临床应用中主要的不良反应及其发生率,以期帮助临床医生选择更加安全、有效的个体化H.pylori根除方案。
1 资料与方法
1.1 一般资料
本研究已获得四川省广元市第三人民医院伦理委员会批准(批准文号:GYSYLP20200012)。研究对象为2020年1月至2020年12月四川省广元市第三人民医院收治的160例H.pylori阳性的健康体检且无临床症状者,将其随机分为实验组(HDDT组,n=80)和对照组(BQT组,n=80)。实验组和对照组使用的药物为统一厂家、统一剂型。两组受试者年龄及体质指数(body mass index, BMI)等一般资料无统计学差异(P>0.05)。
1.2 纳入、排除标准
1.2.1 入选标准 ①成年无临床症状的健康体检者,年龄18~60岁;②治疗前4周未服用过抗生素、铋剂及中药,2周未服用PPI、H2受体拮抗剂等影响H.pylori活性的药物;③初次13C-尿素呼气试验或14C-尿素呼气试验结果阳性,未接受H.pylori根除治疗;④患者知情并同意参与本研究,病历资料和随访记录完整。
1.2.2 排除标准 ①严重心、肺、肾功能不全,免疫力低下者;②合并消化道肿瘤、消化道出血等器质性病变者;③药物过敏禁忌证者;④存在精神疾病、沟通障碍者;⑤妊娠期、哺乳期者。
1.2.3 中途退出标准 ①患者自动要求退出本研究;②患者出现未知或严重的不良反应。
1.3 治疗
HDDT实验组:艾司奥美拉唑(阿斯利康制药有限公司)20 mg/次,4次/d+阿莫西林(浙江金华康恩贝生物制药有限公司)750 mg/次,4次/d;疗程14 d。BQT对照组:艾司奥美拉唑(阿斯利康制药有限公司20 mg/次,2次/d+枸橼酸铋钾(丽珠集团丽珠制药厂)220 mg/次,2次/d+阿莫西林(浙江金华康恩贝生物制药有限公司)1 000 mg/次,2次/d+克拉霉素胶囊(海口奇力制药股份有限公司)500 mg/次,2次/d;疗程14 d。艾司奥美拉唑和枸橼酸铋钾均为餐前半小时服用,阿莫西林、克拉霉素均为餐后半小时服用。用药期间及停药1周内患者严格限烟禁酒。
1.4 随访
通过微信、电话等对所有受试者进行随访,记录用药情况以及药物副作用发生情况。如果出现药物副作用,以患者服药期间出现的最明显的一项不良反应进行统计分析。如果出现未知或严重的不良反应,及时上报伦理委员会,立即停药并进一步处理相关不良反应。
1.5 复查
根除H.pylori判定时间:治疗结束至少4周。H.pylori根除标准:13C-尿素呼气试验或14C-尿素呼气试验复查结果阴性者判定为根除成功,阳性者判定为根除失败。
1.6 统计方法

2 结果
2.1 两组H.pylori的根除率比较

2.2 两组服药期间出现的主要药物不良反应
如表1所示,HDDT实验组出现的药物不良反应主要有头晕、恶心、食欲减退、疲乏和腹泻。BQT对照组出现的药物不良反应主要有恶心、呕吐、腹胀、腹痛、嗳气、食欲减退、口苦和口干。两组均未出现未知或严重不良反应。
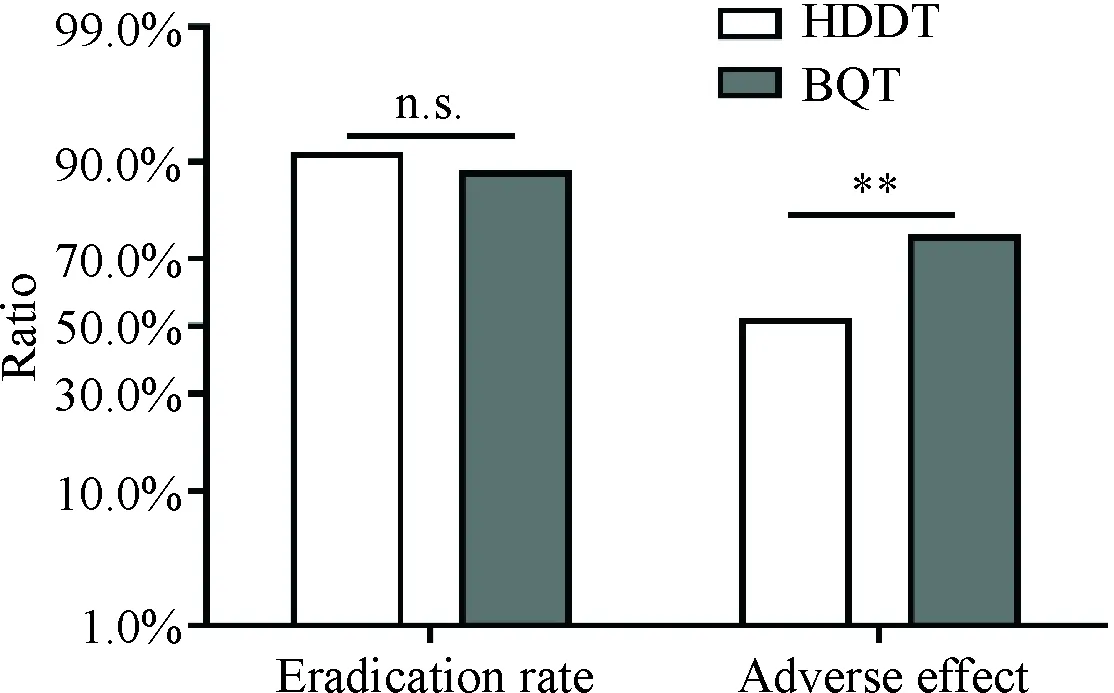
图1 两组H.pylori根除率、药物不良反应发生率对比(n.s.: 无统计差异;**: P<0.01)
2.3 两组药物不良反应发生率比较
实验组治疗期间出现明显药物不良反应者42例,无明显药物不良反应者38例,药物不良反应发生率52.5%;而对照组出现明显药物不良反应病例61例,无明显药物不良反应发生病例19例,药物不良反应发生率为76.25%(表2、图1)。实验组药物不良反应发生率显著低于对照组(P<0.05),而且患者服药依从性好,治疗安全性更高。
3 讨论
H.pylori的根除主要受胃内pH值和菌株抗生素耐药性的影响,此外还与患者服药依从性、CYP2C19基因型[17]及IL1RL1基因多态性[18]等因素相关。H.pylori根除方案中PPI的主要作用是抑制胃酸分泌提高胃内pH值从而促进抗生素药效:在较高的pH状态下,H.pylori更易被抗生素清除。一项来自台湾的研究发现,PPI剂量提高时,CYP2C19基因型对H.pylori根除率的影响被削弱[17]。H.pylori的耐药性是影响根除成功率的另一重要因素。我国H.pylori对阿莫西林、四环素、呋喃唑酮的耐药率目前仍然处于较低水平[19];但另一项对浙江地区难治性H.pylori胃炎患者的耐药性调查显示H.pylori对甲硝唑、左氧氟沙星、克拉霉素的耐药性高达94.44%、44.44%和27.78%[20]。因此H.pylori根除方案的选择应基于药物的剂量和菌株的耐药情况[21]。

表1 两组出现的主要药物不良反应统计 (n)

表2 两组抗H.pylori治疗期间药物不良反应发生率比较
目前H.pylori根除方案主要包括CTT疗法和和BQT疗法,其中抗生素的选择需结合当地抗生素耐药模式、患者既往抗生素使用情况、过敏史及药敏结果[16]。一项meta研究显示,CTT疗法对克拉霉素耐药菌株根除率仅有22.2%[22]。在很多地区,由于甲硝唑和克拉霉素的耐药率急剧上升,CTT疗法甚至不能达到预期80%的根除率[23]。因此BQT疗法被作为替代方案引入[24],该方案已被证明是克拉霉素或甲硝唑高度耐药地区以及最近或反复接触这些抗生素的患者的一线治疗方案。BQT疗法主要优点是可以克服克拉霉素或甲硝唑的耐药性,特别是当根除方案中同时含有甲硝唑和克拉霉素。但是如果BQT疗法治疗失败,多种抗生素的根除方案会造成H.pylori菌株耐药性进一步增强,从而限制或减少了后续治疗中抗生素的选择;而且由于药物数量增加,患者依从性有限。
本研究即高剂量艾司奥美拉唑联合阿莫西林二联14 d疗法H.pylori的根除率与经典四联疗法相当,但药物不良反应明显减少。此外,较少的抗生素种类使用也是HDDT疗法的一大优势。我国学者兰春慧等研究了改良二联疗法根除H.pylori的疗效,证实其与BQT疗法一样有效,且更安全、成本更低,这与本研究结论一致。另外已有多项研究证实HDDT疗法是安全、有效的H.pylori根除方案[25-27]。
本研究发现HDDT实验组与BQT对照组在当地H.pylori根除率方面无明显差异,而且HDDT疗法药物不良反应发生率更低,患者依从性更好,更有利于H.pylori的根除治疗。HDDT疗法出现的药物不良反应主要有头晕、恶心、食欲减退、疲乏、腹泻等,因此HDDT疗法可能不适用于患有慢性头痛、慢性腹泻、疲乏无力、恶心伴有食欲差的患者。虽然HDDT疗法药物不良反应发生率较低,但仍不建议盲目选用该方案,而应综合评估患者的基础疾病及已有的临床症状后再选择个体化治疗方案。

