新疆双峰驼乳酪蛋白血管紧张素转化酶抑制肽的酶法制备和抑制特性
刘 宸,王学清,豆智华,王 俊,李荣蓉,徐赵玉,杨 洁
(新疆大学生命科学与技术学院,新疆 乌鲁木齐 830046)
血管紧张素转化酶(angiotensin converting enzyme,ACE)是通过肾素-血管紧张素系统调节血压的一种关键酶[1],它是一种膜结合外在金属蛋白酶,主要存在于肺组织、外周血管组织和血管内皮细胞及其他种类的细胞中[2]。ACE可以使无活性的血管紧张素Ⅰ的C末端水解2 个氨基酸后转变成有活性的血管紧张素Ⅱ,血管紧张素Ⅱ可以降低血液流速,减少肾脏水分和盐的分泌,导致血管平滑肌收缩,引发高血压,同时ACE可水解血管舒缓激肽,使其失活,而血管舒缓激肽可以舒张血管,使血压降低,当舒缓激肽受到抑制而血管紧张素Ⅱ的活性增加后,就会引发高血压[3]。因此,以ACE为靶点的药物研究引起了越来越多的关注,ACE已被证明在降低高血压方面是成功的[4-5]。自1977年根据ACE底物的化学结构推测出ACE活性部位的模型并据此开发设计了第1个化学合成的ACE抑制剂卡托普利(Captopril)以来,ACE抑制剂药物在高血压治疗中的作用得到了医学界的普遍认可,但其对肾脏的毒副作用使研究者开始寻找安全性更高的ACE抑制剂[6]。天然来源的ACE抑制肽具有安全性高、毒副作用小、易吸收等特点,有着合成化学药物不可比拟的优越性,成为抗高血压药物研究的热点之一,其中食品来源的ACE抑制剂更是研究热点[7]。生物活性肽是食物蛋白质的特殊片段,对人体健康具有一定的生理功能,它们存在于完整的食物蛋白质中,可在食品加工过程中释放,如发酵、体外或体内酶水解[8-9]。
根据联合国粮农组织的统计数据,世界上约有2 900 万峰骆驼[10]。而新疆骆驼占比为全国首位,主要为准噶尔双峰驼,泌乳期长达12~14 个月,全疆双峰驼乳的年产量可达到3.2 万t[11]。由于驼乳含有丰富的生物活性肽和保护酶,其对氧化损伤、肠胃疾病、肝炎和糖尿病都具有良好的治疗作用[12]。同时由于驼乳中含有丰富的α-乳白蛋白,缺乏β-乳球蛋白,具有与母乳相似的蛋白结构,因此引起的过敏反应会大大降低[13]。目前多项研究证明,驼乳中含有丰富的ACE抑制肽,有研究者发现驼乳的全酪蛋白和β-酪蛋白经消化水解后,抗氧化活性和ACE抑制活性得到明显提高[14]。也有研究者对驼乳在不同蛋白酶水解下的产物ACE抑制活性进行比较,并分离出具有降血压功能的肽段[15-16]。同时,对比不同菌株发酵后驼乳和牛乳的活性发现,经发酵后的驼乳具有较高的抗氧化活性和ACE抑制活性,对人结直肠腺癌细胞(Caco-2)、人乳腺癌细胞(MCF-7)和人宫颈癌细胞(HELA)有较强的增殖抑制作用[17]。发酵后的驼乳对自发性高血压大鼠的降血压效果更好,其ACE抑制活性也更强[18]。同时有研究者通过质谱检测在水解后驼乳样品中发现多种具有ACE抑制活性的肽段[19]。目前国内研究大多针对牛乳或羊乳,对驼乳的ACE抑制肽活性研究报道较少。实验室前期研究发现,驼乳的确能够对高血压大鼠起到降低血压的作用,驼乳进入体内需要经过胃肠道的消化,因此本研究在体外模拟驼乳酪蛋白在体内的消化过程,检测水解液对ACE的抑制活性,对驼乳酪蛋白降血压能力进行评价。
1 材料与方法
1.1 材料与试剂
驼乳采自新疆乌鲁木齐市红雁池哈萨克村牧民家准噶尔双峰驼。
马尿酰-组氨酰-亮氨酸(Hip-His-Leu,HHL)标准品、ACE、Tris、甲醛、卡托普利 美国Sigma公司;马尿酸(hippuric acid,HA)标准品 日本东京化成工业株式会社;胃蛋白酶(1∶3 000)、胰蛋白酶(1∶250)上海蓝季科技发展有限公司;乙腈 美国Fisher公司;三氟乙酸(trifluoroacetic acid,TFA) 成都市科龙化工试剂厂;氢氧化钠、盐酸、氯化钠、硼砂、硼酸(均为分析纯) 天津市福晨化学试剂厂。
1.2 仪器与设备
LC-10ATvp高效液相色谱仪(配备UV检测器(SPD-10Avp)和脱气装置(DGU-12A)) 日本岛津公司;Shimpack VP-ODS色谱柱(150 mm×4.6 mm,5 μm) 日本岛津公司;PHS-2F精密pH计 上海精密科学仪器有限公司;3K30低温离心机 德国Sigma公司;SHB-BA15华牌循环水真空泵 河南巩义市英峪予华仪器厂;B3200S超声波清洗仪 美国Branson公司;AL104电子天平 梅特勒-托利多仪器(上海)有限公司;超滤离心管(50、10、3 kDa) 美国Millipore公司;ALPHA 1-2 LD真空冷冻干燥机 德国Martin Christ公司;基质辅助激光解析电离-串联飞行时间质谱(matrix assisted laser desorption ionization time of flight mass spectrometry,MALDI-TOF/TOF-MS)蛋白质组分析仪 美国应用生物系统公司。
1.3 方法
1.3.1 驼乳酪蛋白的制备
驼乳用4 层无菌纱布过滤除去杂质,3 500 r/min离心15 min,除去上层脂肪,反复多次离心,直至上层无脂肪为止,收集脱脂乳,备用。用1 mol/L HCl调节pH值至4.6,8 000 r/min离心10 min,沉淀部分(酪蛋白)用温蒸馏水反复冲洗3 次,冷冻干燥,备用。
1.3.2 驼乳酪蛋白的单酶水解和复合酶水解
单酶水解:采用2 种蛋白酶(胃蛋白酶和胰蛋白酶)分别水解驼乳酪蛋白。酪蛋白溶解于0.05 mol/L NaOH,底物质量浓度为5 g/100 mL,搅拌溶解,40 ℃预水浴,用1 mol/L NaOH或1 mol/L HCl分别调节至pH 2(胃蛋白酶)和pH 8(胰蛋白酶);加入2%蛋白酶,反应过程中持续滴加NaOH或HCl维持反应体系pH值,分别水解0.5、1、2、3、4、5、6、8、10、12 h,取样,测定蛋白质水解度。反应结束后,水解液经90 ℃水浴15 min灭酶,迅速冷却到40 ℃,调节溶液pH值至4.6,冷却,4 000 r/min低温离心10 min,取上清液,调节pH值至7.0,冷冻干燥后冷藏,待分析。实验重复3 次。
复合酶水解:在底物质量浓度5 g/100 mL、酶底比(E/S)0.4、水解温度37 ℃、pH 2.0的条件下进行胃蛋白酶单酶水解,水解2 h后,90 ℃水浴15 min灭酶,冷却至37 ℃后,调节反应pH值至8,加入胰蛋白酶水解,分别在反应后0.5、1、2、3、4 h取酶解产物,90 ℃水浴15 min灭酶,迅速冷却到40 ℃,调节溶液pH值至4.6,冷却,4 000 r/min低温离心10 min,取上清液,调节pH值至7.0,冷冻干燥后冷藏,待分析。实验重复3 次。
1.3.3 蛋白质水解度测定
蛋白质水解度按式(1)计算。

式中:h为水解后每克蛋白被裂解的肽键毫摩尔数/(mmol/g);htot为每克蛋白所含的肽键毫摩尔数(8.3 mmol/g)。
式(1)中,h按式(2)计算。

式中:ρ为底物蛋白质质量浓度/(g/mL);c为水解液中氨基氮浓度/(mmol/mL);c0为未水解底物溶液中氨基氮浓度/(mmol/mL)。
氨基氮浓度测定:采用甲醛滴定法,取样品溶液10 mL置于小烧杯中,加入30 mL超纯水,在搅拌状态下以精密酸度计测定pH值;用0.05 mol/L NaOH标准溶液预滴定至pH 8.2,再加入10 mL中性甲醛,1 min后用0.05 mol/L NaOH标准溶液滴定至pH 9.2,并记录消耗的NaOH标准溶液体积。
溶液中氨基氮浓度按式(3)计算。
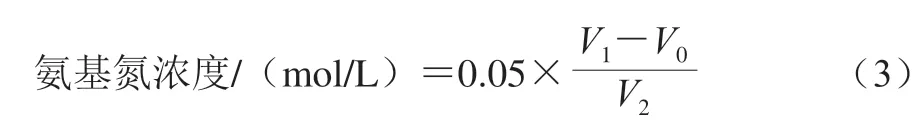
式中:0.05为NaOH标准溶液浓度/(mol/L);V0为空白组消耗NaOH标准溶液体积/mL;V1为样品溶液消耗NaOH标准溶液体积/mL;V2为样品溶液体积/mL。
1.3.4 ACE抑制率测定
1.3.4.1 样本制备
采用HHL方法检测ACE体外抑制率。
硼酸盐缓冲液配制:用超纯水配制含有0.3 mol/L NaCl的0.1 mol/L、pH 8.3硼酸盐缓冲液。
HHL溶液配制:将HHL溶于硼酸盐缓冲液,溶液浓度为5 mmol/L,分装成1 mL,-20 ℃保藏。
ACE溶液配制:将0.25 U ACE用含有0.3 mol/L NaCl的50 mmol/L、pH 7.5 Tris-HCl溶液溶解,溶液浓度为100 mU/mL,分装成250 μL,-20 ℃保藏。
对照组加入100 μL HHL溶液和25 μL硼酸盐缓冲液,样品组加入100 μL HHL溶液和25 μL酶解液,37 ℃水浴10 min,样品组和对照组各加入10 μL ACE溶液,37 ℃水浴30 min,4 500 r/min离心5 min,各加入100 μL 1 mol/L HCl,终止反应后的样品用0.45 μm微孔滤膜过滤,待检测。
1.3.4.2 反相高效液相色谱(reversed phase-high performance liquid chromatography,RP-HPLC)法检测
检测条件:Shim-pack VP-ODS色谱柱(150 mm×4.6 mm,5 μm);流动相A:体积分数0.05% TFA-水溶液,流动相B:体积分数0.05% TFA-乙腈;检测波长228 nm;流速0.5 mL/min;梯度洗脱程序:0~10 min、流动相B体积分数5%~60%,10~12 min、流动相B体积分数60%,12~13 min、流动相B体积分数60%~5%,13~17 min、流动相B体积分数5%;进样量20 μL;温度25 ℃;外标法定量。
酶解产物样品用超纯水溶解至0.4 mg/mL,ACE抑制率按式(4)计算。
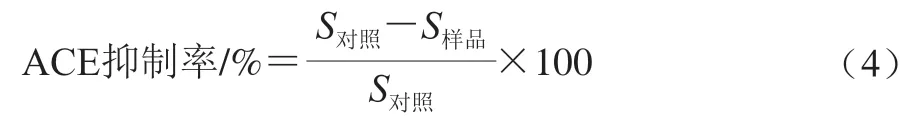
式中:S对照为空白对照组HA的峰面积/(mAU·S);S样品为添加酶解液组HA的峰面积/(mAU·S)。
取HA标品,用硼酸盐缓冲液配制1 mg/mL母液,再用缓冲液稀释成0.01、0.05、0.10、0.50、0.80、1.00 mg/mL,色谱方法检测ACE抑制率,每个标准溶液平行测定3 次,取平均值,绘制标准曲线。
1.3.5 驼乳酪蛋白酶解产物的超滤分离
驼乳酪蛋白的酶解产物用超滤离心管进行50、10、3 kDa超滤分离,测定截留液的ACE抑制活性。
1.3.6 驼乳酪蛋白酶解产物与卡普里托抑制特性的比较
对比0.125、0.250、0.500、0.750、1.000 mmol/L底物(HHL)浓度下,0.4 mg/mL酪蛋白胰蛋白酶水解产物和0.02 μmol/L卡普里托对ACE的抑制活性,以Lineweaver-Burk作图法确定抑制剂对酶促反应的抑制类型,然后根据抑制类型应用作图法,根据米-曼式方程,求出抑制常数(Ki)。
1.3.7 驼乳酪蛋白酶解产物截留液的质谱检测
将3~10 kDa的截留液样品用于MALDI-TOF/TOF分析,在NCBI上查询相关蛋白信息。
1.4 数据处理
用Excel和Prism 5软件对数据进行线性关系和单因素方差分析。
2 结果与分析
2.1 驼乳酪蛋白水解产物中所含HA在RP-HPLC中的响应
以HA标品质量浓度(x,mg/mL)为横轴,峰面积(y)为纵轴绘制标准曲线,得到线性方程为y=6×106x+123 872(R²=0.998 4),表明HA在0.01~1.00 mg/mL内线性关系良好,平均回收率为94.45%,相对标准偏差为3.2%,该方法的稳定性、精密度和重现性的相对标准偏差分别为1.51%、1.38%和1.03%,干扰较少、分析时间短、稳定性、精密度和重现性良好,此方法用于检测ACE抑制活性稳定可靠。
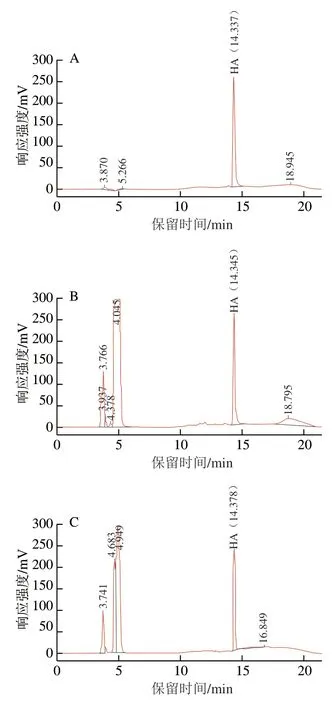
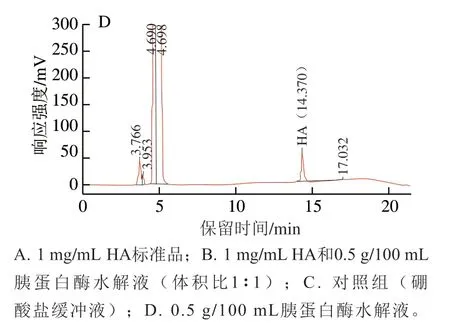
图1 HA溶液和驼乳酪蛋白水解产物的RP-HPLC响应色谱图Fig. 1 RP-HPLC chromatograms of HA and camel casein hydrolysates
HA溶液和驼乳酪蛋白水解产物中HA的RP-HPLC响应色谱图如图1所示。
2.2 驼乳酪蛋白酶解产物水解度和ACE抑制率
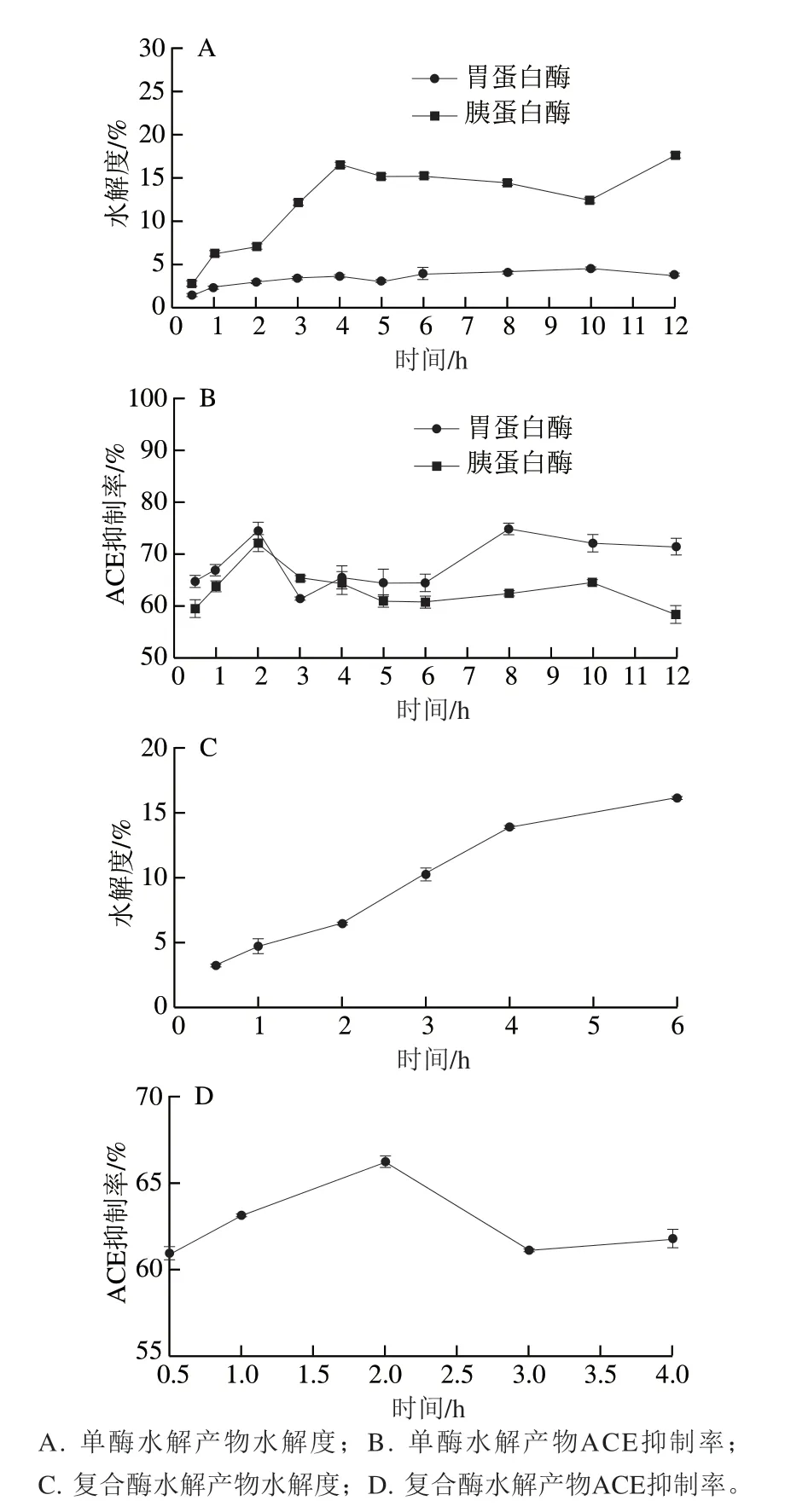
图2 驼乳酪蛋白酶解产物水解度和ACE抑制率随时间的变化Fig. 2 Changes in hydrolysis degree and ACE inhibition activity of camel milk casein with hydrolysis time
由图2A、2B可知,由于蛋白酶水解位点的特异性,对酪蛋白的水解能力有所不同,同一时间,2 种蛋白酶水解酪蛋白的水解度不同。胃蛋白酶的水解能力最弱,其可断裂苯丙氨酸、色氨酸、酪氨酸或缬氨酸等疏水性氨基酸残基的氨基端肽键,水解度小于5%,未水解底物较多,水解2 h,ACE抑制率为74.67%左右。胰蛋白酶专一性较强,只断裂赖氨酸残基或精氨酸残基的羧基参与形成的肽键,在水解4 h后,驼乳酪蛋白酶解产物水解度达到15%以上,ACE抑制率在2 h达到72.33%。2 种酶水解2 h时的ACE抑制率差异明显,水解12 h内的水解度差异明显,底物蛋白经蛋白酶水解一定时问后,反应体系中存在未水解大分子蛋白和部分水解的蛋白。
由图2C、2D可知,驼乳酪蛋白在双酶联合酶解条件下,与单酶水解相比,组合酶解后酶解产物的水解度迅速上升,均高于单酶水解的水解度。水解度的增加表明酶解产物中氨基酸含量增加,即底物蛋白在双酶水解作用下产生了更多短肽,酪蛋白在单酶水解作用一定时间后,底物中敏感肽键含量降低,由于酶作用的位点特异性使反应速率变慢,水解度变化趋向平缓,具有活性的多肽保持平衡,具有ACE抑制活性的多肽含量达到一定值不再增加,或是增加缓慢。而双酶水解酪蛋白时,由于酶作用位点不同,溶液中的大分子多肽段在酶作用下发生变化,溶解肽段含量增加,水解度升高,但ACE抑制率并不随着水解度的增加而增加,当进行双酶水解时,加入胰蛋白酶可能作用于具有活性的肽段,因而引起酶活性的下降。
2.3 驼乳酪蛋白酶解产物半抑制质量浓度(half inhibitory concentration,IC50)及超滤组分ACE抑制活性
以酶解产物质量浓度的对数值作为横坐标,ACE抑制率作为纵坐标,在质量浓度0.01~0.80 mg/mL范围内得出线性关系:y=0.330 7x+0.996 8(R²=0.996 8),通过计算求出酪蛋白酶解产物的IC50为0.198 9 mg/mL。
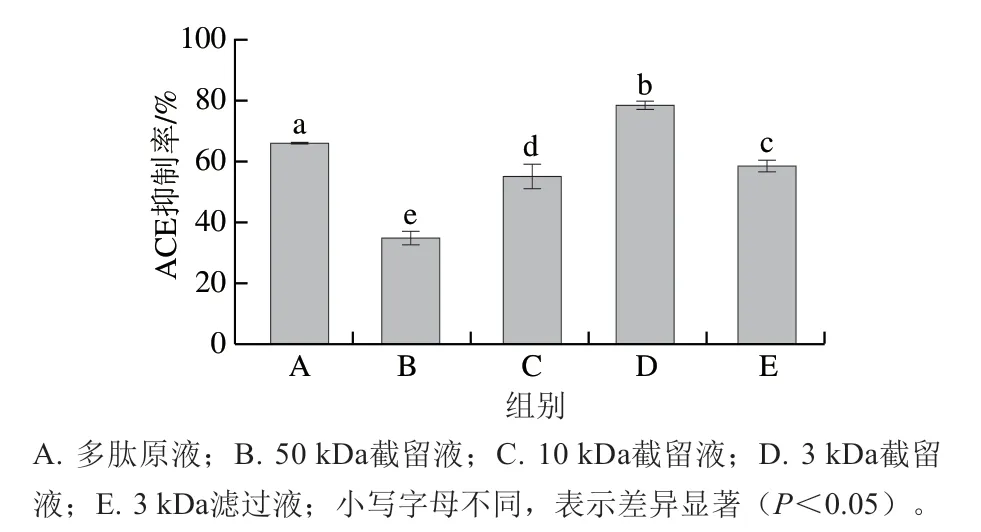
图3 胰蛋白酶酶解产物不同超滤液组分的ACE抑制率Fig. 3 ACE inhibitory activity of different fractions of ultrafiltration
由图3可知,酪蛋白酶解产物经过50、10、3 kDa截留后,表现出不同的ACE抑制率,3 kDa截留液的ACE抑制活性最强。
2.4 驼乳酪蛋白酶解产物对ACE的抑制特性
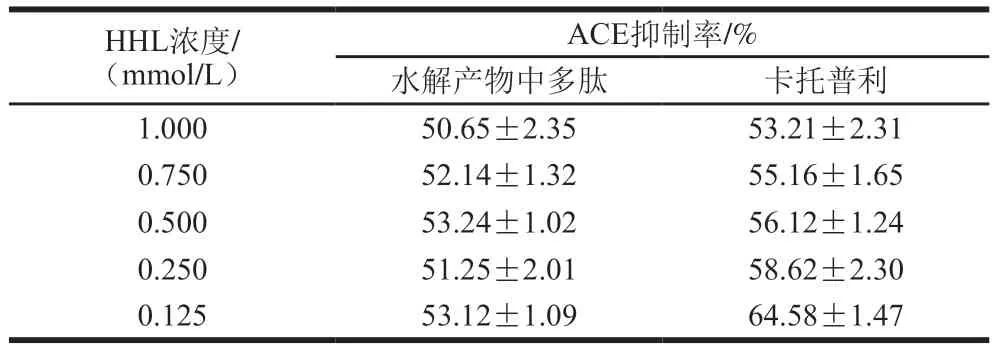
表1 不同HHL浓度下水解产物中多肽及卡托普利的ACE抑制率Table 1 ACE inhibitory activity of casein peptides and captopril at different concentrations of HHL
由表1可知,卡托普利对ACE的抑制率随底物浓度的降低而增加,这是竞争性抑制的典型表现,底物的增加与抑制剂竞争与酶结合,减轻了抑制剂对酶的抑制作用。不同底物浓度条件下,水解产物中多肽的ACE抑制率无明显差异,由此可见,增加底物浓度不能消除多肽对ACE的抑制,符合非竞争性抑制剂的特点。
为研究水解产物对ACE抑制作用的特性,以Lineweaver-Burk作图法确定抑制剂对酶促反应的抑制类型,然后根据抑制类型应用作图法求得抑制常数(Ki)。
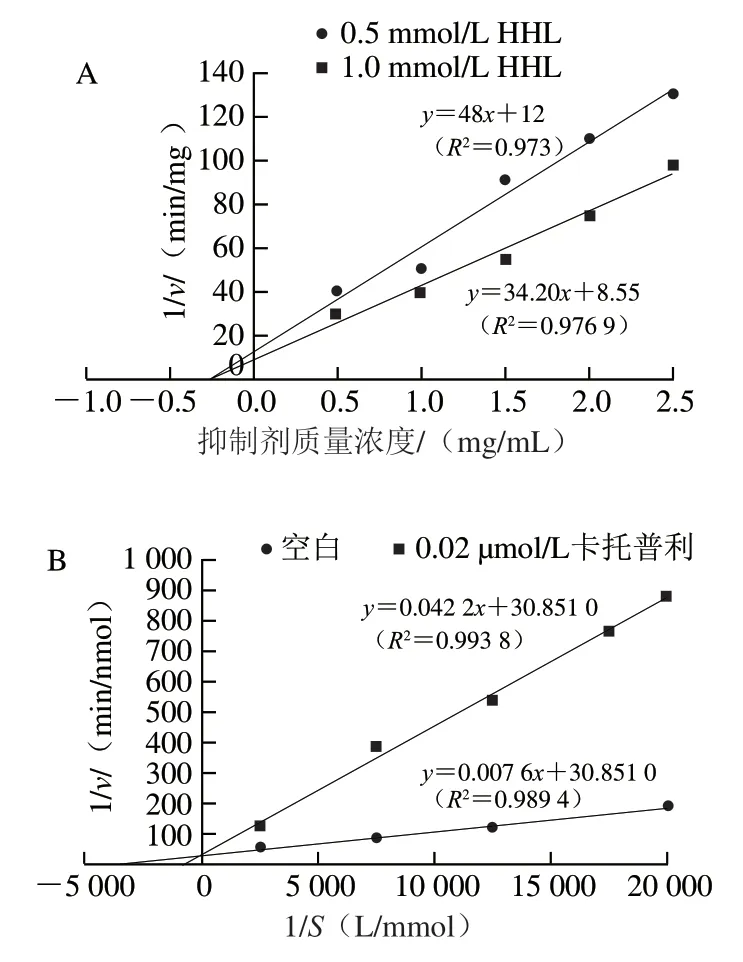
以Dixon作图法求取多肽对ACE的Ki,以抑制剂质量浓度为横坐标,以1/v为纵坐标,采用2 个底物浓度,绘制线性曲线,计算水解产物的Ki,如图4A所示,直线交点的横坐标为Ki,为0.25 mg/mL。
测定在不同底物浓度条件下,加入不同浓度的多肽、卡托普利与未加入抑制剂时的ACE抑制活性。由图4B、4C可知,代表不同底物水解物的几条直线与横轴相交,直线斜率和纵轴截距随水解产物浓度的增大而增大,可推断酶解产物对ACE的抑制为非竞争性抑制。卡托普利是典型的ACE竞争性抑制剂,在抑制剂存在时,直线斜率增大,与无抑制剂的曲线相交于纵轴。
2.5 驼乳酪蛋白酶解产物3~10 kDa截留液中的肽段
3~10 kDa截留液通过质谱检测得到的主要蛋白质和肽段如表2~3所示。
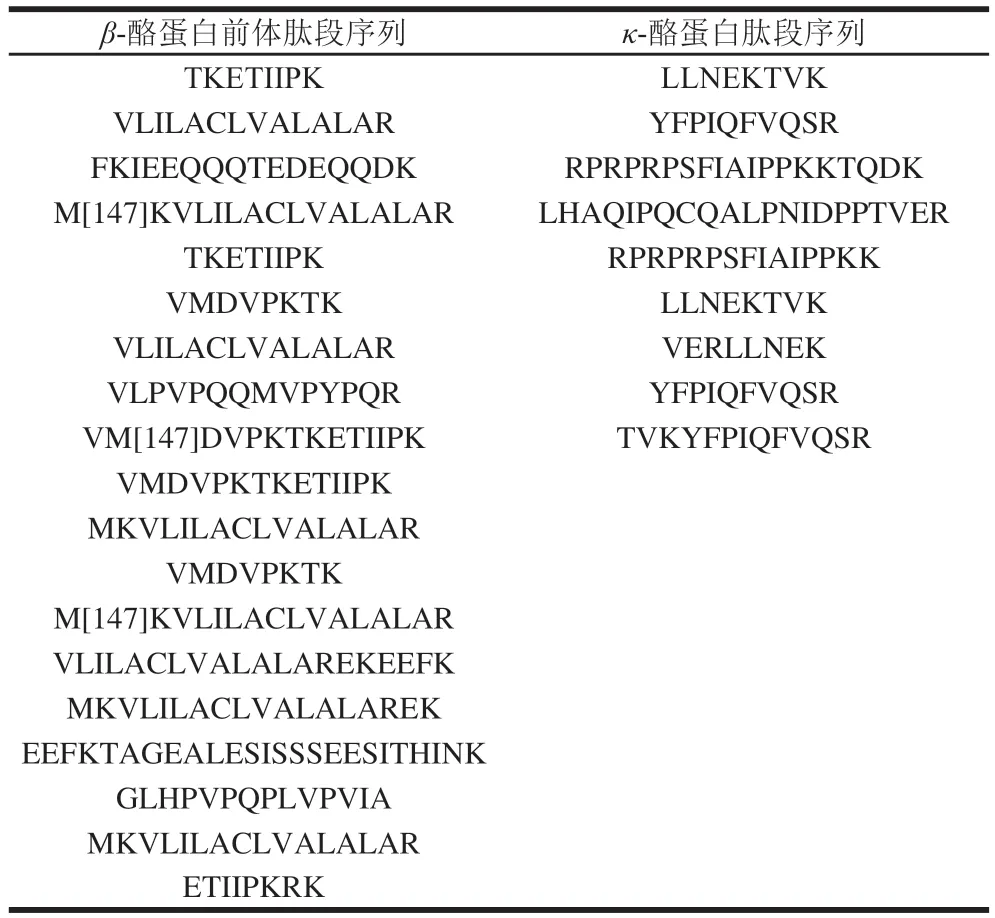
表3 驼乳酪蛋白酶解产物3~10 kDa截留液中酪蛋白肽段序列Table 3 Sequences of casein peptides in 3- 10 kDa retenate
由表2~3可知,3~10 kDa组分中含有多种乳清蛋白肽段,这可能是在酪蛋白的制备过程中,乳清蛋白共沉淀下来,分离不佳。其中乳铁蛋白含量较高,存在66 个小分子肽段,乳铁蛋白不仅是中性粒细胞的组成成分,同时有增强免疫力和抗氧化等生物功能。同时也发现了存在和氧化应激相关的101 个肽段,大部分来自谷胱甘肽硫转移酶和超氧化物歧化酶,这为驼乳具有抗氧化功能的效果提供了理论基础。同时还发现其具有多种瘦素以及和糖原合成相关的糖原合酶1型蛋白和降低血糖的胰岛素肽段共295 个,这也与驼乳能够降低脂肪堆积和起到降糖效果相对应。在来源于血红蛋白亚基β和酪蛋白前体肽段中,发现2 条多肽结构与已知具有ACE抑制活性多肽(LLVVYPWTR和VLPVPQQMVPYPQR)相似,这也为水解液的ACE抑制活性提供了理论依据。
3 结 论
驼乳原本的ACE抑制活性较低,但经过蛋白酶水解后,酪蛋白的ACE抑制活性增加,最终确定胰蛋白酶水解后的酪蛋白水解产物IC50为0.198 9 mg/mL。食物蛋白源的ACE抑制肽通常由蛋白酶在温和条件下水解蛋白质获得,由于酶作用位点特异性,酶解产物的肽链长度及肽段结构与蛋白酶的选择相关。水解液中含有ACE抑制肽和无ACE抑制活性的多肽、游离氨基酸等多种物质,这些组分在酶的作用下发生变化,过程复杂,存在多种转化方式,溶液中小分子肽段含量增加,但ACE抑制活性无明显变化,有研究者认为与酶解液中生成了IC50较低的ACE抑制肽有关。Cheung等[20]研究认为,ACE抑制肽的抑制活性主要取决于C端氨基酸,C端氨基酸为芳香族氨基酸(Tyr、Trp、Phe)和Pro时其抑制活性最强,说明酶解产物的ACE抑制活性不仅与多肽链的长度有关,也与多肽氨基酸结构有关。本研究中双酶水解酪蛋白,由于酶作用位点不同,溶液中的大分子多肽段在酶作用下发生变化,溶解肽段含量增加,水解度升高,但ACE抑制率并不随着水解度的增加而增加,当进行双酶水解时,加入胰蛋白酶可能作用于具有活性的肽段,因而引起酶活性的下降,吴建平等[21]在大豆降压肽的研制中也观察到了同样的现象。经过3~10 kDa分子截留的组分表现出较强的ACE抑制活性;也有研究者通过蛋白酶K水解驼乳酪蛋白,并将水解产物进行超滤,同样发现3 kDa的截留液具有较高的ACE抑制活性,与本研究结果一致[22]。本研究还发现驼乳酪蛋白水解产物对ACE的抑制为非竞争性抑制,反应底物HHL浓度的增加不能消除多肽对ACE的抑制,多肽的抑制常数为0.25 mg/mL。降血压药物卡托普利是ACE的竞争性抑制剂,其活性基团SH螯合ACE活性中心的Zn2+,抑制酶的活性[23]。而目前对食源性蛋白多肽对ACE抑制类型的报道不多。有研究者提出对酶促反应的抑制作用,非竞争性抑制剂优于竞争性抑制剂[24],这也说明驼乳具有和药物联合用药的潜力。本研究发现了LLVVYPWTR和VLPVPQQMVPYPQR 2 条可能具有ACE抑制活性的多肽。Haines等[25]在鹿茸的发酵液中发现了具有ACE抑制活性的多肽LVVYPW、LVVYPWTQ和VVYPWTQ,这与本研究肽段LLVVYPWTR具有较高的相似度,其可能通过相同的空间结构来抑制ACE活性。Chen Li等[26]用复合酶水解牛乳后发现了具有抑制作用的肽段VLPVPQ,Soleymanzadeh等[27]利用乳酸菌PTCC1899发酵驼乳后发现了β-酪蛋白抗氧化活性肽MVPYPQR,而这2 个肽段与本研究检出的属于β-酪蛋白前体的肽段VLPVPQQMVPYPQR具有极高的相似性,不同的是本研究中的肽段是前2 个肽段之间用谷氨酰胺将二者连接。同时在κ-酪蛋白的肽段中具有和ACE抑制肽的肽段IPP相同结构的肽段,但可能由于酶的不同,其肽段过长,并未彻底将肽段IPP分离开,但这也说明水解液中含有多种具有ACE抑制活性的多肽,它们各自具体的抑制活性还需要后续进行实验研究,但这些都解释了驼乳对于辅助治疗高血压方面能起到良好的作用。
总的来说,双酶水解相比单酶水解,驼乳酪蛋白水解度增加,但ACE抑制活性未随着水解度的增加而增加,这可能是第2种蛋白酶(胰蛋白酶)作用于具有活性的肽段,因而引起酶活性的下降。经水解后的酪蛋白水解物与卡托普利符合非竞争性抑制剂的特点,多肽的抑制常数为0.25 mg/mL。且水解后3~10 kDa截留物的ACE抑制活性最好,对其质谱检测发现了2 条与已知ACE抑制肽结构相似的肽段LLVVYPWTR和VLPVPQQMVPYPQR。

