肺动脉高压合并肺缺血再灌注损伤大鼠模型的建立与评价*
丁 运, 凃鹏杰, 陈 龙, 潘小杰, 陈文树△
福建医科大学省立临床医学院,福建省立医院 1胸外科 2骨科,福州 350001
肺动脉高压(pulmonary artery hypertension,PAH)是由多种因素引起的一种进行性疾病,常继发于循环系统及呼吸系统疾病[1],许多接受胸心外科手术的患者合并有PAH;同时,肺缺血再灌注损伤(lung ischemia-reperfusion injury,LIRI)是胸心外科术后常见的病理生理过程,常见于肺移植、肺袖式切除、体外循环后等情况,是一种难以避免且严重影响患者预后的并发症[2]。随着人口老龄化,心肺疾病发生率逐年升高,PAH合并LIRI在临床上越来越多见,是临床上迫切需要解决的重点和难点问题。然而,目前对PAH合并LIRI的研究甚少,也缺乏有效的动物模型。建立有效的动物模型,有利于深入认识和阐明PAH合并LIRI的病因和发病机制,从而指导对该类疾病更好的防控和治疗。本研究成功建立了PAH合并LIRI的大鼠模型,此方法简单实用,成功率高、易复制,现介绍如下。
1 材料与方法
1.1 实验动物的选择及分组
本研究采用8周龄雄性SD大鼠共计40只,购自福建医科大学实验动物中心,许可证号:SCXK(闽)2016-0002。实验过程严格按医学伦理学规范操作。将大鼠随机分为4组:对照组(control),肺动脉高压组(PAH),肺缺血再灌注组(IR),肺动脉高压合并肺缺血再灌注组(PAH+IR),每组10只。
1.2 主要实验仪器及试剂
小动物呼吸机TKR-200C(江西省特力麻醉呼吸设备有限公司),显微外科手术器械(重庆市思睿实验仪器有限公司),PowerLab生物信号采集分析系统及配套的压力换能器和配套心排量导丝(澳大利亚ADInstruments公司),野百合碱(美国Sigma公司)。
1.3 PAH模型制备
PAH组和PAH+IR组大鼠按50 mg/kg体重一次性腹腔注射野百合碱[3]制备PAH模型;对照组和IR组大鼠同期予腹腔注射等量生理盐水。给药4周后进行LIRI模型制备。
1.4 LIRI模型制备
1.4.1 胸部手术前准备及麻醉 术前12 h禁食,4 h禁水。按60 mg/kg体重腹腔注射2%戊巴比妥钠麻醉,麻醉后取仰卧位固定于操作台。颈部及左胸部备皮后常规消毒皮肤,颈部气管正前方纵行切开皮肤,分离气管前组织以显露气管,于第2、3软骨环处横行切开气管膜部,插入18G静脉留置针1~2 cm并固定,接小动物呼吸机辅助呼吸,吸入95% O2和5% CO2混合气体,选择压力控制通气模式,压力0.02~0.04 MPa,频率60次/min,吸呼比值1∶2.5。
1.4.2 胸部手术操作 采用血管夹夹闭肺门法[4]:经左侧第5肋间前外侧切口进胸,按300 U/kg体重经尾静脉注射肝素钠预防血栓形成,5 min后适当调小呼吸机工作压力,使左肺稍萎陷,向右上方拨开胸腺及心脏,游离出左肺门。IR和PAH+IR组大鼠使用无损伤血管夹夹闭左肺门,包括左主支气管及左肺动静脉(图1),见左肺无呼吸运动、左肺门动脉结构无搏动为有效阻断,夹闭肺门1 h以模拟肺缺血。之后松开血管夹,恢复左肺通气和血液灌注2 h以模拟肺再灌注。对照组和PAH组大鼠进行麻醉、插管成功后,只进行开胸操作及分离左肺门,不进行夹闭左肺门操作,观察3 h。

A:血管夹夹闭左肺门;B:左肺门结构
1.5 PAH合并LIRI模型制备
按上述方法,PAH+IR组大鼠采用野百合碱注射法制作PAH模型4周后,采用血管夹夹闭肺门法制作PAH合并LIRI模型。
1.6 观察指标及标本检测
1.6.1 PAH的评估 ①血流动力学参数:恢复再灌注2 h后经右心置管检测平均肺动脉压(mean pulmonary arterial pressure,mPAP)及右心室收缩压(right ventricular systolic pressure,RVSP)[5],将18G静脉留置针经压力换能器连接生物信号采集系统,肝素化的留置针经右心室心尖进入右心室,针尖进入2.5 mm后退出针芯,继续将留置针管向内推2.5~5 mm至右心室和肺动脉,待波形稳定后记录mPAP和RVSP。检测后处死大鼠,获取标本。②右心室肥厚指数(right ventricular hypertrophy index,RVHI):大鼠处死后完整取出心脏,保留心室组织,沿室间沟分离右心室和左心室+室间隔,吸干表面液体后称重,计算并记录右心室重量/(左心室+室间隔)重量为RVHI。
1.6.2 LIRI的评估 ①大体观察:大鼠处死后,完整取出左肺,肉眼观察并记录左肺外观变化。②肺组织湿干重比值(wet-to-dry weight ratio,W/D):取部分左肺组织吸净表面液体后称湿重,置于65 ℃烤箱72 h后称量干重,计算W/D。③肺组织病理学检查及肺损伤评分:取部分左肺组织制作切片,经苏木精-伊红(HE)染色后,使用光学显微镜观察左肺损伤情况。参考肺损伤评分系统[6],根据以下3项进行肺损伤评分:(1)肺出血;(2)肺水肿;(3)炎性细胞浸润(0分,无明显损伤;1分,轻度;2分,中度;3分,重度),3项分数之和为该视野肺损伤评分,每个左肺制作切片3张,每张观察3个高倍镜(200×)视野,取平均值为对应大鼠肺损伤评分。
1.7 统计学方法
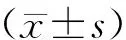
2 结果
2.1 一般情况
PAH+IR组中1只大鼠注射野百合碱3周后死亡,其余大鼠进入手术操作;PAH+IR组中1只大鼠夹闭肺门30 min后死亡,其余均顺利完成操作。PAH+IR组总建模成功率80.0%(8/10)。
2.2 PAH的评估结果
① mPAP及RVSP:PAH和PAH+IR组大鼠的mPAP及RVSP均显著高于对照组和IR组(均P<0.05),同时,PAH+IR组大鼠的mPAP及RVSP明显高于PAH组(均P<0.05),见表1。②RVHI:PAH和PAH+IR组大鼠的RVHI均显著高于对照组和IR组(均P<0.05),但IR组与对照组之间以及PAH+IR组与PAH组之间差异无统计学意义(均P>0.05),见表1。

表1 各组大鼠平均肺动脉压、右心室收缩压、右心室肥厚指数比较
2.3 LIRI的评估结果
①大体观察:IR组、PAH+IR组肺与其他组相比,外观明显呈暗红色、充血明显,表面及边缘不平整,弹性差;PAH+IR组上述改变较IR组更明显,见图2。部分行IR操作的大鼠肺气管腔见血性泡沫样分泌物溢出。②光镜下观察:PAH和PAH+IR组标本切片均可见血管内皮层不同程度增生,肺小血管肌化、闭塞,提示肺血管重构,见图3。对照组和PAH组的肺组织间无明显炎性细胞浸润;IR组肺泡间质及血管周围水肿明显,肺泡间质及间隙内均可见大量炎性细胞浸润,肺泡间隔因水肿、肺泡内出血而明显增宽,PAH+IR组上述情况更加明显,见图3。根据以上表现对肺组织损伤评分结果见表2。③W/D:IR和PAH+IR组大鼠的W/D均显著高于对照组和PAH组(均P<0.05),但PAH组与对照组之间以及PAH+IR组与IR组之间差异无统计学意义(均P>0.05),见表2。
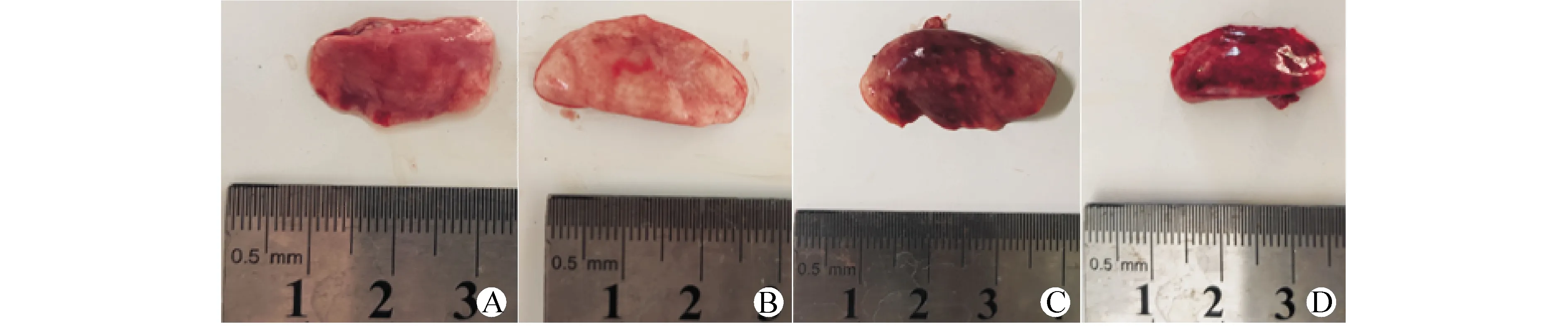
A:对照组;B:PAH组;C:IR组;D:PAH+IR组

A:对照组;B:PAH组;C:IR组;D:PAH+IR组

表2 各组大鼠左肺损伤程度评分、左肺湿干重比值比较
3 讨论
随着人口老龄化的加剧,心血管疾病及呼吸系统疾病发病率逐年增加,PAH合并LIRI的患者成为临床医生不容忽视的一部分群体。但目前缺少有效的防治措施,并且鲜有针对PAH合并LIRI的研究以及PAH合并LIRI的动物模型建立方法报道。因此,建立有效的PAH合并LIRI动物模型,对进一步研究PAH合并LIRI有着重大意义。
目前PAH动物建模方法包括:野百合碱注射、慢性缺氧、肺栓塞、手术分流、遗传修饰[7]。本研究选择通过注射野百合碱构建PAH模型有如下优点:首先,野百合碱通过肝脏被转化为野百合吡咯,野百合吡咯能够选择性地在肺动脉内皮细胞内与DNA和蛋白质形成复合物,引起肺血管内皮功能障碍,导致炎症相关的PAH[8]。与其他方法相比,此方法能更好地模拟临床PAH的病理生理过程[9]。其次,野百合碱注射法具有操作简便、可重复、稳定性好、便宜的优点。此外,采用非手术方法建立PAH模型,避免通过两次手术建立PAH合并LIRI模型,能有效保证大鼠存活率,同时能降低LIRI模型建模手术操作难度。LIRI动物建模方法包括:肺动脉封堵法和肺动脉或肺门阻断法。肺动脉封堵法包括异物封堵法和气囊封堵法;肺动脉或肺门阻断法包括结扎线结扎法和无创血管夹夹闭法[4,10]。与肺动脉封堵法和单纯肺动脉阻断法相比,肺门阻断法在阻断肺动脉的同时阻断肺静脉及支气管,使操作侧的肺处于缺血且无通气的状态,可更好地模拟肺移植中供体肺的LIRI。相较于兔、狗等大动物,本研究采用的大鼠模型成本更低且更容易获得,但由于大鼠体型小,实际开胸手术操作中可能造成其他组织损伤,因此我们使用显微外科器械进行操作,用血管夹直接夹闭左肺门,避免过度游离肺门、分离肺动脉造成血管损伤,在不造成肺门结构损伤的同时完全阻断进入肺的血流和通气,操作简易且达到模型建立的标准。因此,本研究采用野百合碱注射法+血管夹夹闭肺门法构建PAH合并LIRI的大鼠模型,并初步探索PAH和LIRI的相互影响。
参考以往文献,在PAH模型的评估中,通常采用mPAP、RVSP、RVHI及组织病理改变等指标进行评估[3,7],其中mPAP是评估PAH的直接指标;而在LIRI模型的评估中,通常采用肺组织大体外观、肺损伤评分及W/D等指标进行评估[4,10],其中肺损伤评分是参考动物肺损伤评价标准[6]对肺组织镜下改变进行评分,是评估肺损伤的直接指标,W/D可有效反映肺水肿情况,也是评估肺损伤程度的重要指标。本研究发现PAH+IR组大鼠的mPAP、RVSP、RVHI均显著高于对照组,表明PAH+IR组大鼠的PAH建立成功;同时PAH+IR组病理切片可见肺血管重构表现,进一步证实PAH建立成功。PAH+IR组大鼠的肺标本外观较对照组充血、水肿明显,肺组织损伤评分及W/D均显著高于对照组,提示PAH+IR组大鼠的LIRI建立成功。综上评估结果,我们成功建立了PAH合并LIRI的大鼠模型。
本研究中PAH+IR组大鼠的mPAP及RVSP高于PAH组,提示LIRI使肺动脉压进一步升高。这可能是由于缺血缺氧引起肺小动脉平滑肌痉挛[11],使肺血管阻力上升;同时肺缺血再灌注后在高倍镜下可以观察到肺泡内出血明显,肺缺血再灌注使肺泡-毛细血管内膜损伤,导致微血管通透性改变和肺内微血栓形成[12],造成局部肺栓塞,在血流动力学等因素影响下使肺血管阻力上升、肺动脉压升高。然而本研究中PAH+IR组的RVHI与PAH组无明显差异,这可能是由于心室重塑是一种慢性适应性反应,右心室在PAH造成的长期过度后负荷的作用下,心肌细胞通过肌节以并联性增生的方式增粗,导致右心室壁增厚、RVHI升高[13],而本实验中的LIRI为急性反应,所以PAH+IR组与PAH组的RVHI无明显差异,这需要进一步的实验研究验证。
研究中,PAH+IR组比IR组的肺损伤评分明显升高,结合左肺大体外观,提示PAH加重LIRI的损伤。PAH以肺血管收缩和肺血管重构为特征[14],肺小动脉长期的收缩状态引起肺血管壁平滑肌和成纤维细胞的肥大和增生,导致肺小动脉管腔狭窄,血管阻力增加[15];同时胶原和弹性纤维在肺血管壁中沉积,血管弹性减弱,舒缩功能下降,同样增加肺小血管阻力[16],使再灌注时的血流恢复速度减慢,进而影响再灌注的效果,导致肺组织的损伤加重;此外PAH的特征还包括内皮细胞功能障碍以及原位血栓形成[17],这使得肺缺血时肺内血栓形成加剧,同样影响复灌,加重肺损伤。以上PAH和LIRI相互影响的机制尚未明确,有待更进一步的实验探索。
本研究成功建立了PAH合并LIRI的大鼠模型。采用野百合碱注射法+血管夹夹闭肺门法构建PAH合并LIRI模型,更好地模了拟临床PAH发病的病理生理机制和肺移植中供肺的缺血缺氧状态,且操作简单,建模成功率高。本研究也发现PAH和LIRI之间存在相互作用,其机制有待进一步阐明。本模型的建立为全面系统地认识和阐明PAH合并LIRI的病理生理机制以及两者之间的相互作用提供了重要基础。

