外周循环血中血脂比值Chemerin水平与急性冠脉综合征患者冠状动脉病变程度的相关性分析
赵媛媛,丁振江,田雅楠,付亚磊,樊 华,孟兵兵,钱人杰
(承德医学院附属医院心血管内科,河北 承德 067000)
急性冠脉综合征(acute coronary syndrome,ACS),是缺血性心脏病的急性表现,其包括了急性心肌梗死(acute myocardial infarction,AMI)和不稳定型心绞痛(unstable angina,UA)两种类型。斑块破裂是冠脉血栓形成的最常见原因也是导致ACS的常见病理改变,目前大量研究证实,炎症反应过程已经被确定为ACS的主要有害影响中介[1]。同时血脂的紊乱与粥样斑块的不稳定性存在着密不可分的关系,高脂血症更会加速心血管疾病的进展[2]。Chemerin作为新型的脂肪因子,可以影响脂肪细胞的新陈代谢,同时也发挥着促炎的作用。因此,本研究将通过探讨ACS患者外周循环血中脂肪因子Chemerin以及各个血脂比值之间的关系,以及它们与冠状动脉病变的程度的相关性,同时观测它们对ACS的诊断效能,为临床诊疗提供新的生物学参考指标。
1 对象与方法
1.1研究对象:本研究选自2019年7月至2020年1月于我院行冠状动脉造影术检查符合纳入标准者230人,其中ACS患者164例,包括AMI 77例(AMI组),UA 87例(UA组)。ACS诊断标准:符合美国的心脏病学会(AHA)和美国心脏协会(ACC)2014 年 ACS 的诊断标准[3]。同期行冠状动脉造影检查排除冠心病患者为对照组66例(即:冠状动脉主干或其主要分支管腔无狭窄或狭窄<50%)。排除标准:合并有感染、严重肝肾功能不全、恶性肿瘤、近期卒中病史、血液疾病、自身免疫疾病、心肌病、严重心脏瓣膜病、房颤的患者(符合上述之一均予以排除)。
1.2方 法
1.2.1临床资料收集:查阅所有入选研究对象的入院病历,收集研究对象的临床资料信息,包括人口学特征、化验及辅助检查等相关资料,建立Excel数据库。所有入选患者入院均签署知情同意书,且本课题研究通过医院伦理委员会批准。
1.2.2实验室指标测定:所有入选研究对象均于行冠状动脉造影术前经动脉穿刺途径留取动脉血5mL置于采血管中,然后以3000r/min离心15min,收集上层血清置于-80℃冰箱中保存待测。采用酶联免疫吸附法测定外周循环血中脂肪因子Chemerin的含量。同时研究对象的血常规、肝肾功能、血脂等相关临床指标的检测均于入院后采集静脉血,由我院检验科完成常规检测。
1.2.3血脂比值的计算:利用甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC),低密度胆固醇脂蛋白(low-density lipoprotein cholesterol,LDL-c)高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-c)临床化验报告结果,计算出TC/HDL-c、TG/HDL-c、non-HDL-c/HDL-c、LDL-c/HDL-c、血脂综合指数(LCI,TC×TG×LDL-c/HDL-c),其中非高密度脂蛋白胆固醇(non-HDL-c)即为TC与HDL-c的差值。
1.2.4冠状动脉病变严重程度的评估:采用目前国际公认的Gensini评分体系定量评价冠状动脉狭窄程度,计算方法:冠状动脉狭窄积分:<26%计1分,26%~<51%计2分,51%~<76%计4分,76%~<91%计8分,91%~<100%计16分,血管完全闭塞计32分。不同病变的冠状动脉相应系数:①左主干病变为5.0;②左前降支病变近段为2.5、中段为1.5、远段为1.0;二对角支分别为1.0、0.5;③左回旋支病变近段为2.5、中段为1.5、远段为1.0,钝缘支为1.0;④右冠状动脉病变近段、中段、远段、后降支均为1.0。每支冠状动脉狭窄积分乘以其相应系数为该血管积分,对于一支血管多处狭窄病变,应按狭窄最严重处计算。所有病变冠状动脉积分之和即为该研究对象的Gensini积分。分值越高,则提示冠状动脉狭窄程度越重。
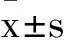
2 结 果
2.1对照组、UA组、AMI组一般临床资料及实验室指标比较:通过表1可看出在年龄层面三组之间无明显差异(P>0.05),在是否吸烟、患高血压病、糖尿病方面,三组之间存在统计学差异(P<0.01),其中AMI组吸烟者所占比例明显高于UA组及对照组。在SBP、WBC、NEUT、LYMPH、MONO、TC、LVDd、TC/HDL-c、TG/HDL-c、LDL-c/HDL-c、Non-HDL-c/HDL-c、LCI、Chemerin上三组之间存在统计学差异(P<0.01),同时我们发现UA组TG/HDL-c值及LYMPH高于对照组与AMI组,除此之外上述指标AMI组水平均高于UA组和对照组。而在HDL-c、EF中,ACS组低于对照组水平(P<0.01)。
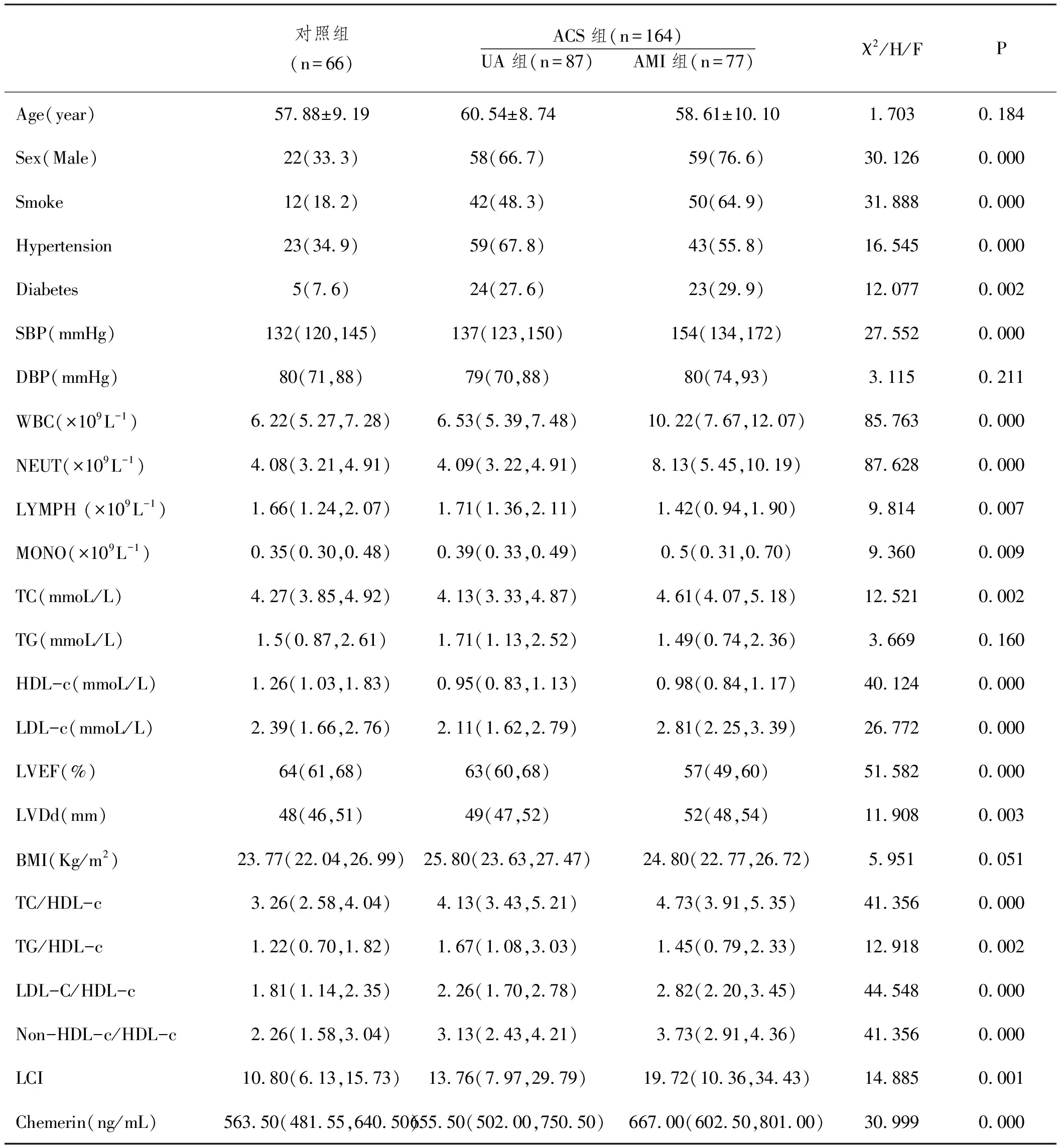
表1 对照组UA组AMI组一般临床资料及实验室指标比较
2.2不同Gensini组间循环血中血脂比值及Chemerin水平的比较:利用SPSS软件将Gensini评分按照三分位法,分为低分组(0~9.5分,77例),中分组(10~48分,78例),高分组(>48分,75例)三组。采用Kruskal-Wallis H检验进行组间比较发现,Chemerin、TC/HDL-c、LDL-c/HDL-c、Non-HDL-c/HDL-c、LCI水平高分组明显高于低分组且差异具有统计学意义(P<0.01),其中Chemerin、LDL-c/HDL-c水平比较中,高分组与中分组之间差异也具有统计学意义(P<0.05)。而中分组的血脂比值及Chemerin水平虽均高于低分组,但在LCI比较上无统计学意义(P>0.05),在Chemerin、TC/HDL-c、TG/HDL-c、LDL-c/HDL-c、Non-HDL-c/HDL-c差异上则具有统计学意义(P<0.05),见表2。
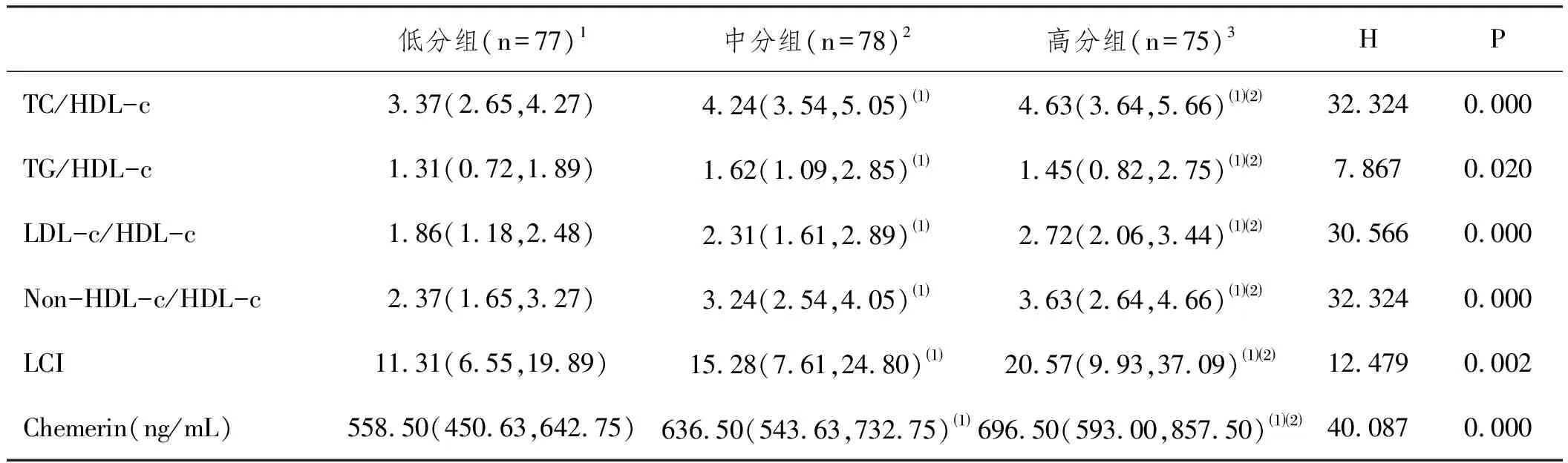
表2 不同Gensini组间循环血中血脂比值及Chemerin水平的比较
2.3循环血中Chemerin、血脂比值与Gensini的相关分析:通过Spearman相关分析得出血脂比值、Chemerin水平均与Gensini评分呈正相关(r=0.388、0.147、0.401、0.388、0.289、0.385,P<0.05),同时Chemerin水平与血脂比值中TC/HDL-c、LDL-c/HDL-c、Non-HDL-c/HDL-c也存在相关性(r=0.217、0.179、0.217,P<0.05),见表3。
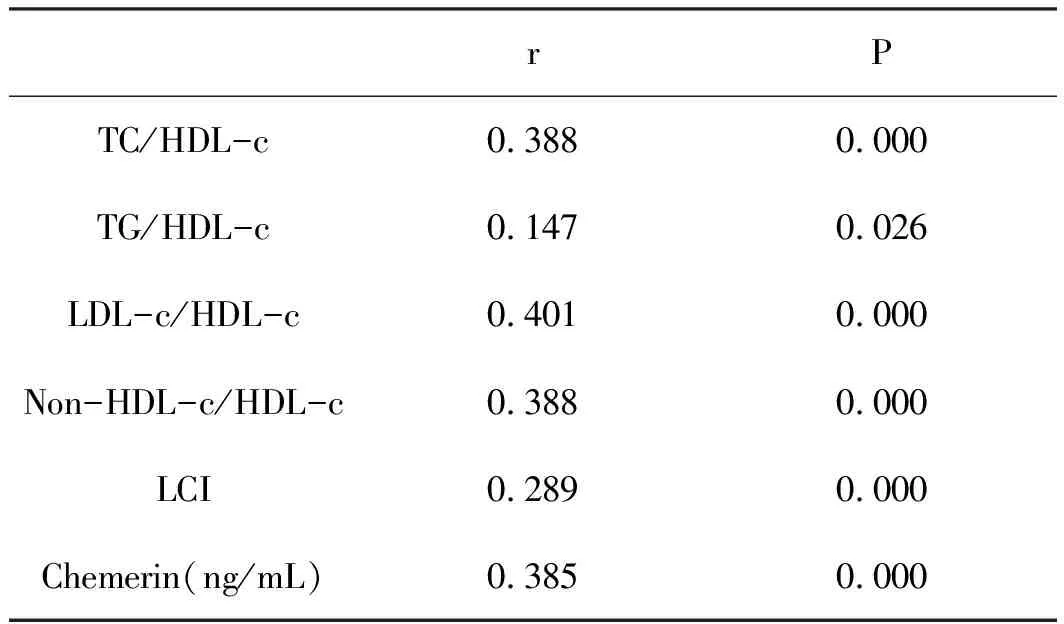
表3 循环血中Chemerin 血脂比值与Gensini评分的相关性分析
2.4关于ACS多重危险因素的回归分析:以ACS为因变量,并把表1中一般临床资料及实验室指标统计分析后差异具有统计学意义的因素(P<0.05)纳入自变量,构建二元Logistic回归模型,采用向前选择法逐步拟合模型(α入选=0.05,α剔除=0.1)。通过逐步校正,最终进入模型的为Chemerin、性别、高血压病、WBC、TC、HDL-c以上因素可作为ACS发生的独立危险因素。同时可看出男性的发生ACS风险是女性的8.64倍(P<0.01),而患有高血压病相对于无高血压病者,发生ACS的风险增加(OR=5.954,95%CI:2.327~15.239)。并且本研究中可有85.7%的ACS研究对象可用该模型来解释,见表4。
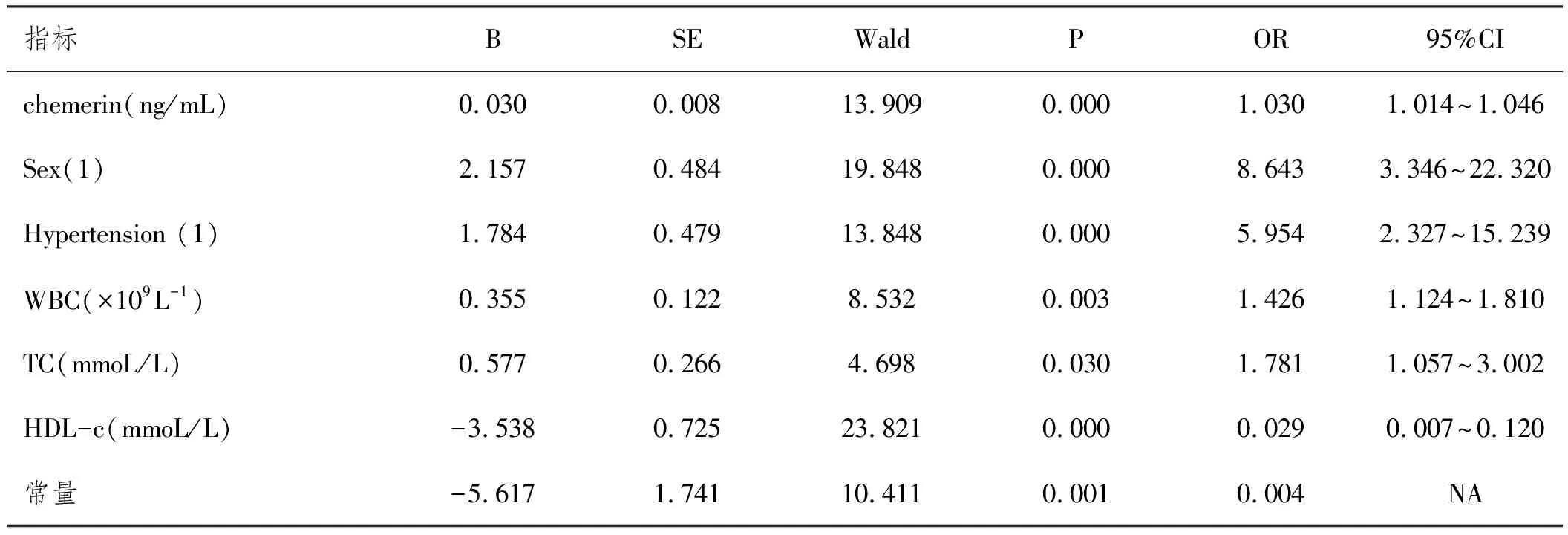
表4 ACS二元Logistic多重危险因素回归模型
2.5循环血中血脂比值、Chemerin水平对ACS的诊断效能:Chemerin对ACS的预测诊断价值,ROC曲线下面积为0.716。(P<0.001,95%CI:0.649~0.783)。而Chemerin联合TC/HDL-c、LDL-C/HDL-c的预测诊断价值,曲线下面积则提高至0.816。(P<0.001,95%CI:0.759~0.874),见表5、图1。
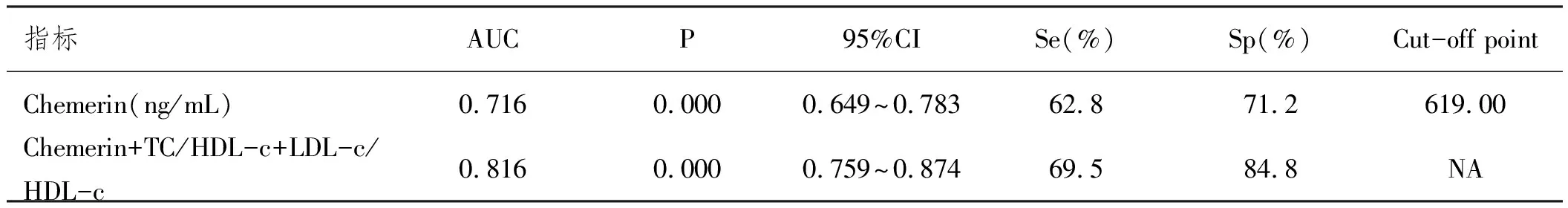
表5 血脂比值chemerin水平对ACS的诊断效能
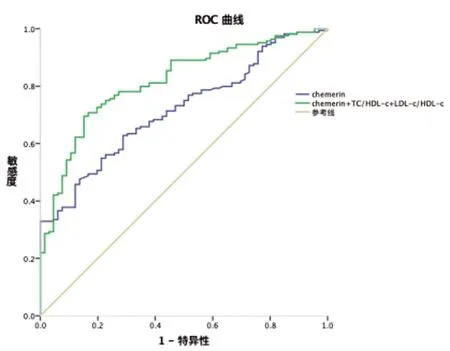
图1 联合Chemerin及血脂比值对ACS的预测价值
3 讨 论
动脉粥样硬化(atherosclerosis,AS)是大多数心脑血管疾病的病理基础,可引起心血管疾病的高负担,脂质代谢紊乱和炎症在AS的病理过程中占据了主导地位,这些过程之间的相互作用促进AS的进展[4]。多种数据表明,AS、不稳定斑块的形成、局部炎症反应已经成为发生ACS的关键环节[5]。
脂肪组织作为一种复杂且高度活跃的代谢和内分泌器官,可分泌多种脂肪因子,这些脂肪因子对碳水化合物和脂类代谢有广泛影响,并在炎症、血管内皮功能障碍和AS的发病机制中发挥重要作用这也是AS和相关疾病的新靶点[6]。Chemerin作为一种新型脂肪因子,在肥胖和代谢综合征状态下水平会升高,而脂肪组织则是Chemerin产生的主要来源,Chemerin可以影响脂肪细胞的新陈代谢。最新研究表明,Chemerin也具有促炎的特性,在内皮细胞(endothelial cells,ECs)生物学的背景下,Chemerin在ECs功能障碍和扰乱血管稳态方面发挥着重要作用,其机制可能是Chemerin在增加细胞黏附分子的表达,激活NF-κB,并通过NF-κB,丝裂原活化激酶和PI3K/Akt通路鼓励单核细胞与ECs黏附方面发挥了促炎作用[7]。相关学者研究发现,Chemerin还参与免疫细胞的招募并在炎症疾病的初始阶段通过发育过程充当各种免疫细胞之间的桥梁,同时它可以通过刺激SMC增殖和通过自噬迁移,导致血管结构重塑[8]。有相关基础研究显示,Chemerin可增加AS斑块中的脂质积聚,并加剧斑块的不稳定性,其作用机制可能是通过p38mapk途径介导的[9]。因此,这些因素不仅仅与斑块的形成联系密切,而且血管结构重塑所致的血管丛易破裂出血也是导致斑块不稳定性的主要原因之一。本研究综合了血脂及Chemerin水平在ACS人群中的表达,而血脂比值则更可以反映出血脂水平总体的动态变化。因此,通过综合分析发现TC/HDL-C、TG/HDL-C、non-HDL-C/HDL-C、LDL-C/HDL-C、LCI、Chemerin水平ACS组明显高于对照组,且均与冠状动脉病变严重程度存在正相关性,与此同时我们发现Chemerin水平与血脂比值中TC/HDL-c、LDL-c/HDL-c、Non-HDL-c/HDL-c存在正相关性,这更加系统化的证实了血脂水平失调和炎症途径双重因素可以预测冠状动脉粥样硬化斑块负荷方面的理念。并且Chemerin水平可作为预测发生ACS的独立危险因素(OR=1.03,P<0.05)。另一方面,本次研究还通过描绘ROC曲线确定了Chemerin在预测ACS的发生的截断值为619.00ng/mL,与联合相关血脂比值所描绘出的ROC曲线下面积相仿。
因此,循环血中血脂比值及Chemerin水平在ACS发生中可能具有重要作用,可能作为辅助诊断ACS、评估冠状动脉狭窄严重程度的新方向,为临床治疗提供新靶点。另外,本次研究为单中心、观察性的病例-对照研究,由于样本数量有限,且尚需进行随访、深入研究上述标志物对于ACS的长期的预后价值,对提前干预冠脉严重病变及在发生ACS的预防及以后的临床工作提供的新的指导角度。

