己酮可可碱对神经病理性疼痛大鼠前扣带回皮质内BRD4表达的影响
薛婷婷,郑昌健,陈永权
(1.皖南医学院第一附属医院 弋矶山医院 麻醉科,安徽 芜湖 241001;2.皖南医学院 麻醉学实验实训中心,安徽 芜湖 241002)
疼痛是一种与组织损伤或潜在损伤相关的不愉快的主观感觉和情绪体验(international association for the study of pain,IASP),其负性情绪可给患者造成严重的精神和心理损害。研究表明前扣带回皮质与慢性疼痛引起的相关负性情绪有密切联系[1]。嗅结构域蛋白4(bromodomain-containing protein 4,BRD4)是嗅结构域和超末端(bromodomain and extra-terminal domain,BET)家族的一个蛋白分子。BET蛋白均由两个串联的嗅结构域和一个超末端结构域构成[2],该类蛋白可通过与组蛋白或非组蛋白的乙酰化赖氨酸残基结合招募转录复合物从而调节基因的表达,在细胞增殖和炎症等过程中发挥着重要作用[3-5]。目前有研究证明BRD4在大脑中表达且参与海马区长期记忆的形成过程[6]。己酮可可碱(pentoxifylline,PTX)为肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的抑制剂,研究证明在脊髓背根神经节水平炎症刺激下TNF-α可激活BRD4信号通路分子蛋白与靶基因的耦联,此外,在大鼠急性炎症痛模型的基础上,抑制TNF-α可明显减轻大鼠的痛觉过敏且下调背根神经节中上调的BRD4[7]。本研究对慢性坐骨神经压迫(chronic constriction injury,CCI)大鼠腹腔注射PTX,拟探讨抑制TNF-α能否下调神经病理性疼痛大鼠前扣带回皮质内BRD4分子的表达,同时改善疼痛引起的大鼠的焦虑表现。
1 材料与方法
1.1 实验动物 雄性健康SPF级大鼠20只,体质量250~300 g,由长沙市天勤生物技术有限公司提供。随机分为4组:正常组(N组)、假手术组(S组)、模型组(C组)以及造模后己酮可可碱治疗组(P组),每组5只。大鼠分笼饲养,饲养温度恒温26℃,相对湿度70%,昼夜交替节律12 h。
1.2 神经病理性疼痛模型制备 2%戊巴比妥钠45 mg/kg腹腔注射麻醉大鼠,参考Bennet等提供的模型制备方法建立CCI模型结扎大鼠坐骨神经[8]:平行于股骨处逐层切开大鼠外皮,钝性分离肌肉,游离出大鼠坐骨神经主干约7 mm左右,在坐骨神经分叉上方结扎坐骨神经,共结扎4道,每道间隔1 mm,结扎松紧度以大鼠术侧肌肉微微抽搐为准。S组仅游离坐骨神经不结扎。以造模后大鼠术侧后足机械缩足阈值相较其基础值下降≥40%为模型建立成功的标准筛选C组与P组大鼠。
1.3 给药方案 P组大鼠,PTX(MCE,HY-B0175)于造模后第6天确认CCI模型建立成功后开始给药,腹腔注射100 mg/kg,连续注射8 d,直至处死大鼠进行取材。
1.4 观察指标
1.4.1 痛阈测定 大鼠机械缩足阈值(mechanical withdrawal threshold,MWT)使用von-frey纤维丝用up-down法进行测量[9],热缩足潜伏期(the paw withdrawal latency,PWL)用红外热刺痛仪测量。测量痛阈在安静环境下进行,测量前30 min先让大鼠熟悉环境,待其安静后再行测量。每次痛阈测量间隔时间需大于5 min以减小测量误差,且连续测量次数不宜过多,防止损伤大鼠后足。造模前先连续测量3天,取平均值作为基础值,造模后第3、5、7、10、14天再分别进行测定,记录大鼠痛阈变化趋势。测定时间均在上午8:00~10:00。
1.4.2 焦虑表现记录 本实验采用旷场实验对大鼠的焦虑表现进行观察统计。造模后第14天将大鼠置于旷场实验箱(1 m×1 m×0.5 m)中,箱体正上方摄像头采集大鼠的实验信息,人为定义旷场箱中心区域(0.5 m×0.5 m)为实验中央区。实验开始前1小时将大鼠放入旷场箱所在房间适应环境。实验开始时将大鼠从中央区放入,使用三点法对大鼠追踪定位,设定观察时间为15 min,记录大鼠的运动轨迹。实验保证在安静环境下进行,相邻大鼠测量间隔用酒精擦拭清洁旷场箱,减少气味的影响。实验结束后对采集的相关数据进行分析。
1.4.3 ELISA测定TNF-α 术后14 d麻醉大鼠后断头法处死大鼠,根据大鼠脑立体定位图谱取前扣带回皮质,置入离心管中-80℃冻存。组织于冰上匀浆,按ELISA试剂盒(Abclonal,RK00029)说明书内容反复冻融两次后离心取上清液测定大鼠前扣带回皮质TNF-α含量。
1.4.4 Western blot测定BRD4 取出冻存组织,冰上匀浆裂解后离心取上清液测定蛋白浓度,再加入上样缓冲液煮沸,使蛋白变性。配置8%聚丙烯凝胶电泳,样品按15 μL、30 μg标准上样,电泳结束后根据marker对应蛋白分子量切胶再进行转膜,5%脱脂奶粉封闭2 h后加入BRD4一抗(abcam,ab128874,1∶1 000),4℃摇床孵育12~18 h,TBST洗涤条带3次,再将条带加入对应二抗中(biosharp,BL003A,1∶10 000)室温孵育1 h,TBST洗涤3次,最后加上显影液曝光,比较不同组间BRD4表达的差异。
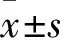
2 结果
2.1 各组大鼠处理后第14天痛阈阈值变化比较 S组大鼠与N组相比,机械缩足阈值及热缩足潜伏期差异无统计学意义(P>0.05);C组与N、S组大鼠相比,其机械缩足阈值及热缩足潜伏期均降低(P<0.05);P组与C组大鼠相比,机械缩足阈值及热缩足潜伏期均升高(P<0.05)。见表1。

表1 各组大鼠处理后第14天痛阈阈值变化对比
2.2 各组大鼠旷场实验参数比较 旷场实验中,正常大鼠会进入实验中央区进行探索行为,而焦虑的大鼠则很少进入中央区,沿着箱体贴壁行走。S组与N组差异无统计学意义(P>0.05);而C组大鼠几乎不进中央区,进入中央区次数及在中央区停留时间相对N组减少(P<0.05);P组大鼠相较C组进入中央区次数增多(P<0.05),在中央区停留时间延长(P<0.05),大鼠焦虑表现改善,见图1、表2。
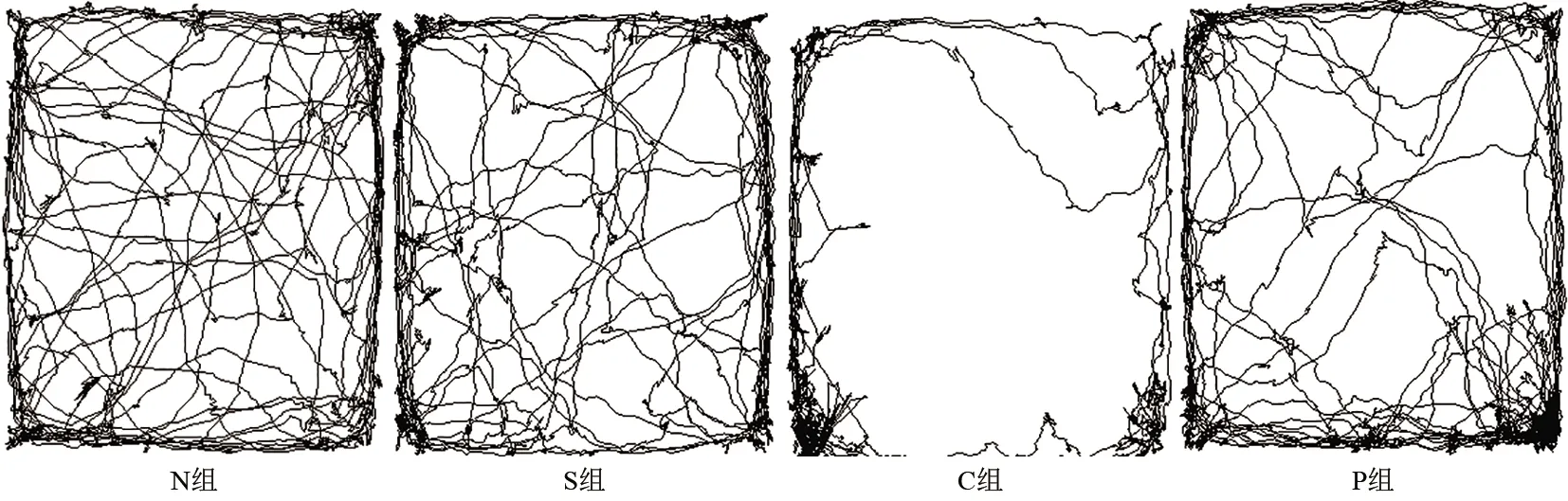
图1 各组大鼠旷场实验轨迹图
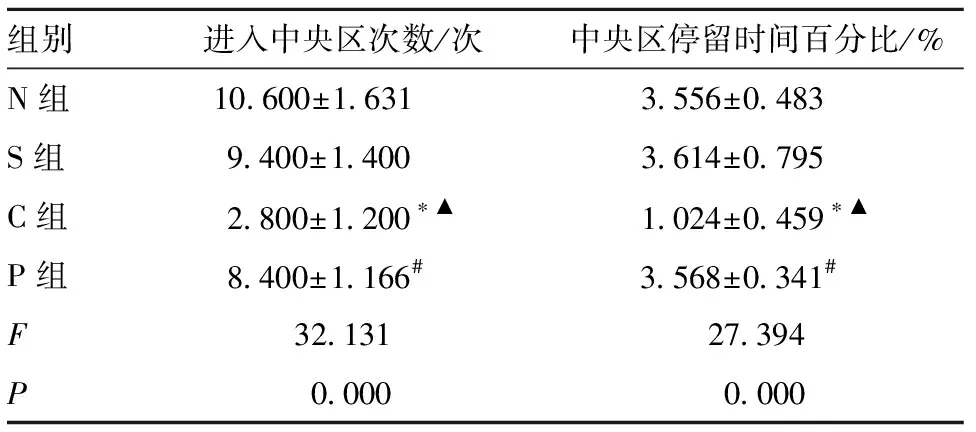
表2 各组大鼠旷场实验参数比较
2.3 各组大鼠前扣带回皮质TNF-α表达比较 N组与S组TNF-α表达差异无统计学意义(P>0.05);C组TNF-α表达相较N、S组大鼠增多(P<0.05);PTX腹腔注射后大鼠前扣带回皮质TNF-α含量减少(P<0.05)。见表3。

表3 各组大鼠前扣带回皮质TNF-α表达比较
2.4 各组大鼠前扣带回皮质内BRD4表达WB条带灰度值比较 S组BRD4表达与N组比较差异无统计学意义(P>0.05);C组大鼠前扣带回皮质内BRD4含量较N、S组增多(P<0.05);P组BRD4表达较C组减少(P<0.05)。见图2、表4。
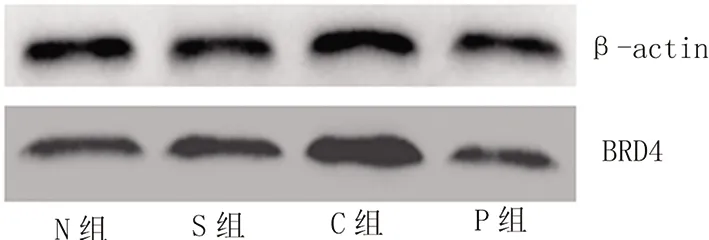
图2 各组大鼠前扣带回皮质内BRD4表达WB条带图

表4 各组大鼠前扣带回皮质内BRD4表达WB条带灰度值比较
3 讨论
神经病理性疼痛是指由躯体感觉神经系统的损伤或疾病而直接造成的疼痛,属于一种慢性疼痛,发病率约为6.9%~10%,以自发性疼痛、痛觉过敏、异常疼痛和感觉异常等表现为临床特征[10]。本研究参考Bennet等[8]的方法对大鼠行CCI手术建立神经病理性疼痛模型,术后大鼠手术侧后足机械缩足阈值及热缩足阈值降低,提示大鼠产生痛觉过敏甚至痛觉超敏。
有研究表明,BET 蛋白参与脊髓损伤所引起的神经病理性疼痛过程,靶向抑制BET蛋白可降低脊髓损伤后小胶质细胞的反应性,促进神经保护,改善脊髓损伤所引起的痛觉过敏并且促进功能恢复[11]。BET家族主要包括4种蛋白:BRD2、BRD3、BRD4及BRDT。BRD4是目前BET家族中研究最广泛的一个蛋白,在哺乳动物体内广泛表达,目前该蛋白已被证实在脊髓水平参与急性疼痛的调节[7]。足底完全弗氏佐剂(complete Freund′s adjuvant,CFA)注射建立急性炎症痛模型,大鼠背根神经节中BRD4表达增加,抑制BRD4可降低痛觉神经元的兴奋性,减轻痛觉过敏。此外,在慢性神经病理性疼痛模型中,BRD4也被证实参与了脊髓水平疼痛感觉分辨信息的调控[12],抑制BRD4可显著提高疼痛大鼠下降的机械缩足阈值。另一方面,研究证明BRD4在神经元功能中起着重要作用,介导学习与记忆的转录调节[6],该蛋白可在皮层与海马的神经元细胞中表达,通过调节神经元中即刻早期基因和突触相关蛋白的转录参与长期记忆的形成,抑制BRD4可导致小鼠的记忆缺陷,消除小鼠的恐惧反应,从而影响记忆的巩固。此外,抑制BRD4还可降低小鼠癫痫发作的易感性也证明了BRD4蛋白分子对脑神经元功能的重要性。
TNF-α是炎症发生过程中至关重要的炎性介质,在神经病理性疼痛的发生发展中起着重要作用。研究表明,TNF-α可刺激诱导背根神经节BRD4/Nav 1.7信号通路目的基因的表达,抑制TNF-α可缓解CFA大鼠痛觉过敏,降低脊髓水平BRD4信号通路相关蛋白含量[7]。PTX可有效抑制TNF-α的表达,实验中常用作TNF-α的拮抗剂,该分子为二甲基黄嘌呤类衍生物,能够有效地通过血脑屏障,常采用腹腔注射方式给药,且研究证实PTX预防性腹腔注射可减轻神经病理性疼痛大鼠痛觉过敏的发展[13]。
疼痛可导致前扣带回皮质活性增强[14],且该部位的激活与慢性疼痛所引起的悲伤、焦虑、抑郁等负性情绪相联系[15-17],早期也有临床研究发现手术切除前扣带回皮质可缓解慢性疼痛患者的焦虑抑郁情绪[18]。本研究对CCI大鼠腹腔注射PTX抑制大鼠前扣带回皮质TNF-α表达后,大鼠痛觉过敏明显缓解,焦虑表现改善,同时前扣带回皮质内因疼痛上调的BRD4水平也随之下降,说明了前扣带回皮质内BRD4信号通路参与了神经病理性疼痛的发生发展。
本研究使用PTX后,神经病理性疼痛大鼠前扣带回皮质BRD4表达有一定的下降,但仍高于N组及S组,另一方面相关研究表明抑制BRD4可抑制TNF-α介导的炎症反应[19],也可选择性抑制TNF-α介导的NF-ΚB目标基因的表达[20]。说明BRD4/TNF-α信号通路调节机制十分复杂,可能存在双向调节或者反馈机制,具体的调节机制及作用有待进一步研究。
综上所述,己酮可可碱腹腔注射可以有效减轻神经病理性疼痛大鼠的机械与热痛觉过敏,下调疼痛大鼠前扣带回皮质增高的BRD4蛋白,改善大鼠的焦虑表现,为BRD4信号通路在神经病理性疼痛的研究机制中提供一个新的切入点。

