游离长链非编码RNA TUG1在结直肠癌的表达及其对化疗敏感性的影响
崔瑛,王晓辉,刘艳霞
(许昌市人民医院1.质控办;2.血液肿瘤科;3.护理部,河南 许昌 461000)
结直肠癌是常见的消化道恶性肿瘤,其发病与遗传因素、饮食运动等生活方式和老龄化密切相关,近年来随着经济发展、环境污染加剧和人口老龄化,其发病率亦呈上升趋势[1]。结直肠癌治疗以手术切除为主,对于手术无法根治的患者采用术后辅助化疗作为一线治疗方案,然而很多患者在化疗几个周期后会出现耐药情况,严重影响到治疗和预后[2,3]。牛磺酸上调基因1(Taurine up-regulated gene 1,TUG1)是长链非编码RNA的一种,既往研究发现TUG1与多种癌症的发生发展有关,它能通过诱导癌细胞转移和上皮-间质转化促进结直肠癌的进展[4-6]。本研究通过测定结直肠癌患者血清游离TUG1表达与体外癌细胞下调TUG1对化疗敏感性的变化,来探讨TUG1的表达与结直肠癌患者病情和化疗耐药的关系,报告如下。
1 资料与方法
1.1 一般资料2018年5月-2019年4月本院收治的结直肠癌患者137例作为研究对象,纳入标准:所有患者均接受了手术切除治疗,均经术后病理证实为结直肠癌。其中男性为73例,女性64例,年龄为32~87岁,平均为63.21±4.27岁。另收集100例同期在本院体检健康者血清作为对照,其中男性52例,女性48例,年龄为33~85岁,平均为62.89±5.13岁。结直肠癌组患者与健康体检者年龄和性别比较,差异无统计学意义(P>0.05),一般资料具有可比性。本研究已通过伦理委员会审查。
1.2 试剂与仪器 人结直肠癌细胞系SW620购自中国科学院上海细胞库,培养液选用Leibovitz’s L-15培液(添加10%胎牛血清),购自上海玉博生物科技有限公司。R1200总RNA提取试剂盒购自北京索莱宝科技有限公司,转染试剂采用Lipofectamine3000购自美国Invitrogen公司。PCR引物合成在生工生物完成,RNA反转录试剂盒与RTqPCR试剂盒均购自德国Qiagen公司。TUG1抑制剂Smart Silencer-TUG1(ss-TUG1)及阴性对照ss-NC购自广州锐博生物科技公司;CCK8试剂盒购自南京固与生物;顺铂(Cisplatin,DDP)购自大连美仑生物技术有限公司。
恒温恒湿箱采用无锡玛瑞特科技有限公司LRH-150HC,酶标仪选用赛默飞世尔科技FC型酶标仪,RT-qPCR仪采用美国Applied Biosystems公司的ABI7500。
1.3 研究方法
1.3.1 结直肠癌患者和体检健康人群血清TUG1相对表达量的测定 结直肠癌患者入院接受手术治疗前采血后立即分离血清,采用RNA提取试剂盒提取血清中的总RNA,逆转录成cDNA后进行RT-qPCR,读取Ct值,采用2–ΔΔCT计算TUG1相对表达量,采集到的健康体检者静脉血亦采用同样的方法测定血清TUG1相对表达量。TUG1基因的上游引物为5'-GGCUUCUAUUCUGAAUCCU-3',下游引物为5'-AGGAUUCAGAAUAGAAGC-3';内参基因选用β-actin。
1.3.2 细胞系DDP敏感性与TUG1表达关系的测试 将SW620细胞系于温度37℃,含有5%CO2培养箱中培养,取对数生长期细胞(5×104/ml)100μl/孔接种于6孔板,常规培养24h后,按照Lipofectamine3000转染试剂盒说明书分别采用TUG1抑制剂(Smart Silencer-TUG1,ss-TUG1)和阴性对照(Smart Silencer-negative control,ss-NC)转染人结直肠癌SW620细胞系,构建TUG1低表达SW6 20-TUG1组和正常表达SW620-NC组。两组细胞常规培养5~6h,置换新的培养液,继续培养24h后,采用RT-qPCR检测两组细胞TUG1的表达量,每组各检测3个复孔并重复检测3次。
同时将转染后的两组细胞悬液按照1×105个细胞/孔接种于96孔板,每孔100μl,各4板,进行常规培养。次日分别给予0mg/L(空白)、10mg/L、25mg/L、50mg/L、75mg/L和100mg/L的顺铂(DDP)处理,每个浓度3个复孔,在DDP处理的0h、24、48与72 h,各取出1板加入CKK8溶液于37℃孵育2h,酶标仪检测490nm处吸光度值(OD值),上述测量值均重复测量3次。
1.4 观察指标TUG1表达与结直肠癌病情的关系:对比结直肠癌患者和体检健康人群血清TUG1含量的差异,并分析结直肠癌患者TUG1表达量与患者的临床病理特征的关系。
TUG1表达与结直肠癌细胞对DDP敏感度的关系:对比转染培养后SW620-NC与SW620-TUG1两组细胞TUG1相对表达量,采用Graph-PadPrism5.0计算72h时半数抑制浓度(inhibitory concentration of 50%,IC50),比较10mg/L的DDP用药后不同时间点OD值的变化,计算10mg/L DDP的生长抑制率=(加药-空白)/空白×100%。
1.5 统计学处理 采用SPSS21.0软件,结直肠癌患者血清TUG1与临床病理特征关系的分析采用单因素分析中的卡方检验(χ2),血清及细胞系TUG1表达量()采用t检验进行比较,组间不同时间点比较先采用重复测量数据的方差分析,再采用t检验进行比较,P<0.05为差异有统计学意义。
2 结果
2.1 结直肠癌患者和体检健康人群血清TUG1相对表达量的比较 结直肠癌患者血清TUG1相对表达量为6.11±0.23,体检健康人群血清TUG1相对表达量为2.76±0.24,结直肠癌患者血清TUG1相对表达量高于体检健康人群,差异有统计学意义(t=114.151,P<0.05)。
2.2 结直肠癌患者血清TUG1与临床病理特征的关系 以结直肠癌患者血清TUG1相对表达量的平均值6.11为界,将结直肠癌患者分为高表达组(TUG1相对表达量>6.11)和低表达组(TUG1相对表达量<6.11)。结果显示,血清TUG1表达高低与性别、年龄和肿瘤大小无关(P>0.05),与癌组织分化程度、浸润深度、淋巴结转移和是否远处转移有关(P<0.05),见表1。
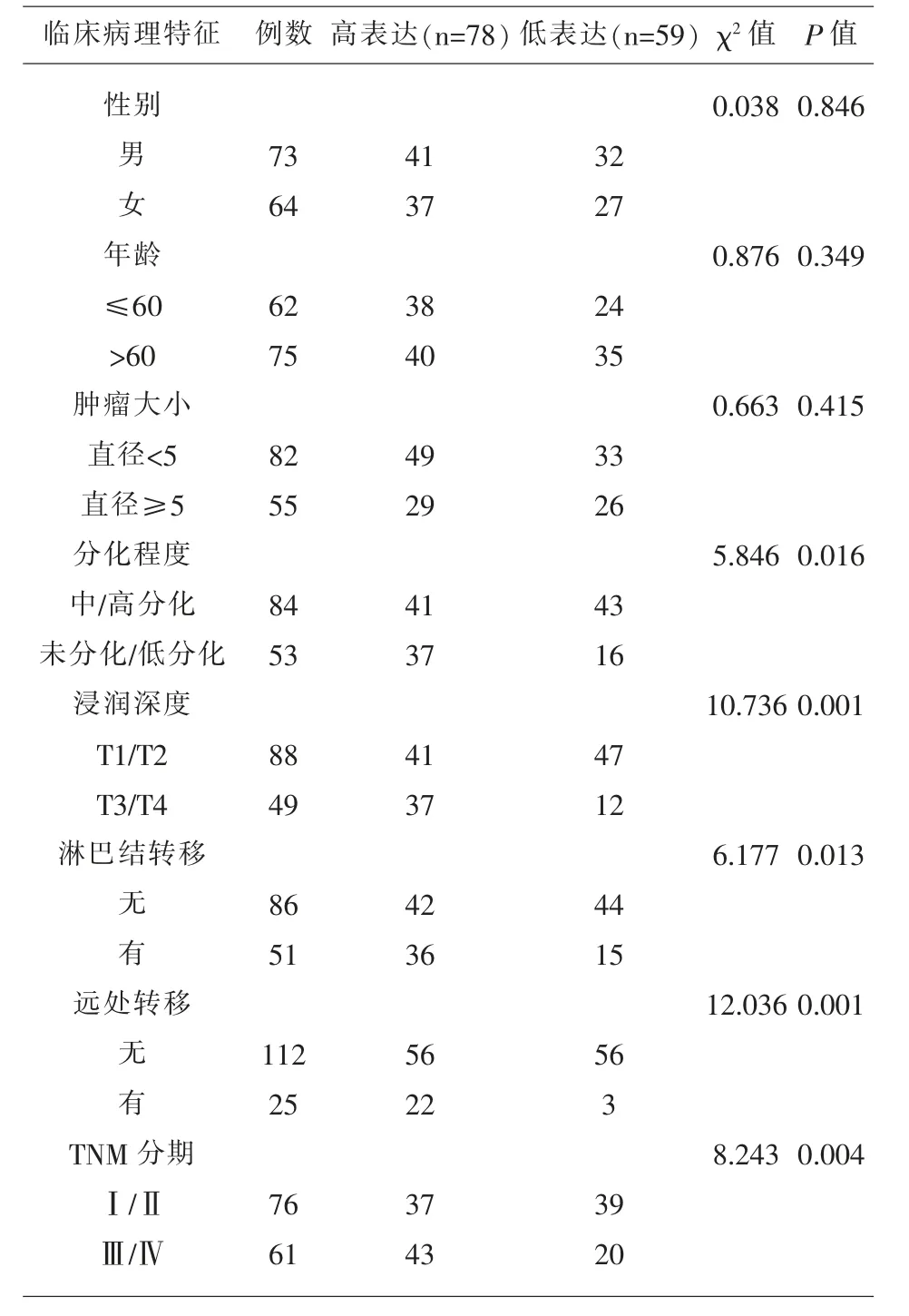
表1 结直肠癌患者血清TUG1与临床病理特征的关系
2.3 SW620-NC与SW620-TUG1细胞TUG1相对表达量的比较ss-TUG1和ss-NC转染SW620细胞系构建SW620-TUG1细胞与SW620-NC细胞后,采用RT-qPCR检测TUG1相对表达量,显示SW620-TUG1细胞中TUG1相对表达量为1.19±0.28;明显低于SW620-NC细胞3.07±0.35,差异有统计学意义(t=7.265,P=0.001),表示通过转染成功下调了TUG1表达。
2.4 SW620-NC与SW620-TUG1细 胞IC50的 比较DDP处理72h后软件计算得到两组细胞的IC50,SW620-TUG1组的IC50为23.18±2.19mg/L,SW620-NC组为75.29±3.72mg/L,SW620-TUG1组的IC50低于SW620-NC组,差异有统计学意义(t=20.908,P<0.001)。
2.5 SW620-NC与SW620-TUG1细胞用药后不同时间点OD值的变化DDP用药后0h、24h、48h和72h,SW620-TUG1组OD值均明显低于SW620-NC组,差异有统计学意义(P<0.05),且随着时间的推移,两组细胞间OD值的差异越来越大,见表2和图1。
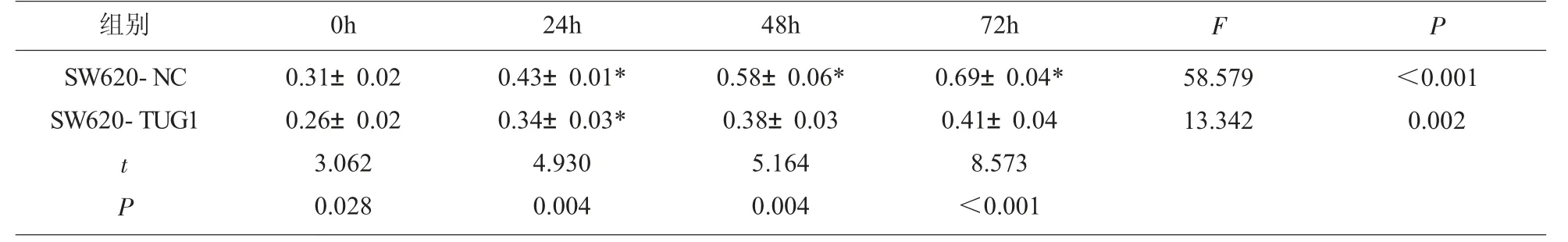
表2 SW620-NC与SW620-TUG1细胞10mg/L的DDP用药后不同时间点OD值
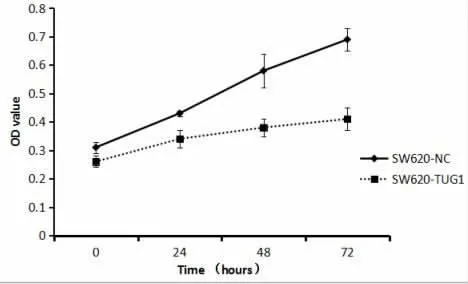
图1 10mg/L DDP用药后不同时间点OD值的比较
2.6 SW620-NC与SW620-TUG1细胞在不同时间点生长抑制率的比较48h和72h测得SW620-TUG1细胞的生长抑制率明显高于SW620-NC,差异有统计学意义(P<0.05),且随着时间的推移,两组间差异越来越大,见表3、图2。
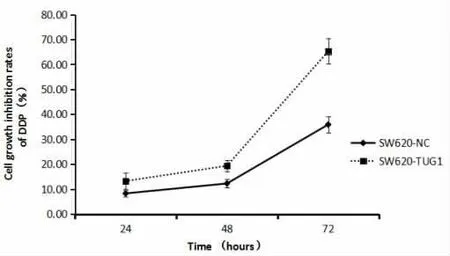
图2 DDP用药后不同时间点生长抑制率的比较
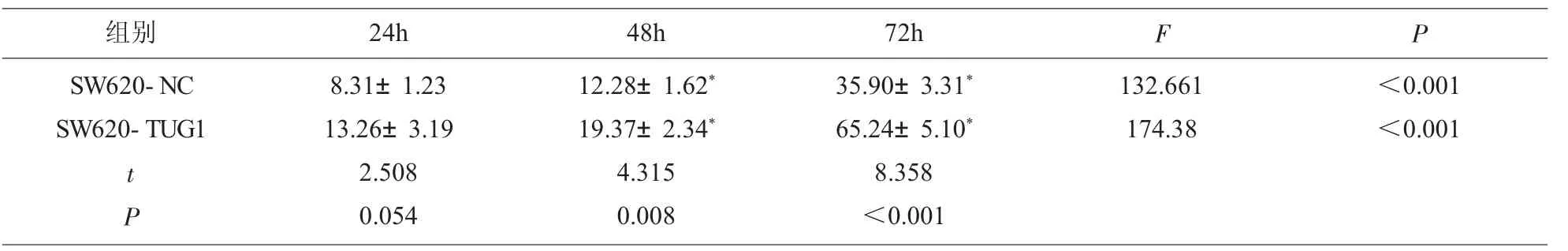
表3 SW620-NC与SW620-TUG1细胞不同时间点生长抑制率的比较
3 讨论
结直肠癌是常见的消化道恶性肿瘤之一,据WHO最新数据统计其发病率在恶性肿瘤中高居第四,致死率高居第三,严重危害人类生命健康[7]。结直肠癌具有很强异质性,个体基因的改变可能与其病理组织学特征及对化疗药物的敏感度都密切相关,因此对结直肠癌患者化疗前检测相关基因的表达对其选择治疗方案和预后的改善都能起到一定帮助[8]。
长链非编码RNA虽然不编码蛋白质,但其在各种生物活动和疾病进展中发挥着重要的调节作用,包括癌细胞的耐药性[9]。TUG1作为长链非编码RNA的一种,近年来也逐步受到临床和科研的广泛关注。既往研究表明,TUG1呈高表达的食管鳞癌患者对化疗敏感性较差,胃癌组织中TUG1通过沉默P57表达从而促进胃癌发生与进展,TUG1还能通过介导上皮-间充质转换促进癌细胞转移[10-12],故推测结直肠癌患者癌症的发展和对化疗敏感性也可能与TUG1的表达有关。血清游离TUG1与组织TUG1表达呈正相关[13],且样本容易获取,还能实现表达状态的监测,因此本研究采用血清TUG1水平反映患者癌组织TUG1的表达。
结果发现,结直肠癌患者血清TUG1表达量明显高于健康体检者,且其表达的高低与癌组织分化程度、浸润深度、淋巴结转移和是否远处转移均有关。低分化癌组织中TUG1表达量高于高分化癌组织,癌细胞浸润程度高的TUG1表达量高于浸润程度较低的,发生淋巴结转移的患者TUG1表达高于未发生转移的,发生远处转移的TUG1表达高于近端转移。总之癌症病情越严重,组织病理学分级越高,TUG1表达量越高,这与姚凯、Jiang L等人[6,10]通过对结直肠癌患者组织中TUG1表达和患者临床病理特征之间关系进行分析得出的研究结果相符。Qin CF等人[13]对结直肠癌患者血清与组织中的TUG1含量进行比较发现,确实呈现明显正相关关系,且血清与组织中的TUG1含量均与患者术前TNM分期显著相关,提示术前血清TUG1亦可一定程度上反映结直肠癌的病情的严重程度,这将为后续结直肠癌术前诊断带来便利。TUG1在癌症的发生和进展中发挥着作用,调控机制可能与TUG1的竞争性抑制作用有关,它可以促进一系列微小RNA调控的靶蛋白的表达,增强Wnt/β-连环蛋白途径的活性和下游基因转录的核定位,促进肿瘤细胞的的增殖,通过激活内皮-间充质相关基因表达,增加癌细胞迁移和侵袭能力,从而促进癌症进展[14,15]。
DDP是一种铂类抗癌药物,属于细胞周期非特异性药物,能够通过干扰DNA复制杀死无限增殖的肿瘤细胞,是包括结直肠癌在内的多种癌症一线化疗药物。通过体外细胞培养进行DDP敏感性实验发现,SW620-TUG1细胞系中TUG1的表达受到抑制,DDP用药前OD值已明显低于SW620-NC细胞,说明TUG1的表达与癌细胞生长和增殖活性呈 正 相 关。DDP用 药 后24h、48h、72h,SW620-TUG1细胞与SW620-NC细胞OD值差异随着时间增加而增大;相比TUG1高表达的SW620-NC细胞,TUG1低表达的SW620-TUG1细胞经DDP处理72h的IC50明显降低,且生长抑制率明显升高,下调TUG1的表达能增强DDP对癌细胞的抑制率,揭示了TUG1高表达介导了结直肠癌细胞对DDP抗性,这可能同样与TUG1介导癌细胞增殖和转移有关,与DDP药物作用形成了竞争性拮抗关系,同时TUG1促进肿瘤细胞上皮间质转化,使得肿瘤细胞获得了肿瘤干细胞特性,从而减弱了DDP对细胞周期干扰效果[10]。Fukuda Y等人研究[16]指出肿瘤细胞的耐药性与ABC转运蛋白超家族介导药物转运系统改变有关,而近期Li C等学者研究[17,18]表明TUG1是通过mir-186/cpeb2轴介导结直肠癌的甲氨蝶呤化疗抵抗,亦有Niu Y等学者研究[12]指出,TUG1能在非小细胞肺癌中通过招募相关因子,促进组蛋白甲基转移酶活性,诱导LIMK2b基因启动子甲基化从而抑制其转录,促进肿瘤细胞增殖,并诱导其化疗抵抗,但其在结直肠癌中的具体调控信号通路是否也与肺癌中一致,仍有待进一步实验研究。此外,结果中还可以发现DDP作用48h和72h后SW620-TUG1细胞与SW620-NC细胞生长抑制率差异显著,SW620-NC细胞随着时间延长对DDP的敏感性降低,进一步说明了高表达的TUG1与癌细胞对DDP耐药相关。
综上,TUG1在结直肠癌患者血清中表达上调,与患者病情严重程度密切相关,进一步实验显示下调TUG1能增加癌细胞对DDP的敏感性,从而增强DDP的细胞毒性。本研究可为结直肠癌化疗药物DDP敏感性测试提供新的靶点,也为日后化疗的个体化用药提供一定参考意义,未来可能通过监测结直肠癌患者血清TUG1表达量选择或及时调整其术后化疗方案。

