患者小肠中细菌过度生长与NAFLD的关系研究
郑岩,周子博,于雅丽
(郑州市骨科医院检验科,河南 郑州 450001)
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是由一系列因素导致肝细胞脂质大量聚集引发的疾病[1]。现在肥胖人数与糖尿病患者数量庞大,再加上当机体出现遗传易感性和胰岛素抵抗,NAFLD的发病率越来越高[2]。一些炎症因子与自由基的异常释放将导致肝细胞坏死,进而出现慢性肝炎、肝纤维化,发展到NAFLD。血清透明质酸(hyaluronic acid,HA)、层黏蛋白(Laminin,LN)、III型前胶原(typeⅢsticking layer before collagenⅢ,PCIII)、IV型 胶原(collagen typeⅣ,IV-4))能作为肝纤维化的诊断指标[3-5]。已有研究证明,在NAFLD的发展过程中,患者小肠中细菌的过度生长扮演了重要的角色[6]。
肝硬化失代偿期时,肠道的淤血水肿,蠕动减慢,延迟,肠壁局部神经体液因素的异常以及肠黏膜通透性增高等因素为肠道内细菌的繁殖提供了适宜的环境,进而导致患者小肠中细菌过度生长,又可进一步加重肝损害,进而形成患者小肠中细菌过度生长与肝损害的恶性循环[7,8]。近年来,患者小肠中细菌过度生长与肝硬化发作之间的关系引起了广泛关注。在这项研究中,葡萄糖氢呼气试验用于检测小肠中细菌的过度生长,分析患者小肠中细菌过度生长在NAFLD中的作用。
1 资料与方法
1.1 一般资料 选取2018年1月-2019年12月在我院治疗的NAFLD患者110例(NAFLD组),其中轻度、中重度脂肪变患者分别为72例和38例;其中男性65例,女性45例;年龄32~72岁,平均年龄(54.40±9.28)岁。纳入标准:⑴诊断符合中华医学会肝病学分会脂肪肝和酒精性肝病学组制定的标准[9];⑵年龄18岁以上;⑶患者及家属知情同意。排除标准:⑴既往有腹部手术史;⑵合并有恶性肿瘤、内分泌疾病、肠梗阻及肠易激综合征等疾病;⑶入选前1个月有抗生素、美托洛尔等药物使用史。同时选取健康志愿者100例作为对照组,其中男性60例,男性40例;年龄30~69岁,平均年龄(55.10±10.11)岁。两组一般资料比较无统计学意义(P>0.05)。
1.2 患者小肠中细菌过度生长检测2组患者均空腹12 h以上进行检测。检测前嘱患者刷牙漱口,避免吸烟和剧烈运动。采用Breath Tracker TM Digital MicroLyzer SC呼气仪(美国QuinTron公司)进行小肠中细菌过度生长检测。检测方法严格按检测仪操作说明进行,诊断标准[10]:⑴基础呼气氢值>20×10-6,且隔半小时重复测定>20×10-6;⑵喝完乳果糖后1.5 h内呼气氢值增加>20×10-6。以上2项任意1项阳性即诊断为SIB0。
1.3 患者HA、LN、PCⅢP及Ⅳ-C水平检测 空腹抽取患者肘静脉血4ml,3 000 r/min离心离心15 min,分离上层血清液,HA、LN、PCⅢP及Ⅳ-C水平采用放射免疫分析法检测,试剂盒购于北京北方生物技术研究所,所用仪器为雅培i2000时间分辨荧光免疫分析仪。
1.3 统计学处理 数据分析采用SPSS22.0软件,年龄、HA、LN、PCⅢ和Ⅳ-C等资料采用表示,组间比较使用t检验,性别、患者小肠中细菌过度生长发生率等资料采用n(%)表示,组间比较使用χ2检验。检验水准:α=0.05。
2 结果
2.1 小肠细菌过度生长发生率情况NAFLD组小肠细菌过度生长发生率为51.82%(57/110),明显高于对照组的9.00%(9/100),差异比较有统计学意义(χ2=44.562,P=0.000<0.05);NAFLD组中,中重度脂肪变患者小肠细菌过度生长发生率为71.05(27/38),明显高于轻度脂肪变患者的41.67%(30/72),差异比较有统计学意义 (χ2=8.603,P=0.003<0.05)。
2.2 NAFLD组小肠细菌过度生长阳性和阴性患者血清HA等比较NAFLD组小肠细菌过度生长阳性者血清HA、LN、PCⅢ和Ⅳ-C分别为(134.40±21.10)ng/ml、(176.61±30.22)ng/ml、(130.22±21.13)ng/ml和(74.40±13.32)ng/ml,明显高于小肠细菌过度生长阴性者(P<0.05)。见表1。
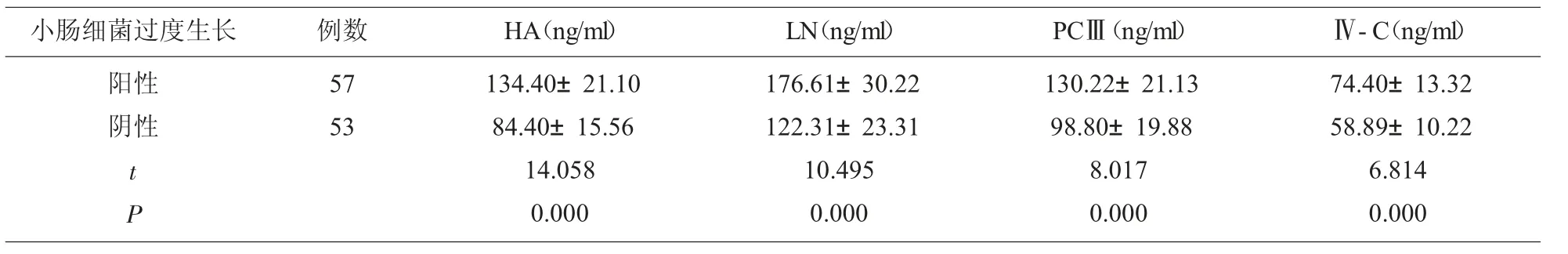
表1 NAFLD组小肠细菌过度生长阳性和阴性患者血清HA等比较
3 讨论
NAFLD是指排除过量饮酒等因素,以肝细胞脂肪病变为主要病理表现的综合征。肝纤维化是NAFLD的重要原因,研究表明[11],有50%的NAFLD患者肠道中细菌过度生长。肠道细菌的过度生长在NAFLD的发生和发展中起重要作用。临床实践证明[12],在对非酒精性脂肪肝肝纤维化患者的诊断中,一些血清学指标可以在一定程度上反映肝纤维化的进程,并且有很好的诊断价值,这就启示我们在对NAFLD的诊断与鉴别中,血清学指标可被纳入到检测项目中来。
HA,LN,PCⅢP和IV-C的合成与分泌主要发生在肝星状细胞内,HA是一种多糖,当肝脏遭到损伤时其合成加快,但肝脏的降解功能下降,至患者血清中HA呈现高水平,不能恢复到正常水平,因此,HA能够在一定程度上反应肝脏受损的程度[13,14]。在肝脂肪与内皮细胞中均有LN的存在,但是当肝脏内由于一些因素导致炎症细胞激活时,炎症因子会大量聚集,LN合成过程加速,显示出基底膜的转化[15]。PCⅢ反映了III型胶原蛋白的合成水平,肝硬化严重时,PCⅢ水平显著升高[16]。当Ⅳ-C大量聚集时,与LN共同形成基底膜,HA和PCⅢP不能被正常吸收与代谢,水平大幅度升高[17,18]。NAFLD患者有不同程度的肝损伤。不仅发生肝脂肪变性,而且肝纤维化趋向于发展为肝硬化。
本研究结果显示,在NAFLD患者中,患者小肠中细菌过度生长且血清HA、LN、PCⅢ和Ⅳ-C水平显著升高。分析原因是当肠道菌群失调时,肠粘膜受到一定程度的损害,导致其通透性增加,使大量内毒素通过门脉系统,导致肠道内大量毒素积聚,这些毒素到达肝脏,损害肝细胞,激活肝星状细胞的活性,使HA、PCⅢ、Ⅳ-C、LN因子大量产生,使其在肝细胞外基质的过度沉积,导致肝脏纤维化,能够在一定程度上呈现肝纤维化进程,引起脂肪性肝炎,同时还通过降低肝脏对体内毒素清除能力。小肠细菌的过度生长通过影响肝细胞生长环境,引发炎症与细胞坏死,使肝纤维化与肝损伤程度有关,进一步增加NAFLD的发生率,是引发NAFLD的原因之一。
本研究结果还显示,NAFLD组患者小肠中细菌过度生长发生率显著较对照组升高,重度脂肪变患者小肠中细菌过度生长发生率显著较轻度患者高。患者小肠中细菌过度生长会损伤肠道粘膜,使其对外的屏障作用遭受影响,进一步引发而至肠粘膜缺血、萎缩,造成肠道菌群失调。肝脏清除毒素的能力降低,并且大量毒素直接进入人体而不在肝脏中解毒,造成大量有害因子的释放,引起肝细胞损伤与坏死,抑制正常的凋亡过程。患者小肠中细菌还可以损伤肝窦内皮细胞,激发施瓦特曼反应,使肝内微循环发生障碍,这是引起NAFLD的原因之一。患者小肠中细菌过度生长使得小肠微绒毛发生异常,微绒毛的屏障与保护的作用受到抑制,免疫防御机制受损,NAFLD患者肝脏对内毒素的清除功能变得微弱,肠道中细菌的过度生长与NAFLD形成恶性循环,故需纠正患者肠道中细菌的过度生长,以便减少NAFLD的发生。
有研究发现[19,20],在小鼠发生NAFLD的环境影响因素中,肠源性内毒血症的作用尤为突出,小肠细菌过度生长加剧了体内毒素的产生,而小肠细菌过度生长在NAFLD的具体发生机制还没有明确结论,本研究通过检测HA、LN、PCⅢP、Ⅳ-C水平来探讨患者肠道中细菌过度生长在NAFLD中的作用,NAFLD患者发生小肠中细菌过度生长的几率显著增加,小肠中细菌过度生长可作为NAFLD的危险因素,从肠道微生态学的角度来说,防治患者肠道细菌产生的有毒物质损伤肝脏,将有助于预防NAFLD的恶化。
综上所述,NAFLD患者小肠中细菌过度生长发生率高,可能在疾病发生发展中有一定作用。

