电位滴定法测定二次电池废料中锰
明帮来,谢英豪,钟敏方,张学梅
(广东邦普循环科技有限公司,佛山 528137)
随着新能源汽车产业和电子领域的快速发展,锂离子电池、镍氢电池等二次电池使用量快速增长,退役电池量随同增长,退役的二次电池无论是经梯次利用还是直接报废,最终均需对其进行拆解,回收其中的镍、钴、锰等金属材料[1-4]。锰作为主要的回收金属元素之一,其含量直接影响废料的定价,因此,针对二次电池废料中锰含量的检测方法的研究具有重要意义。
测定锰的常用方法有硫酸亚铁铵滴定法,文献[5-6]采用硝酸铵氧化法,用硫酸亚铁铵滴定法测定锂离子正极材料锰酸锂和镍钴锰酸锂中锰含量;文献[7]采用高氯酸氧化法,用硫酸亚铁铵滴定法测定锰矿石、硫酸锰中锰含量;两种方法对比,后者操作更简单。此外,还有电感耦合等离子体原子发射光谱法、火焰原子吸收光谱法和乙二胺四乙酸二钠(Na2EDTA)滴定法等,如:文献[8]采用电感耦合等离子体原子发射光谱法测定用于镍氢电池的稀土系储氢合金中锰含量;YS/T 1006.2-2014《镍钴锰酸锂化学分析方法 第2 部分:锂、镍、钴、锰、钠、镁、铝、钾、铜、钙和铁量的测定 电感耦合等离子体原子发射光谱法》[9]以钇为内标,采用电感耦合等离子体原子发射光谱法测定锂离子正极材料镍钴锰酸锂中锰含量;文献[10]采用火焰原子吸收光谱法测定矿石中锰的含量;文献[11]采用Na2EDTA 滴定法测定锂离子正极材料锰酸锂中锰含量。硫酸亚铁铵滴定法由于需要控制严格的氧化条件,操作要求较高,目前应用逐渐减少。二次电池废料中锰含量较高,含有复杂的共存元素[1-4,12],因此,电感耦合等离子体原子发射光谱法、火焰原子吸收光谱法和Na2EDTA 滴定法均不是理想的方法。高锰酸钾电位滴定法由于其无需氧化、操作简单等优势,已广泛应用于锰含量的测定。文献[13-14]采用高锰酸钾电位滴定法分别测定铜镍锰钎料和富锂锰基正极材料中锰含量。
本工作研究了商业化的镍钴锰酸锂型、锰酸锂型锂离子电池废料和稀土系镍氢电池废料中锰含量的测定。采用盐酸、硝酸溶解样品,在中性焦磷酸钠介质中,用高锰酸钾标准滴定溶液进行滴定,针对稀土系镍氢电池废料,则提出了先采用氢氟酸氟化分离沉淀铈后再过滤分离测定,试验结果可靠。
1 试验部分
1.1 仪器与试剂
ZD-2型电位滴定仪,配213 型铂电极、215 型钨电极和搅拌装置;雷磁PHS-3C型pH 计(精度为0.01);TAS-990型原子吸收分光光度计;G4型漏斗式过滤器。
50%(体积分数,下同)盐酸溶液、0.05 g·mL-1碳酸钠溶液、饱和焦磷酸钠溶液。
除特别说明外,所用试剂均为分析纯;试验用水均为符合GB/T 6682-2016《分析实验室用水规格和试验方法》规定的三级水。
1.2 试验原理
采用盐酸、硝酸溶解试样,将试样中不同价态的锰氧化还原为锰(Ⅱ);对于含有干扰元素铈(Ⅲ)的稀土系镍氢电池废料,还需进一步采用氢氟酸沉淀分离稀土元素以消除干扰。经定容、干过滤,分取一定体积的滤液,加入过量的饱和焦磷酸钠溶液,用pH 计测定酸度,以50%盐酸溶液或0.05 g·mL-1碳酸钠溶液调节溶液pH 为7.0±0.5,然后置于电位滴定仪上,插入铂电极和钨电极,在搅拌下用高锰酸钾标准滴定溶液进行氧化还原滴定,滴定至电位升至620 m V(滴定终点),其滴定过程反应式为:

1.3 试验方法
1.3.1 高锰酸钾标准滴定溶液的标定
锰溶液的制备:称取0.25 g(精确至0.000 1 g)经表面处理的电解锰[表面处理过程:称取2.0 g电解锰(wMn≥99.95%),置于250 mL烧杯中,加入约20 mL水,滴加50%盐酸溶液至锰表面具有金属光泽,用水冲洗5次,再用乙醇冲洗,于120 ℃下干燥10 min,冷却至室温],置于250 mL烧杯中,加水约10 mL,缓慢滴加50%盐酸溶液,待剧烈反应完成后再加入10 mL 50%盐酸溶液,加热煮沸,冷却至室温,移至250 mL容量瓶中,以水稀释至刻度,混匀。
高锰酸钾标准滴定溶液的配制:称取1.65 g高锰酸钾,先用少量水溶解后,再稀释定容至1 L,放置6 d后,用G4漏斗式过滤器抽滤,滤液保存于棕色玻璃瓶中,混匀。
高锰酸钾标准滴定溶液的标定:移取20.00 mL锰溶液于500 mL烧杯中,边搅拌边加入250 mL饱和焦磷酸钠溶液后,用pH 计测定其酸度,以50%盐酸溶液和0.05 g·mL-1碳酸钠溶液调节溶液p H至7.0±0.5,在电位滴定仪上,用高锰酸钾标准滴定溶液滴定至发生电位突跃为止,记录高锰酸钾标准滴定溶液消耗体积。随同标定做空白测定。
按式(2)计算高锰酸钾标准滴定溶液的浓度(c,mol·mL-1),所得数据保留四位有效数字。
基层兽医在临床诊断中,常常把具有发热、咳嗽的牛病简单的判定为牛感冒,常常导致误诊并延误治疗。本文对牛支原体肺炎、牛传染性鼻气管炎等8种具有发热、咳嗽症状的传染性牛病的鉴别诊断和防治予以论述,期望能给广大基层兽医朋友有所帮助。
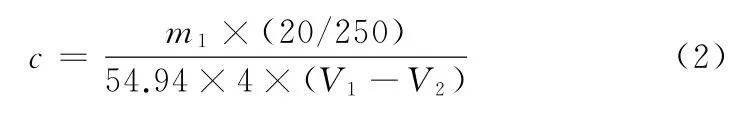
式中:m1为配制锰溶液所称取锰的质量,g;20为标定时移取锰溶液的体积,m L;250为配制锰溶液所定容的体积,m L;54.94 为锰的摩尔质量,g·mol-1;4为Mn2+与Mn O4-在滴定反应式中的系数比;V1为滴定时消耗的高锰酸钾标准滴定溶液的体积,m L;V2为滴定空白试验溶液时消耗的高锰酸钾标准滴定溶液的体积,m L。
1.3.2 试样的预处理
1)锂离子电池废料
称取1.00 g锂离子电池废料于250 mL 烧杯中,用少量水湿润,加入20 mL盐酸和10 mL硝酸,盖上表面皿,低温加热约30 min。冷却至室温,移至250 mL 容量瓶中,以水稀释至刻度,混匀,用快速定量滤纸干过滤。
2)稀土系镍氢电池废料
称取1.00 g稀土系镍氢电池废料于250 mL聚四氟乙烯烧杯中,用少量水湿润,加入20 mL 盐酸和10 mL 硝酸,盖上表面皿,低温加热约30 min。取下稍冷,加入5 mL氢氟酸(以去除稀土元素),盖上表面皿,低温加热至近干,取下冷却。再加入20 mL 50%盐酸溶液,仔细冲洗表面皿和烧杯壁,加热煮沸至可溶性盐类溶解,取下冷却至室温,移至250 mL容量瓶中,以水稀释至刻度,混匀,用中速定量滤纸干过滤。
1.3.3 滴 定
分取一定量的上述滤液于500 mL 烧杯中(wMn<15.00%时分取50.00 mL,wMn≥15.00%时分取20.00 mL),在不断搅拌下,于试液中加入250 mL饱和焦磷酸钠溶液,用pH 计测定酸度,以50%盐酸溶液和0.05 g·mL-1碳酸钠溶液调节溶液pH 至7.0±0.5。置于电位滴定仪上,插入铂电极和钨电极,在搅拌下用高锰酸钾标准滴定溶液进行氧化还原滴定,滴定至电位升至620 m V(滴定终点)时,记录滴定消耗的高锰酸钾标准滴定溶液的体积。
1.3.4 数据处理
试样中锰含量以锰的质量分数(wMn)计,按式(3)计算,所得结果保留至小数点后两位。

式中:c为高锰酸钾标准滴定溶液的浓度,mol·mL-1;54.94为锰的摩尔质量,g·mol-1;4 为Mn2+与MnO4-在滴定反应式中的系数比;m2为称取试料的质量,g;V为试液定容的总体积,m L;V3为分取滤液的体积,m L;V4为滴定试料所消耗的高锰酸钾标准滴定溶液的体积,m L;V5为滴定空白试验所消耗的高锰酸钾标准滴定溶液的体积,m L。
2 结果与讨论
2.1 溶样方法的选择
稀土系贮氢合金中锰以金属锰(Mn)或锰氢化物(Mn Hx)形式存在[16],其中氢以H-的形式存在;层状锰酸锂(LiMn O2)中锰的价态为Mn(Ⅲ)[17],尖晶石型锰酸锂(LiMn2O4)[18]和镍钴锰酸锂[LiNixCoyMn(1-x-y)O2][19-20]中锰的价态有Mn(Ⅲ)和Mn(Ⅳ)两种价态。锰虽然有Mn(Ⅱ)、Mn(Ⅲ)、Mn(Ⅳ)、Mn(Ⅵ)、Mn(Ⅶ)等多种价态,但根据锰元素和氢元素在酸性溶液中的标准电极电势[21],如,可知金属锰(Mn)和锰氢化物(Mn Hx)中H-具有很强的还原性,Mn(Ⅲ)、Mn(Ⅳ)、Mn(Ⅵ)、Mn(Ⅶ)具有很强的氧化性,只有Mn(Ⅱ)较稳定。基于上述情况,贮氢合金、镍钴锰酸锂和锰酸锂等通常采用盐酸即可直接溶解;而电池废料中由于还含有铁和铝,以及少量的铜,需要加入硝酸才能溶解。试验采用盐酸、硝酸混合酸溶解试样,使试样中多种价态的锰完全转化为可被高锰酸钾滴定的Mn(Ⅱ)价态。
试验采用20 mL盐酸和10 mL硝酸对镍氢型、镍钴锰酸锂型及锰酸锂型的电池废料进行溶解。结果表明:镍氢型的电池废料能完全溶解,镍钴锰酸锂型及锰酸锂型的电池废料在溶解后有黑色不溶物。黑色不溶物的主要成分是导电石墨,将黑色不溶物全部移入滤纸中,用水冲洗滤渣10次,将带不溶物的滤纸放入30 mL铂坩埚中,干燥、灰化,于马弗炉中700 ℃灼烧,加入2 g碳酸钠、3 g氢氧化钠,在于900 ℃条件下熔融2 h后,取出,冷却,放入250 mL烧杯中,再用20 mL 盐酸和少量水浸取,加热溶解盐类。取出坩埚,冷却,转移至200 mL 容量瓶中,以水稀释至刻度,混匀。采用原子吸收光谱法测定锰含量,发现残渣中锰的质量分数低于0.006%。表明采用20 mL盐酸和10 mL硝酸可以溶解完全,不溶物推荐采用干过滤分离,不影响测定结果。
2.2 共存元素的干扰
锂离子电池废料中含有镍、钴、铜、铁、铝、锂等共存元素[1-3],以及含有微量的镁、锌、钙、钠、钾[15];镍氢电池废料中有镍、钴、铝、铜、铁、镧、镨、钕、铈等共存元素[12]。进行共存元素综合干扰试验,针对两种电池废料,考察了上述共存元素不同存在量时,对10.00 mg锰的测定值和回收率的影响,结果见表1。
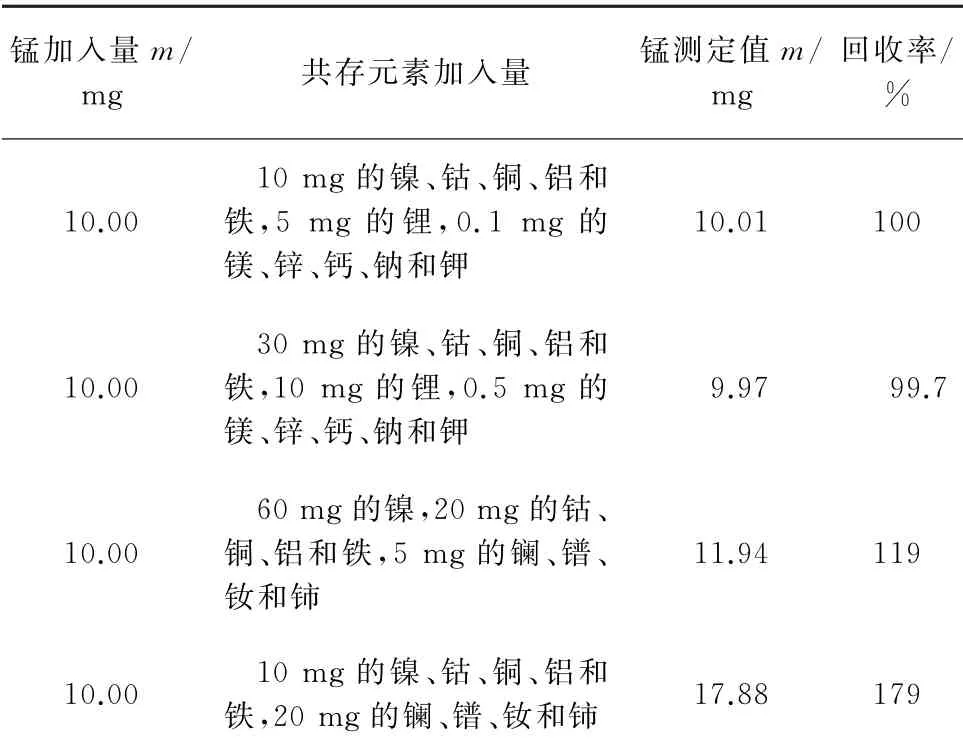
表1 共存元素干扰试验Tab.1 Interference test of coexisting elements
由表1可知,镍、钴、铜、铝、铁、镁、锌、钙、钠、钾等共存元素不会造成干扰,镧、镨、钕、铈中某种元素存在干扰。进一步考察了同等量的镧、镨、钕、铈对锰的测定的影响,结果见表2。

表2 等量的镧、镨、钕、铈的干扰试验Tab.2 Interference test of the same amount of lanthanum,praseodymium,neodymium,and cerium
由表2可知,4种元素对锰的干扰来自铈,这是由于铈(Ⅲ)在焦磷酸钠中性介质中也能被高锰酸钾氧化生成铈(Ⅳ),从而导致回收率偏高。其反应式见式(4):

2.3 稀土元素干扰的去除
根据文献[22]报道,可用氢氟酸氟化分离沉淀稀土系贮氢合金中稀土元素,故试验采用加入氢氟酸与试样中稀土元素铈、镧、镨、钕生成氟化物沉淀,以去除稀土元素的干扰;但由于过量的氟化氢对玻璃器皿及电极具有腐蚀作用,故氢氟酸氟化分离沉淀后,需将试液低温蒸发至近干除去过量的氢氟酸,再以盐酸溶解可溶性盐。
考虑到稀土系贮氢合金中稀土元素的质量分数通常低于45%[22],试验于聚四氟乙烯烧杯中加入50.00 mg锰,分别加入100.00 mg的镧、镨和钕及150.00 mg铈,再加入5 mL氢氟酸,然后按1.3.2节中2)进行处理,定容混匀后,分别采用不过滤和用快速、中速、慢速定量滤纸干过滤处理沉淀,分取待测液用于滴定。同时,将所有稀土沉淀转移至滤纸中,水洗沉淀10次,用硝酸和高氯酸对滤纸及沉淀进行溶解,采用原子吸收光谱法测定沉淀中锰含量,结果见表3。

表3 氟化分离沉淀稀土元素试验Tab.3 Test for fluorination separation and precipitation of rare earth elements
由表3可知:使用5 mL 氢氟酸能完全分离沉淀稀土元素,同时为保证试验效率和过滤效果,采用中速定量滤纸干过滤,稀土氟化沉淀中锰含量可以忽略不计,可消除铈的干扰。
2.4 饱和焦磷酸钠溶液用量的选择
焦磷酸钠为弱碱性钠盐,与锰、镍、钴、铜、铁、铝等金属离子络合能力强,能防止其在中性介质中水解生成沉淀,另焦磷酸根也参与滴定反应,饱和焦磷酸钠溶液的用量对滴定影响较大。试验移取含30.00 mg锰和170.00 mg共存元素的待测溶液于500 mL烧杯中,缓慢加入不同量的饱和焦磷酸钠溶液,调节酸度后进行滴定,结果见表4。

表4 饱和焦磷酸钠溶液用量对滴定的影响Tab.4 Effect of the amount of saturated sodium pyrophosphate solution on titration
结果表明:当饱和焦磷酸钠溶液加入量在50~150 mL时,溶液生成的白色沉淀不消失,表明焦磷酸钠不够,则在滴定过程中参与滴定反应的焦磷酸根不足,出现滴入高锰酸钾标准滴定溶液后电位反应滞后,电位先升高,待反应完全后又降低才能趋于稳定的现象,最终导致滴定终点提前到达,测定结果偏低;当饱和焦磷酸钠溶液加入量为200~300 mL时,测定结果满意,但在200 mL 时沉淀消失较慢,表明焦磷酸钠可能刚好足量。考虑到饱和焦磷酸钠溶液应适当过量,试验选择其用量为250 mL。
2.5 滴定时酸度的选择
试验移取含30.00 mg锰的锰溶液于500 mL烧杯中,加入250 mL饱和焦磷酸钠溶液,用50%盐酸溶液和0.05 g·mL-1碳酸钠溶液分别调节溶液pH至4.0,5.0,6.0,7.0,8.0,9.0,测得不同酸度时的锰量,结果见表5。
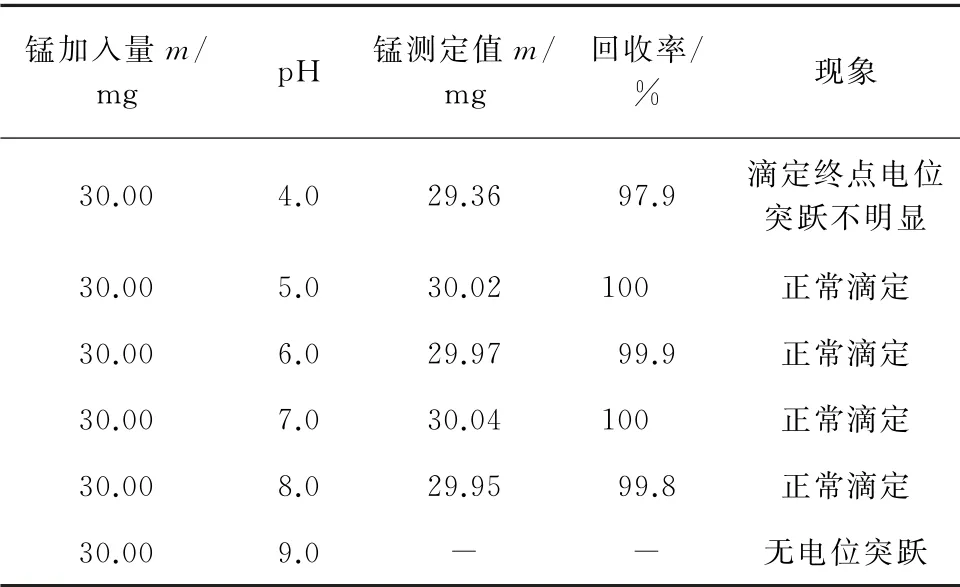
表5 酸度对滴定的影响Tab.5 Effect of acidity on titration
结果表明:pH 在5.0~8.0时,可正常滴定,测定结果准确,电位突跃明显;而pH 过低或者过高都会影响测定。考虑加入250 mL饱和焦硫酸钠溶液后试液一般呈弱碱性,试验选择在p H为7.0±0.5的中性条件下进行滴定。
2.6 精密度试验
按试验方法对5个二次电池废料实际样品进行测定,每个样品平行测定11次,计算测定值的相对标准偏差(RSD),结果见表6,其中1号样品为稀土系镍氢电池废料,其余2~5号样品为锂离子电池废料。由表6可知:RSD 均不大于0.57%,方法具有较高的精密度。

表6 精密度试验结果(n=11)Tab.6 Results of test for precision(n=11)
2.7 回收试验
称取5个试样各1.00 g,按试验方法进行测定,并进行加标回收试验,结果见表7。

表7 回收试验结果Tab.7 Results of test for recovery
由表7可知:加标回收率为99.6%~101%,表明方法准确度较高。
本工作根据电池废料类型不同,选择不同的处理方法,采用电位滴定法测定二次电池废料中的锰含量,操作简单,对含锰量为5.00%~60.00%的废料的测定表明,其RSD 不大于0.57%,加标回收率为99.6%~101%,结果准确,已应用于电池回收行业,可推荐为仲裁方法。

