HPV16 E7乳酸乳球菌疫苗联合顺铂抗肿瘤效果研究∗
卡得了亚·哈依沙尔,得丽扎尔·热合曼,王中香,孙素荣,李轶杰
(新疆大学 生命科学与技术学院,新疆生物资源基因工程重点实验室,新疆 乌鲁木齐 830046)
0 引言
宫颈癌(Cervical Cancer)是妇女最常见的恶性肿瘤之一,也是女性癌症死亡的第四大病因,超过85%的病例发生在发展中国家[1].最近几十年以来,放疗联合顺铂(DDP)化疗是晚期宫颈癌治疗的全球标准,但五年58%无进展生存率和66%的总生存率促使研究者探索更好的治疗策略,包括改良化疗、靶向药物治疗和免疫疗法[2].研究显示免疫疗法与放化疗联合使用,可能改善局部控制和增强全身反应,故探讨免疫疗法与化疗在局部晚期和转移性宫颈癌中联合作用已成为提高宫颈癌疗效的新方向[2].大多数宫颈癌都由16和18等高危型人乳头瘤病毒(Human Papilloma Virus,HPV)持续感染导致[1].虽然HPV预防性疫苗已经成功上市,但此类预防疫苗仅对有限的HPV亚型提供保护性免疫,而对数以百万已经感染HPV的患者没有治疗作用.HPV16型等高危型早期蛋白中的E7是宫颈上皮恶性转变的关键蛋白,也是免疫治疗中理想的靶抗原[3].前期我们构建的原核表达改造后的HPV16 E7,真核表达鼠白细胞介素12(Interleukin-12,IL-12)的乳酸乳球菌疫苗LL-E7P-IL-12D免疫小鼠后诱导产生HPV16 E7特异性免疫应答,并在体内获得抑制肿瘤生长的保护效果[4].然而,肿瘤组织未消退的荷瘤小鼠最终还会因缓慢生长的肿瘤导致死亡,其抗肿瘤效果有待进一步增强.顺铂是临床上常见的具有细胞毒性的细胞周期非特异性药物[5],可以抑制肿瘤细胞的DNA复制过程和损害肿瘤细胞的膜结构,具有较强的抗肿瘤作用[6].本文探讨顺铂与HPV16 E7乳酸乳球菌疫苗联用是否能够提高抗肿瘤效果.
1 材料与方法
1.1 材料
RPMI Medium 1640 basic细胞培养基、胰蛋白酶、PBS、100×青链霉素混合液购自Hyclone公司;胎牛血清购自浙江天杭生物科技股份有限公司;γ-干扰素(IFN-γ)、IL-10,IL-12酶联免疫试剂盒购自武汉博士德公司;顺铂购自上海源叶生物科技有限公司;其他实验所用试剂均为国产分析纯试剂.8~10周龄的雌性C57BL/6小鼠购于新疆医科大学实验动物中心.HPV16 E7转化的C57BL/6肺上皮细胞TC-1,携带人乳头状瘤病毒16型E7蛋白和小鼠IL-12 DNA的乳酸乳球菌HPV16 E7疫苗(LL-E7P-IL-12D,357),原核表达红色荧光蛋白和真核表达增强型绿色荧光的乳酸乳球菌(LL-RP-GD,358)由实验室冻存.
1.2 方法
1.2.1 动物荷瘤模型的建立与处理
用磷酸盐缓冲溶液(Phosphate buffer solution,PBS)将HPV16 E6E7相关TC-1肿瘤细胞悬液稀释为1×106个/mL后,在C57BL/6小鼠右后背部皮下按1×105/100μL每只注射TC-1细胞,获得荷瘤小鼠模型.小鼠皮下肿瘤直径达到2 mm左右时随机分为6组,每组6只,分别为溶剂对照组:PBS;顺铂化疗组:DDP;乳酸乳球菌疫苗组:357;乳酸乳球菌对照组:358;疫苗顺铂联用组:357+DDP和乳酸乳球菌对照顺铂联用组:358+DDP.小鼠体内肿瘤直径5~9 mm时,DDP组,357+DDP组和358+DDP组于当天和第三天按照2.5 mg/kg的浓度腹腔注射顺铂治疗;两次化疗处理中间,357组、358组、357+DDP组和358+DDP组分别通过鼻粘膜添加1.0×109/20μLPBS每只的重组乳酸乳球菌免疫治疗;PBS组用等体积磷酸盐缓冲溶液处理,两周后重复治疗.荷瘤小鼠出现死亡时治疗终止.小鼠注射肿瘤细胞后隔天记录体重变化,每3~4天观察并记录肿瘤的生长情况,当平均肿瘤直径>18 mm时处死小鼠.
肿瘤体积计算方法:肿瘤体积(mm)=(长径×短径2)/2[4].
1.2.2 ELISA检测血清中IL-10、IL-12和IFN-γ的表达水平
首次乳酸乳球菌鼻粘膜免疫治疗后第三天毛细吸管眼静脉采血法收集小鼠血液并分离血清.血清中IL-10、IL-12和IFN-γ水平分别使用IL-10、IL-12p70和IFN-γELISA试剂盒检测.
1.2.3 相关数据统计分析
实验数据用(x±s)表示,统计学处理使用Prism软件包分析.两样本均值比较采用t检验,生存期比较采用寿命表法,*表示P <0.05为差异有统计学意义;**表示P <0.01;***表示P <0.001.
2 结果
2.1 荷瘤小鼠体重变化趋势
由图1荷瘤小鼠的体重变化趋势可知,C57BL/6小鼠注射TC-1肿瘤细胞后小鼠体重各组间未发生明显改变.第7天首次治疗后各组小鼠体重均有不同程度下降,疫苗治疗357组和溶剂对照PBS和乳酸乳球菌对照358在初次治疗后小鼠体重有6天轻微下降,随后对照组体重变化不大,而疫苗治疗组体重逐渐增加,至注射肿瘤细胞27天时显著高于其他各组;DDP化疗后小鼠体重均呈现6天连续下降,6天体重稳定和2天升高现象;其中联合治疗组小鼠体重虽略低于DDP组,但组间差异不显著.
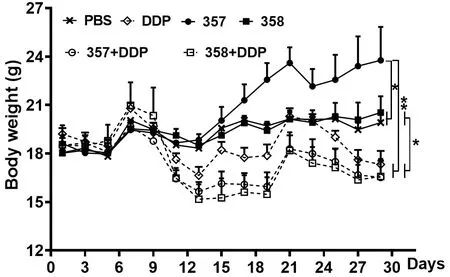
图1 小鼠体重趋势图Fig 1 Body weight trend chart of mice
2.2 乳酸乳球菌疫苗与顺铂联用抗肿瘤效果
C57BL/6小鼠背部皮下注射1×105个TC-1细胞第7天,小鼠肿瘤直径5~9 mm时,化疗组分别在7天和第9天腹腔注射50 μg/100 μL溶于PBS的顺铂,免疫组在第8天鼻腔免疫1.0×109重组乳酸乳球菌;两周后重复1次,每3天记录肿瘤生长情况.肿瘤细胞注射后第29天,如图2所示疫苗组(357:551.9±193 mm3)、化疗组(DDP:218.4±108.5 mm3)及联合治疗组(357+DDP:289.9 ±242 mm3;358+DDP:199.3 ±180 mm3)小鼠肿瘤体积均显著小于溶剂对照组(PBS:1946 ±180.7 mm3)和乳酸乳球菌对照组(358:1 128 ±230.6 mm3),且乳酸乳球菌对照组的肿瘤体积也显著小于溶剂对照组.顺铂单独化疗组(DDP)及联合治疗组(357+DDP,358+DDP)肿瘤体积小于疫苗组357,但彼此差异并不显著.
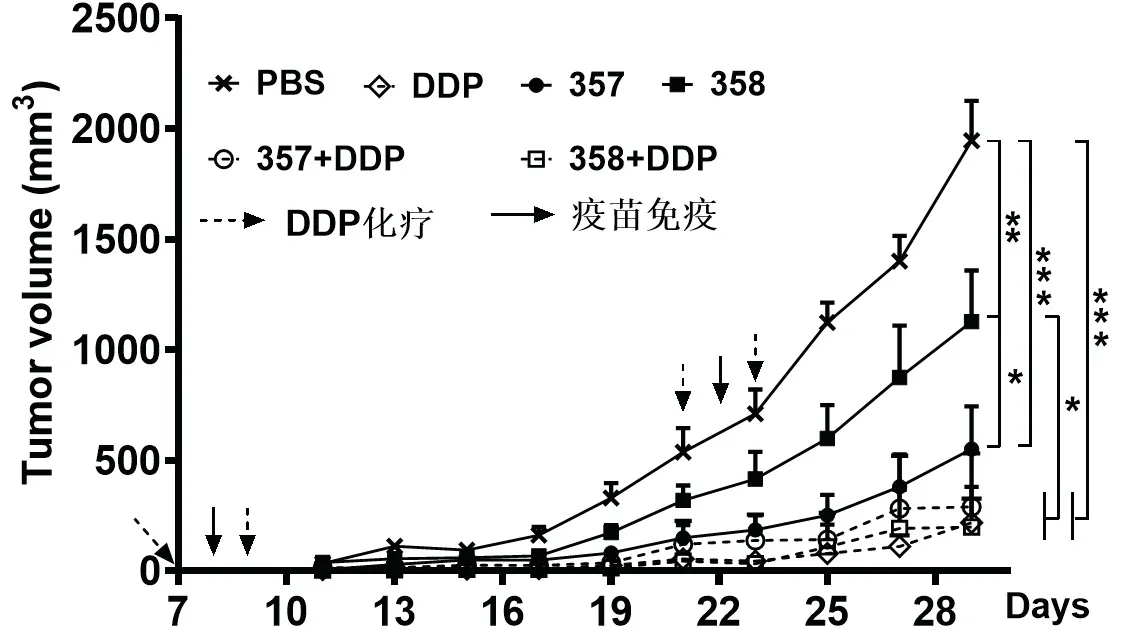
图2 荷瘤小鼠体内肿瘤生长曲线Fig 2 The inhibition effect of tumor growth in vivo
小鼠注射肿瘤29天后,如图3所示荷瘤小鼠陆续意外死亡或因肿瘤直径>18 mm而被安乐死,至44天时对照组PBS组和358组小鼠均因肿瘤直径大于安乐死标准被处死.至60天时,DDP组、357组和357+DDP组存活小鼠皮下已触及不到肿瘤,而358+DDP组小鼠皮下肿瘤在停止治疗后继续生长;至肿瘤注射85天所有小鼠皮下均未发现肿瘤生长迹象时,DDP组和358+DDP组各有1只存活,357组有2只存活,联合治疗组357+DDP有3只存活.
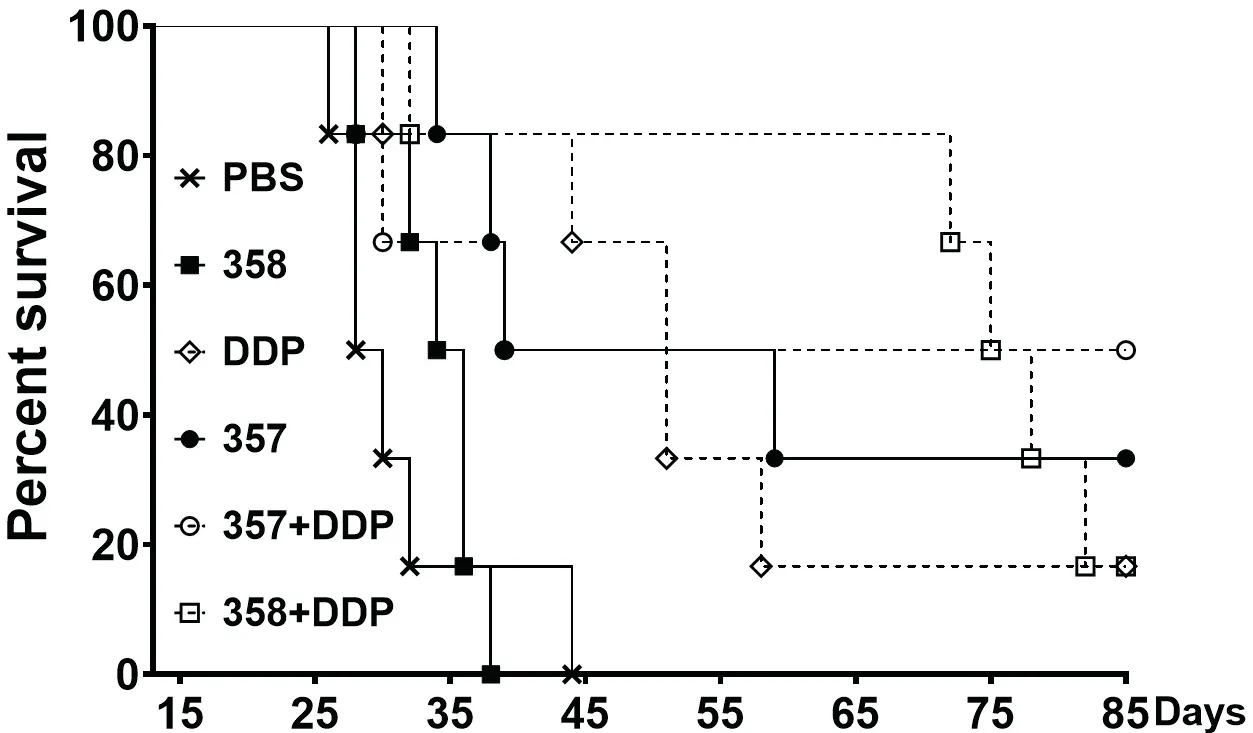
图3 荷瘤小鼠存活率Fig 3 Survival rate of tumor-bearing mice after treatment
2.3 血清中细胞因子测定
荷瘤小鼠分别于乳酸乳球菌首次滴鼻免疫后第3天通过毛细吸管眼静脉采血法收集小鼠血并分离血清.血清经1∶5稀释后按博士德ELISA操作说明书检测,结果见图4.所有实验组中只有357疫苗组血清中显著检测到IL-12与IFN-γ表达,而各组血清中抑制Th1免疫细胞和诱导Treg细胞发挥免疫抑制作用的IL-10表达差异并不显著.

图4 血清中细胞因子水平测定Fig 4 The expression level of cytokines in serum
3 讨论
最近几十年以来,放疗联合顺铂化疗是晚期宫颈癌治疗的金标准[2],但晚期宫颈癌患者的五年生存率仍然很低.随着免疫疗法在众多恶性肿瘤中取得的成功,免疫疗法与放化疗在局部晚期和转移性宫颈癌中联合作用已成为提高宫颈癌疗效的新方向.前期我们证明携带人类乳头状瘤病毒16型E7蛋白和小鼠IL-12 DNA的活乳酸乳球菌疫苗鼻腔免疫后产生了针对HPV16 E7特定的CTL反应,降低了肿瘤组织的生长速率,其中有25%的小鼠皮下产生肿瘤消退现象[4].这与大多数免疫疗法仅对平均大小为45 mm3肿瘤治疗有效一致[7],然而未发生肿瘤组织消退的荷瘤小鼠最终还会因缓慢生长的肿瘤导致死亡,因此有必要联合多种治疗手段抑制肿瘤组织的快速增长,以增强肿瘤疫苗的治疗效果[4].
研究显示,顺铂等化疗药物易对患者和模型动物产生吞咽困难,体重减轻,肌肉萎缩,胃肠道疾病等不良影响[8],也存在小剂量连续化疗和高剂量间隔化疗两种治疗方式的争议[9,10].本研究中,357+DDP组与DDP组死亡小鼠皮下肿瘤直径均未达到18 mm的安乐死标准,这可能与顺铂连续化疗引发的意外死亡有关,也间接证实小剂量连续顺铂化疗具有非肿瘤原因的死亡风险[9].此外,抗癌分子IL-12具有促进T-helper 1 (Th1)分化和T细胞介导的杀伤癌细胞,抑制肿瘤血管生成的作用,但系统性发送IL-12治疗在机体中存在显著毒性[11].与对照358和PBS组荷瘤小鼠体重变化不大、357+DDP和358+DDP组化疗期间体重持续下降不同,357组荷瘤小鼠体重受鼻粘膜免疫应激短暂下降后,随即与正常小鼠一样持续增加,这与前期通过鼻粘膜途径发送IL-12不引发显著毒性的报道相符[4,12].然而,虽与DDP组的小鼠体重下降差异不显著,但357+DDP组荷瘤小鼠非正常死亡时间较DDP组提前,提示鼻内发送携带IL-12真核表达框的乳酸乳球菌疫苗仍可能存在较弱的毒性.令人意外的是,对照358组荷瘤小鼠皮下的肿瘤生长速度显著低于溶剂对照PBS组,与顺铂联用时(358+DDP组)虽然没有改善化疗引发的荷瘤小鼠体重减轻,却显著延长荷瘤小鼠的生存周期,这可能与乳酸乳球菌本身具有调节宿主免疫应答的能力有关[13].
本研究中乳酸乳球菌疫苗与顺铂联合治疗的肿瘤生长抑制的效果优于疫苗单独治疗的效果,但治疗组间差异并不显著,这可能与实验中乳酸乳球菌疫苗免疫治疗的间隔过长有关[7,8],也可能是化疗与乳酸乳球菌疫苗治疗间隔较近顺铂抑制免疫细胞的功能所致[5],再者顺铂小剂量连续化疗引起的非肿瘤死亡风险也可能掩盖了联合治疗的效果[9].然而,实验中乳酸乳球菌疫苗与化疗联用时较高的无瘤生存率依旧显示出该策略具有抑制肿瘤生长和消除肿瘤的潜力.因而在后期的研究中,通过增加化疗与免疫的时间间隔及缩小两次疫苗免疫的治疗间隔,则有望消除目前疫苗与化疗联用时的非肿瘤死亡因素,获得提高联合治疗策略抗肿瘤的效果.
- 新疆大学学报(自然科学版)(中英文)的其它文章
- On Size,Order,Minimum Degree and Conditional Diameter of Graphs∗
- 给定点数,最小度和条件直径的图的边数的上界∗
- Some Logarithmic Submajorisation Inequalities Related to Heinz Mean∗
- 关于Heinz均值的Log-次优化不等式∗
- Logarithmic Submajorization and Symmetric Quasi-Norm Inequalities on Operators∗
- 有关算子的一些Log-次优化不等式和对称拟范数不等式∗

